外源肉碱对鲤鱼背肌脂肪酸组成及其CPT I基因表达的影响
董 婧,李 林,于业辉,董晓庆,陈玉珂,裴怀全,王秋举,张东鸣
(1 吉林农业大学 动物科技学院,吉林 长春 130118;2 沈阳农业大学 畜牧兽医学院,辽宁 沈阳 110866)
L-肉碱(L-carnitine)最主要的生理学功能是参与长链脂肪酸氧化,辅助脂酰CoA通过电位差阴离子通道进入线粒体基质,最终释放出酰基CoA参与β-氧化,产生ATP[1]。L-肉碱对鱼类的作用有促生长,促脂肪酸氧化,节约蛋白质,减少氨排泄、抵抗氨及外源性化合物的毒性,有助于适应极端水温的应激、提高高水平运功能力,改变肌肉组成、提高生殖能力[2]。但研究结果并非都是积极的,在过去的20年,研究者一直在探讨动物饲料中是否需要添加外源肉碱。Dias等[3]研究表明,L-肉碱对欧洲黑鲈(Dicentrarchuslabrax)无促生长、促脂肪酸氧化作用;Selcuk等[4]对虹鳟(Oncorhynchusmykiss)的研究结果也无促生长、促脂肪酸氧化作用;而 Ozório[5]综述了L-肉碱添加的积极作用,并分析了其作用效果的影响因素,结果表明外源性添加L-肉碱可以促进脂肪作为能量来源,通过调节脂肪代谢酶的活性,来维持机体脂肪代谢的动态平衡。
肉碱棕榈酰转移酶I(carnitine palmitoyltransferase I,CPT I)是线粒体脂肪酸氧化过程中的关键调节酶,对脂肪的分解供能具有重要的调控作用。目前,对于人和哺乳动物的CPTI基因已有较多研究。CPTI与机体脂肪沉积有密切的关系,其表达水平与机体脂肪含量相关,表达水平升高有助于增加脂肪酸分解,降低机体脂肪含量[6]。由于CPT I在能量代谢中的重要作用,其与心肌肥厚、糖尿病等许多代谢疾病的发生发展有密切关系[7]。研究发现,调控CPT I活性的因子有很多,如丙二酰CoA(M-CoA)的变构抑制、CPTI基因与转录因子表达量的变化以及线粒体外膜的脂类组成及其流动性等[8-9]。营养素可以影响CPT I活性并最终影响线粒体脂肪酸的β-氧化[10]。在对虹鳟的研究中发现,多不饱和脂肪酸可以通过改变线粒体膜的组成间接影响CPT I的活性,且饲料中的脂肪酸主要是通过调控CPTI基因的表达从而影响机体脂肪酸的氧化[11]。基因表达对酶活性的调控及功能的实现成为营养调控的一大研究热点。而鱼类CPTI基因表达的研究报道还很少,而且L-肉碱对CPTI基因表达的调控及对脂肪酸氧化的作用机制也未见报道。
本试验选择鲤鱼幼鱼为研究对象,在饲料中添加不同含量的L-肉碱,研究其对鲤鱼背肌脂肪酸组成的影响;采用RT-PCR技术克隆鲤鱼CPTI基因的部分cDNA序列,评估L-肉碱对鲤鱼背肌中CPTI基因表达的影响,以期为进一步探讨肉碱调控CPTI基因功能,作用机理及L-肉碱添加问题提供参考资料和理论依据。
1 材料与方法
1.1 材 料
用于CPTI基因克隆的鲤鱼(Cyprinuscarpio)(750~800 g/尾)购于辽宁沈阳东陵路沈阳农业大学院内食品市场,4尾试验鱼购回后立即解剖取其背部白肌,液氮浇冻后于-80 ℃保存备用。
饲养试验用鱼购于辽宁省大伙房水库坝下鱼种场,挑选体质量为(2.5±0.5) g/尾的鲤鱼幼鱼540尾,随机分到18个150 cm×60 cm×80 cm的水族箱中,用加热棒将水温控制在(26±1) ℃,光周期为12L/12D。按鲤鱼幼鱼营养要求配制试验配方,L-肉碱添加量分别为0,50,100,150,200,400 mg/kg,基础饲料组成和营养成分见表1。原料经粉碎过60目(孔径250 μm)筛,按配方称质量,逐级混匀,挤压成直径1.0 mm的颗粒,在60 ℃恒温箱中经5 h烘干后置于-4 ℃冰柜中保存、备用。
饲养试验前用对照组饲料驯养15 d后分组,共设6个处理组,每个处理组3个重复,每个重复30尾鱼。分组后预饲1周,然后开始60 d的正式试验,分组前用10~20 mg/L的高锰酸钾水溶液药浴,试验期间平均水温(26±1) ℃,溶解氧≥5 mg/L,pH 7~8,NH3-N≤0.2 mg/L,亚硝酸盐≤0.05 mg/L。每天早上吸污后,换水1/3(经空气泵充分曝气1 d的自来水,且与玻璃缸中的水温保持一致)并记录水温。日投饵率视鱼群摄食情况变动于3%~6%,日投饵3次(08:00,13:00,18:00),投饵方法为人工手撒。饲养试验结束后禁食24 h,每缸随机取4尾鱼,取其背部白肌放入冻存管中,用液氮浇冻后于-80 ℃保存备用。
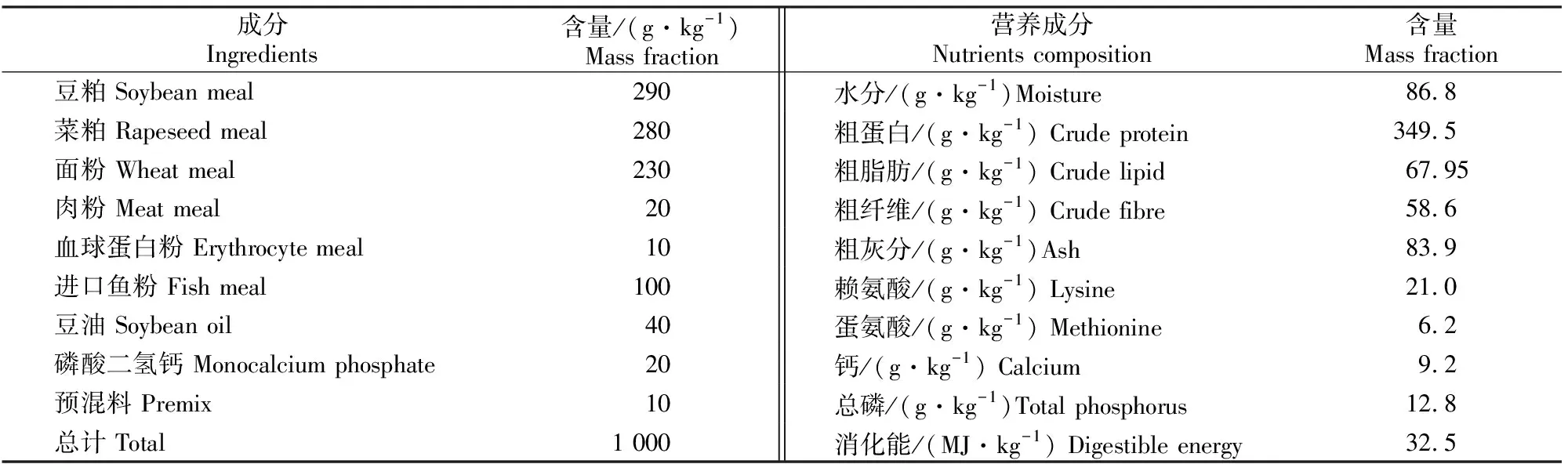
表 1 基础饲料组成和营养成分
主要试剂:L-肉碱,购于Sigma公司,货号C0158,纯度≥98%;脂肪酸标准品,购自Sigma公司,产品代号18919;氯仿、甲醇、正己烷、石油醚、氢氧化钾、异丙醇、无水乙醇等,均为分析纯试剂;RNAiso Plus试剂盒,TaKaRa;反转录试剂盒,TaKaRa;DreamTagTMGreen PCR Master Mix(2X),Fermentas;SybrGreen qPCR Master Mix(2X),ABI。
主要仪器:离心浓缩仪,配有真空泵以及110 V变压器;XHF-D高速分散器(内切式匀浆机);HP7890型气相色谱仪(带有氢火焰离子化检测器,FID);HP化学工作站;弹性石英毛细管柱(DB23 30 m×0.25 mm,膜厚0.25 μm,安捷伦公司);高速冷冻离心机(德国Eppendorf公司);电子分析天平;ABI Stepone plus型荧光定量PCR仪(美国ABI公司)。
1.2 鲤鱼背肌脂肪酸组成的测定
将鲤鱼背肌样品用研钵研磨成粉末,放入50 mL离心管中,加入氯仿与甲醇混合液(体积比2∶1)15 mL和蒸馏水5 mL,用高速分散器混合均匀,离心(3 500 r/min)20 min,小心取出底层液体放入15 mL玻璃管中,真空旋转蒸发2 h左右,然后加入1 mL正己烷将粗脂肪溶解,再加入KOH-CH3OH(2 mol/L)0.2 mL,50 ℃水浴10 min,水浴结束后加50 mL/L的硫酸-甲醇0.2 mL轻轻混匀后离心(2 000 r/min)10 min,吸出上层脂肪酸于15 mL玻璃管中,放入离心浓缩仪蒸干,除去氯仿,最后将干燥后的脂肪酸用适量正己烷溶解,移入进样瓶供气相色谱(GC)分析用。
GC分析的色谱条件:进样1 μL;进样口温度260 ℃,检测温度270 ℃;柱升温程序:初始温度150 ℃,保持5 min,以5 ℃/min速率升到230 ℃,保持20 min;氢气和空气流量分别为30和400 mL/min;载气为N2,流量为1.5 mL/min。色谱峰的定性采用脂肪酸标样标定,统计脂肪酸含量,分析其组成。
1.3 鲤鱼CPT I基因克隆及序列分析
根据GenBank中斑马鱼(Daniorerio,BC083470.1)、虹鳟(AF327058.3)、鲑鱼(Salmosalar,AM230810.1)等的CPTI保守序列,用Primer Premier 5.0软件设计CPTI基因上下游引物和实时定量PCR检测引物,在上海生物工程技术服务有限公司合成(表2)。RNAiso Plus试剂盒提取鲤鱼背部白肌的总RNA,利用琼脂糖凝胶电泳检测RNA质量。取1 μL提取的总RNA进行cDNA的合成。PCR反应体系为50 μL :ddH2O 10 μL,DreamTagTMGreen PCR Master Mix (2X)35 μL,cDNA 2.5 μL,CPTI基因上、下游引物(10 μmol/L)各1.25 μL。PCR程序:94 ℃预变性5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PCR产物送上海生物工程技术服务有限公司纯化测序。所得序列通过BLASTN进行比对,运用DNAMAN、MEGA4.0软件进行氨基酸序列的翻译和比对及系统进化树构建。

表 2 CPT I基因克隆及实时定量PCR检测引物的设计
1.4 实时定量PCR检测CPT I基因的表达
提取鲤鱼背部白肌总RNA,严格按反转录试剂盒操作说明反转录成cDNA。实时定量检测利用ABI Stepone plus型荧光定量PCR仪进行。反应体系为20 μL:10 μmol/L实时定量PCR检测上、下游引物各1 μL,反转录产物cDNA 1 μL,SybrGreen qPCR Master Mix(2X) 10 μL,灭菌水7 μL。反应条件为95 ℃ 15 s,60 ℃ 1 min,40个循环。根据扩增曲线得到的Ct值,计算出目标基因CPTI和内参基因18S rRNACt值的差异ΔCt;以差异最大的样本作为参照样本,计算出不同样品相对于参照样本基因的表达倍数2ΔΔCt,从而制作相对定量的图表。
1.5 数据分析
试验数据用“平均值±标准差(mean±SD)”表示,试验结果采用SPSS 13.0统计软件进行方差分析,采用Duncan多重比较法分析试验结果,当P<0.05时,认为差异显著,当P<0.01时,认为差异极显著。
2 结果与分析
2.1 外源肉碱对鲤鱼背肌脂肪酸组成的影响
饲料中外源肉碱添加量对鲤鱼背肌脂肪酸组成的影响见表3。
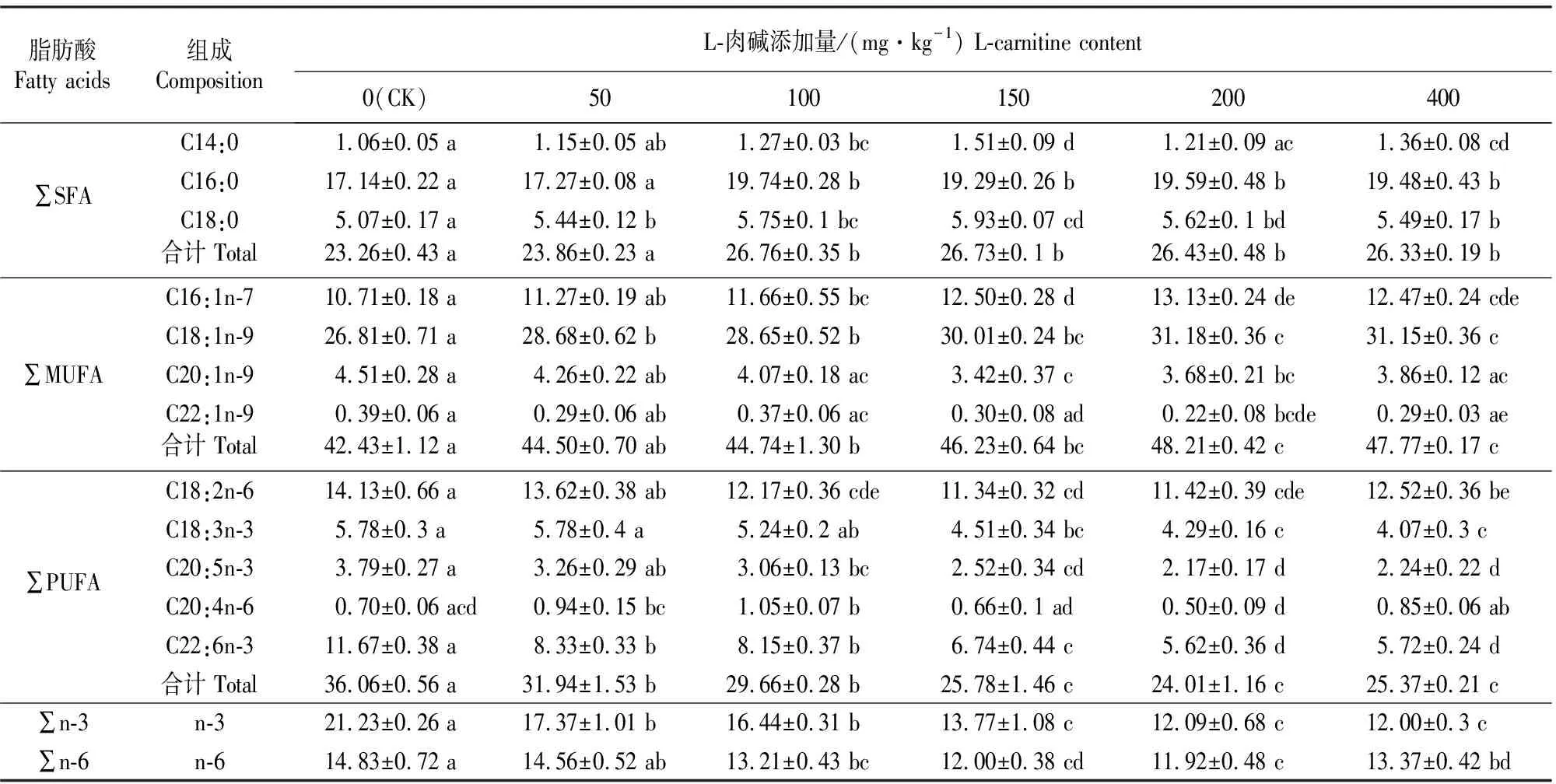
表 3 饲料中外源肉碱添加量对鲤鱼背肌脂肪酸组成的影响
由表3可以看出,外源肉碱对鲤鱼背肌脂肪酸组成有显著影响(P<0.05)。随饲料中L-肉碱添加量的增加,鲤鱼背肌∑SFA和∑MUFA脂肪酸含量升高,∑PUFA、EPA(C20:5n-3)、DHA(C22:6n-3)、∑n-3和∑n-6脂肪酸含量降低。当L-肉碱添加量分别为100,150,200,400 mg/kg时,与空白对照组(0 mg/kg)相比,∑SFA和∑MUFA含量显著升高(P<0.05);∑n-6和EPA含量显著下降(P<0.05)。饲料中L-肉碱添加量为50,100,150,200,400 mg/kg时,鲤鱼背肌∑PUFA、∑n-3、DHA脂肪酸含量较空白对照组显著降低(P<0.05)。饲料中L-肉碱添加量为150,200,400 mg/kg时,鲤鱼背肌∑PUFA和∑n-3脂肪酸含量较添加量为50,100 mg/kg组显著降低(P<0.05),但各组间差异不显著。
2.2 鲤鱼CPT I基因部分cDNA的克隆与序列分析
用RNAiso Plus试剂盒提取鲤鱼背肌总RNA并进行质量检测,反转录后对CPTI基因进行PCR扩增,获得1条特异的扩增条带,测序得其大小为857 bp,与预期片段大小一致。对PCR产物测序得其核苷酸和蛋白序列如图1所示。运用DNAMAN软件,对获得的鲤鱼CPTI基因核苷酸序列与斑马鱼(NM_001005940.1)、虹鳟(NM_001171855.1)CPTI基因核苷酸序列进行同源性比对分析,结果表明其同源性分别为89%和79%,可初步确定所得序列为鲤鱼CPTI基因的部分序列。

图1 鲤鱼背肌CPT I基因的部分cDNA及氨基酸序列
利用获得的鲤鱼(GenBank:AFC88887.1)CPTI基因与人类(Homosapiens,GenBank:NP_001027017.1和NP_004368.1)、猕猴(Macacamulatta,GenBank:XP_001101846.1)、褐家鼠(Rattusnorvegicus,GenBank:NP_113747.2)、羊(Ovisaries,GenBank:NP_001009259.1)、牛(Bostaurus,GenBank:NP_001029521.1)、蟾蜍(Xenopustropicalis,GenBank:NP_001072766.1)、斑马鱼(GenBank:NP_001005940.1)、虹鳟(GenBank:NP_001118207.1)、鲷鱼(Sparusaurata,GenBank:ABI79327.1)等物种CPTI基因的氨基酸序列构建系统进化树,结果如图2所示。图2显示,本试验获得的鲤鱼CPTI基因与斑马鱼等鱼类的CPTI基因聚类在一起,随后共同聚类为CPTIB群,推测其为CPTIB亚型。

图2 鲤鱼背肌CPT I基因氨基酸序列的系统进化树
2.3 外源肉碱对鲤鱼背肌CPT I基因mRNA表达丰度的影响
图3表明,鲤鱼饲料中L-肉碱添加量为150 mg/kg时,鲤鱼背肌CPTI基因表达丰度最高,为对照组的4倍;L-肉碱添加量为150 和200 mg/kg时表达量差异不显著,但与其他试验组相比差异均达显著水平(P<0.05);空白对照组(0 mg/kg)鲤鱼背肌CPTI基因mRNA的表达丰度最低,显著低于其他各试验组(P<0.05)。

图3 不同添加量的L-肉碱对鲤鱼背肌CPT I基因mRNA表达丰度的影响柱上标不同小写字母表示差异显著(P<0.05)
3 讨 论
鱼体肌肉组织中的脂肪酸构成由饲料成分、鱼体对脂类的消化吸收和代谢作用等因素共同决定。肉碱被称之为“条件性必需营养物质”,其对脂肪酸的正常代谢极为重要。脂肪酸是机体组织的主要能量来源,线粒体外膜上被活化的长链脂肪酸由肉碱介导通过线粒体内膜进行β-氧化,产生ATP供能。另外,细胞器内脂酰基的完全活化与跨膜转运均需要细胞内肉碱的参与。Ozório[5]提出,在标准饲养条件下,鱼类体内合成的肉碱能够满足生长需求,而外源性添加肉碱可以促进脂肪作为能量来源,表明肉碱可通过调节脂肪代谢酶的活性,来维持机体脂肪代谢的动态平衡。本试验结果显示,外源肉碱对鲤鱼背肌脂肪酸组成有显著影响(P<0.05),随饲料中L-肉碱添加量的增加,鲤鱼背肌∑SFA和∑MUFA脂肪酸含量显著升高(P<0.05),∑PUFA、EPA、DHA、∑n-3和∑n-6脂肪酸含量显著降低(P<0.05),这与Chatzifotis等[12]的研究结果一致。Jalali Haji-abadi等[13]研究指出,在虹鳟饲料中添加肉碱可以降低∑n-3的含量,饲喂1 000 mg/kg肉碱时,肌肉组织中的EPA和DHA含量均下降。Ozório[14]研究表明,非洲鲶鱼(Clariasgariepinus)饲喂肉碱后对其肌肉中的∑n-3和∑n-6长链脂肪酸含量影响不显著。Nogueira等[15]研究显示,在红鲷(Pagruspagrus)饲养试验中,添加肉碱可以降低机体组织中的∑n-6和C18:3n-3含量,而对EPA和DHA含量影响不大。同时,Ozório等[16]研究指出,外源肉碱的添加促进了长链脂肪酸的氧化。PUFAs在生物体中的合成转化是一个复杂的过程。脂肪酸在机体内保留的百分值反映了PUFA的合成能力。低百分值的脂肪酸是鱼类优先进行氧化利用的,高百分值的脂肪酸则相反,被选择性的沉积下来。本试验结果与研究对象的生长阶段是有一定关系的,推测外源性肉碱的添加使PUFA的利用大于合成,其调控机制还有待进一步研究。
CPTI基因位于线粒体外膜的内侧,催化脂酰CoA转化为脂酰肉碱,通过线粒体内膜运送脂酰基进行β-氧化,是线粒体脂肪酸β-氧化的限速酶,其对机体的能量代谢起着重要的调控作用。水产动物中,目前仅有虹鳟、斑马鱼、鲑鱼、金头鲷(Sparusaurata)的CPTI基因全序列或部分序列,而对其基因型的报道仅见于虹鳟和金头鲷[9,17-19]。本研究对鲤鱼CPTI基因部分cDNA序列进行了克隆及分析,为其在鲤鱼脂肪代谢中的作用研究奠定了基础。将试验获得的CPTI基因片段同GenBank上发表的斑马鱼和虹鳟的CPTI基因序列进行同源性比对分析,结果表明其同源性分别为89%和79%,表明所得CPTI基因片段具有较高的保守性。通过序列比对分析和系统树的构建,推测获得的CPTI基因序列为肌肉亚型(CPTIB)。Harpaz[2]综述了肉碱对鱼类的作用,其中对鱼类肉碱水平与CPT I活性相互关系的报道非常少,肉碱调控脂肪酸代谢的机理目前并不清楚。田娟等[20]研究表明,随草鱼(Ctenopharyngodonidella)饲料中L-肉碱添加量的增加,脂肪代谢过程中的分解酶活性升高,合成酶活性降低,使得肠系膜、肌肉和肝胰脏脂肪含量下降。高小强等[21]研究表明,牙鲆(Paralichthysolivaceus)饲料中添加适量的L-肉碱可加速脂肪酸氧化,提高能量利用率,促进动物生长发育,但剂量过高可能会抑制机体内参与脂肪酸氧化过程的各种酶的活性,降低营养利用率,导致动物生产性能下降。Yang等[22]研究表明,银鲈(Bidyanusbidyanus)饲料中添加L-肉碱能够降低银鲈的腹脂率和机体的脂肪含量。
目前已知的鱼类CPTI基因序列非常少,关于肉碱对水产动物CPTI基因表达水平的影响目前尚未见报道。本研究结果显示,鲤鱼饲料中的L-肉碱添加量为150 mg/kg时,CPTI基因mRNA 的表达丰度最高,是对照组的4倍;L-肉碱添加量为150和200 mg/kg时差异不显著,但与其他试验组相比有显著差异(P<0.05);空白对照组(0 mg/kg)CPTI基因mRNA 的表达丰度最低,且显著低于其他各试验组(P<0.05),推测适量添加L-肉碱可以提高CPTI基因的表达水平及活性,这可以合理解释田娟等[20]、高小强等[21]的研究结论。推测外源肉碱的添加可能提高了机体组织中的肉碱水平,作为酶作用底物提高了CPT I的活性及基因表达水平,促进了长链脂肪酸的氧化,有效调控了机体各组织中脂肪酸含量的变化。本试验中CPTI基因mRNA 的表达丰度与背肌脂肪酸组成的变化两者之间是有关系的,但其相关性还需进一步验证。CPTI基因表达在脂类氧化中非常重要,脂类氧化的调控机制有助于更好地保护组织代谢,以免受生理和外界环境的刺激。了解CPTI基因表达的调控机制才能找到调节肉碱作用的影响因素,以更好地解释饲料中添加L-肉碱的相关文献报道的矛盾结果,有利于更加科学合理地将L-肉碱用于动物产品的生产。
[参考文献]
[1] Kerner J,Hoppel C.Fatty acid import into mitochondria [J].Biochim Biophys Acta,2000,1486:1-17.
[2] Harpaz S.L-carnitine and its attributed functions in fish cultureand nutrition:A review [J].Aquaculture,2005,249:3-21.
[3] Dias J,Arzel J,Corraze G,et al.Effects of dietary L-carnitine supplementation on growth and lipid metabolism in European seabass (Dicentrarchuslabrax) [J].Aquaculture Research,2001,32:206-215.
[4] Selcuk Z,Tiril S U,Alagil F.Effects of dietary L-carnitine and chromium picolinate supplementations on performance and some serum parameters in rainbow trout (Oncorhynchusmykiss) [J].Aquac Int,2010,18(2):213-221.
[5] Ozório R O A.Dietary L-carnitine supplementation to cultivated fish:A mini-review [J].Curr Nutr Food Sci,2009,5:40-48.
[6] Steiber A,Kerner J,Hoppel C L.Carnitine:A nutritional,biosynthetic,and functional perspective [J].Mol Aspects Med,2004,25:455-473.
[7] Zammit V A,Ramsay R R,Bonomini M,et al.Carnitine,mitochondrial function and therapy [J].Adv Drug Delivery Rev,2009,61:1353-1362.
[8] Bezaire V,Heigenhauser G J F,Spriet L L.Regulation of CPT I activity in intermyofibrillar and subsarcolemmal mitochondria from human and rat skeletal muscle [J].Am J Physiol Endocrinol Metab,2004,286:85-91.
[9] Morash A J,Kajimura M,McClelland G B.Intertissue regulation of carnitine palmitoyltransferase I (CPT I):Mitochondrial membrane properties and gene expression in rainbow trout (Oncorhynchusmykiss) [J].Biochim Biophys Acta,2008,1778:1382-1389.
[10] Morash A J,Kajimura M,McClelland G B.Effect of dietary fatty acid composition on the regulation of carnitine palmitoyltransferase (CPT) I in rainbow trout (Oncorhynchusmykiss) [J].Comp Biochem Physiol B,2009,152:85-93.
[11] Wang J T,Liu Y J,Tian L X.Effect of dietary lipid level on growth performance,lipid deposition,hepatic lipogenesis in juvenile cobia (Rachycentroncanadum) [J].Aquaculture,2005,249:439-447.
[12] Chatzifotis S,Takeuchi T,Seikai T.The effect of dietary carnitine supplementation on growth of red sea bream(Pagrusmajor) fingerlings at two levels of dietary lysine [J].Aquaculture,1996,147:235-248.
[13] Jalali Haji-abadi S M A,Soofiani N M,Sadeghi A A,et al.Effect of supplemental dietary L-carnitine and ractopamine on the performance of juvenile rainbow trout,Oncorhynchusmykiss[J].Aquaculture Research,2010,41:1582-1591.
[14] Ozório R O A.Dietary L-carnitine and energy and lipid metabolism in African catfish (Clariasgariepinus) juveniles [D].Netherlands:Wageningen University,2001.
[15] Nogueira N,Cordeiro N,Canada Paula,et al.Separate and combined effects of cyclic fasting and L-carnitine supplementation in red porgy (PagruspagrusL.1758) [J].Aquaculture Research,2010,41:795-806.
[16] Ozório R O A,Uktoseja J L A,Huisman E A,et al.Changes in fatty acid concentrations in tissues of African catfish (ClariasgariepinusBurchell),as a consequence of dietary carnitine,fat and lysine supplementation [J].British Journal of Nutrition,2001,86:623-636.
[17] Gutieres S,Damon M,Panserat S,et al.Cloning and tissue distribution of a carnitine palmitoyltransferase I gene in rainbow trout (Oncorhynchusmykiss) [J].Comp Biochem Physiol B,2003,135:139-151.
[18] Boukouvala E,Leaver M J,Favre-Krey L,et al.Molecular characterization of a gilthead sea bream(Sparusaurata)muscle tissue cDNA for carnitine palmitoyltransferase 1B(CPT 1B) [J].Comp Biochem Physiol B,2010,157:189-197.
[19] Morash A J,Moine C M R L,McClelland G B.Genome duplication events have led to a diversification in theCPTIgene family in fish [J].Am J Physiol Regul Integr Comp Physiol,2010,299:579-589.
[20] 田 娟,冷向军,李小勤,等.肉碱对草鱼生长性能、体成分和脂肪代谢酶活性的影响 [J].水产学报,2009,33(2):295-302.
Tian J,Leng X J,Li X Q,et al.Effects of dietary carnitine on growth performance,body composition and lipid metabolism enzymes of grass carp,Ctenopharyngodonidella[J].Journal of Fisheries of China,2009,33(2):295-302.(in Chinese)
[21] 高小强,田青杰,石洪玥,等.饲料中添加L-肉碱对牙鲆幼鱼生长、生化组成及血液指标的影响 [J].广东海洋大学学报,2012,32(1):39-46.
Gao X Q,Tian Q J,Shi H Y,et al.Effects of dietary L-carnitine on growth performance,body composition and blood parameters of Japanese flounder(Paralichthysolivaceus)juvenile [J].Journal of Guangdong Ocean University,2012,32(1):39-46.(in Chinese)
[22] Yang S D,Liu F G,Liou C H.Effects of dietary L-carnitine,plant proteins and lipid levels on growth performance,body composition,blood traits and muscular carnitine status in juvenile silver perch(Bidyanusbidyanus) [J].Aquaculture,2012,342/343:48-55.

