microRNA-101a在尿酸诱导的肾小管上皮细胞转分化中的作用
叶菡洋 陈琰 金建 李占园 金领微 郑育 王红 周志宏
microRNA-101a在尿酸诱导的肾小管上皮细胞转分化中的作用
叶菡洋 陈琰 金建 李占园 金领微 郑育 王红 周志宏
目的 研究尿酸对肾小管上皮细胞间充质转分化的影响及microRNA-101a在其中的作用。方法 体外培养大鼠肾小管上皮细胞(NRK-52E),分别以0、10、100、500μmol/L的尿酸诱导细胞,采用实时定量PCR检测各组α-平滑肌肌动蛋白(α-SMA)、I型胶原(ColⅠ)及E钙蛋白mRNA的表达水平;Wersten blot检测各组中α-SMA的表达,免疫荧光检测各组中胶原蛋白I(COL)表达水平,观察细胞是否发生转分化。再用实时定量PCR检测各组中miR-101a及COX-2mRNA的表达水平,Wersten blot检测各组中COX-2的表达。进一步实验选择100μmol/L尿酸诱导细胞,并转染miR-101a mimics,分为3组,miR-101a组:先转染miR-101a mimics,再以100μmol/L尿酸培养基培养;空白对照组:以100μmol/L尿酸培养基培养;阴性对照组:细胞转染随机合成的miRNA NC片段,再以100μmol/L尿酸培养基培养。检测各组中α-SMA、ColⅠ、E钙蛋白及COX-2mRNA的表达量。结果 培养基中尿酸浓度越高,α-SMA、ColⅠ表达水平也越高,E钙蛋白越低,提示细胞发生转分化,同时miR-101a表达减少,COX-2mRNA表达增多。miR-101a组与空白对照组和阴性对照组比较,α-SMA、ColⅠ及COX-2的表达明显降低(P<0.05),E钙蛋白明显升高(P<0.05),空白对照组与阴性对照组间差异无统计学意义(P>0.05)。结论 尿酸诱导肾小管上皮细胞转分化可能呈浓度依赖性,miR-101a及COX-2可能参与尿酸诱导肾小管上皮细胞转分化的调节过程。
尿酸 microRNA-101a 环氧化酶-2 肾小管上皮细胞 上皮细胞-间充质转分化
在我国,尿酸性肾病是导致慢性肾功能不全的常见原因之一,许多临床和实验数据表明尿酸是慢性肾功能不全发展过程中的一个重要原因。目前这方面的研究多数是定位于尿酸导致肾脏内皮细胞功能紊乱、氧化应激与炎症反应,最终导致肾脏纤维化,肾小球滤过率下降[1-3],但关于尿酸对肾小管上皮细胞影响的研究较少,其机制也尚未明确。环氧化酶-2(cycloxygenase-2,COX-2)是被公认的介导炎症的重要蛋白之一,有研究报道,microRNA-101a(miR-101a)具有调节COX-2表达的作用,参与许多炎症反应的过程[4],而炎症反应是促进肾小管上皮细胞-间充质转分化(epithelialmesenchymal transition,EMT)的重要因素之一。笔者通过尿酸诱导大鼠上皮细胞实验,探讨尿酸是否具有促进对肾小管上皮细胞转分化的作用及可能存在的机制,现报道如下。
1 材料和方法
1.1 材料 NRK-52E大鼠肾小管上皮细胞株购自中科院上海细胞库;胎牛血清(FBS)、培养基DMEM(low glucose)、Hanks平衡盐溶液、0.05%胰酶/EDTA均购自美国Gibco公司;尿酸购自德国Sigma公司;Trizol、DEPC水(RNase-free and Dnase-free)、LipofectamineTM2000转染试剂均购自美国Invitrogen公司;流式细胞仪(flow cytometry,FCM)购自德国BD公司。miScript Reverse Transcription Kit购自德国Qiagen公司,PCR试剂盒(SYBR Green Realtime PCR Master Mix),96孔板及封板膜均购自美国ABI公司,RT试剂盒购自加拿大MBI Fermentas公司,电泳转印系统购自德国BIO-RAD公司,GAPDH、COX-2和α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的引物均购自美国Invitrogen公司,BCA蛋白浓度测定试剂盒购自美国Pierce公司,COX-2、I型胶原(collagen I,ColⅠ)和α-SMA抗体购自香港Abcam公司;酶标仪ECX800购自美国Bio-TEX;Backman DU800计算机分光光度分析仪购自美国Backman公司;激光扫描共焦显微镜购自德国Carl Zeiss公司;其他试剂均为进口或国产分析纯化。
1.2 NRK-52E细胞的培养及尿酸诱导 以含有5% FBS的DMEM(低糖)培养基培养NRK-52E大鼠肾小管上皮细胞株,并于37℃、5%CO2的孵箱中孵育,平均每3d传代培养。将同一代的细胞经传代后分4组,分别以0、10、100、500μmol/L尿酸培养基培养细胞。
1.3 实时定量PCR检测
1.3.1 不同尿酸浓度诱导下的细胞α-SMA、ColⅠ和E钙蛋白mRNA的表达 加尿酸培养24h后,收集细胞,加Trizol裂解,氯仿萃取,异丙醇浓缩过夜,提总RNA,取300ng总RNA,应用RevertAidTMFirst StrandcDNA Synthesis Kit逆转试剂盒合成cDNA,再应用ABI 7500 FAST型荧光定量PCR仪进行检测α-SMA、ColⅠ、E钙蛋白mRNA的表达。PCR条件:95℃退火15s,60℃延伸60s,共40个循环。采用GAPDH作为内标计算,样品目的基因的相对表达率(relativeexpression,RQ)采用ΔΔCT方法计算[5]。引物序列详见表1。
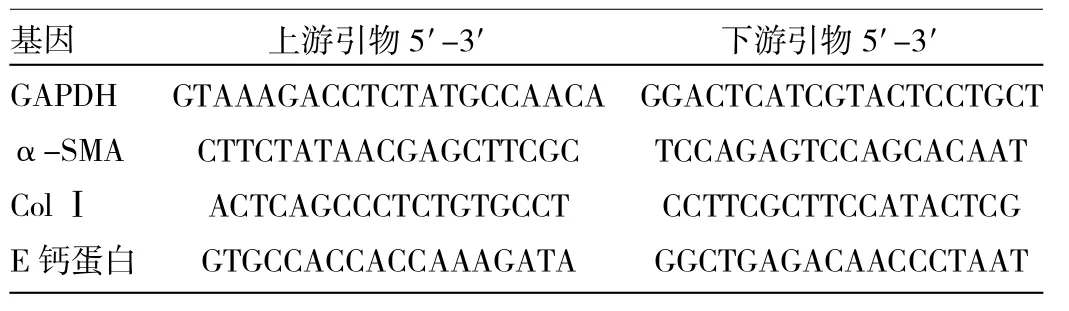
表1 GAPDH、α-SMA、ColⅠ与E钙蛋白引物序列
1.3.2 不同尿酸浓度诱导下的细胞miR-101a和COX-2 mRNA的表达 加尿酸培养24h后,收集细胞,加Trizol裂解,氯仿萃取,异丙醇浓缩过夜,提总RNA,取100ng总RNA,应用miRNA Isolation Kit试剂盒分离<100nt的小分子RNA,应用miScript Reverse Transcription Kit逆转录试剂盒合成cDNA,逆转录引物:5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCTTCAGTT-3'。再应用ABI 7500 FAST型荧光定量PCR仪进行检测miR-101a的表达。实时定量PCR条件:95℃退火5s,60℃延伸34s,共40个循环。上游引物:5'-TTCGTCGTCGTCGGTACAGTACTGTGAT-3',下游引物:5'-GCAGGGTCCGAGGTATTC-3'。采用U6 RNA作为内标进行标准化计算。U6上游引物:5'-CGCTTCACGAATTTGCGTGTCAT-3',下游引物:5'-CTGGTGTCGTGGAGTCGGCAA-3'。COX-2 mRNA表达的检测方法同上,COX-2上游引物:5'-TGATCGAAGACTACGTGCAACAC-3',下游引物:5'-CAGCAATCTGTCTGGTGAATGAC-3'。
1.4 Western blot检测
1.4.1 不同尿酸浓度诱导下的细胞α-SMA的表达 加尿酸培养48h后,裂解RNK-52E细胞提取总蛋白质,用BCA蛋白浓度测定试剂盒测定蛋白浓度,取30μg总蛋白,行10%SDS-PAGE电泳,转膜,5%脱脂牛奶封闭。一抗(α-SMA抗体,1∶500)4℃孵育过夜,TBS-T溶液洗膜,室温下加入IgG抗体(1∶4 000)孵育,洗膜,用Odyssey近红外双色激光成像系统选择800通道进行扫描蛋白电泳条带,以GAPDH作为内参照标化α-SMA的表达,用AlphaEaseFC凝胶成像分析软件进行半定量分析。
1.4.2 不同尿酸浓度诱导下的细胞COX-2的表达 步骤同上,一抗为COX-2抗体1∶800,二抗为山羊抗兔抗体1∶4 000。
1.5 免疫荧光检测不同尿酸浓度下ColⅠ的表达 尿酸诱导72h后,细胞用4%的多聚甲醛固定,0.5%Triton X-100破膜10min,5%的血清封闭室温下45min,一抗(ColⅠ抗体 1∶100)4℃孵育过夜,PBS漂洗,二抗(Dy-Light 549标记的驴抗兔,1∶500)37℃孵育1h,漂洗,再用4',6-二脒基-2-苯基吲哚染核,最后激光扫描共焦显微镜下观察。
1.6 miR-101a mimics片段的合成、转染NRK-52E细胞 miR-101a mimics片段由上海吉玛公司设计并合成。miR-101a mimics序列为:正义链:5'-UACAGUACUGUGUAUAACUGAA-3',反义链:5'-CAGUUAUACACACAGUACUGUAUU-3'。miR-101a mimics阴性对照为随机合成,正义链∶5'-UUCUCCGAACGUGUCACGUTT-3',反义链:5'-ACGUGACACGUUCGGAGAATT-3',与大鼠基因组各基因均无显著同源性。将NRK-52E细胞接种至6孔板,以每孔5μl的miR-101a mimics和5μl的Lipofectamine 2000转染细胞,分为3组,miR-101a组:先转染miR-101a mimics,再以100μmol/L尿酸培养基培养;空白对照组:以100μmol/L尿酸培养基培养;阴性对照组:细胞转染随机合成的miRNA NC片段,再以100μmol/L尿酸培养基培养。24h后弃去细胞培养基,PBS漂洗细胞,再收集细胞进行实时定量PCR测定miR-101a表达量以检测转染效果。
1.7 实时定量PCR检测转染后各组中E钙蛋白、ColⅠ、α-SMA和COX-2 mRNA的表达 实验方法与计算方法同上。
1.8 Western blot检测转染后各组中COX-2和α-SMA的表达 实验方法与计算方法同上。
1.9 免疫荧光检测转染后各组中ColⅠ的表达 实验方法与计算方法同上。
1.10 统计学处理 采用SPSS 17.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD检验。
2 结果
2.1 实时定量PCR检测不同尿酸浓度诱导下的细胞α-SMA、ColⅠ和E钙蛋白mRNA的表达 随着尿酸浓度的升高,α-SMA和ColⅠ的mRNA表达逐渐越高,而E钙蛋白mRNA表达越低,详见图1。
2.2 实时定量PCR检测不同尿酸浓度诱导下的细胞miR-101a和COX-2 mRNA的表达 随着尿酸浓度的升高,miR-101a表达减少,COX-2 mRNA表达增多,详见图2。

图1 不同尿酸浓度下α-SMA、ColⅠ和E钙蛋白mRNA的表达(与0μmol/L组比较,*P<0.05;与10μmol/L组比较,#P<0.05;与100μmol/L组比较,△P<0.05)
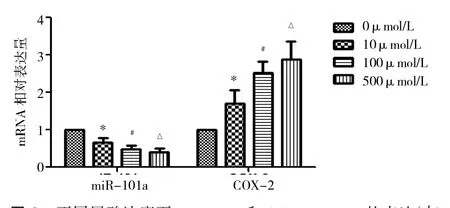
图2 不同尿酸浓度下miR-101a和COX-2 mRNA的表达(与0μmol/L组比较,*P<0.05;与10μmol/L组比较,#P<0.05;与100μmol/L组比较,△P<0.05)
2.3 Western blot检测不同尿酸浓度诱导下的细胞α-SMA表达水平的比较 随着尿酸浓度的升高,α-SMA表达水平越高,详见表2和图3。

表2 不同尿酸浓度下α-SMA蛋白的灰度值
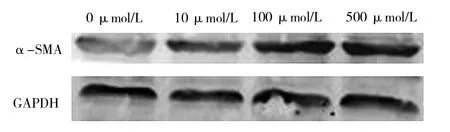
图3 不同尿酸浓度诱导下的细胞α-SMA的表达
2.4 Western blot检测不同尿酸浓度诱导下的细胞COX-2的表达 随着尿酸浓度的升高,COX-2的表达增多,详见表3和图4。
2.5 免疫荧光检测不同尿酸浓度下ColⅠ的表达 随着尿酸浓度的升高,ColⅠ表达水平越高,详见图5。
2.6 实时定量PCR测定转染效果 转染miR-101a mimics组miR-101a的表达量为122.33±27.67,较空白对照组(1.00±0.00)和阴性对照组(0.77±0.43)明显升高(P<0.05)。

表3 不同尿酸浓度下α-SMA蛋白的灰度值
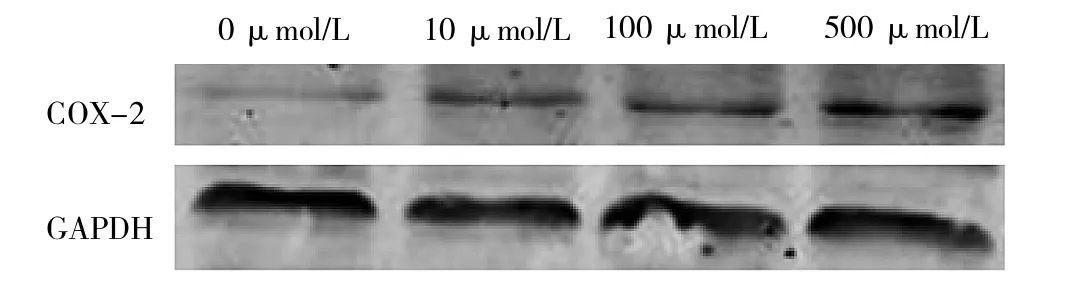
图4 不同尿酸浓度诱导下的细胞COX-2的表达
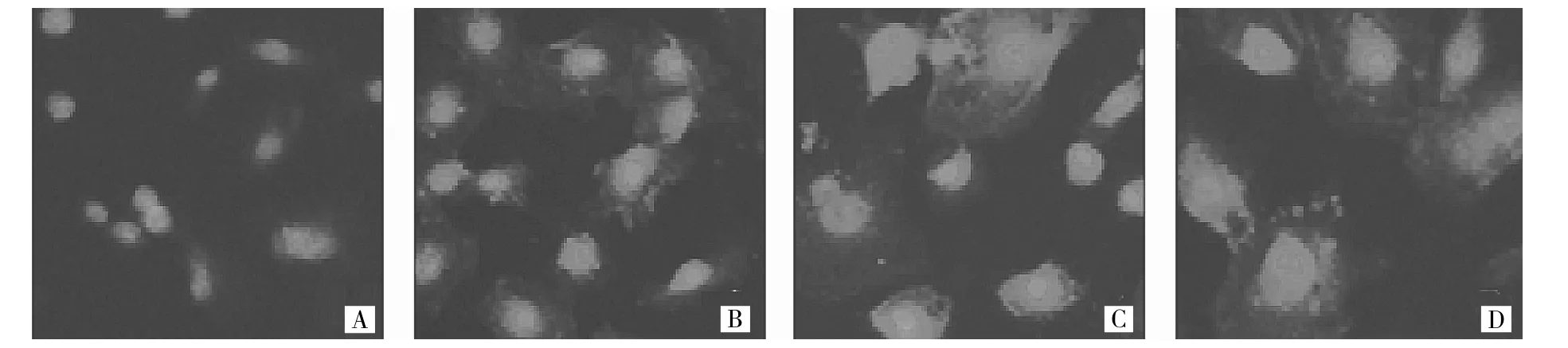
图5 不同尿酸浓度下ColⅠ的表达(A:0 μmol/L;B:10 μmol/L;C:100 μmol/L;D:500 μmol/L)
2.7 实时定量PCR检测转染后各组中E钙蛋白、ColⅠ、α-SMA和COX-2 mRNA的表达 转染miR-101a mimics组ColⅠ、α-SMA和COX-2 mRNA的表达量较空白对照组和阴性对照组明显减少,而E钙蛋白mRNA表达明显增多(P<0.05),空白对照组与阴性对照组间比较差异无统计学意义,详见图6。
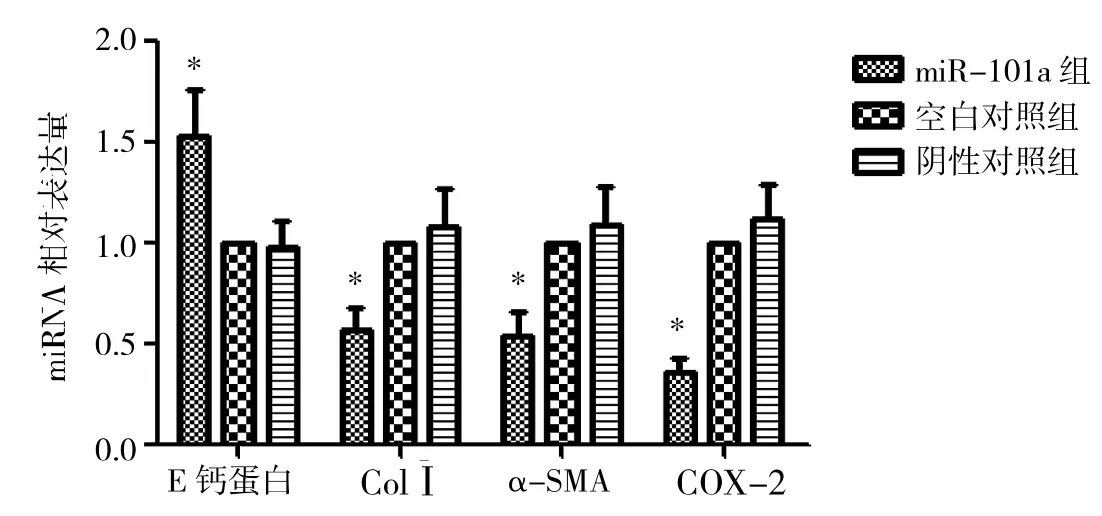
图6 转染后各组中E钙蛋白、ColⅠ、α-SMA和COX-2 mRNA的表达(与空白对照组比较,*P<0.05)
2.8 Western blot检测转染后各组中COX-2和α-SMA表达水平的比较 转染miR-101a mimics组COX-2和 α-SMA的表达量较空白对照组和阴性对照组明显减少(P<0.05),而空白对照组和阴性对照组间比较差异无统计学意义,详见表4和图7。
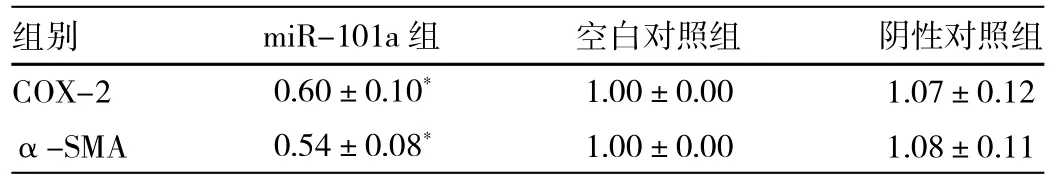
表4 转染后各组中COX-2及α-SMA灰度值的比较
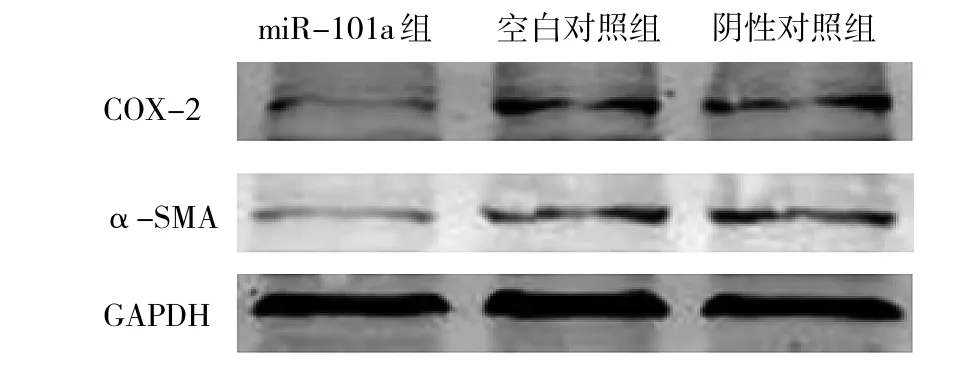
图7 转染后各组中COX-2和α-SMA的表达
2.9 免疫荧光检测转染后各组ColⅠ的表达 转染miR-101a mimics组ColⅠ的表达量较空白对照组和阴性对照组明显减少,详见图8。

图8 不同尿酸浓度下ColⅠ的表达(A:miR-101a组;B:空白对照组;C:阴性对照组)
3 讨论
高尿酸血症长期以来一直被认为是肾功能不全的表现之一,近年来越来越多的研究表明高尿酸血症也是导致肾功能不全发生、发展的重要原因之一。有临床资料显示,在血压正常的个体血清尿酸水平是肾功能下降的独立危险因素[6]。一项关于21 475例健康志愿者的临床调查研究显示,尿酸升高是肾脏疾病新的独立危险因素[7]。许多与肾脏疾病相关的危险因素都直接影响肾小管的结构或功能。一些促纤维基因或炎症介质诱导肾小管上皮细胞间充质转分化,后者是以α-SMA表达增多及E钙蛋白表达减少为特征的表型转化,这种表型转化与肾脏纤维化密切相关。
本实验证明尿酸可能诱导肾小管上皮细胞发生EMT,且呈浓度依赖性。Ryu等[8]研究表明尿酸通过活化Snail和Slug蛋白促进E钙蛋白合成减少降解增多,从而诱导肾小管上皮细胞发生EMT。另外,尿酸还可以同诱导氧化应激及局部炎症反应,激活局部肾素-血管紧张素系统,导致内皮细胞功能紊乱,从而引起肾脏损害[9]。COX-2是公认的重要促炎介质之一,介导前列腺素类炎症介质的产生,当受到炎症刺激时,COX-2被诱导处于高表达水平。体外研究表明,一定高浓度的尿酸能直接诱导肾脏系膜细胞合成COX-2和前列腺素E2(PGE2)的增加,促进炎症反应[10]。而炎症反应被证实与EMT发生密切相关,尤其表现在器官纤维化及肿瘤的发生等方面[11]。有研究报道,miR-101a与COX-2基因的3'UTR区序列互补配对并与之结合从而抑制该基因的表达,提示COX-2可能为miR-101a靶基因之一[12]。Tanaka等[13]通过实验证实带有荧光标记的COX-2 3'URT区域的报告结构基团,起荧光活性能被miR-101a显著抑制,说明miR-101a能直接与COX-2的3'URT直接结合,强烈推测COX-2是miR-101a的靶基因之一。本实验用尿酸诱导上皮细胞,发现ColⅠ和α-SMA表达升高,而E钙蛋白表达降低,并呈浓度依赖性,表明尿酸诱导的肾小管上皮细胞发生转分化,而同时我们也检测到miR-101a表达下调,而COX-2表达上调,提示尿酸诱导肾小管上皮细胞发生EMT可能和miR-101a与COX-2相关,COX-2参与促进EMT,而miR-101a可能参与其中的调节。进一步我们设计实验,体外肾小管上皮细胞培养并转染miR-101a,发现COX-2、α-SMA、ColⅠ表达明显减少,而E钙蛋白表达增多,提示miR-101a能抑制尿酸诱导的肾小管转分化,实验结果支持miR-101a可能参与尿酸诱导EMT的调节。
综上所述,本研究结果提示尿酸可诱导肾小管上皮细胞发生EMT,并呈浓度依赖性,且可能与尿酸引起的局麻炎症反应相关,miR-101a及COX-2参与其中的调节作用。本研究阐述了尿酸导致肾脏损害的另一个可能的潜在机制,但具体机制尚有待进一步的研究。
[1]Wang H H,Xiang G D.Changes of plasma concentration of osteoprotegerin and its association with endothelial dysfunction before and after hypouricemic therapy in patients with hyperuricemia[J].Mod Rheumatol,2014,20:1-5.
[2]Chen L,Lan Z,Lin Q,et al.Polydatin ameliorates renal injury by attenuating oxidative stress-related inflammatory responses in fructose-induced urate nephropathic mice[J].Food Chem Toxicol,2013,52:28-35.
[3]Kim I Y,Lee D W,Lee S B,et al.The role of uric acid in kidney fibrosis:experimental evidences for the causal relationship[J].Biomed Res Int,2014,2014:638732.
[4]Strillacci A,Griffoni C,Sansone P,et al.MiR-101 downregulation is involved in cyclooxygenase-2 overexpression in human colon cancer cells[J].Journa,2009,315(8):1439-47.
[5]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C (T))Method[J].Methods,2001,25(4):402-408.
[6]Bellomo G,Venanzi S,Verdura C,et al.Association of uric acid with change in kidney function in healthy normotensive individuals[J].Am J Kidney Dis,2010,56(2):264-272.
[7]Obermayr R P,Temml C,Gutjahr G,et al.Elevated uric acid increases the risk for kidney disease[J].J Am Soc Nephrol,2008, 19(12):2407-2413.
[8]Ryu E S,Kim M J,Shin H S,et al.Uric acid-induced phenotypic transition of renal tubular cells as a novel mechanism of chronic kidney disease[J].Am J Physiol Renal Physiol,2013,304 (5):F471-F480.
[9]Yu M A,Sanchez-Lozada L G,Johnson R J,et al.Oxidative stress with an activation of the renin-angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction[J].J Hypertens,2010,28 (6):1234-1242.
[10]Nicholas K,Melissa C,Eliana G V,et al.Identification of the molecular pathways that drive constitutive renal COX-2 expression:implications for novel COX-2-targetted therapies that spare the cardiovascular system[J].The FASEB Journal, 2014,28(1):837-839.
[12]Chakrabarty A,Tranguch S,Daikoku T,et al.,MicroRNA regulation of cyclooxygenase-2 during embryo implantation[J].Journa,2007,104(38):15144-151449.
[13]Tanaka T,Haneda S,Imakawa K,et al.A microRNA,miR-101a, controls mammary gland development by regulating cyclooxygenase-2 expression[J].Differentiation,2009,77(2):181-187.
Roles of microRNA-101a in epithelial-mesenchymal transition of rat renal tubular epithelial cells induced by uric acid
Objective To investigate the role of microRNA-101a (miR-101a)in epithelial-mesenchymal transition (EMT)of rat renal tubular epithelial cells induced by uric acid.Methods Cultured renal tubular epithelial NRK-52E cells were treated with medium containing various concentration of uric acid(0 μmol/L,10 μmol/L,100 μmol/L,500 μmol/L).The expression of α-smooth muscle actin(α-SMA)mRNA and protein was detected by real time PCR and Western Blot,expression of collagen I(ColⅠ)mRNA and protein by real time PCR and immunofluorescence,and expression of E-cadherin mRNA by real time PCR.The expression of miR-101a,cycloxygenase-2(COX-2)was detected by real time PCR or Western Blot.Before treated with 100 μmol/L uric acid,the cultured NRK-52E cells were transfected with miR-101a(miR-101a group),transfected with randomly synthesized miRNA (negative control group)or not transfected(blank control group).Real time PCR was preformed to examine efficiency of transfection.Then the expression of α-SMA,ColⅠ,E-cadherin and COX-2 was determined.Results With the increasing of uric acid concentration,the expression of α-SMA and ColⅠwas increased,and E-cadherin decreased,while the expression of miR-101a decreased and COX-2 increased.The expression of α-SMA,ColⅠand COX-2 in miR-101a group was significantly decreased,E-cadherin increases,compared with blank control group and negative control group(P<0.05), while there was no significant difference between the latter two groups.Conclusion Uric acid induces EMT of rat real tubular epithelial NRK-52E cells in a concentration-dependent manner,miR-101a and inflammation may be involved in EMT of NRK-52E cells induced by uric acid.
Uric acid MicroRNA-101a Cycloxygenase-2 Epithelial-mesenchymal transition Renal tubular epithelial cells
2014-07-23)
(本文编辑:严玮雯)
325027 温州医科大学附属第二医院肾内科(叶菡洋、陈琰、李占园、金领微、郑育、王红、周志宏),内分泌科(金建)
周志宏,E-mail:markzhou@wzhealth.com

