两种不同类型的胃癌组织中DNA氧化损伤的水平及临床意义
林海鸿 姜平 屠洋洋 林宪慧 徐涛 罗顺斌 余俊华 蔡剑平 郑志强
两种不同类型的胃癌组织中DNA氧化损伤的水平及临床意义
林海鸿 姜平 屠洋洋 林宪慧 徐涛 罗顺斌 余俊华 蔡剑平 郑志强
目的 检测胃腺癌、印戒细胞癌组织及正常胃黏膜组织中8-羟基脱氧鸟苷(8-oxodGsn)水平,探讨DNA氧化损伤与不同类型胃癌临床指标间的关系。方法 提取42例胃癌(腺癌28例,印戒细胞癌14例)及癌旁5cm以外的正常组织的DNA,并采用核酸酶P1和碱性磷酸酶消化成单个核苷,再采用高效液相色谱-串联质谱法(LC-MS/MS)检测其8-oxodGsn的水平;同时联合免疫组化法对组织中的8-oxodGsn进行定位分析。结果 不同类型胃癌组织与正常组织中8-oxodGsn水平的差异均有统计学意义(均P<0.05)。8-oxodGsn主要分布于肿瘤细胞的细胞质和细胞核内,腺癌细胞中以细胞核分布居多,印戒细胞癌中以细胞质分布居多。不同类型胃癌组织中8-oxodGsn水平在癌组织浸润深度、淋巴结转移程度、远处器官转移程度、临床病理分期等差异均有统计学意义(均P<0.05)。结论 8-oxodGsn水平在两种类型的胃癌组织中均有不同程度的增加,提示DNA氧化损伤可能是胃癌发生、发展的重要因素。
8-oxodGsn 胃腺癌 印戒细胞癌 高效液相色谱-串联质谱
氧化应激在肿瘤的发生、发展过程中扮演着重要角色,尤其是DNA的氧化。当过强的氧化刺激因素,诸如紫外线、生化及生物损伤等造成DNA上的碱基发生氧化后,未能及时修复的DNA氧化损伤会显著增加体内突变率。越来越多的证据表明,肿瘤细胞内存在着高水平的氧化损伤,在多种肿瘤组织中均检测到高水平的8-羟基脱氧鸟苷(8-oxodGsn)[1]。胃癌的发生是一个复杂、多因素的过程,DNA氧化损伤是导致胃癌发生的原因之一[2]。目前,关于不同类型的胃癌组织中DNA的氧化损伤程度是否相同尚未清楚。笔者采用LC-MS/MS定量方法和免疫组化定位方法对常见类型的胃癌组织及正常胃黏膜组织中的8-oxodGsn水平进行检测,探讨DNA氧化产物8-oxodGsn在这两种不同类型胃癌组织中的水平及其与临床病理指标间的关系,现报道如下。
1 材料和方法
1.1 材料及标本 [13C,15N2]8-oxodGsn(加拿大Toronto Research Chemicals公司),[15N5]dGsn(美国Cambridge Isotope Laboratories公司),甲磺酸去铁铵(DFOM)(美国Sigma-Aldrich公司),TRIzol(美国Invitrogen公司),蛋白酶K(美国AMERESCO公司),核酸酶P1(日本WAKO公司),碱性磷酸酶(美国NEB公司),小鼠抗8-oxoGsn单克隆抗体(美国Abcam公司),山羊抗小鼠IgG抗体(北京康为世纪有限公司),RNase-free DNase I(日本Takara公司),色谱级甲醇、乙腈、醋酸铵(美国Fisher Scientific公司),免疫组化试剂盒PV6000、DAB显色剂、抗体稀释液、伊红、苏木素、丙酮(北京中衫金桥生物科技有限公司),异丙醇、氯仿、乙醇、冰醋酸等试剂均为分析纯(北京化学试剂有限公司)。Agilent1290高效液相仪,Agilent6490质谱仪。所有组织标均本来自温州医科大学附属第二医院普外科,其中胃癌组织42例,包括腺癌28例和印戒细胞癌14例,对照组组织为所对应同一例患者癌旁5cm以外的正常组织。
1.2 DNA的提取、消化及质谱检测 DNA的抽提和消化按照欧洲DNA氧化损伤标准委员会(ESCODD)推荐的操作方法[3],在此过程中加入DFOM来降低DNA人为氧化水平。抽提得到的DNA需要进一步消化成单个核苷用于质谱检测,具体步骤如下:取20μg DNA,用1mmol/L的DFOM溶液定容至79μl,100℃金属浴变性3min,立即冰上冷却,加入10μl核酸酶P1(1U/μl),再37℃水浴孵育2h,加入11μl碱性磷酸酶稀释液[其中包括1μl碱性磷酸酶(10U/μl)和10μl buffer(10X)],37℃水浴孵育1h,离心(10 000g,10min,4℃),取90μl上清液于内插管中,加入5μl[13C,15N2]8-oxodGsn(20pg/μl)和2μl[15N5]dGsn(0.25ng/μl),吹打混匀。直接进行质谱检测或者-80℃保存。液相色谱条件和质谱条件如Gan等[4]所描述。
1.3 方法 水化组织切片5min,RNA酶处理1h,磷酸盐缓冲液(PBS)清洗后,3mol/L盐酸变性5min,再放入1mol/L Tris-base溶液中5min,PBS清洗,加入山羊血清封闭30min,甩去血清,再滴加一抗(小鼠抗8-oxodGsn单克隆抗体),4℃孵育过夜,并设立对照,以PBS代替一抗为阴性对照,PBS振洗再依次滴加二抗(山羊抗小鼠IgG抗体)及辣根过氧化物酶标记的显色底物,DAB染色,甲基绿复染,脱水,透明后中性树胶封片。
1.4 临床分期 参照美国癌症联合委员会(AJCC)的制定第7版肿瘤分期手册[5]。
1.5 结果判断 随机取5个高倍视野,观察8-oxodGsn在细胞核和细胞质的着色情况,并进一步分析细胞核着色及细胞质着色细胞所占百分比或个数。
1.6 统计学处理 采用SPSS 16.0统计软件,计量资料以表示,组间比较采用t检验。
2 结果
2.1 胃癌组织和正常组织间8-oxodGsn水平的比较 见图1。
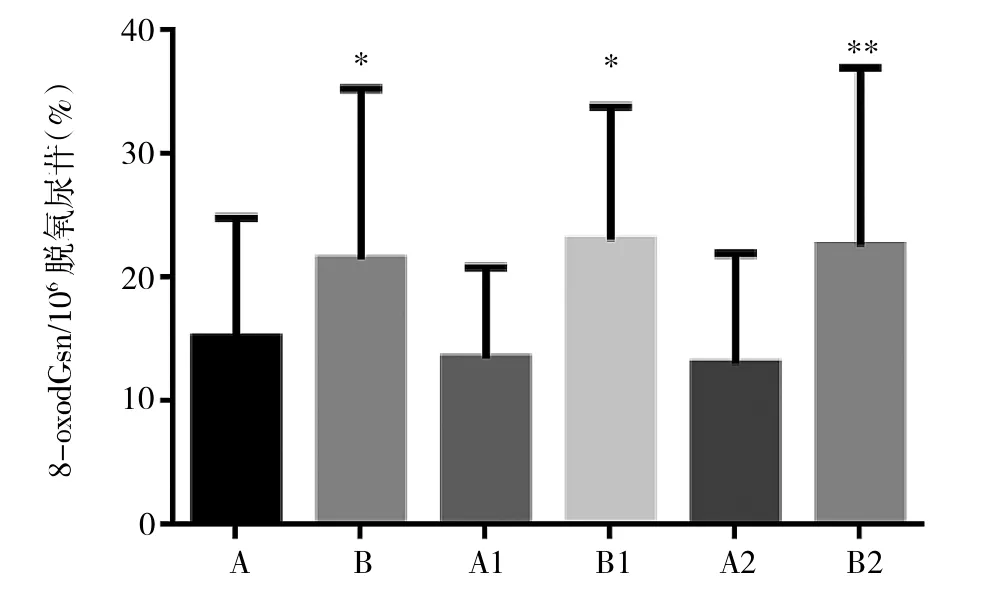
图1 胃癌组织和正常组织中8-oxodGsn水平的比较(A:胃癌旁正常组织;B:胃癌组织;A1:印戒细胞癌旁正常组织;B1:印戒细胞癌组织;A2:胃腺癌旁正常组织;B2:胃腺癌组织。与正常组织比较,*P<0.05,**P<0.01)
由图1可见,正常组织中8-oxodGsn水平均明显高于胃癌组织(均P<0.01)。
2.2 胃腺癌与印戒细胞癌组织的免疫组化结果 8-oxodGsn主要分布于胃癌细胞的细胞质和细胞核内,在腺癌组织中以细胞核相对较多,细胞质较少,而在印戒细胞癌中则以细胞质居多,细胞核稍少,详见图2、3。

图2 腺癌中8-oxodGsn的表达(免疫组化染色,×400)

图3 印戒细胞癌中8-oxodGsn的表达(免疫组化染色,×400)
2.3 8-oxodGsn水平与临床病理特征的关系 见表1。
由表1可见,年龄≥56岁与<56岁患者在腺癌和印戒细胞癌中8-oxodGsn水平的差异均无统计学意义(均P>0.05),不同性别的腺癌和印戒细胞癌患者中8-oxodGsn水平的差异均无统计学意义(均P>0.05)。无论是腺癌还是印戒细胞癌,未浸润到浆膜层的癌组织中8-oxodGsn水平明显低于浸润到浆膜的癌组织,淋巴结转移的癌组织中8-oxodGsn水平要比未转移的高,临床病理分期4期比3期高,差异均有统计学意义(均P<0.05)。
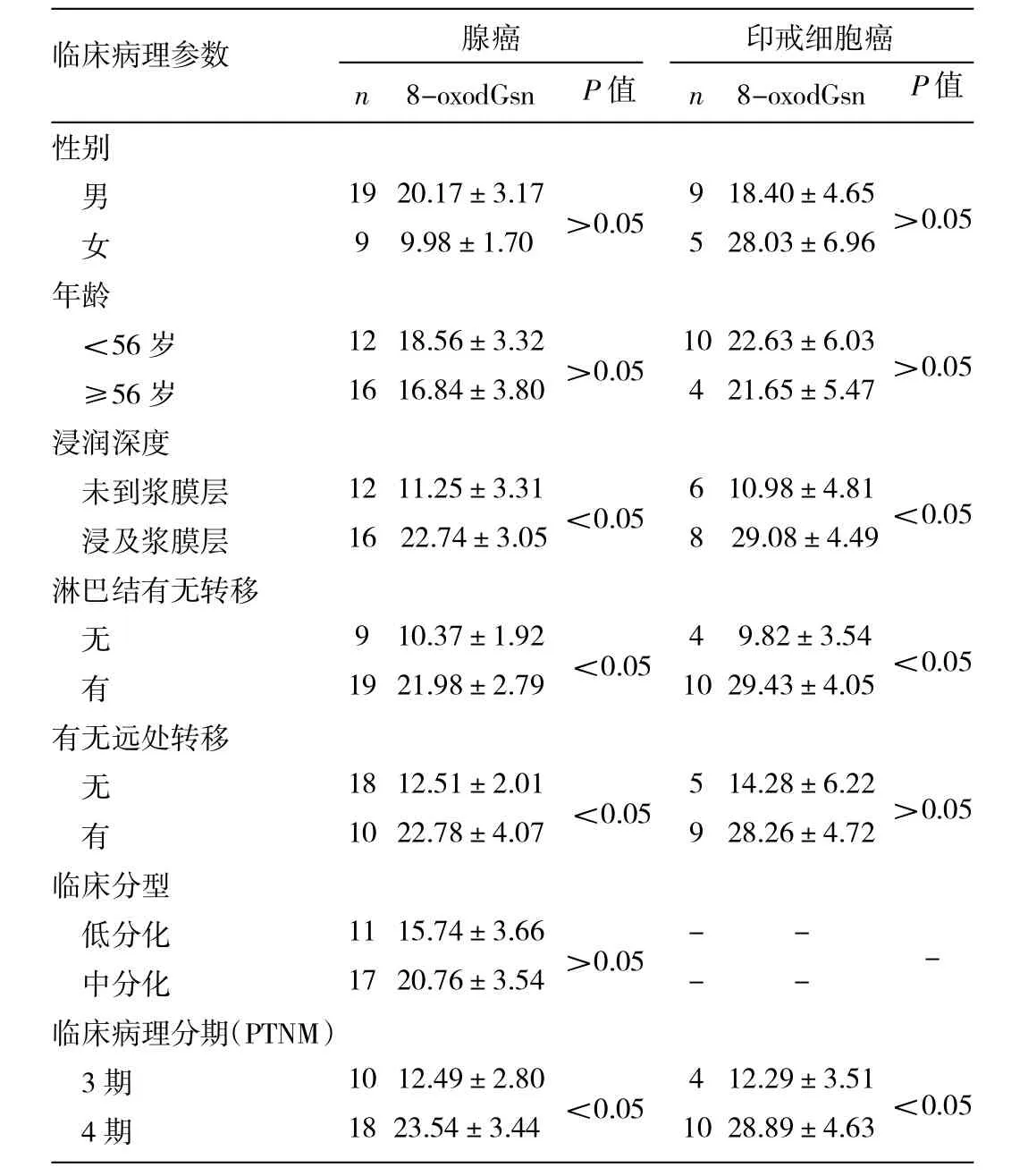
表1 8-oxodGsn水平与临床病理特征的关系(%)
3 讨论
胃组织DNA氧化与其组织固有层的炎症细胞产生的活性氧簇(ROS)密切相关,在氧化过程中产生过量的ROS可以攻击临近细胞的细胞核和线粒体DNA,从而导致上述细胞DNA损伤。持续的氧化应激在癌症发生、发展中起重要作用,这就是癌症发病机制的持续氧化学说。虽然该学说中的具体细胞或分子机制,例如是否通过慢性炎症的积累还不很清楚,但已有的证据表明,氧化应激DNA损伤是胃癌的发生、发展的一个重要因素[6]。
本研究通过免疫组化染色发现,两种不同类型的胃癌组织中8-oxodGsn在细胞内的分布状况不同:在印戒细胞癌组织中,细胞质中8-oxodGsn水平较多,细胞核相对较少,这与以前的研究结果相一致,其原因可能是线粒体的DNA缺乏蛋白质保护,对自由基攻击更加敏感,且DNA修复率低,因此线粒体DNA比细胞核DNA更容易发氧化[7-8]。本研究中发现,腺癌组织中8-oxodGsn的分布与印戒细胞癌组织中的分布相反,即细胞核中8-oxodGsn水平较多,而细胞质少。笔者认为这可能与腺癌的DNA氧化水平程度较印戒细胞癌水平更高是有一定联系的。
8-oxodGsn作为一个普遍存在的DNA氧化损伤标志物,国外研究发现8-oxodGsn与癌症的发生存在着紧密的联系[9],可能是由于损伤DNA没有被及时修复致使损伤DNA累积引起基因突变。在肿瘤组织中的水平远远高于正常组织中的水平,并且8-oxodGsn的高表达与很多肿瘤的预后不佳密切相关[8,10-12]。因此,8-oxodGsn作为一种氧化突变分子,可能是导致基因突变和细胞癌变的原因之一,从这个角度讲,8-oxodGsn检测很可能可以用于评价不同种类胃癌易感人群的预警和抗氧化治疗效果,并且有助于我们更好地判断胃癌患者的预后。
[1]Loft S,Poulsen H E.Cancer risk and oxidative DNA damage in man[J].J Mol Med(Berl),1996,74(6):297-312.
[2]Baik S C,Youn H S,Chung M H,et al.Increased oxidative DNA damage in Helicobacter pylori-infected human gastric mucosa [J].Cancer Res,1996,56(6):1279-1282.
[3]European Standards Committee on Oxidative DNA Damage(ESCODD).Measurement of DNA oxidation in human cells by chromatographic and enzymic methods[J].Free Radic Biol Med, 2003,34(8):1089-1099.
[4]Gan W,Nie B,Shi F,et al.Age-dependent increases in the oxidative damage of DNA,RNA,and their metabolites in normal and senescence-accelerated mice analyzed by LC-MS/MS: urinary 8-oxoguanosine as a novel biomarker of aging[J].Free Radic Biol Med,2012,52(9):1700-1707.
[5]Groot Koerkamp B,Wiggers J K,Allen P J,et al.American Joint Committee on Cancer staging for resected perihilar cholangiocarcinoma:a comparison of the 6th and 7th editions[J].HPB (Oxford),2014,16(12):1074-1082.
[6]Chaturvedi R,de Sablet T,Asim M,et al.Increased Helicobacter pylori-associated gastric cancer risk in the Andean region of Colombia is mediated by spermine oxidase[J].Oncogene,2014, 273.
[7]Richter C,Park J W,Ames B N.Normal oxidative damage to mitochondrial and nuclear DNA is extensive[J].Proc Natl Acad Sci U S A,1988,85(17):6465-6467.
[8]Yakes F M,Van Houten B.Mitochondrial DNA damage is more extensive and persists longer than nuclear DNA damage in human cells following oxidative stress[J].Proc Natl Acad Sci U S A, 1997,94(2):514-519.
[9]Cerda C,Sanchez C,Climent B,et al.Oxidative stress and DNA damage in obesity-related tumorigenesis[J].Adv Exp Med Biol 2014,824:5-17.
[10]Murtas D,Piras F,Minerba L,et al.Nuclear 8-hydroxy-2'-deoxyguanosine as survival biomarker in patients with cutaneousmelanoma[J].Oncol Rep,2010,23(2):329-335.
[11]Sheridan J,Wang L M,Tosetto M,et al.Nuclear oxidative damage correlates with poor survival in colorectal cancer[J].Br J Cancer,2009,100(2):381-388.
[12]Soini Y,Haapasaari K M,Vaarala M H,et al.8-hydroxydeguanosine and nitrotyrosine are prognostic factors in urinary bladder carcinoma[J].Int J Clin Exp Pathol,2011,4(3):267-275.
[13]Sova H,Jukkola-Vuorinen A,Puistola U,et al.8-Hydroxydeoxyguanosine:a new potential independent prognostic factor in breast cancer[J].Br J Cancer,2010,102(6):1018-1023.
8-oxodGsn levels in gastric adenocarcinoma and signet ring cell carcinoma
Objective To investigate oxidative DNA damage in gastric adenocarcinoma,signet ring cell carcinoma and normal gastric mucosa by detecting 8-dihydro-2'-deoxyguanosine (8-oxodGsn)levels.Methods Specimens of gastric cancer tissues and normal gastric mucosa were obtained from 28 cases of adenocarcinoma and 14 cases of signet ring cell carcinoma.The DNA was extracted from tissue specimens and digested by nuclease P1 and alkaline phosphatase.The levels of 8-oxodGsn were determined by LC-MS/MS method and the expression of 8-oxodGsn in tissue was detected by immunohistochemical method.Results There was a significant difference in 8-oxodGsn levels between gastric cancer and normal gastric mucosa(P<0.05).Immunohistochemical staining showed that 8-oxodGsn was mainly distributed in nucleus in gastric adenocarcinoma,while mainly in cytoplasm in signet ring cell carcinoma.The expression levels of 8-oxodGsn were significantly correlated with invasion depth,lymph node metastasis,distant metastasis and clinical staging of gastric cancer(all P<0.05).Conclusion 8-oxodGsn levels are increased in gastric adenocarcinoma and gastric signet ring cell carcinoma in different extend,which suggested that oxidative DNA damage may be an important factor in the development of gastric cancer.
8-oxodGsn Gastric adenocarcinoma Signet ring cell carcinoma LC-MS/MS
2014-08-18)
(本文编辑:严玮雯)
325027 温州医科大学附属第二医院普外科(林海鸿、屠洋洋、林宪慧、余俊华),药理教研室(罗顺斌、徐涛);卫生部北京医院(蔡剑平、姜平)
郑志强,E-mail:zhe_zhi2000@yahoo.com.cn

