动物隐花色素研究进展
吕垣澄,吴晓晖
复旦大学生命科学学院,遗传工程国家重点实验室及发育与疾病国际联合研究中心,遗传与发育协同创新中心,上海 200433
隐花色素(Cryptochromes)是一类在高等真核生物中广泛存在的、对蓝光和近紫外光敏感的黄素类蛋白,也称紫外光-A/蓝光受体(UV-A/blue-light receptor)。隐花色素因其有助于孢子繁殖的隐花植物吸收蓝光而得名,植物隐花色素主要在植物光形态建成、开花调控、生物钟调控及气孔开放和感知磁场中发挥作用[1]。1993年拟南芥隐花色素基因cry1(又名hy4)首先被克隆[2],1996年起,黑腹果蝇(Drosophila melanogaster)、小鼠(Mus musculus)和人(Homo sapiens)等动物的隐花色素基因也陆续被克隆。与植物隐花色素不同,动物的隐花色素主要在动物生物钟调控、免疫应答、糖类代谢以及感知磁场等过程中发挥作用。本文将对动物隐花色素的克隆与表达、结构特征、生理功能和作用机制进行综述。
1 动物隐花色素的克隆与表达
隐花色素在多种动物中广泛存在。无脊椎动物中,果蝇的隐花色素基因dCry克隆于1996年[3]。2005年,帝王斑蝶(Danaus plexippus)的隐花色素基因dpCry1和dpCry2也被发现[4]。目前发现,果蝇之外的绝大部分昆虫都有不止一个隐花色素基因[5]。哺乳动物一般具有两个隐花色素基因,其中人的隐花色素基因hCry1和 hCry2克隆于1996年[3,6]。两年后,小鼠隐花色素基因mCry1和mCry2也被克隆[7]。此后,非哺乳类脊椎动物的隐花色素基因也被陆续克隆,目前已知非洲爪蟾(Xenopus laevis)具有XtCry1、XtCry2和 XtCry43个隐花色素基因[8],鸡(Gallus gallus domesticus)具有cCry1、cCry2和cCry43个隐花色素基因[9]。斑马鱼(Danio rerio)则具有 zCry1a、zCry1b、zCry2a、zCry2b、zCry3和 zCry46个隐花色素基因[10]。
动物隐花色素常高表达于神经组织。果蝇dCRY高表达在腹侧神经元[11](Ventral lateral neurons,LNvs)及复眼感光细胞[12],主要定位于细胞质。小鼠mCRY1高表达于视交叉上核(Suprachiasmatic nucleus,SCN),定位于线粒体;mCRY2高表达于视网膜,定位于细胞核[7]。人hCRY2高表达于视网膜神经节细胞层(Ganglion cell layer,GCL),定位于细胞核和细胞质[13]。
2 动物隐花色素的结构特征
动物隐花色素蛋白包含N端的光修复酶同源区(Photolyase homology region,PHR)以及序列和长度不保守的 C端调控尾区(C-terminal regulatory tail region)。前者缺乏光修复酶的DNA损伤修复功能,后者与蛋白细胞内定位有关[3]。2011年,Zoltowski等[14,15]解析了果蝇隐花色素蛋白dCRY的结构。PHR区的三维结构包含N端的α/β结构域和C端的螺旋结构域,两个结构域间是一个长的联结。螺旋结构域的两个凸角形成一个腔,可以非共价结合黄素腺嘌呤二核苷酸(Flavin adenine dinucleotide,FAD)。PHR区凹槽处的催化中心不结合 DNA底物,而是结合C端调控尾上第536位上保守的色氨酸(Trp536)突出,从而模拟光修复酶对DNA光化产物的识别。dCRY上的Trp 342、Trp 397和Trp 4203个氨基酸组成的光活化电子传递链接受光能后,能将结合的氧化态 FAD(FADox)转变为双电子还原态 FAD(FAD•-)。这一光致还原过程会引发dCRY构象改变,导致C端调控尾离开PHR区的凹槽。2013年,Czarna等[16]又解析了小鼠隐花色素蛋白 mCRY1的结构,mCRY1与dCRY在个别氨基酸上的差异赋予mCRY1一些不同的特性。如mCRY1的Ser71、Ser280是腺苷酸活化蛋白激酶AMPK的磷酸化位点,可以响应细胞的代谢状态而调控 mCRY1的稳定性;Ser247是丝裂原活化蛋白激酶MAPK的磷酸化位点,影响mCRY1作为转录抑制物的活性。
3 动物隐花色素调控生物钟的功能与作用机制
生物钟是生物体行为、生理和代谢活动广泛存在的昼夜节律。动物生物钟的形成和维持依靠转录/翻译负反馈环路中的转录激活物和抑制物,它们使体内生物钟蛋白以及钟控蛋白的含量昼夜变化。隐花色素参与了生物钟的形成。根据隐花色素在调控生物钟中的作用,它们被分为两类(图 1)。I型隐花色素(如果蝇dCRY)是无转录抑制作用,作为光受体对光响应的隐花色素。II型隐花色素(如小鼠和人的CRY)作为转录抑制物,对光无依赖。有意思的是,帝王斑蝶既具有类似dCRY的I型光依赖但无抑制作用的隐花色素dpCRY1,也具有类似mCRY1/2的II型有抑制作用但无光依赖的隐花色素 dpCRY2[4]。斑马鱼中,zCRY3和zCRY4是类似dCRY的I型隐花色素,zCRY1a、zCRY1b、zCRY2a和zCRY2b是类似mCRY1/2的II型隐花色素[10]。
dCRY是果蝇生物钟转录/翻译负反馈环路的一部分,参与对光响应和生物钟调控。在黑暗状态下,dCRY的 C端尾嵌入 PHR区的凹槽,阻止其与Timless蛋白及E3泛素连接酶JETLAG (JET) 相结合[14,17]。此时,转录因子CLOCK和CYCLE激活携带E-box启动子元件的基因period (per)、timless (tim)以及cry表达[18]。PER蛋白与TIM蛋白相结合形成复合物,磷酸化后进入核内抑制CLOCK和CYCLE的功能,从而保持PER与TIM的含量稳定在较低水平。在光照下,dCRY蛋白PHR区结合的FAD被光致还原引发 dCRY构象改变,暴露出的 PHR区与TIM及JET结合。JET的泛素化作用导致dCRY和TIM降解,从而解除 PER与 TIM对 CLOCK和CYCLE的抑制,促进per和tim表达。野生型果蝇在夜间被光刺激后,会表现出时相位移。而具有FAD结合位点突变的 cryb果蝇即使给予正常明暗周期,其PER和TIM蛋白的表达也发生紊乱[19]。
小鼠等哺乳动物的CRY1和CRY2属于充当转录抑制物的II型隐花色素。小鼠视交叉上核CRY1的表达呈现昼夜节律,在连续黑暗中也能保持。野生型小鼠在连续黑暗中能保持与在正常光暗周期下相同的约 24 h的自主活动周期,不受光照影响。mCry1或mCry2敲除小鼠在正常光暗周期下能维持约24 h的自主活动周期,但在连续黑暗中分别展现加速和减缓的周期性自主活动[20]。小鼠自主的节律性活动不仅依靠mCRY1和mCRY2,也受到光受体(视黑素)传递的光信号调节[21]。mCry1和 mCry2双敲除的小鼠,在连续黑暗下完全丢失自主活动节律,但在正常光暗周期下仍能维持约24 h的自主活动周期[20]。在夜里给予双敲除小鼠光诱导,能使Per表达上调形成类似于生物钟的相移[22]。
哺乳动物生物钟也依赖于内在的转录/翻译负反馈环路(图 1)。在生物钟周期的起始,转录因子CLOCK-BMAL1异源二聚体激活启动子区含E盒增强子的基因 Cry1、Cry2、Per1、Per2、Per3、Rev-erbα和Rev-erbβ等表达。产生的各种CRY与PER蛋白在细胞质中结合并入核。一段时间后,随着上述蛋白在细胞核内浓度的增加,CRY蛋白发挥转录抑制功能,阻遏CLOCK和BMAL1介导的转录。另一方面,表达出的REV蛋白入核并与促进Bmal1基因转录的ROR蛋白竞争性结合Bmal1启动子中的RORE响应元件,从而阻遏Bmal1的转录[23]。这些事件导致CLOCK-BMAL1异源二聚体浓度降低,转录激活水平进一步下降。随后,新一轮生物钟周期又随着核内CRY、PER和 REV等蛋白表达下降和降解,CLOCK-BMAL1异源二聚体所受阻遏的解除而逐渐启动[24]。
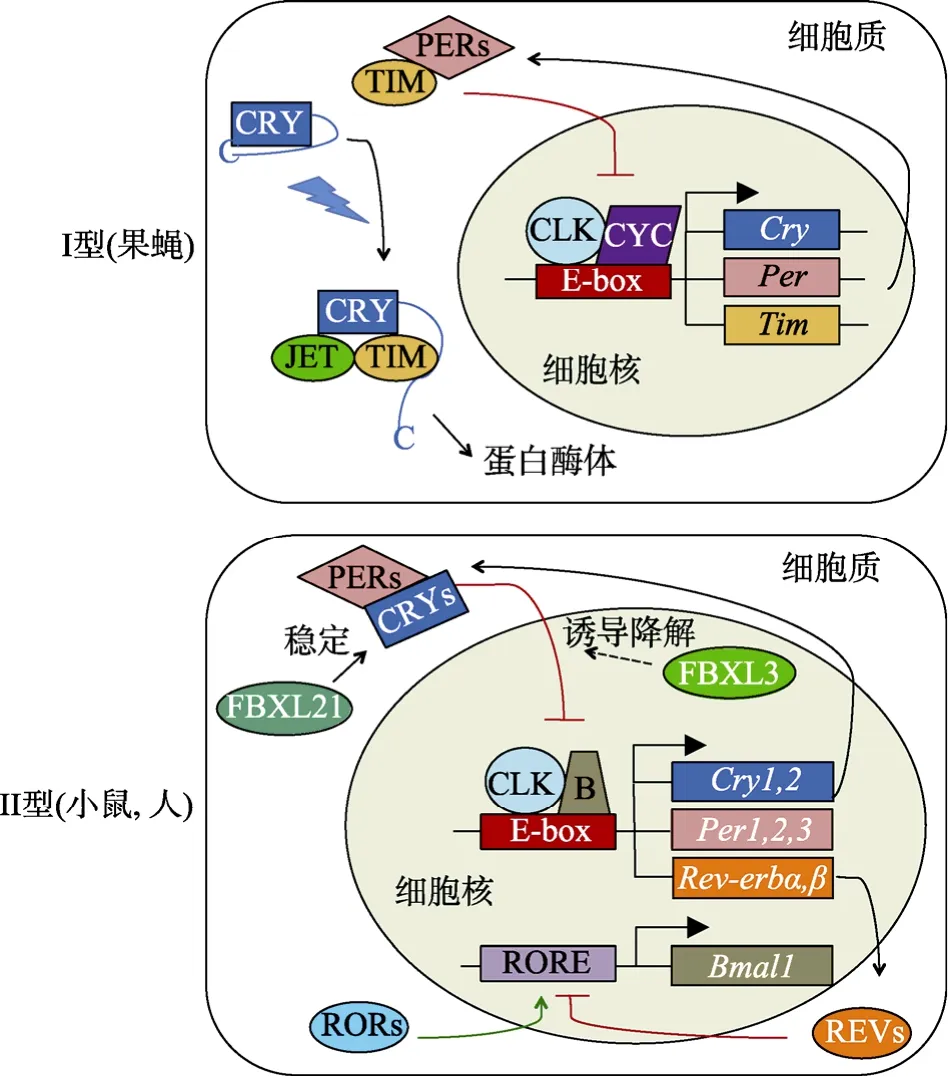
图1 两种类型隐花色素的转录/翻译反馈循环的示意图
除了转录/翻译负反馈循环路,磷酸化、泛素化、乙酰化、Sumo化等翻译后修饰对于调控生物钟蛋白的稳定性及细胞亚定位也起着重要作用。以CRY蛋白为例,属于F盒型E3泛素连接酶家族的FBXL3在核内结合CRY并诱导其泛素化降解[25,26]。同一家族的FBXL21则主要在细胞质中结合CRY保持其稳定[27]。另外,CRY1的Ser 247和CRY2的Ser 265位点一样都可被激酶 MAPK磷酸化,增强自身对CLOCK-BMAL1异源二聚体的阻遏活性,但CRY2的C端比CRY1多一个可被激酶DYRK1A磷酸化的Ser 557位点[28]。该位点磷酸化伴随着糖原合成酶激酶GSK-3β介导的Ser 553位点磷酸化,最终诱导CRY2自身被蛋白酶体降解[29],这使 CRY2对 CLOCKBMAL1异源二聚体的阻遏效果弱于 CRY1。这样,在CRY1和CRY2核内蛋白总量相对恒定时,其比例将可以双向调控生物钟周期[30]。这与 Cry1和 Cry2基因敲除小鼠分别展现加速和减缓的周期性自主活动相吻合[20]。
隐花色素也是生物钟与糖类代谢和免疫应答联系的中心分子。小鼠CRY1和CRY2作用于糖皮质激素受体(Glucocorticoid receptor)后,抑制糖皮质激素受体参与的转录[31]。CRY1和CRY2结合小分子KL001后,避免自身被泛素化降解,CRY1量增多,CRY2量则维持稳定,在减缓生物钟的同时抑制胰高血糖素诱导的糖异生作用[30]。而缺少了CRY1和CRY2,细胞 NF-κB和 PKA信号通路会被激活,前炎症细胞因子的水平提升[32]。
4 动物隐花色素在磁场感知中的作用和可能机制
磁场感知(Magnetoreception)是指生物利用地磁场为归航、筑巢及长距离迁徙等行动提供方位信息的能力。昆虫、鱼类、鸟类和哺乳动物的许多物种都有磁场感知能力。例如,Canton-S品系果蝇未受训练时在测试装置中趋向于无磁场的一侧;通过训练建立起食物与磁场间的条件反射后则可趋向有磁场的一侧[33](图2)。红鲑鱼(Oncorhynchus nerka)洄游的方向不受光照影响,但当磁场方向逆时针偏转90度后其游动方向也相应逆时针偏转近 90度[34]。鸽(Columba livia)可以在没有太阳指向的阴天正确归航,但颈背部粘上磁铁后会在阴天迷失方向[35]。C57BL/6J品系小鼠经过训练后可将窝搭在特定的磁场方向上[36],野牛(Bos primigenius)、马鹿(Cervus elaphus)、西方狍(Capreolus capreolus)吃草和休息时的体轴指向也依地磁场方向调整[37]。
研究发现隐花色素和近紫外光的存在是果蝇感知磁场能力的必要条件[33]。缺乏400~420 nm波长近紫外光时,Canton-S果蝇无法鉴别磁场。cry基因缺陷(cryb)或缺失(cry0)的 Canton-S果蝇无论是否接受训练也都不能在测试装置中展现磁场趋向性。但体内表达帝王斑蝶的 dpCry1或 dpCry2基因后,cryb突变果蝇可在波长420 nm以下光照射时感知磁场[38]。表达人 hCry2转基因后,cryb突变果蝇也可在400~500 nm近紫外光和蓝光照射下恢复磁场感知[39]。有意思的是,上述波长正处于相应隐花色素的敏感波段,提示光照可能是通过隐花色素发挥作用[40,41]。
迁徙鸟类的磁场感知也可能与隐花色素相联系[42]。处于强度较低的短波长单色光(370 nm紫外光,424 nm蓝光,502 nm蓝绿光或565 nm绿光)中时,知更鸟(Erithacus rubecula)的春季迁徙方向保持正常。处于其隐花色素不敏感的长波长黄光或红光中时,知更鸟会迷失方向[43]。花园莺(Sylvia borin)感受磁场变化后其神经节细胞活跃,而其视网膜和神经节细胞中均有丰富的 CRY1蛋白分布,与此相反,非迁徙鸟类的神经节细胞在感受磁场变化后不活跃,细胞中CRY1含量也很低[44,45]。
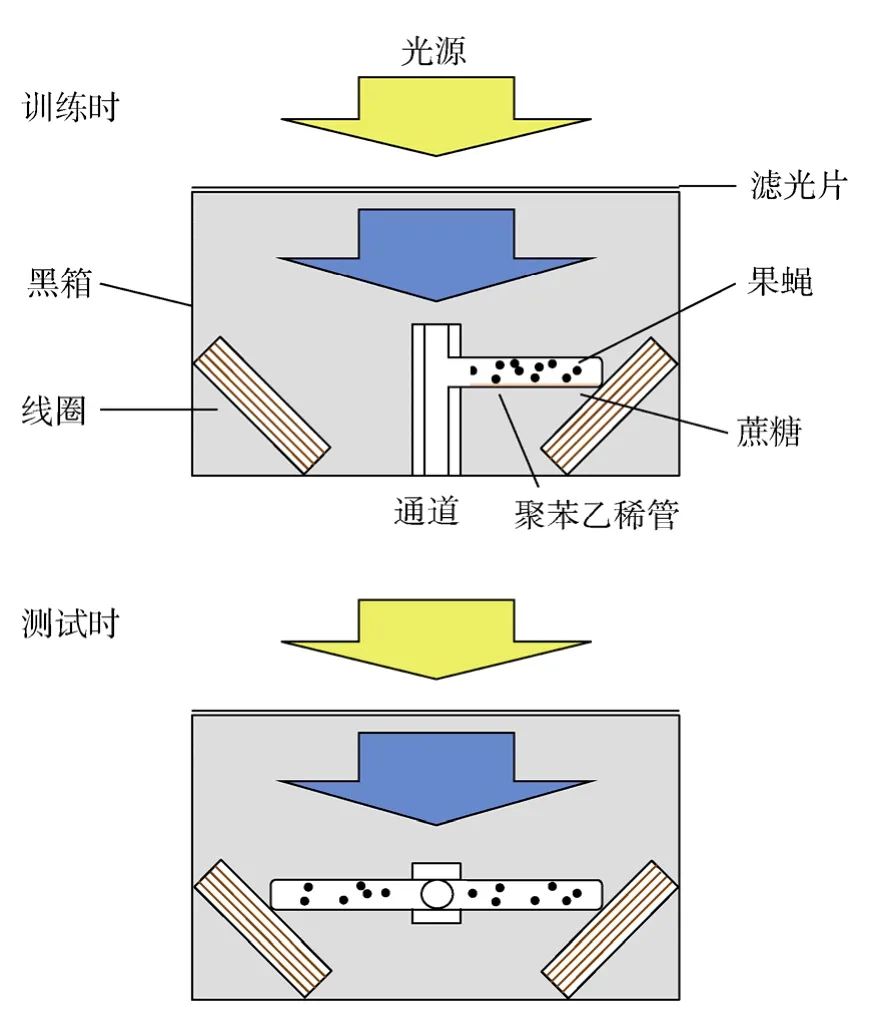
图2 果蝇感知磁场的行为检测原理图
长期以来,解释动物磁场感知机理的主要有磁晶体感知(Magnetite-based magnetoreception)和化学磁感知(Chemical magnetoreception)两种假说[46]。磁晶体感知假说认为在外部磁场作用下,细胞中的磁晶体颗粒簇阵列将发生形变,影响细胞膜上离子通道的开放,产生相应的细胞膜电位,帮助动物感知磁场。鸽、知更鸟等上喙部都有磁晶体存在,产生的信号可能通过三叉神经传递至脑[47]。鲑鱼的嗅瓣也被发现具有磁晶体[46]。然而,很多有磁感知能力的动物体内未发现磁晶体或与磁晶体相联系的神经通路。知更鸟暴露于地磁场强度1%的微弱高频振荡磁场中也会失去对春季迁徙方向的偏好[48]。这些都暗示存在磁晶体感知外的其他磁感知机制。
化学磁感知假说认为,动物细胞内某些磁感受器具有对磁场敏感的自由基对(Radical pair),可以接受能量发生电子跃迁。若电子在跃迁过程中自旋方向不变化,自由基对处于单重态。一旦磁场造成电子自旋方向的变化,产生自旋不配对的电子,自由基对便会处于三重态。不同的磁场方向和强度改变自由基对处于单重态和三重态的比率和转换的频率,产生不同的磁场信号传输到神经系统,参与动物对磁场的感知。由于电子自旋状态的共振效应,自由基对对于磁场的响应会比磁晶体更敏感,这可能是微弱人工磁场能干扰动物磁感知能力的原因[48]。同时,电子跃迁所需能量可由光引发的电子传递来提供。因此,隐花色素等细胞内的光受体视为可能的磁受体[46]。果蝇dCRY在光刺激下能与一个参与视觉信号通路的蛋白复合物 Signalplex结合[49],这种结合靠dCRY的C端尾与脚手架蛋白INAD (Inactivation No-After potential D)的相互作用介导。这可能是 dCRY调节腹侧神经元细胞膜兴奋性及发放频率的基础[50]。考虑到隐花色素存在于绝大部分无脊椎动物和脊椎动物,化学磁感知可能是动物中更普遍的磁感知机制。
解释化学磁感知分子机制最常用的是[FADH•+Trp•]假说。这一观点认为,隐花色素蛋白结合的FAD辅基受到光子撞击后会接受一个质子并从最邻近的色氨酸残基(Trp)上夺得一个电子,形成[FADH•+Trp•]自由基对充当磁敏自由基对[51]。但是这一假说近年来受到果蝇实验结果的挑战。虽然帝王斑蝶dpCry2上FAD相邻345位色氨酸突变成苯丙氨酸后不能再帮助cryb果蝇感知磁场[38],但在cryb果蝇中表达FAD相邻342位色氨酸突变成苯丙氨酸的果蝇dCry基因,或FAD相邻328位色氨酸突变成苯丙氨酸的帝王斑蝶 dpCry1基因都能使其恢复磁场感知。在体外实验中,上述突变能阻碍[FADH•+ Trp•]自由基对形成所需的光致还原过程[38]。对此,也有人提出隐花色素可能通过[FADH•+ O2•-]自由基对充当磁敏自由基对[52]。这一观点的主要实验证据是拟南芥隐花色素AtCRY1在FADH•回到氧化态的过程需要超氧化物的参与,因此可能形成[FADH•+ O2•-]自由基对[53]。考虑到人视网膜富含隐花色素而超氧化物缺乏,这一假说也可用于解释人为何不能感知磁场[52]。但总体而言,[FADH•+ O2•-]假说还需要动物体内的直接实验证据支持。
目前没有证据表明隐花色素在磁场感知和生物钟调节过程中使用了相似的分子机理。dCRY感知磁场不受PER、TIM和CYCLE等生物钟蛋白缺陷的影响,tim或cycle基因敲除的果蝇具有正常感知磁场能力[38]。通过连续光照造成果蝇生物钟紊乱时,dCRY处于低水平,其他生物钟蛋白无法积累,但磁感知能力不受影响[33]。
5 结语与展望
隐花色素在动物中广泛存在,对其基本结构及分子作用机制等已经有了较多的研究,但对其生理作用机制和在疾病中的影响仍有待进一步探索。在生理作用机制方面,隐花色素是目前动物中已知的唯一直接参与磁场感知的蛋白,但如何参与仍不明确。例如,II型隐花色素作为转录抑制物调控生物钟时不依赖光,为何却在果蝇中参与感知磁场时接受光诱导?人的隐花色素在果蝇具有感知磁场功能,但人却不能像果蝇一样感知磁场。进化是否抹去了隐花色素感知磁场的必要条件,这些条件究竟是什么? 了解隐花色素磁敏自由基对组成和磁场信号传递的神经通路有望对此做出回答。在疾病影响方面,隐花色素参与生物钟维持机体生命活动的基本节律。生物钟紊乱不仅可以影响思维和免疫,而且与肥胖、糖尿病等代谢疾病和心血管疾病密切相关。哺乳动物隐花色素CRY1和CRY2可双向调控生物钟周期,通过调控 CRY1和CRY2的比例可能有望用于纠正生物钟紊乱和各种相关疾病。目前,已有研究人员根据这一思路寻找调控隐花色素蛋白活性的小分子化合物[30]。总之,隐花色素研究具有重要的理论意义和应用价值。综合利用神经生物学、模式动物遗传学、分子细胞生物学等手段开展工作,解析隐花色素相关信号和生理通路,将有望揭开动物隐花色素的神秘面纱。
[1]Chaves I,Pokorny R,Byrdin M,Hoang N,Ritz T,Brettel K,Essen LO,van der Horst GT,Batschauer A,Ahmad M.The cryptochromes: blue light photoreceptors in plants and animals. Annu Rev Plant Biol,2011,62: 335–364.
[2]Ahmad M,Cashmore AR. HY4 gene of A. thaliana encodes a protein with characteristics of a blue-light photoreceptor.Nature,1993,366(6451): 162–166.
[3]Todo T,Ryo H,Yamamoto K,Toh H,Inui T,Ayaki H,Nomura T,Ikenaga M. Similarity among the Drosophila(6–4)photolyase,a human photolyase homolog,and the DNA photolyase-blue-light photoreceptor family. Science,1996,272(5258): 109–112.
[4]Zhu H,Yuan Q,Briscoe AD,Froy O,Casselman A,Reppert SM. The two CRYs of the butterfly. Curr Biol,2005,15(23):R953–R954.
[5]Yuan Q,Metterville D,Briscoe AD,Reppert SM. Insect cryptochromes: gene duplication and loss define diverse ways to construct insect circadian clocks. Mol Biol Evol,2007,24(4): 948–955.
[6]Hsu DS,Zhao X,Zhao S,Kazantsev A,Wang RP,Todo T,Wei YF,Sancar A. Putative human blue-light photoreceptors hCRY1 and hCRY2 are flavoproteins. Biochemistry,1996,35(44): 13871–13877.
[7]Kobayashi K,Kanno SI,Smit B,van der Horst GTJ,Takao M,Yasui A. Characterization of photolyase/blue-light receptor homologs in mouse and human cells. Nucleic Acids Res,1998,26(22): 5086–5092.
[8]Takeuchi T,Kubo Y,Okano K,Okano T. Identification and characterization of cryptochrome4 in the ovary of western clawed frog Xenopus tropicalis. Zoolog Sci,2014,31(3): 152–159.
[9]Watari R,Yamaguchi C,Zemba W,Kubo Y,Okano K,Okano T. Light-dependent structural change of chicken retinal Cryptochrome4. J Biol Chem,2012,287(51): 42634–42641.
[10]Kobayashi Y,Ishikawa T,Hirayama J,Daiyasu H,Kanai S,Toh H,Fukuda I,Tsujimura T,Terada N,Kamei Y,Yuba S,Iwai S,Todo T. Molecular analysis of zebrafish photolyase/cryptochrome family: two types of cryptochromes present in zebrafish. Genes Cells,2000,5(9): 725–738.
[11]Emery P,Stanewsky R,Helfrich-Förster C,Emery-Le M,Hall JC,Rosbash M. Drosophila CRY is a deep brain circadian photoreceptor. Neuron,2000,26(2): 493–504.
[12]Yoshii T,Todo T,Wülbeck C,Stanewsky R,Helfrich-Förster C. Cryptochrome is present in the compound eyes and a subset of Drosophila's clock neurons. J Comp Neurol,2008,508(6): 952–966.
[13]Thompson CL,Bowes Rickman C,Shaw SJ,Ebright JN,Kelly U,Sancar A,Rickman DW. Expression of the blue-light receptor cryptochrome in the human retina. Invest Ophthalmol Vis Sci,2003,44(10): 4515–4521.
[14]Zoltowski BD,Vaidya AT,Top D,Widom J,Young MW,Crane BR. Structure of full-length Drosophila cryptochrome.Nature,2011,480(7377): 396–399.
[15]Levy C,Zoltowski BD,Jones AR,Vaidya AT,Top D,Widom J,Young MW,Scrutton NS,Crane BR,Leys D. Updated structure of Drosophila cryptochrome. Nature,2013,495(7441):E3–E4.
[16]Czarna A,Berndt A,Singh HR,Grudziecki A,Ladurner AG,Timinszky G,Kramer A,Wolf E. Structures of Drosophila cryptochrome and mouse cryptochrome1 provide insight into circadian function. Cell,2013,153(6): 1394–1405.
[17]Ozturk N,Selby CP,Zhong D,Sancar A. Mechanism of photosignaling by Drosophila cryptochrome: role of the redox status of the flavin chromophore. J Biol Chem,2014,289(8):4634–4642.
[18]Stanewsky R. Clock mechanisms in Drosophila. Cell Tissue Res,2002,309(1): 11–26.
[19]Stanewsky R,Kaneko M,Emery P,Beretta B,Wager-Smith K,Kay SA,Rosbash M,Hall JC. The cryb mutation identifies cryptochrome as a circadian photoreceptor in Drosophila. Cell,1998,95(5): 681–692.
[20]van der Horst GT,Muijtjens M,Kobayashi K,Takano R,Kanno S,Takao M,de Wit J,Verkerk A,Eker AP,van Leenen D,Buijs R,Bootsma D,Hoeijmakers JH,Yasui A.Mammalian Cry1 and Cry2 are essential for maintenance of circadian rhythms. Nature,1999,398(6728): 627–630.
[21]Lucas RJ,Hattar S,Takao M,Berson DM,Foster RG,Yau KW. Diminished pupillary light reflex at high irradiances in melanopsin-knockout mice. Science,2003,299(5604): 245–247.
[22]Okamura H,Miyake S,Sumi Y,Yamaguchi S,Yasui A,Muijtjens M,Hoeijmakers JHJ,van der Horst GTJ. Photic induction of mPer1 and mPer2 in cry-deficient mice lacking a biological clock. Science,1999,286(5449): 2531–2534.
[23]Solt LA,Burris TP. Action of RORs and their ligands in(patho)physiology. Trends Endocrinol Metab,2012,23(12):619–627.
[24]Shearman LP,Sriram S,Weaver DR,Maywood ES,Chaves I,Zheng B,Kume K,Lee CC,van der Horst GT,Hastings MH,Reppert SM. Interacting molecular loops in the mammalian circadian clock. Science,2000,288(5468): 1013–1019.
[25]St John PC,Hirota T,Kay SA,Doyle FJ 3rd. Spatiotemporal separation of PER and CRY posttranslational regulation in the mammalian circadian clock. Proc Natl Acad Sci USA,2014,111(5): 2040–2045.
[26]Yumimoto K,Muneoka T,Tsuboi T,Nakayama KI. Substrate binding promotes formation of the Skp1-Cul1-Fbxl3(SCFFbxl3) protein complex. J Biol Chem,2013,288(45):32766–32776.
[27]Hirano A,Yumimoto K,Tsunematsu R,Matsumoto M,Oyama M,Kozuka-Hata H,Nakagawa T,Lanjakornsiripan D,Nakayama KI,Fukada Y. FBXL21 regulates oscillation of the circadian clock through ubiquitination and stabilization of cryptochromes. Cell,2013,152(5): 1106–1118.
[28]Harada Y,Sakai M,Kurabayashi N,Hirota T,Fukada Y.Ser-557-phosphorylated mCRY2 is degraded upon synergistic phosphorylation by glycogen synthase kinase-3 beta. J Biol Chem,2005,280(36): 31714–31721.
[29]Kurabayashi N,Hirota T,Sakai M,Sanada K,Fukada Y.DYRK1A and glycogen synthase kinase 3β,a dual-kinase mechanism directing proteasomal degradation of CRY2 for circadian timekeeping. Mol Cell Biol,2010,30(7): 1757–1768.
[30]Hirota T,Lee JW,St John PC,Sawa M,Iwaisako K,Noguchi T,Pongsawakul PY,Sonntag T,Welsh DK,Brenner DA,Doyle FJ 3rd,Schultz PG,Kay SA. Identification of small molecule activators of cryptochrome. Science,2012,337(6098): 1094–1097.
[31]Lamia KA,Papp SJ,Yu RT,Barish GD,Uhlenhaut NH,Jonker JW,Downes M,Evans RM. Cryptochromes mediate rhythmic repression of the glucocorticoid receptor. Nature,2011,480(7378): 552–556.
[32]Narasimamurthy R,Hatori M,Nayak SK,Liu F,Panda S,Verma IM. Circadian clock protein cryptochrome regulates the expression of proinflammatory cytokines. Proc Natl Acad Sci USA,2012,109(31): 12662–12667.
[33]Gegear RJ,Casselman A,Waddell S,Reppert SM.Cryptochrome mediates light-dependent magnetosensitivity in Drosophila. Nature,2008,454(7207): 1014–1018.
[34]Quinn TP. Evidence for celestial and magnetic compass orientation in Lake Migrating Sockeye Salmon Fry. J Comp Physiol,1980,137(3): 243–248.
[35]Keeton WT. Magnets Interfere with Pigeon Homing. Proc Natl Acad Sci USA,1971,68(1): 102–106.
[36]Muheim R,Edgar NM,Sloan KA,Phillips JB. Magnetic compass orientation in C57BL/6J mice. Learn Behav,2006,34(4): 366–373.
[37]Begall S,Červeny J,Neef J,Vojtěch O,Burda H. Magnetic alignment in grazing and resting cattle and deer. Proc Natl Acad Sci USA,2008,105(36): 13451–13455.
[38]Gegear RJ,Foley LE,Casselman A,Reppert SM. Animal cryptochromes mediate magnetoreception by an unconventional photochemical mechanism. Nature,2010,463(7282):804–807.
[39]Foley LE,Gegear RJ,Reppert SM. Human cryptochrome exhibits light-dependent magnetosensitivity. Nat Commun,2011,2: 356.
[40]Song SH,Ozturk N,Denaro TR,Arat NO,Kao YT,Zhu H,Zhong D,Reppert SM,Sancar A. Formation and function of flavin anion radical in cryptochrome 1 blue-light photoreceptor of monarch butterfly. J Biol Chem,2007,282(24):17608–17612.
[41]Özgur S,Sancar A. Analysis of autophosphorylating kinase activities of Arabidopsis and human cryptochromes. Biochemistry,2006,45(44): 13369–13374.
[42]Dodson CA,Hore PJ,Wallace MI. A radical sense of direction:signalling and mechanism in cryptochrome magnetoreception.Trends Biochem Sci,2013,38(9): 435–446.
[43]Wiltschko R,Stapput K,Bischof HJ,Wiltschko W. Lightdependent magnetoreception in birds: increasing intensity of monochromatic light changes the nature of the response.Front Zool,2007,4: 5.
[44]Mouritsen H,Janssen-Bienhold U,Liedvogel M,Feenders G,Stalleicken J,Dirks P,Weiler R. Cryptochromes and neuronalactivity markers colocalize in the retina of migratory birds during magnetic orientation. Proc Natl Acad Sci USA,2004,101(39): 14294–14299.
[45]Niessner C,Denzau S,Stapput K,Ahmad M,Peichl L,Wiltschko W,Wiltschko R. Magnetoreception: activated cryptochrome 1a concurs with magnetic orientation in birds. J R Soc Interface,2013,10(88): 20130638.
[46]Johnsen S,Lohmann KJ. The physics and neurobiology of magnetoreception. Nat Rev Neurosci,2005,6(9): 703–712.
[47]刘小峰,史远. 鸟类磁感受的生物物理机制研究进展. 生物物理学报,2009,25(4): 247–254.
[48]Thalau P,Ritz T,Stapput K,Wiltschko R,Wiltschko W.Magnetic compass orientation of migratory birds in the presence of a 1. 315 MHz oscillating field. Naturwissenschaften,2005,92(2): 86–90.
[49]Mazzotta G,Rossi A,Leonardi E,Mason M,Bertolucci C,Caccin L,Spolaore B,Martin AJM,Schlichting M,Grebler R,Helfrich-Forster C,Mammi S,Costa R,Tosatto SCE.Fly cryptochrome and the visual system. Proc Natl Acad Sci USA,2013,110(15): 6163–6168.
[50]Fogle KJ,Parson KG,Dahm NA,Holmes TC. CRYPTOCHROME is a blue-light sensor that regulates neuronal firing rate. Science,2011,331(6023): 1409–1413.
[51]Rodgers CT,Hore PJ. Chemical magnetoreception in birds:the radical pair mechanism. Proc Natl Acad Sci USA,2009,106(2): 353–360.
[52]Solov'yov IA,Schulten K. Magnetoreception through cryptochrome may involve superoxide. Biophys J,2009,96(12):4804–4813.
[53]Muller P,Ahmad M. Light-activated cryptochrome reacts with molecular oxygen to form a flavin-superoxide radical pair consistent with magnetoreception. J Biol Chem,2011,286(24):21033–21040.

