高效毛细管电泳测定药品和人体血清中的氢溴酸加兰他敏
高慧君,刘荔贞,白云峰,郭芳芳,冯 锋,3⋆
(1.山西大学化学化工学院,山西太原030006;2.山西师范大学化学与材料科学学院,山西临汾041004;3.山西大同大学有机化学研究所,山西大同037009)
加兰他敏(Galanthamine),又名尼瓦林、强肌宁、雪花胺(结构式见图1),是从石蒜科植物中分离得到的一种异喹啉生物碱,具有较高的药用价值。它是一种可逆性乙酰胆碱酯酶(AchE)抑制剂,临床主要用于治疗轻、中度阿尔兹海默病(AD,老年痴呆,具有较小的毒副作用和较好的治疗效果。根据中国AD协会最新调查表明,全球有3 000多万人患有老年痴呆,成为威胁人类健康的“四大杀手”之一,因此越来越多的人研究治疗痴呆症的药物。加兰他敏的氢溴酸盐作为治疗AD的药物首先在奥地利获得批准,近年来又在美国、欧洲等陆续上市,而且它还在抗病毒、抗疟疾、抗肿瘤、精神分裂症辅助治疗、慢性外伤性脑损伤的治疗、面瘫和偏瘫等方面有着重要的作用。
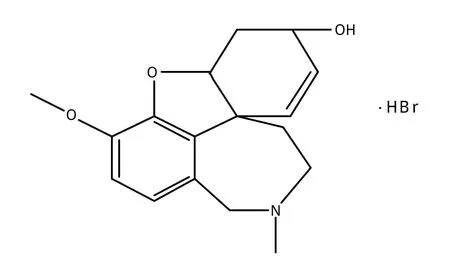
图1 氢溴酸加兰他敏的结构式
目前,加兰他敏的分析方法主要有荧光法[1]、薄层色谱法[2]、放射免疫法[3]、核磁共振[4]和酶测定法[5]等。荧光法由于在测定波长下还可能会检测到其他物质,因此不能准确定量;薄层色谱法灵敏度较低;免疫法和核磁共振价格贵。高效液相色谱法(HPLC)[6]和毛细管电泳法(CE)是现在使用较多的方法,可以直接进行测定。但在测定中药提取液或者生物样品时,若样品量较少则无法用HPLC测定,可用具有高效、高灵敏度、分析速度快、用样量少等优点的CE法测定。已有文献中,研究的主要是非手性下的分离[7]、手性分离[8]或者结合质谱[9]和柱后电化学发光[10]对石蒜中生物碱成分的测定。我们建立一种简单、快捷的毛细管区带电泳对药物和生物样品中的加兰他敏进行测定,为临床试验提供一种有效的方法。
1 实验方法
1.1 仪器与试剂
P/ACE System MDQ毛细管电泳仪,32 Karat software色谱工作站(美国Beckman公司);B3200S超声波清洗器(上海必能信超声有限公司);AP250D分析天平(美国Ohaus);未涂层石英毛细管,内径75 μm,总长度57 cm,有效长度50 cm(河北永年锐沣色谱器件有限公司);HH-42型数显恒温搅拌循环水箱(常州国华电器有限公司);TFL-16C型高速电动离心机(菏泽石油化工学校仪器设备厂);PSH-2C型酸度计(上海大普仪器有限公司)。
氢溴酸加兰他敏对照品(上海阿拉丁试剂有限公司),磷酸(分析纯,天津市大茂化学试剂厂),磷酸二氢钠(分析纯,天津市化学试剂六厂),三氯乙酸(分析纯,天津市大茂化学试剂厂),氢溴酸加兰他敏注射液(上海旭东海普药业有限公司),甲醇(色谱纯,天津市北联精细化学品开发有限公司),正常人血清由山西大同大学附属医院提供。
1.2 溶液的配制
1.2.1 标准溶液的配制
称取适量的氢溴酸加兰他敏对照品,用二次蒸馏水稀释,分别配制成0.015,0.029,0.059,0.082 ,0.110,0.128,0.160 mg/mL 系列浓度的对照标准液。所有溶液用0.22 μm的微孔滤膜(水系)过滤,并进行超声处理,置于冰箱中4℃保存。
1.2.2 药物样品溶液的配制
取适量氢溴酸加兰他敏注射液稀释,用0.22 μm的微孔滤膜(水系)过滤,并进行超声处理,置于冰箱中4℃保存。
1.2.3 生物样品溶液的配制
取适量去激素的人体血清,加入一定量10%三氯乙酸,保证蛋白质完全沉淀,10 000 r/min离心10 min,移取上清液并加入适量氢溴酸加兰他敏对照品,震荡摇匀,在真空干燥箱干燥,过滤后进样分析。
1.3 电泳操作条件
新的未涂层石英毛细管,需要先进行活化处理,冲洗方法是:在20 psi条件下,分别使用甲醇5 min,H2O 5 min,0.1 mol/L HCl 5 min,H2O 5 min,0.1 mol/L NaOH 30 min,H2O 5 min,运行电解质20 min。两次运行之间,用0.1 mol/L NaOH 2 min,H2O 1 min,运行电解质2 min。检测波长289 nm,压力进样0.5 psi,0.5 s,运行电压15 kV,温度25℃。
2 结果与讨论
2.1 氢溴酸加兰他敏的紫外吸收光谱
用二极管阵列检测器在线检测对照品氢溴酸加兰他敏在缓冲溶液中的光谱,确定氢溴酸加兰他敏在289 nm处有最大吸收,故选择检测波长为289 nm。
2.2 电泳分离条件的选择
2.2.1 缓冲体系的选择
本实验分别考察了硼砂-硼酸、磷酸盐溶液为背景电解质的分离效果。背景电解质不仅可以改变毛细管内壁表面电势,而且影响溶液的浓度和被测物的扩散系数,从而会使样品组分的分离效果和迁移时间发生改变。结果表明,在磷酸-磷酸盐的缓冲体系下,迁移时间较快,峰形好,分离度高,分离效果较理想。
2.2.2 缓冲溶液浓度的选择
本实验在固定pH为2.5的条件下,又分别以(A)20 mmol/L、(B)40 mmol/L、(C)50 mmol/L、(D)60 mmol/L、(E)80 mmol/L的NaH2PO4-H3PO4为背景电解质进行了考察,结果见图2。随着浓度的增大,迁移时间也随着增大。浓度越大,产生电流越大热量越高,浓度的降低,则会导致峰形变宽,变差,分离效果变差。因此,选择50 mmol/L为最佳浓度,在这个条件下峰形较好,而且分析时间也较快。
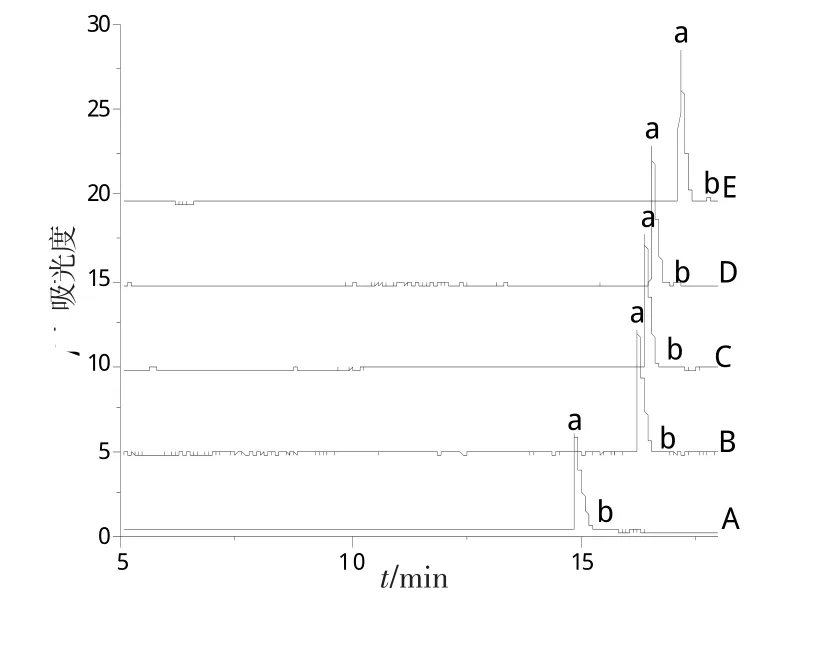
图2 缓冲溶液浓度对分析物分离的影响
2.2.3 缓冲溶液pH的选择
运行缓冲液pH的选择是又一个优化分离效果的重要考察因素,它能改变电渗流的大小,酸度越低,电渗流越小,进而影响迁移时间及样品的解离,从而影响分离的选择性和灵敏度。在固定浓度为50 mmol/L的条件下分别对pH为 (A)4.0、(B)3.5,(C)3.0,(D)2.5,(E)2.1 进行了考察,结果如图 3。随着pH的增加,迁移时间只是稍有增加。pH≥3.0时,随着pH的增加,峰形也会变宽,稍有拖尾现象。在pH为2.5和2.1时,迁移时间并未发生改变,可能是在pH为2.5时,被分析物与背景电解质溶液中的氢离子结合达到平衡饱和状态。因此,本实验选择pH=2.5为最佳的酸度条件。
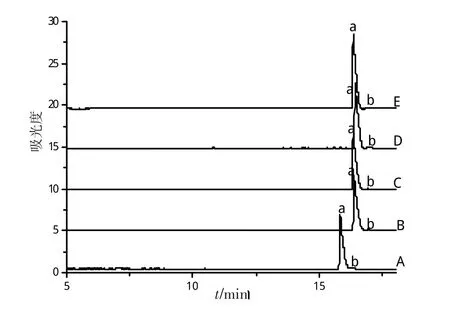
图3 缓冲溶液pH对分析物分离的影响
2.2.4 运行电压的选择
工作电压的选择,虽然对分离效果影响不是非常大,但是会影响分析时间,因此也作为一个考察因素。一般情况下,电压越高,迁移时间越快,分析时间缩短,峰形变尖,这是由于电渗流的增加所致,电渗流的迁移速度快于溶质的电泳速度。但是电压过高,又会产生较大的电流和较高的热量,反而会使分离效果变差。本实验在固定pH为2.5,缓冲液的浓度为50 mmol/L的条件下,分别对电压为(A)23 kV,(B)20 kV,(C)15 kV,(D)12 kV进行了考察,结果见图4。
2.3 标准曲线与最低检出限
在优化的电泳条件下,对一系列的标准溶液进行分析测定,用分析物的峰面积(Y)与分析物的浓度(X)做标准曲线,结果显示其有较好的线性关系。依据3倍信噪比来确定其最低检出限。得到的线性方程Y=409 424x+5 312.8,r=0.998 9,线性范围 0.015 ~ 0.160 mg/mL,最低检出限 2.57×10-5mg/mL。
2.4 精密度与重现性试验
将供试品溶液配制成3种不同浓度的样品,连续进样分别测定3次,结果日内迁移时间和峰面积变异系数分别为 0.10%~0.22%,0.13%~1.10%。将上面的样品放置在4℃条件下恒温保存,每天均重复测定3次,共测定3 d,结果日间迁移时间和峰面积变异系数分别为 0.14%~0.34%,0.76%~1.63%。实验结果表明,本方法具有较好的精密度和重复性。
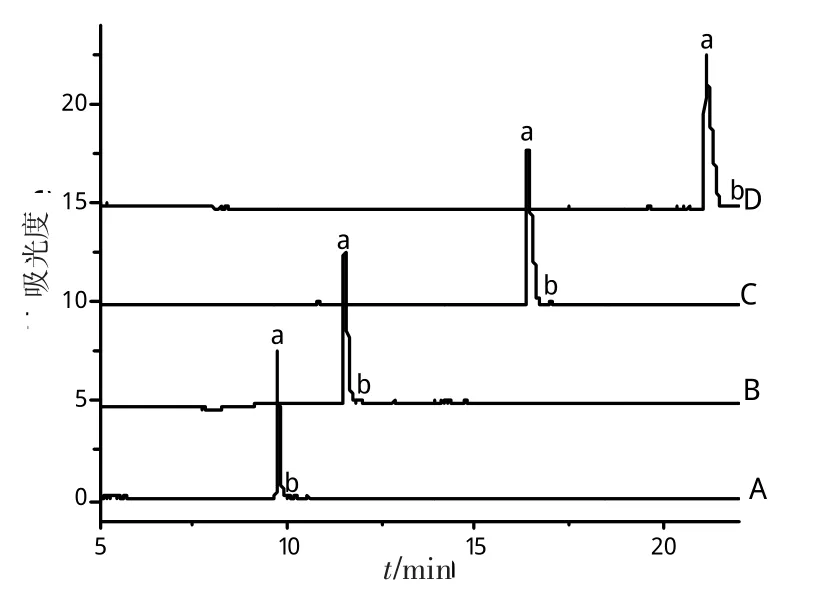
图4 电压对分析物分离的影响
2.5 加样回收实验
在供试品溶液中加入3种不同浓度的氢溴酸加兰他敏标准溶液,得到的回收率结果见表2。
在处理好的人血清样品中加入3种不同浓度的氢溴酸加兰他敏标准溶液,得到的回收率结果见表1。在血清中测得的氢溴酸加兰他敏电泳图如图5。

表1 加样回收实验及样品含量测定结果
2.6 实际样品含量的测定
精密称取批号为的氢溴酸加兰他敏注射液,置于10 mL容量瓶中,超声并定容至刻度,摇匀。进样分析,按标准曲线法计算含量,结果:药品批号110801,含量(n=5)0.522 4,0.525 1,0.510 5,0.501 1,0.499 3 mg/g,平均0.511 7 mg/g,RSD=2.32。电泳图见图6。
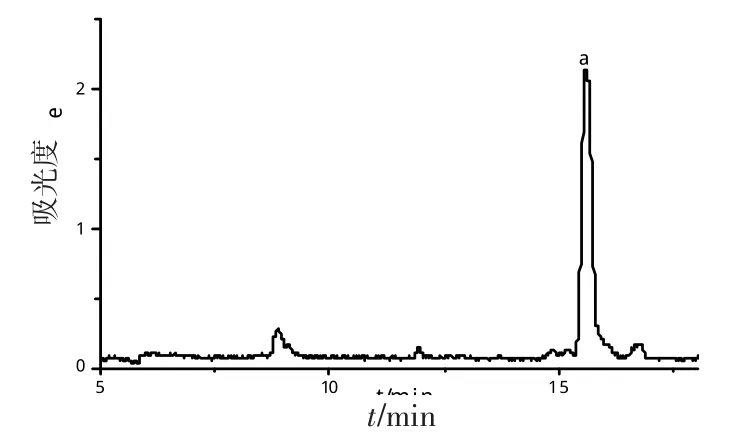
图5 血清中氢溴酸加兰他敏的电泳图
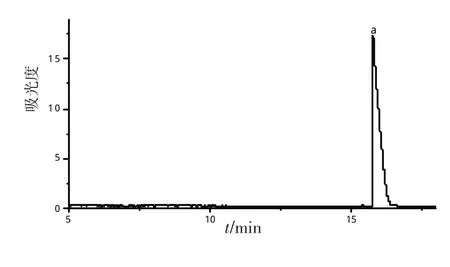
图6 氢溴酸加兰他敏注射液的电泳图
3 结论
本实验采用毛细管电泳法测定氢溴酸加兰他敏含量,对不同的实验条件和电泳条件进行了详细地分析与优化选择,经大量试验得出所建立的方法重现性、精密度和回收率均较好的方法,且成本较低,灵敏度较高,用量小,分析速度快,而且在生物样品中测定的结果也较好,为临床的测定提供可能性的方法。
[1]Culzoni M J,Aucelio R Q,Escandar G M.Spectrofluorimetry in organized media coupled to second-order multivariate calibration for the determination of galanthamine in the presence of uncalibrated interferences[J].Talanta,2010,82:325-332.
[2]Abou-Donia A H,Toaima S M,Hammoda H M,et al.New rapid ralidated HPTLC method for the determination of galanthamine in Amaryllidaceae plant extracts[J].Phytochem Anal,2008,19:353-358.
[3]Tanahashi T,Poulev A,Zenk M H.Radioimmunoassay for the quantitative determination of galanthamine[J].Planta Med,1990,56:77-81.
[4]Lubbe A,Choi Y H,Verpoorte R,et al.Analysis of metabolic variation and galanthamine content in Narcssus bulbs by(1)H NMR[J].Phytochem Anal,2010,21:66-72.
[5]da Silva J I,de Moraes M C,Vieira L C,et al.Acetylcholinesterase capillary enzyme reactor for screening and characterization of selective inhibitors[J].J Pharm Biomed Anal,2013,73:44-52.
[6]Tenchera J,Yambolier I,Zhivkova Z.Reversed-phase liquid chromatography for the determination of galanthamine and its metabolites in human plasma and urine[J].J Chromatogr,1987,421:396-400.
[7]Gotti R,Fiori J,Bartolini M,et al.Analysis of Amaryllidaceae alkaloids from Narcissus by GC-MS and capillary electrophoresis[J].J Pharm Biomed Anal,2006,42:17-24.
[8]Rizzi A,Schuh R,Brückner A,et al.Enantiomeric resolution of galanthamine and related drugs used in anti-Alzheimer therapy by means of capillary zone electrophoresis employing derivatized cyclodextrin selectors[J].J Chromatogr B,1999,730:167-175.
[9]Visky D,Jimidar L,Ael W V,et al.Capillary electrophoresis-mass spectrometry in impurity profiling of pharmaceutical products[J].Electrophoresis,2005,26:1541-1549.
[10]Deng B Y,Xie F,Li L Q,et al.Determination of galanthamine in Bulbs Lycoridis Radiatae by coupling capillary electrophoresis with end-column electrochemilumine-scence detection[J].J Sep Sci,2010,33:2356-2360.

