食管鳞癌中CAV-1基因的表达及甲基化状态
周珍 郭艳丽 韩立杰,2 郭炜 李书梅 沈素朋 董稚明
1.河北医科大学第四医院肿瘤研究所病理研究室,河北 石家庄 050011;
2.河北省沧州市中心医院放疗科,河北 沧州 061001;
3.河北医科大学第四医院病案室,河北 石家庄 050011
食管鳞癌中CAV-1基因的表达及甲基化状态
周珍1 郭艳丽1 韩立杰1,2 郭炜1 李书梅3 沈素朋1 董稚明1
1.河北医科大学第四医院肿瘤研究所病理研究室,河北 石家庄 050011;
2.河北省沧州市中心医院放疗科,河北 沧州 061001;
3.河北医科大学第四医院病案室,河北 石家庄 050011
背景与目的:作为重要的表观遗传学现象之一,DNA甲基化对基因表达发挥着重要的调控功能。研究表明肿瘤细胞基因组正常DNA甲基化模式异常改变所导致的肿瘤相关基因功能异常可能参与肿瘤发生与发展。本研究通过检测食管鳞状细胞癌(esophageal squamous cell carcinomas,ESCC)组织中质膜微囊蛋白-1(caveolin-1,CAV-1)基因的表达及甲基化状态,探讨CAV-1基因在食管鳞癌发生及发展中的作用。方法:分别应用甲基化特异性PCR(MSP)、RT-PCR法、免疫组织化学SP法检测食管癌及相应癌旁正常黏膜组织标本中CAV-1基因甲基化状态、mRNA及蛋白表达情况。结果:CAV-1 mRNA在食管癌和癌旁正常组织中的表达量分别为0.86±0.56和0.40±0.36,食管癌组织中CAV-1 mRNA表达量明显高于癌旁正常组织,2者差异有统计学意义(P<0.05)。CAV-1 mRNA表达与患者的淋巴结转移及肿瘤组织学分级有关(P<0.05);食管鳞癌组织中,CAV-1蛋白表达阳性率为66.7%(34/51);显著高于正常食管黏膜组织(15.7%,8/51)(P<0.01)。CAV-1蛋白表达与患者的淋巴结转移有关(P<0.05),而与肿瘤的临床分期和分化程度无关(P>0.05)。51例食管癌组织中1例发生了基因启动子区甲基化,甲基化率为2.0%(1/51);而相应癌旁正常黏膜组织中未发现有该基因的甲基化现象。食管癌组织中该基因的甲基化率与相应癌旁正常组织相比,差异无统计学意义(P>0.05)。结论:CAV-1基因在食管鳞癌组织中mRNA及蛋白表达均明显高于癌旁正常黏膜组织,该基因的高表达对于肿瘤的发生及淋巴结的转移起到了一定的促进作用;癌及癌旁组织中该基因的表达异常均与该基因的甲基化状态无关。
食管磷癌;甲基化;CAV-1基因;表达
食管癌的发生具有多阶段、多因素的特征。在癌变过程中,涉及抑癌基因或癌基因的表达失调导致细胞传导通路的活化或抑制等改变。细胞质膜微囊(caveolae)直径为50~100 nm、是存在于细胞膜上的许多烧瓶样的小凹结构。它主要存在或定位于细胞质膜附近,是各种信号转导通路和信号分子的“整合器”,在囊泡运输、信号转导、胆固醇转运和肿瘤抑制中起重要作用。质膜微囊蛋白-1(caveolin-1,CAV-1)是细胞质膜微囊的关键蛋白,是维持其结构和功能的重要物质,并在功能上调控这些信号转导分子的活化状态,参与跨膜信号转导的调节,从而使之更加的准确、有效、迅速。CAV-1具有脚手架结构,对应着N端82~101氨基酸残基,在原位和体外能结合和抑制多种信使蛋白,这些信号分子的激活常导致细胞转化,CAV-1通过与这些信号分子结合而使它们失活[1]。研究表明CAV-1参与细胞的内吞、调节细胞信号转导及细胞内外的物质转运等;本研究检测了食管鳞癌中CAV-1基因的甲基化状态及其mRNA及蛋白表达情况,旨在了解食管鳞癌中CAV-1基因启动子区域甲基化状态对其mRNA及蛋白表达的影响。
1 材料和方法
1.1 材料
1.1.1 主要试剂
蛋白酶K(购自德国Merck公司)、氢醌(购自美国Sigma公司);亚硫酸氢钠(购自美国Sigma公司)、 WizardDNA 纯化试剂盒(购自美国Promega公司)、TRIzol(购自美国Invit ro2gen),所有引物均在北京赛百胜公司合成;兔抗人CAV-1多克隆抗体(购自美国Santa Cruz公司);免疫组化染色采用的即用型免疫组织化学SP试剂盒,购自北京中杉金桥生物技术开发公司。
1.1.2 研究对象和标本来源
组织标本均来自河北医科大学第四医院2008—2011年间的食管癌手术患者,共51例。其中男性37例,女性14 例,年龄45~74岁,平均年龄59.3岁。每例患者均取癌组织原发灶及相应癌旁正常黏膜组织,全部患者术前均未经化疗和放疗。手术切除标本一部分在新鲜状态下放入液氮冷藏,后转到-80 ℃低温冰箱保存以提取DNA及RNA,一部分标本用10%中性福尔马林溶液固定,常规制作蜡块保存,用于HE染色和免疫组织化学染色。HE染色经常规病理诊断证实癌组织均为鳞状细胞癌,癌旁组织均为正常食管鳞状上皮。按照国际抗癌联盟(UICC)标准进行TNM分期,51例肿瘤患者中Ⅰ期0例(0%),Ⅱ期40例(78.4%),Ⅲ期10例(19.6%),Ⅳ期1例(2.0%)。肿瘤组织学分级为:高分化16例(31.4%),中分化5例(9.8%),低分化30例(58.8%)。
1.2 方法
1.2.1 RT-PCR 检测CAV-1 mRNA的表达
按TRIzol试剂说明书提取总RNA(美国Invitrogen公司),并参照逆转录试剂盒(Reverse Transcription System A3500,美国Promega公司)说明书的比例加样,将RNA逆转录成cDNA。GAPDH作为内参照,引物及退火温度见表1。将PCR产物进行2%琼脂糖凝胶电泳,采用Gel work22 ID软件,对电泳图像中CAV-1的表达进行半定量。以CAV-1条带的光密度值与GAPDH条带的光密度值的比值作为CAV-1基因的相对表达量。
1.2.2 免疫组织化学方法检测CAV-1蛋白表达
4~5 μm的石蜡切片常规脱蜡至水,3%甲醇过氧化氢封闭内源性过氧化物酶,采用pH=9.0的EDTA缓冲液进行高压锅抗原热修复2 min。依次加入一抗(兔抗人CAV-1多克隆抗体)工作液按1∶100稀释及相应生物素化二抗和辣根过氧化物酶标记的三抗,DAB显色,苏木精复染细胞核,常规脱水,透明,中性树胶封片。PBS取代一抗作为空白对照,其余步骤同上。利用已知阳性切片作为阳性对照。
1.2.3 甲基化特异性PCR(MSP)[2]方法
酚/氯仿抽提法提取癌组织和癌旁正常组织基因组DNA。每个样本取1~10 μg DNA用3 mol/L NaOH变性处理,于10 mmol/L氢醌和3 mmol/L亚硫酸氢钠中50 ℃水浴,至完全溶解。然后,用Wizard DNA纯化试剂盒纯化经亚硫酸氢钠处理的DNA。经亚硫酸氢盐处理后,DNA中的C转变为U,而基因的CpG岛发生甲基化后,则不能发生这种改变,根据此原理设计相应的甲基化和非甲基化引物,检测该基因是否发生甲基化。具体引物序列及退火温度见表1。扩增产物经2%琼脂糖凝胶电泳,用UV凝胶电泳成像及图像分析系统进行图像分析。MSP阳性对照采用正常人血有核细胞基因组DNA经甲基化酶(Sss Ⅰ)处理以后进行PCR,阴性对照用灭菌双蒸水取代DNA模板进行PCR。为进行MSP检测的质量控制,随机选取10%标本进行重复实验。
1.3 统计学处理
采用SPSS 13.0软件包对数据进行统计分析。各组间的差异用χ2检验进行分析,相关性分析采用Spearman分析,双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 食管癌中CAV-1 mRNA表达
检测51例食管鳞癌组织及相应的癌旁组织中CAV-1 mRNA表达情况(图1)。CAV-1 mRNA在食管癌和癌旁正常组织中的表达量分别为0.86±0.56和0.40±0.36,食管癌组织中CAV-1 mRNA表达量明显高于癌旁正常组织,2者的差异有统计学意义(P<0.05)。在食管鳞癌患者中,CAV-1 mRNA表达与患者的淋巴结转移及临床分期有关(P<0.05),而与肿瘤的组织分化程度,年龄和性别无关(P>0.05,表2)。
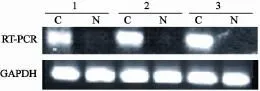
图1 食管鳞癌组织中CAV-1的表达Fig. 1 mRNA analysis of CAV-1 gene and GAPDH in ESCC tissues

表1 RT-PCR及MSP引物序列及反应条件Tab. 1 The primer sequence and reaction condition of RT-PCR and MSP
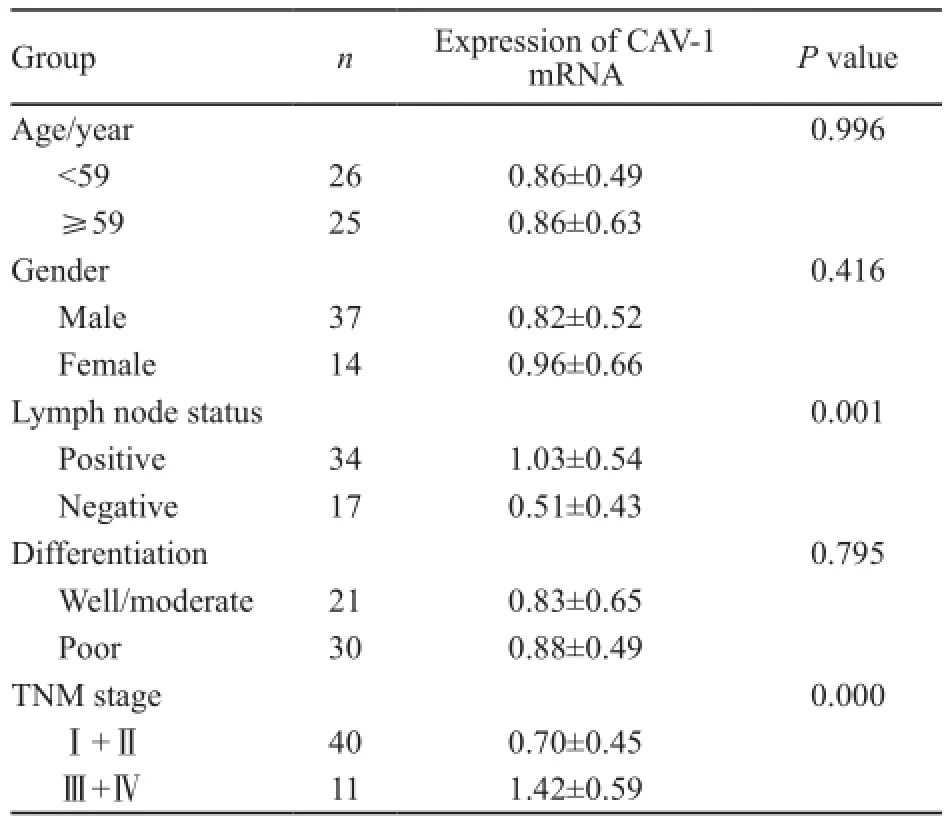
表2 食管鳞癌组织中CAV-1 mRNA表达与患者临床病理特征的关系Tab. 2 The correlation of mRNA expression of CAV-1 and ESCC clinical pathological characteristic
2.2 食管癌中CAV-1 蛋白表达
CAV-1 蛋白免疫组化染色为细胞质着色(图2)。51例食管鳞癌组织中,34例CAV-1蛋白表达阳性,阳性表达率为66.7%(34/51),正常食管黏膜组织中8例CAV-1蛋白表达阳性,阳性表达率为15.7%(8/51),食管癌组织CAV-1蛋白阳性表达率显著高于正常食管黏膜组织中CAV-1蛋白表达阳性率(P<0.01)在食管鳞癌中,CAV-1蛋白表达与患者的淋巴结转移情况有关(P<0.05),而与肿瘤临床分期和组织分化程度无关(P>0.05,表3)。
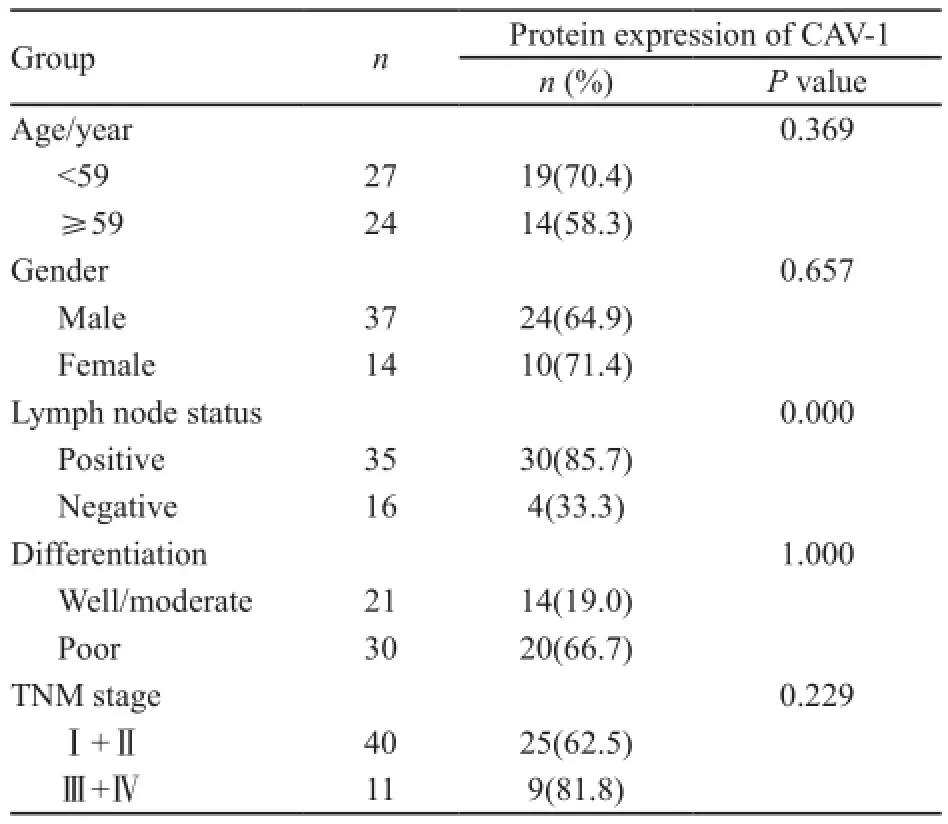
表3 食管鳞癌组织中CAV-1蛋白表达与患者临床特征的相关性Tab. 3 The correlation of protein expression of CAV-1 and ESCC clinical pathological characteristic
2.3 食管鳞癌中CAV-1基因甲基化状态
经UCSC序列检索发现CAV-1基因在横跨部分启动子及第一外显子的近300 bp范围内富含CG二核苷酸序列,且密度高达20%以上(图3),推测CAV-1基因在癌组织中的表达改变可能与基因CpG岛甲基化有关。进一步利用MSP的方法,设计引物,检测了MSP区域(-152至+49)位点的甲基化状况。检测结果发现51例食管癌组织中,仅有1例扩增出了甲基化条带,甲基化率为2.0% (1/51);而相应正常黏膜组织中未发现甲基化现象;食管癌组织甲基化率与相应癌旁正常组织相比差异无统计学意义(P>0.05)。
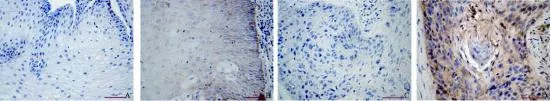
图2 食管鳞癌及相应癌旁组织中CAV-1蛋白的表达Fig. 2 Protein analysis of CAV-1 gene in ESCC and corresponding adjacent non-cancerous tissues (EliVision, ×400)
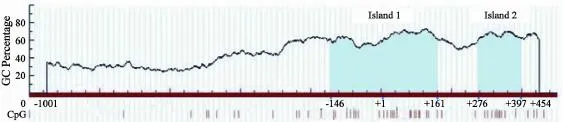
图3 CAV-1基因的CpG岛分布Fig. 3 CAV-1 CpG island prediction results
3 讨 论
CAV-1基因位于人染色体7q31.1,相对分子质量为21×103~240×103,全长37 392 bp,含3个外显子;其mRNA全长2 723 bp,编码1个含178氨基酸残基的蛋白质。CAV-1是细胞质膜微囊的主要成分。Caveolins家族包括3种亚型:CAV-1,CAV-2和CAV-3。其中CAV-1有α和β 2种亚型,它们参与细胞的微囊形成、微囊的转运和信号转导[3]。大量研究表明CAV-1与肿瘤发生紧密相关,CAV-1是维持微囊结构和功能的重要物质,在许多肿瘤的发生、发展中发挥着重要的作用。
许多临床研究发现,CAV-1抑制恶性细胞的生长。据报道,因杂合性缺失、突变和过甲基化等原因,CAV-1在卵巢癌[4]、乳腺癌[5]、肉瘤[6]等肿瘤中表达下调。但是,另外的一些研究结果却与此相反。有研究报道,CAV-1在结肠腺癌[7]、胰腺癌[8]中可能具有促肿瘤生成作用。Yang等[9]的研究已经证实并记录了CAV-1在老鼠和人类的前列腺癌细胞中是过表达的。这可能与酪氨酸磷酸化,丝氨酸磷酸化和P132L基因点突变这3种不同的机制使CAV-1肿瘤抑制作用失活有关[10]。
本研究发现,CAV-1基因在食管鳞癌中mRNA及蛋白表达均明显高于癌旁正常黏膜组织,该基因的高表达对于肿瘤的发生及淋巴结的转移起到了一定的促进作用。因此,CAV-1在某些肿瘤中起着抑制肿瘤的作用,而在另一些肿瘤中反而促进肿瘤的生长,它发挥的作用可能与肿瘤组织类型的不同有关。而且从癌及癌旁组织的研究中我们发现,该基因的表达异常均与该基因的甲基化状态无关。这可能与我们在研究中对甲基化的位点选择局限有关。
总之,我们的研究结果表明CAV-1的甲基化状态可能与食管癌无关,而其在食管癌中表达较正常食管黏膜升高,提示CAV-1基因对食管癌的发生、发展可能有促进作用,并且CAV-1基因在食管癌中表达的升高可能预示着食管癌患者的不良预后,这对食管癌的早期预防和诊断及判断预后具有重要意义。
[1] RAZANI B, WOODMAN S E, LISANTI M P. Caveolae: from cell biology to animal physiology [J]. Pharmacol Rev, 2002, 54: 431-467.
[2] CANENE-ADAMS K. General PCR[J]. Methods Enzymol, 2013, 529: 291-298.
[3] LIU P, RUDICK M, ANDERSON R G. Multiple functions of caveolin-1 [J]. Biol Chem, 2002, 277: 41295-41298.
[4] WIECHEN K, DIATCHENKO L, AGOULNIK A, et al. Caveolin-1 is down-regulated in human ovarian carcinoma and acts as a candidate tumor suppressor gene [J]. Am J Pathol, 2001, 159(5): 1635-1643.
[5] SYEED N, HUSSAIN F, HUSAIN S A, et al. 5’-CpG island promoter hypermethylation of the CAV-1 gene in breast cancer patients of Kashmir[J]. Asian Pac J Cancer Prev, 2012, 13(1): 371-375.
[6] WIECHEN K, SERS C, AGOULNIK A, et al. Down-regulation of caveolin-1, a candidate tumor suppressor gene in sarcomas[J]. Am J Pathol, 2001, 158(3): 833-839.
[7] FINE S W, LISANTI M P, GALBIATI F, et al. Elevated expression of caveolin-1 in adenocarcinoma of the colon[J]. Am J Clin Pathol, 2001, 115(5): 719-724.
[8] SUZUOKI M, MIYAMOTO M, KATO K, et al. Impact of caveolin-1 expression on prognosis of pancreatic ductal adeno carcinoma [J]. Br J Cancer, 2002, 87(10): 1140-1144.
[9] YANG G, ADDAI J, WHEELER T M, et al. Correlative evidence that prostate cancer cell-derived caveolin-1 mediates angiogenesis [J]. Neuropathology, 2007, 38(11): 1688-1695.
[10] WILLIAMS T M, LISANTI M P. Caveolin-1 in oncogenic transformation, cancer, and metastasis [J]. Am J Physiol Cell Physiol, 2005, 288(3): C494-C506.
Expression and methylation status of CAV-1 gene in esophageal squamous cell carcinoma
ZHOU Zhen1, GUO Yan-li1, HAN Li-jie1,2, GUO Wei1, LI Shu-mei3, SHEN Su-peng1, DONG Zhi-ming1
(1.Laboratory of Pathology, Hebei Cancer Institute, Fourth Hospital of Hebei Medical University, Shijiazhuang Hebei 050011, China; 2. Department of Radiotherapy, Cangzhou Central Hospital, Cangzhou Hebei 061001, China; 3. Department of Medical Records, Fourth Hospital of Hebei Medical University, Shijiazhuang Hebei 050011, China)
DONG Zhi-ming E-mail: dongzhiming2000@163.com
Background and purpose: As one of the important epigenetic phenomena, DNA methylation plays an important regulatory function for the expression of genes. Study shows that abnormal changes of DNA methylation patterns of normal tumor cell genome leads to dysfunction of cancer related gene, and this may be associated with tumor occurrence and development. The study investigated the promoter methylation and expression of caveolin-1 (CAV-1) gene in esophageal squamous cell carcinoma (ESCC), and to elucidate its role in ESCC. Methods: We used MSP approach, RT-PCR, and immunohistochemistry method respectively to examine the methylation status of the 5’CpG island of CAV-1 gene and its expression at mRNA and protein levels in tumors and corresponding normal tissues. Results: CAV-1 mRNA expression in tumor tissues (0.86±0.56) was signi fi cantly higher than that in corresponding normal tissues (0.40±0.36, P<0.05). The mRNA expression of CAV-1 was correlated with status of lymphatic metastasisand TNM stage of ESCC patients (P<0.05). The protein expression of CAV-1 in tumor specimens (66.7%, 34/51) was signi fi cantly higher than that in corresponding normal tissues (15.7%, 8/51, P<0.01). The protein expression of CAV-1 was signi fi cantly associated with lymphatic metastasis of ESCC (P<0.05), however, it was not associated with differentiation and TNM stage (P>0.05). The promoter methylation frequency of CAV-1 in tumor specimens was 2.0% (1/51), and the methylation phenomenon has not been found in corresponding normal tissues. The promoter methylation frequency of CAV-1 in tumor specimens showed no signi fi cant difference compared with the corresponding normal tissues (P>0.05). Conclusion: The mRNA and protein expression of CAV-1 in tumor specimens was signi fi cantly higher than that in corresponding normal tissues. Aberrant high expression of CAV-1 has played a certain role in promoting tumorigenesis and lymph node metastasis. The expression both in ESCC and corresponding normal tissues has no correlation with the promoter methylation status.
Esophageal squamous cell carcinoma; Methylation; CAV-1 gene; Expression
10.3969/j.issn.1007-3969.2014.10.013
R735.1
A
1007-3639(2014)10-0789-05
2014-07-15
2014-08-12)
河北省医学研究重大专项基金资助(NO: 冀财预复[2012]2056号)。
董稚明 E-mail:dongzhiming2000@163.com

