脑干及外周听觉结构与功能的性别差异*
刘锦峰 李晓婷 王宁宇
听觉系统结构的性别差异,包括外耳道直径及长度、耳蜗及基底膜的长度、外毛细胞及螺旋神经节数量及分布、听觉皮层的体积、神经元数量及密度等;听觉系统功能上的性别差异体现在行为学听阈、耳声发射(OAE)、听性脑干反应(ABR)等,且呈现一定的频率特性及年龄相关性,这也与听觉病理有关。系统认识听觉系统的性别差异有助于提高对新生儿听力筛查结果及临床听力学评估结果的判读水平,并加深对听觉病理的认识。本文就皮层下听觉结构及功能的性别差异进行综述。
1 脑干及外周听觉结构的性别差异
听觉结构的性别差异是听觉功能性别差异的基础,从外耳至听觉皮层,结构上的性别差异被广泛关注。女性外耳道比男性窄而长[1];中耳腔容积在出生后至成人经历了较大的发育改变,表现为容积增大和气化增加,成人鼓室腔(640.1±69.1 mm3,n=8)约为婴幼儿(451.7±68.2 mm3,n=6)的1.5倍,虽然鼓室平均容积在男性(595.6±123.8 mm3)略大于女性(535.6±119.9 mm3),但是无统计学差异[2],说明中耳在解剖结构方面不存在性别和耳别的差异[3];耳蜗长度、基底膜长度则显示出性别差异,Sato等(1991)报道男性耳蜗的平均长度(37.1±1.6 mm)明显长于女性(32.3±1.8mm),耳蜗长度出生后不随年龄的增大而变化,女性的基底膜较男性窄而短[4];但是外毛细胞(OHC)数量及螺旋神经节数量等性别差异不够明显,Ulehlova等(1987)发现较长的耳蜗具有较多的内毛细胞和OHC,推测男性OHC数量应该多于女性,而Wright(1987)研究认为女性OHC较多,由于样本量少,OHC数量的性别差异尚不确定;此外,有研究发现,内毛细胞和OHC的分布密度与耳蜗长度成反比关系,较长的耳蜗毛细胞密度较低,较短的耳蜗毛细胞密度较高[7],女性的耳蜗短于男性,因此其毛细胞的分布密度高于男性[4]。在孕14周到孕8月之间OHC过度生成(Pujor,1992),而出生后的耳蜗已经发育成熟,这提示OHC分布密度的性别差异可能在孕晚期形成。大鼠听觉脑干的形态学及雌激素受体表达的部位分布均未发现性别差异[5],对南美泡蟾的研究同样显示雄激素受体(AR)及雌激素受体(ER)在雄性及雌性动物中表达分布类似,但是在一些脑区雌激素受体及雄激素受体的表达强度存在性别差异,在听觉中脑雌性泡蟾的ERα 及ERβ表达高于雄性,相反雄性泡蟾中雄激素受体表达高于雌性[6],这为听觉脑干功能的性别差异提供了基础。
2 脑干及外周听觉功能的性别差异
多数文献显示脑干及外周听觉功能存在性别差异,女性好于男性,同时,男女性外周听觉功能的性别差异还呈现出频率特点及随年龄变化的特征。
2.1纯音听阈的性别差异 纯音听阈(pure tone threshold, PTT)可准确反映听敏度,文献对于男、女性听敏度的研究整体呈现出频率特点和年龄变化特点,频率特点表现为在较高频率区女性听敏度好于男性,而低频率区男性好于女性。Jerger等(1993)发现青年女性听敏度在1 000 Hz以上频率好于男性,相反,男性低频(500 Hz以下频率)听敏度好于女性。Chung 等(1983)则发现在2 000 Hz以上时,青年女性听敏度好于男性约2~3.5 dB,在2 000 Hz及以下频率时,女性听敏度的优势不明显,在1 dB以内。Snihur[7]对青年人的观察显示女性PTT显著低于男性,特别是在3 000 Hz及以上频率区PTT的性别差异达4~5 dB。可见,听敏度性别差异的频率特点表现为女性的优势随频率增加而增大。
同时,听敏度随年龄衰退时也体现出性别差异,女性更年期前与男性相比,其听敏度衰退较慢[8],但是有听力损失的老年男性人群1 000 Hz以下听敏度要好于老年女性,这与正常人群的特点相符。由于Goycoolea等(1986)在没有工业噪声部落人群中未发现听阈的性别差异,因此有学者认为这一性别差异与男性的职业和娱乐噪声接触有关(Kryter,1983),认为男女性PTT不存在本质差异,只与男女性的噪声易感性差异有关。但是,Pearson等[8]对年龄相关性听力损失的纵向研究显示,即使在消除噪声性听力损失的因素后,男性的听力衰退仍然显著快于女性,支持男女性PPT在生理及病理情况下均存在差异。
此外,成人PPT性别差异特点在儿童中未观察到,Pavlovcinova等[9]研究结果显示12岁儿童的PTT无性别差异,提示PTT的性别差异存在年龄相关性变化,可能要到青春期后才显现。
2.2耳声发射的性别差异 OAE反映耳蜗放大机制。自发性耳声发射(SOAE)及瞬态诱发耳声发射(TEOAE)的多数观察指标呈现出明显的性别差异,而畸变产物耳声发射(DPOAE)的性别差异不明显,同时OAE的性别差异也存在年龄相关性及频率特性,这些特性在TEOAE的测试结果中最为明显。
2.2.1自发性耳声发射的性别差异 SOAE是在无刺激情况下直接在密封的外耳道中记录到的纯音信号,在外、中耳传声功能正常情况下,SOAE直接反映OHC的功能。SOAE信号峰数量、检出率及强度等的性别差异在新生儿与成人均已被广泛关注[10~13]。SOAE信号峰数量的性别差异在新生儿时不明显(表1),但是随年龄增加SOAE信号峰数量的性别差异逐渐显现。除Kok等(1993)结果显示女婴(4.6)高于男婴(3.3)(P=0.04)外,多数文献结果显示新生儿SOAE信号峰数量的性别差异不够明显。Liu等[10]发现虽然女婴SOAE信号峰数量(4.49个)略高于男婴(4.28个),但差异无统计学意义,与文献报道[11,12]一致。Morlet等[12]发现早产儿与新生儿中,男、女婴每耳SOAE信号峰数量类似,也无性别差异。婴儿10~31天龄时期(Burns,1992)及1岁以内[13]SOAE信号峰数量也无性别差异,但1岁以上小儿女性每耳SOAE信号峰数量显著高于男性[13]。Moulin等(1993)研究显示19~36岁青年人中女性SOAE信号峰数量(2.8±2.3)显著高于男性(1.8±1.3)(P<0.05),这一结果也得到了Snihur的证实[7],提示SOAE信号峰数量的性别差异随年龄改变,至少在1岁以后才显现。
SOAE检出率的性别差异同样呈现出年龄依赖性。新生儿SOAE检出率的性别差异存在分歧,Morlet等[12]、Collet等(1993)和Burns等(1992)研究显示SOAE检出率女婴高于男婴,但Kok等(1993)和Liu等[10]研究未发现SOAE检出率的性别差异。但5~13女童的SOAE的检出率高于男童(Strickland,1985),在成人的研究中除Snihur[7]研究未显示性别差异外,其余文献普遍显示女性SOAE的检出率高于男性[14,15]。同时,SOAE检出率随年龄增加而降低,检出率的性别差异随年龄增大也进一步扩大(表1)。
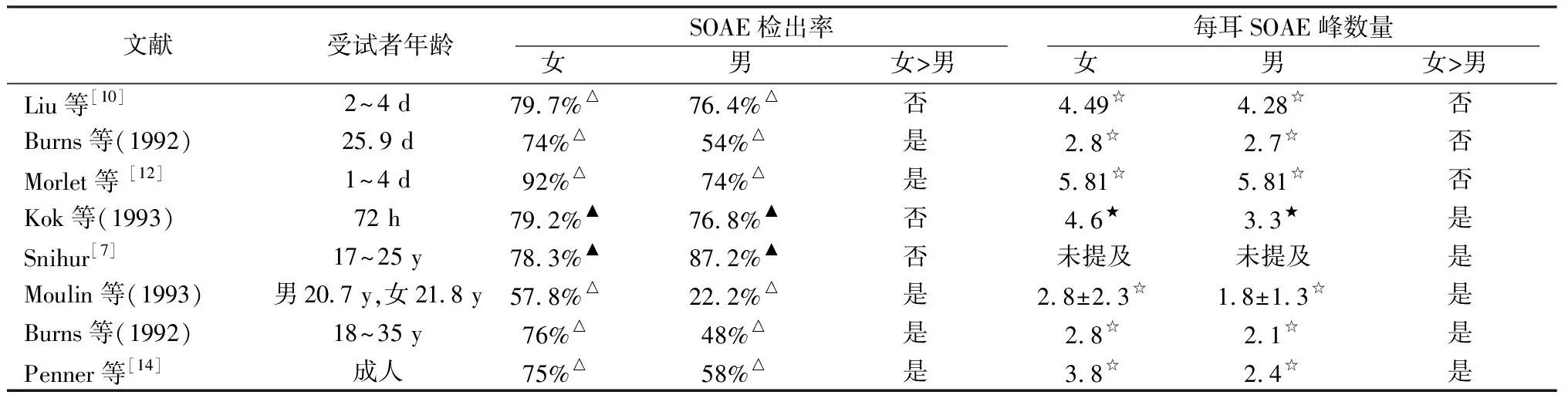
表1 不同文献对SOAE信号峰数量及检出率性别差异比较
注:△男、女受试者的检出率的计算为检出SOAE受试者的比例,只要有一侧耳检出SOAE便纳入为检出者;▲男、女性耳的检出率计算为检出耳占测试耳的比例。☆每侧检出SOAE耳的SOAE信号峰数量的平均值。★每侧检出SOAE耳的SOAE信号峰数量的中位数
由于SOAE信号的确定标准存在差异[16],即使测试设备相同,不同的确定标准也会影响SOAE信号纳入的数量,可能会影响SOAE平均信号强度及SOAE强度性别差异的分析。但整体而言,除Snihur[7]的研究中女性SOAE强度高于青年男性外,其他文献未观察到SOAE强度的性别差异。Kok等(1993)及Liu等[10]研究显示新生儿SOAE平均强度及最大SOAE强度均无性别差异。Kuroda[11]研究显示SOAE强度在儿童及成人中均无明显性别差异,虽然在小于5岁的儿童中女性SOAE强度会略高于男性。Lamprecht-Dinnesen等[13]以每耳SOAE信号峰的中间强度SOAE为代表,计算男、女性SOAE的平均强度,也显示儿童SOAE强度没有性别差异。Moulin 等(1993)结果显示SOAE在成人中无性别差异。SOAE信号强度无性别差异的原因可能有:①这一指标本身无性别差异;②每耳SOAE信号峰数量不一致,每个SOAE信号强度差异较大,因此难以找到合适的方式比较,即使以最大信号峰或者信号峰中的中间强度SOAE为代表均具有局限性,因为每个SOAE仅能代表其频率位置OHC功能,而无法整体反映耳蜗OHC功能。
SOAE信号峰出现的频率可能与OHC在基底膜的分布及功能等有关,研究发现[17]SOAE出现的频率位置(频率分布)存在明显性别差异,男性SOAE分布峰的频带较低,而女性的分布峰频带较高。在男婴,46.1%SOAE出现在较低频带区(≤2 kHz),高于女婴的32.0% (P<0.05)。在女婴,50.9% SOAE出现在较高频带区(2.51~4.50 kHz),高于男婴的37.5%(P<0.05)[17],这一结果与Morlet的报道[18]相似,Morlet研究显示,男性63.2%SOAE出现在在较低频带(0.5~3.5 kHz)区,高于女性的43.9%。SOAE频率分布的性别差异提示OHC功能或者分布频率可能存在性别差异,也可能是男性PPT的低频优势和女性高频优势的原因。
2.2.2瞬态诱发耳声发射的性别差异 TEOAE性别差异研究主要集中于click声诱发的耳声发射(cEOAE),click声是一个宽频刺激声,可以使耳蜗整体兴奋,因此cEOAE总反应能量是OHC能量沿耳蜗的一个总合。依据OAE信号的频率和潜伏期关系可以将这一能量分解于不同的频带(frequency bands)和半倍频程(half octave)频带。这样cEOAE也可以依据频率特异性方式来反映OHC功能。
文献普遍显示新生儿cEOAE总反应幅值呈现女婴高于男婴的特点,女婴高于男婴0.7~1.2 dB左右[19~22],多数文献显示这一差异具有统计学意义[19,20]。在2月龄婴儿中同样如此[23],而且在儿童[9,24]及成人[22,25]中女性cEOAE强度优势进一步扩大(表2)。总体上,TEOAE总反应的性别差异呈现出随年龄增加而增大的特征。
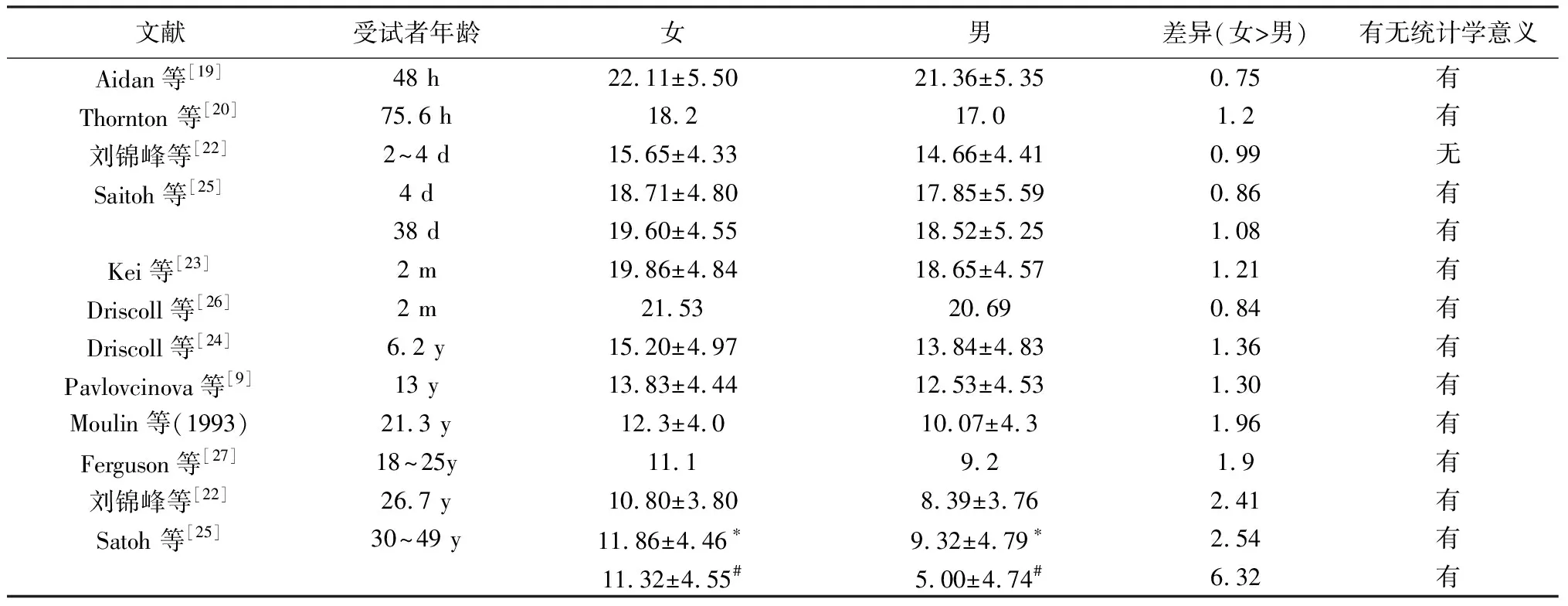
表2 不同文献报道的男、女TEOAE总反应幅值比较
注:Satoh等[25]平均听阈的计算方式:(500 Hz+2×1 000 Hz+2 000 Hz)/4,*平均听阈为0~10 dB HL;#平均听阈为10~20 dB HL;
频带分析显示cEOAE性别差异随年龄增加而增大的同时也具有频率特性,cEOAE频带信噪比(SNR)的性别差异特征也是随频率增加而差异增大,在新生儿、儿童及成人中均是如此,只是随年龄增加,频带SNR的性别差异进一步增大。刘锦峰等[22]及Cassidy等[28]频带分析显示除1 kHz男婴SNR大于女婴外,其余分析频率均为女婴高于男婴,新生儿SNR的性别差异在3 kHz及4 kHz差异有统计学意义[22]。成人SNR在不同频带区均为女性高于男性,在2 kHz及4 kHz区具有统计学意义。
2.2.3畸变产物耳声发射 DPOAE性别差异研究较少。Pavlovcinova 等[9]未发现儿童DPOAE的性别差异;Keogh 等[29]和Rourke等[30]的研究显示性别可以影响学龄期儿童DPOAE, 主要影响高频;Bowman[31]发现在3 222.7 Hz以下频率区成人男女性DPOAE幅值类似,但在较高的f2频率,女性的DPOAE幅值比男性高,但差异无统计学意义;而Moulin等(1993)发现除2 000 Hz处(2f1-f2)女性DPOAE强度显著高于男性外,余频率青年人DPOAE均无性别差异。2 000 Hz处(2 f1-f2)DPOAE的性别差异还与刺激强度有关,刺激强度越大差异越大,L1=L2=50 dB SPL时女性DPOAE为1.21 dB,高于男性(-2.61 dB SPL)(t= 2.28,P<0.05);L1=L2=60 dB SPL时女性DPOAE强度为5.1 dB,高于男性(0.9 dB SPL)(t=2.35,P<0.05);L1=L2=70 dB SPL时女性DPOAE强度为11.28 dB,高于男性(7.5 dB SPL)(t=2.30,P<0.05)。文献对于DPOAE性别差异研究结果的不一致可能与刺激声频率比(f2/f1)及刺激强度(L1、L2)设置的不同有关。
2.3听性脑干反应的性别差异
2.3.1简单声刺激诱发ABR的性别差异 ABR为声刺激诱发的脑干电活动,反映听觉信息从耳蜗至皮层下的神经电传导过程。在ABR的性别差异研究中,多数学者关注click-ABR(c-ABR)的波V潜伏期、波幅及I-V波间期等[32],新生儿气导c-ABR的波V潜伏期女婴短于男婴约0.2~0.3 ms[33];Jerger等(1980)发现25~55岁听力正常及听力损失组的成人,女性ABR波潜伏期均短于男性,波幅大于男性,其中波V潜伏期女性较男性短0.2 ms,而波幅较男性高25%;Fujita等(1991)发现女性波III潜伏期短于男性约0.14 ms,波V潜伏期短于男性0.19 ms,这一特征与年龄无关。Don等(1993)认为女性ABR波幅较大和潜伏期较短与女性耳蜗长度较短和基底膜硬度梯度较大有关;女性ABR波潜伏期较短是因为女性耳蜗的行波时间较快,波幅较大与每单位时间较多的神经元活动有关[32];但也有学者认为,ABR性别差异存在随年龄的改变现象,波III、V潜伏期和I-V波间期在婴幼儿具有显著性别差异,且随年龄增加而增大。López-Escámez等[34]进一步回归分析显示自儿童时期至五十岁左右,男性波I、V潜伏期随年龄增加而延长,而女性不存在年龄相关的改变;男女性I-V、I-III和III-V波间期均不存在随年龄的变化,女性左右耳的波III、V潜伏期、I-V波及I-III波间期均显著短于男性,说明ABR性别差异随年龄变化主要发生在男性。
但关于ABR反应阈的研究存在较大分歧,Stuart等[33]认为新生儿气导或骨导c-ABR反应阈没有性别差异;Sininger等[32]报道新生儿中男婴tone burst ABR(tb-ABR)及c-ABR的气导反应阈低于女婴4.22 dB;Cone-Wesson[35]观察到女婴骨导ABR反应阈低于男婴,但只在4 000 Hz纯音刺激时差异才有统计学意义,而click刺激与500 Hz纯音刺激时ABR无显著差异。性别相关的阈上ABR波幅和潜伏期与ABR阈值不一致,提示阈值敏感性与波V波幅和潜伏期无关[32]。
2.3.2复杂声刺激诱发ABR的性别差异 ABR也可以由复杂刺激声诱发产生,复杂声可以是元音、辅音、辅元音、单个字词或音乐等,其中言语诱发听性脑干反应(speech-evoked auditory brainstem responses,speech-ABR) 是以言语声诱发的脑干电反应,能客观、可靠、精确的反映脑干对言语信号的编码,并具有良好的可重复性[36],已经成为脑干言语处理机制的发育、生理及病理等研究的重要工具。言语信号具有多频率构成及多波谱特性,而听觉脑干通过极为精确的时间及波谱编码来反映这一刺激特征,这使脑干电反应与刺激声在时域和频域上能良好匹配。speech-ABR波形均由瞬态成分及周期性反应组成,瞬态成分包括:起始复合波V、A波及V/A斜率,过渡部分C波及结束波O波,反映神经同步性好坏,主要观察指标为潜伏期;周期性反应包括D、E及F波,反映神经元锁相特征,主要观察指标为波幅。Krizman 等[37]对男女青年脑干言语编码的测试显示,女性起始反应复合波潜伏期短于男性,且V/A斜率也大于男性,而周期成分波幅也显著高于男性,提示女性脑干对于言语刺激起始的神经反应的同步性好于男性,锁相活动优于男性,且频率越高优势越明显。
综上所述,脑干及外周的大部分听觉结构及功能均存在一定的性别差异,而且呈现随年龄增大而增大的特征,同时也呈现出一定的频率特性,在较高频率区女性优于男性,而低频区性别差异不显著或者男性略优于女性。其原因主要与性激素有关,而性激素的变化可能与听觉病理也有关系,如孕期听觉症状的出现、老年性聋的男女性差异、自闭症言语处理能力障碍等。因此认识听觉结构与功能的性别差异将有助于加深对听觉生理病理的认识,提高对听力功能检测结果的分析能力。
3 参考文献
1 Ismail H, Thornton AR. The interaction between ear and sex differences and stimulus rate[J]. Hear Res, 2003, 179: 97.
2 Ikui A, Sando I, Haginomori S, et al. Postnatal development of the tympanic cavity: a computer-aided reconstruction and measurement study[J]. Acta Otolaryngol,2000, 120:375.
3 Stieger C, Djeric D, Kompis M, et al. Anatomical study of the human middle ear for the design of implantable hearing aids[J]. Auris Nasus Larynx, 2006, 33: 375.
4 Morlet T, Perrin E, Durrant JD, et al. Development of cochlear active mechanisms in humans differs between gender. Neurosci[J]. Lett, 1996, 220: 49.
5 Charitidi K, Canlon B. Estrogen receptors in the central auditory system of male and female mice[J]. Neuroscience, 2010, 165:923.
6 Chakraborty M, Burmeister SS. Sexually dimorphic androgen and estrogen receptor mRNA expression in the brain of túngara frogs[J]. Hormones and Behavior, 2010,58: 619.
7 Snihur AW, Hampson E. Sex and ear differences in spontaneous and click-evoked otoacoustic emissions in young adults[J]. Brain Cogn,2011, 77:40.
8 Pearson JD, Morrell CH, Gordon-Salant S, et al. Gender differences in a longitudinal study of age-associated hearing loss[J]. J Acoust Soc Am, 1995, 97: 1 196.
9 Pavlovcinova G, Jakubikova J, Trnovec T, et al. A normative study of otoacoustic emissions, ear asymmetry, and gender effect in healthy schoolchildren in Slovakia[J]. Int J Pediatr Otorhinolaryngol, 2010, 74: 173.
10 Liu JF, Shi BY, Wang NY, et al. Characterization of spontaneous otoacoustic emissions in 2-4 day old neonates with respect to gender and ear[J]. Neural Regen Res, 2009, 4: 67.
11 Kuroda T. Clinical investigation on spontaneous otoacoustic emission (SOAE) in 447 ears[J]. Auris Nasus Larynx,2007, 34: 29.
12 Morlet T, Collet L, Duclaux R, et al. Spontaneous and evoked otoacoustic emissions in pre-term and fullterm neonates: is there a clinical application[J]? Int J Pediatr Otorhinolaryngol,1995, 33: 207.
13 Lamprecht-Dinnesen A, Pohl M, Hartmann S, et al. Effects of age, sex and ear side on SOAE parameters in infancy and childhood[J]. Audiol Neurootol, 1998, 3: 386.
14 Penner MJ. Frequency variation of spontaneous otoacoustic emissions during a naturally occurring menstrual cycle, Amenorrhea, and oral contraception:a brief report[J]. Ear Hear, 1995, 16: 428.
15 Martinez Ibargüen A, Santaolalla Montoya F, Sanchez Del Rey A. Normality parameters of the spontaneous otoacoustic emissions[J]. Acta Otorrinolaringol Esp,1995, 46:175.
16 刘锦峰,韩静, 石宝玉, 等. 自发性耳声发射随时间变化的稳定性分析[J].首都医科大学学报,2011, 32:37.
17 Liu JF, Wang NY, Li JL, et al. Frequency distribution of Synchronized spontaneous otoacoustic emissions showing sex-dependent differences and asymmetry between ears in 2- to 4-day-old neonates[J]. Int J Pediatr Otorhinolaryngol,2009,73:731.
18 Morlet T, Perrin E, Durrant JD, et al. Development of cochlear active mechanisms in humans differs between gender[J]. Neurosci Lett, 1996, 220: 49.
19 Aidan D, Lestang P, Avan P, et al. Characteristics of transient-evoked otoacoustic emissions in neonates[J]. Acta Otolaryngol, 1997, 117: 25.
20 Thornton AR, Marotta N, Kennedy CR. The order of testing effect in otoacoustic emissions and its consequences for sex and ear differences in neonates[J]. Hear Res, 2003, 184:123.
21 Berninger E. Characteristics of normal newborn transient-evoked otoacoustic emissions Ear asymmetries and sex effects[J]. Int J Audiol, 2007, 46: 661.
22 刘锦峰, 王宁宇, 温晓慧, 等. 新生儿与成人瞬态诱发耳声发射性别差异的比较[J].听力学及言语疾病杂志,2012, 20: 429.
23 Kei J, Mcpherson B, Smyth V, et al. Transient evoked otoacoustic emissions in infants: effects of gender, ear asymmetry and activity status[J]. Audiology, 1997, 36: 61.
24 Driscoll C, Kei J, McPherson B. Transient evoked otoacoustic emissions in 6-year-old school children a normative study[J]. Scand Audiol, 2000, 29: 103.
25 Saitoh Y, Sakoda T, Hazama M, et al. Transient evoked otoacoustic emissions in newborn infants: Effects of ear asymmetry, gender, and age[J]. J Otolaryngol, 2006, 35: 133.
26 Driscoll C, Kei J, Murdoch B, et al. Transient evoked otoacoustic emissions in two-month-old infants a normative study[J]. Audiology, 1999, 38: 181.
27 Ferguson MA, Smith PA, Davis AC, et al. Transient-evoked otoacoustic emissions in a representative population sample aged 18 to 25 years[J]. Audiology, 2000, 39: 125.
28 Cassidy JW,Ditty KM.Gender differences among newborns on a transient otoacoustic emissions test for hearing[J]. J Music Ther, 2001, 38: 28.
29 Keogh T, Kei J, Driscoll C, et al. Distortion product otoacoustic emissions in schoolchildren: effects of ear asymmetry, handedness, and gender[J]. J Am Acad Audiol, 2001, 12:506.
30 Rourke C. A normative study of distortion product otoacoustic emissions in 6-years-old schoolchildren[J]. Int J Audiol, 2002, 41:162.
31 Bowman DM, BrownDK, Kimberley BP. An examination of gender differences in DPOAE phase delay measurements in normal-hearing human adults[J]. Hear Res, 2000, 142:1.
32 Sininger YS, Cone-Wesson B, Abdala C. Gender distinctions and lateral asymmetry in the low-level auditory brainstem response of the human neonate[J]. Hear Res, 1998, 126:58.
33 Stuart A, Yang EY. Gender effects in auditory brainstem responses to air- and bone-conducted clicks in neonates[J]. J Commun Disord,2001, 34:229.
34 López-Escámez JA, Salguero G, Salinero J. Age and sex differences in latencies of waves I, III and V in auditory brainstem response of normal hearing subjects[J]. Acta Otorhinolaryngol Belg, 1999, 53:109.
35 Cone-Wesson B, Ramirez GM. "Hearing sensitivity in newborns estimated from ABRs to bone-conducted sounds" [J].Journal of the American Academy of Audiology, 1997, 8: 299.
36 刘锦峰, 王宁宇, 付欣, 等. 学龄期儿童与青年人言语诱发听性脑干反应的比较[J].中华耳鼻咽喉头颈外科杂志, 2012, 47: 646.
37 Krizman J, Skoe E, Kraus N. Sex differences in auditory subcortical function[J]. Clin Neurophysiol, 2012, 123: 590.

