二嗪类有机光电功能材料的应用进展
梅群波 翁洁娜 童碧海 田汝强 蒋渊知 华庆芳 黄 维
(1南京邮电大学信息材料与纳米技术研究院,有机电子与信息显示国家重点实验室培育基地,南京210046;2安徽工业大学冶金与资源学院,分子工程与应用化学研究所,安徽马鞍山243002)
1 引言
有机光电材料通常是含有π共轭体系和氮、硫等杂原子的芳香性有机分子,在可见光区域有很好的吸收特性,有较大的Stoke位移,可以通过分子设计获得所需的光电性能,具有结构组成多样化和性能调节空间大等优点.1-3基于有机光电材料的众多优点,使得有机光电材料在光电子器件方面具有巨大的应用潜力,常被应用于有机电致发光器件(OLED)1-3、有机薄膜晶体管(OFET)、4,5有机太阳能电池(OPV)6等.在p-n型有机材料的分子设计中,咔唑和三芳胺基团常作为传输空穴的p-掺杂型单元,常用的n-掺杂型单元主要为含O、N、S的杂环基团,1-3例如吡啶、二嗪、三嗪、咪唑、噁二唑、噻唑、三唑、喹啉、邻菲罗啉等.在上述的这些n-掺杂型单元中,单杂环的二嗪类化合物由于具有更高的电子亲和势,具有较高的发光效率、良好的电学和光学性质,并且容易合成和进行化学修饰,也被广泛应用于OLED、7-11OPV、12-14OFET15-17和化学和生物传感器18-21等领域.
二嗪即二氮杂苯,是指含有两个氮原子的六元杂环化合物,根据两个氮原子相对位置,可分为如图1所示三种异构体,分别为:哒嗪(1,2-二嗪)、嘧啶(1,3-二嗪)和吡嗪(1,4-二嗪).二嗪具有高缺π芳香特性,将之引入至推-拉电子结构的共轭骨架中有利于分子内电荷转移(ICT).受氮原子的吸电子诱导效应和吸电子共轭效应的影响,相比吡啶,二嗪的碱性更弱,二嗪环更加稳定,较难发生亲电取代反应.但是对亲核试剂比较活泼,二嗪可以在氮的邻、对位发生亲核芳香取代反应,与有机金属化合物在氮α位反应.产物在氧化剂作用下芳构化生成取代二嗪.二嗪还容易被过酸氧化为单N-氧化物,使环上的亲电取代反应和亲核取代反应变得容易,使得可以容易地通过化学修饰获得种类繁多的二嗪类衍生物.由于不同的芳香取代基的引入,与二嗪的π共轭体系之间的轨道相互作用不但稳定了二嗪环的分子骨架,而且能形成多种不同的电子结构,从而获得具有各种特殊结构和性质的新型功能材料.此外,二嗪容易被质子化并形成氢键,其氮原子易与金属发生配位作用,因此二嗪衍生物是超分子自组装和传感等领域关注的焦点之一.在过去的二十年中,哒嗪、嘧啶和吡嗪杂环常作为功能π共轭材料的构建单元.22二嗪比只含一个氮原子的吡啶具有更高电子亲和势,更适合作为电子受体单元应用于光电材料中以提高材料的电子传输和注入性能.7
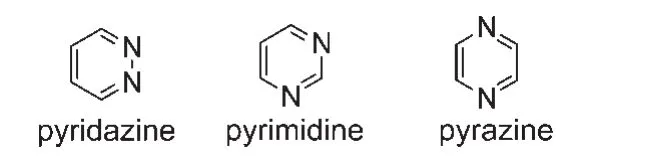
图1 二嗪的三种(哒嗪,嘧啶,吡嗪)同分异构分子式Fig.1 Three kinds of formula isomers of diazine(pyridazine,pyrimidine,and pyrazine)
由于哒嗪、嘧啶和吡嗪这三种异构体中两个氮原子所在位置不同,它们的电子亲和性不同,对材料的光电性能有不同程度的影响.例如,Su及其合作者8合成了一系列如图2所示的主体材料H1-H7,研究结果证明,可以通过改变氮原子的数量和位置来调节材料的能级、单线态-三线态交换能(ΔEST)和载流子迁移率.相对于以苯环和吡啶环为核的材料(H1-H4),含有嘧啶和吡嗪核的材料(H5-H7)的单线态能级和ΔEST明显降低.其中以4,6-二取代嘧啶环为核的主体材料H6具有更低的最低未占据分子轨道(LUMO)能级和最小的ΔEST,电子注入能力和载流子平衡能力得到提高,以H6作为主体制得高效的红光磷光OLED.北京大学邹德春课题组23系统研究了以二嗪化合物为C^N配体的铱(III)配合物Ir1-Ir4,相对于含吡嗪的铱(III)配合物Ir1和Ir2,基于嘧啶的铱(III)配合物Ir3和Ir4的LUMO能级增大,磷光发射蓝移.以Ir1和Ir3为磷光客体,可分别获得高效的黄光和绿光磷光OLED.二嗪类铱配合物由于双氮原子的影响,在改进发光性质以及配合物的稳定性等方面有积极意义.对配合物进行修饰,可以有效地调节材料发光颜色,同时引进空穴传输基团或高分子链以提高发光效率,简化器件制作.很多研究证明,配体的结构对铱(III)配合物的分子前线轨道分布等性质影响很大,从而影响铱(III)配合物的发光颜色和发光强度.24Thummel课题组25合成了一系列含有两个邻菲罗啉单元,中间分别由哒嗪、嘧啶或吡嗪环链接的双齿桥联配体,这些配体与钌配位生成一系列单核钌配合物和双核钌配合物(见图3).这些钌的配合物在电化学发光和太阳能电池中都会有很好的应用.由此可见,在光电材料设计中,引入不同的二嗪单元可以使得未参与配位的sp2-杂化N原子在不同程度上有效地调节材料的光电性能.本文对近年来二嗪类化合物在光伏材料、薄膜半导体材料、液晶材料、传感材料和电致发光材料等领域的研究进展进行了较全面的总结和评述.
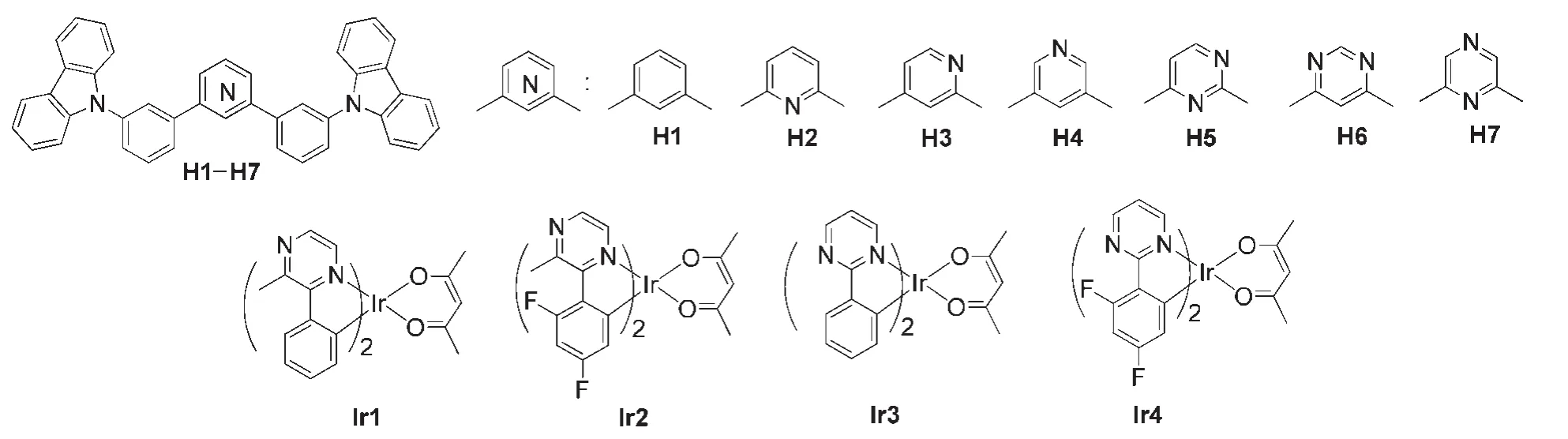
图2 含吡啶/二嗪单元的主体材料和铱(III)配合物8,23Fig.2 Some host materials containing pyridine/diazine unit and iridium(III)complexes8,23
2 哒嗪类化合物在光电材料中的应用
在二嗪类化合物中,最为少见的是哒嗪,自然界存在的哒嗪衍生物只有少数的几种,目前的应用大多作为构建在除草剂和药物中,作为生物活性结构单元.哒嗪是高度缺电子π芳香杂环,常作为吸电子单元(受体)被引入到具有推-拉电子体系的π共轭有机物中.哒嗪的pKa值为2.3,容易质子化和形成氢键,并且其氮原子易于与金属进行配位作用.26近些年哒嗪衍生物在发光材料、非线性光学材料、场效应晶体管材料、液晶材料和超分子组装材料等领域都受到一定程度的关注.
哒嗪应用于功能材料始于2005年,Yasuda等15报道将哒嗪单元作为受体引入到图4中的聚合物1中,由于分子间强相互作用,聚合物1紧密堆积,其中1b-1e在氯仿溶液中的量子效率为51%-61%,1b还是一种性能良好的OFET材料,其空穴迁移率为3×10-3cm2·V-1·s-1.Wu等27用薗头偶联方法合成了含有哒嗪单元的聚合物2(见图4),它在四氢呋喃溶液中的量子效率为36%,而且呈现较强的聚集荧光.Hadad等28结合薗头偶联和羟醛缩合反应合成了一系列共轭分子3-7.由于分子内电荷转移,使得化合物3-7呈现非常特别的发光性质.
Schmitt等18研究了如图5所示的基于1,4-二苯乙烯基哒嗪衍生物8和9的荧光探针.在不同的溶剂中,化合物8和9的荧光发射变化显著,呈现出正向的溶致变色现象,对质子化溶剂非常敏感,并且对Fe(III)离子具有响应.Do等29合成了如图5所示对称的双哒嗪衍生物10和非对称的二哒嗪衍生物11,它们的荧光发射对溶剂的极性也非常敏感.基于10或11的聚甲基丙烯酸酯薄膜可作为检测不同溶剂的传感器.
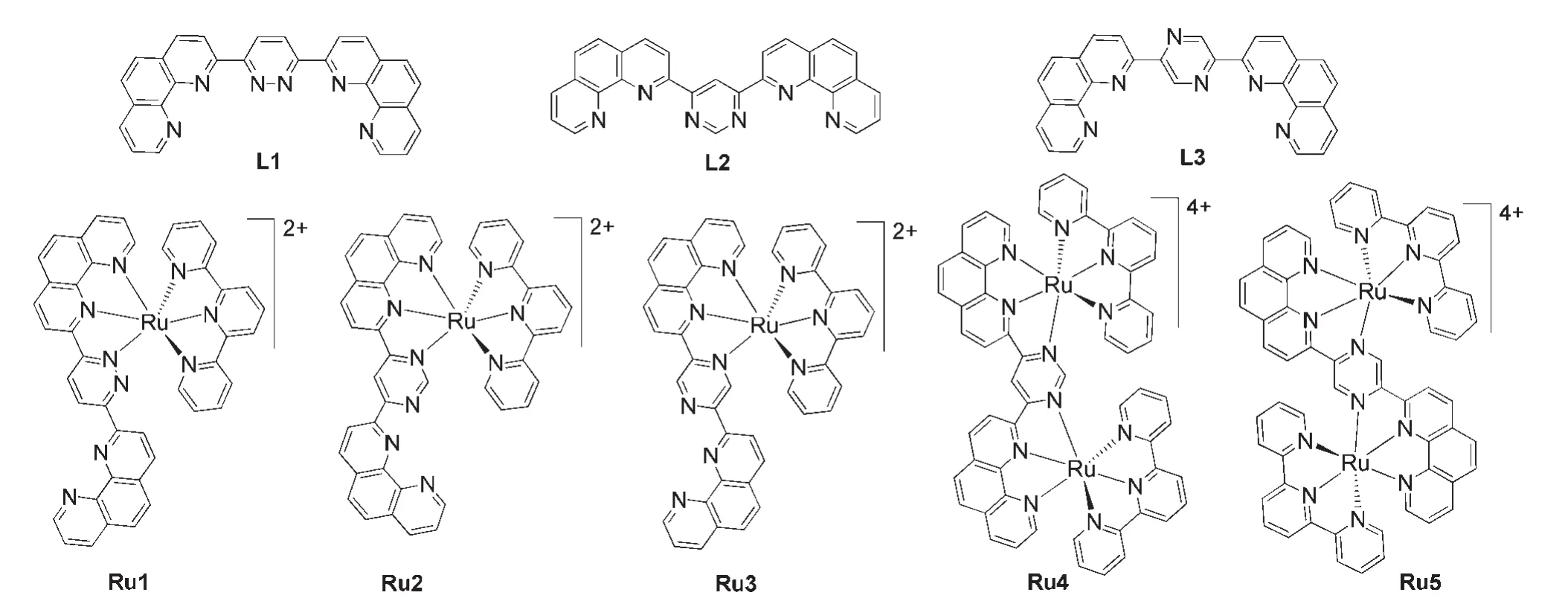
图3 含二嗪单元的双齿配体及其钌(II)配合物25Fig.3 Bis-tridentate chelators containing diazine unit and their ruthenium(II)complexes25
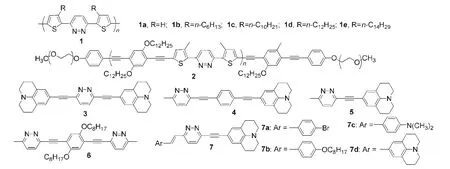
图4 一些含哒嗪单元的发光材料15,27,28Fig.4 Some luminescent materials containing pyridazine unit15,27,28
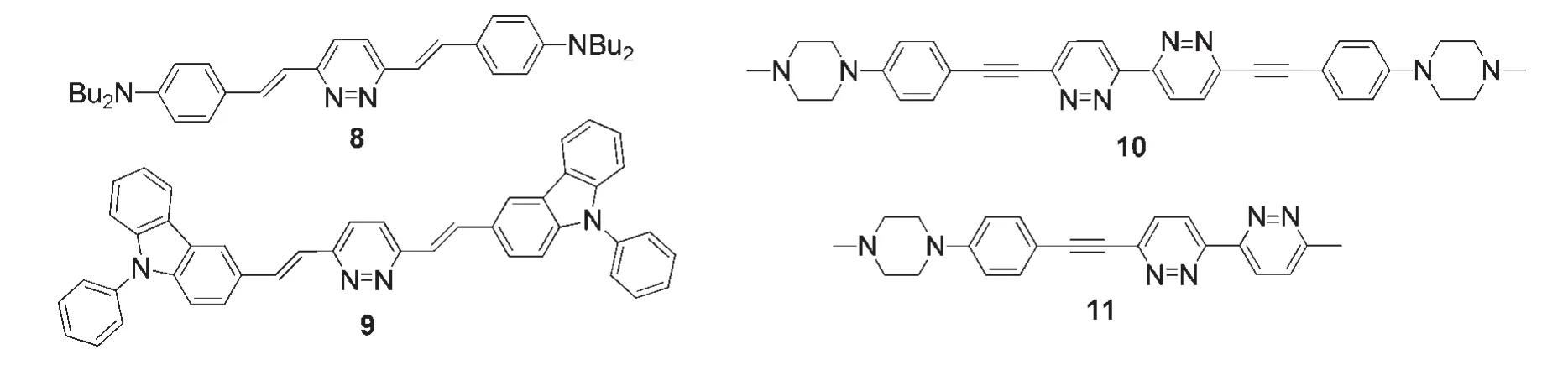
图5 一些含哒嗪单元的化学传感器18,29Fig.5 Some chemosensors containing pyridazine unit18,29
在液晶材料(LCD)的设计中,引入3,6-哒嗪单元可获得性能良好的负介电各向异性液晶材料.这是由于3,6-哒嗪单元的孤对电子定域于氮原子上,可形成与液晶材料的长轴相互垂直的偶极.图6给出了部分含有3,6-哒嗪单元的液晶材料的结构式.Paschke等30设计了如图6所示的含有3,6-哒嗪结构单元的液晶材料12-14,研究结果证明以哒嗪环替代苯环或吡啶基引起明显的介晶行为改变,趋向于形成层列C相.图6中的线性哒嗪寡聚物15-17呈现出层列相液晶性质,31而三氟甲基的引入后,材料18和19则呈现向列相液晶性质.32Wild等33在商业化的向列相液晶材料中使用3,6-双取代的哒嗪衍生物20(见图6),观察到挠曲电效应显著增长.Park等34通过Stille偶联反应合成了含有哒嗪单元的液晶材料21(见图6),由于强烈的分子间π-π堆积作用,其结构具有明显的层列相液晶性质.
哒嗪单元的两个N原子相邻,3-芳基取代的哒嗪衍生物(C^N=N)通常可作为环金属配体制备各类重金属配合物(图7所示).与2-芳基吡啶配体(C^N=CH)相比较,基于哒嗪的C^N=N配体中未参与配位的邻位N原子上不含氢原子,配位中心周围空间位阻变小,利于增强C^N=N配体与金属Ir中心的配位作用,使得容易生成三环金属铱(III)配合物(图7所示).35哒嗪类三环金属铱(III)配合物中的C^N=N配体与金属Ir中心的配位作用增强可使第一级自旋轨道耦合更大,促成有效的单线态和三线态激发态混合,从而可能提高铱(III)配合物的发光量子效率.36Gao等11设计合成了(图7所示)以3,6-二苯基哒嗪为C^N=N配体的铱(III)配合物Ir5.相对于三环铱(III)配合物三(2-苯基吡啶)合铱(Ir(ppy)3),Ir5中金属Ir原子与N原子的配位作用增强,提高了铱(III)配合物的稳定性,其熔点高达438°C.以Ir5磷光客体,掺杂到主体材料4,4'-二(9-咔唑)联苯(CBP)中,得到的绿光磷光有机电致发光二极管(PhOLED)最大外量子效率为14.6%,相应的电流效率和功率效率分别为52 cd·A-1和33.5 lm·W-1.Fang等37利用3-氯哒嗪衍生物中氯原子的化学活性合成了新的C^N=N配体,直接与3H2O·IrCl3在温和的条件下合成了三环金属铱(III)配合物Ir6(见图7).而大多三环基于C^N=CH配体的三环金属铱(III)配合物的合成需要以昂贵的Ir(acac)3为原料在高温条件下合成.这进一步说明哒嗪类C^N=N配体与金属Ir原子的结合能力强,基于哒嗪类C^N=N配体的三环金属铱(III)配合物更加容易合成.以Ir6作为磷光客体材料制备的橙红光器件(584 nm),启动电压为5.0 V,最大亮度为8256.2 cd·m-2,最大外量子效率为9.1%,最大电流效率为13.7 cd·A-1.
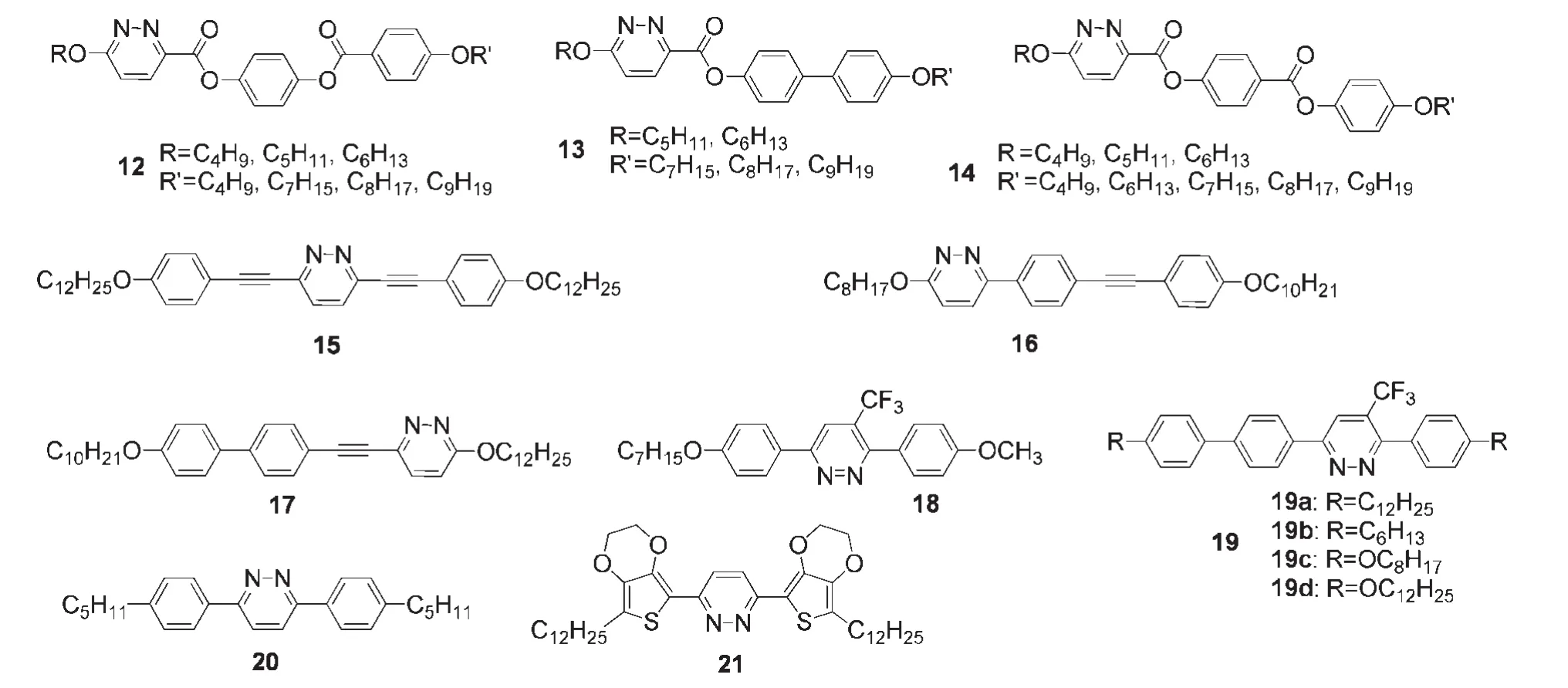
图6 部分含哒嗪单元的液晶材料30-34Fig.6 Some liquid crystal materials containing pyridazine unit30-34
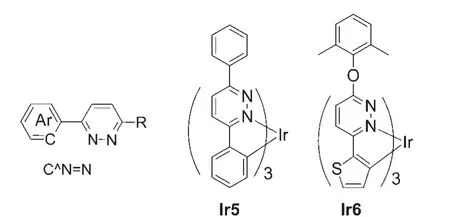
图7 部分含哒嗪单元的铱(III)配合物35-37Fig.7 Some iridium(III)complexes containing pyridazine unit35-37
3 嘧啶类化合物在光电材料中的应用
嘧啶是一种常见的六元共轭杂环,与吡啶单元相比,嘧啶单元更缺电子,具有更高的电子亲和势,更适合作为电子传输单元.38,39另外,嘧啶单元具有一定的碱性,也是潜在的配体单元,在修饰调节分子的光电性质方面具有非常重要的作用.嘧啶环的引入能明显提高材料的发光性能,在已报道的文献中,嘧啶衍生物不仅可被用作OLED功能材料、OFET材料、液晶材料,还可以作为荧光分子和双光子吸收发色团以及荧光探针.
3.1 应用于OLED中含嘧啶单元的功能材料
在2-芳基嘧啶衍生物中,由于不存在C―H键的邻位相互作用,较之联苯和2-芳基吡啶类化合物具有更好的共平面性和共轭性,利于电子传输.Wong等40报道了一系列嘧啶衍生物22a-22c(图8),它们由苯基和嘧啶交替构成,具有很高的热稳定性,在419 nm处有很强的蓝光发射,光致发光量子效率依次为37%、54%和37%.结构为氧化铟锡(ITO)/聚3,4-乙撑二氧噻吩-聚苯乙烯磺酸盐(PEDOT-PSS)/4-(N-咔唑基)-4'-(N-苯基萘氨基)联苯(NCB,NCB的具体结构式见图8)/22b(或22c)/Mg:Al(10:1)/Ag的电致发光器件的亮度都大于2000 cd·m-2,外量子效率为1.3%-1.8%.图8中的含有螺芴单元的嘧啶衍生物23也是一种发光很强的蓝光材料,在氯仿溶液中和薄膜状态下均具有很高的光致发光量子效率,分别为100%和80%.41以23作为主体材料,掺杂了苝的多层蓝光器件的最大亮度高达80000 cd·m-2.图8中的含有芴单元的嘧啶衍生物24是一种具有与23类似结构的材料,将之应用于OLED中,在高启动电压下可观测到蓝绿光,这种蓝绿光可能来源于材料的激基复合物的发射.Gunathilake等42通过醛醇缩合反应合成一系列如图8中的含有嘧啶单元的共轭聚合物25-27,其中25a具有最高的光致发光量子效率(83%).我们课题组43也设计合成一系列蓝光到近紫外光的具有p-n共轭结构的嘧啶类双极发光材料28-32.基于咔唑核的双嘧啶取代衍生物29的发光量子效率高达93%,其荧光发射中心位于397 nm,是目前已报道的嘧啶类发光材料中发射波长最短的.
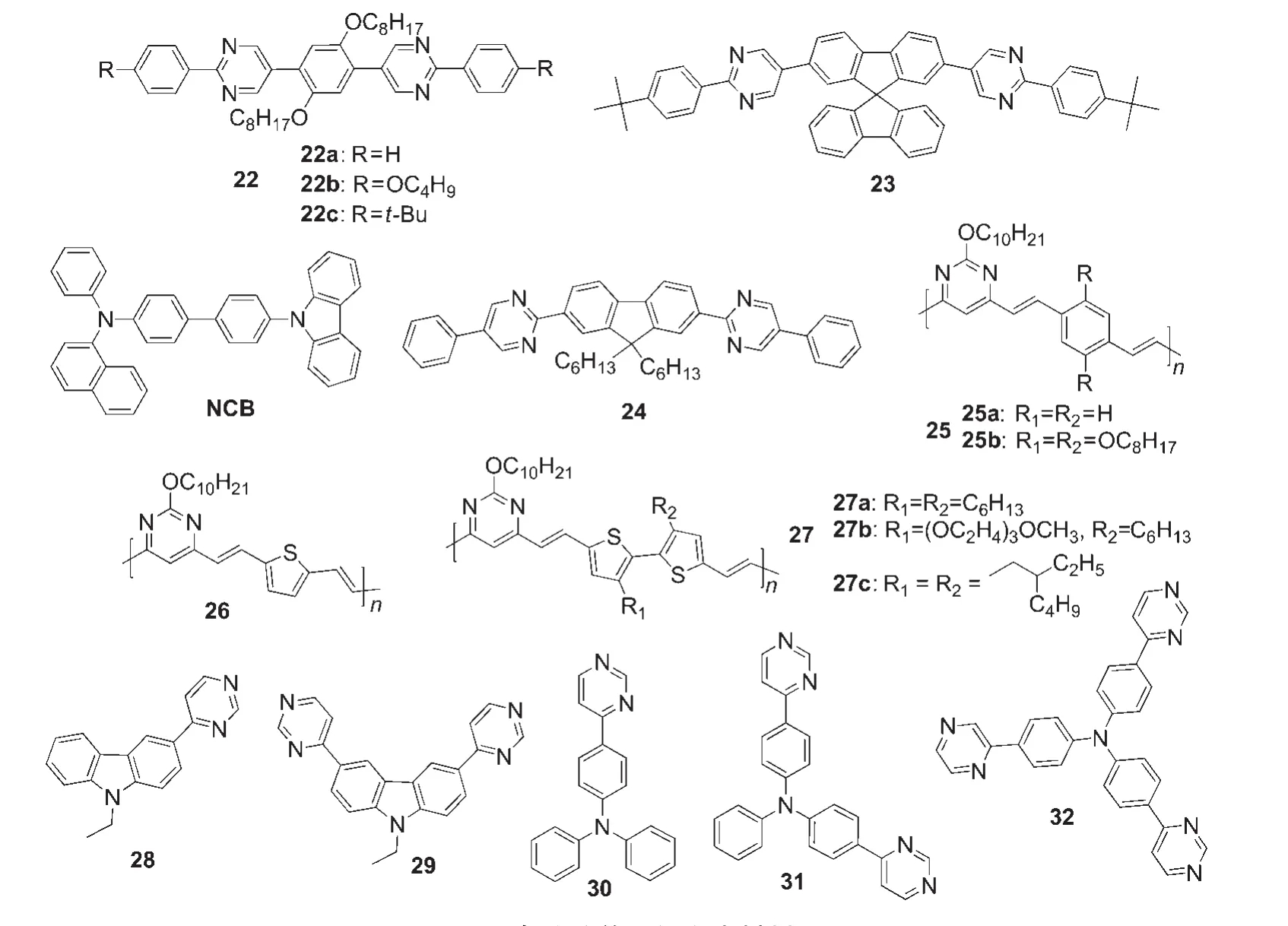
图8 含嘧啶单元的发光材料40-43Fig.8 Some luminescent materials containing pyrimidine unit40-43
Aldred等44报道了与24结构类似的如图9所示的2,5-二取代嘧啶衍生物33和34,其中化合物33具有5.57 eV的电离势(Ip)和2.56 eV的电子亲和势(EA),可作为多层OLED的空穴阻挡或电子注入层材料.Sasabe等45以如图9所示的2-苯基嘧啶衍生物35-36和Ir(ppy)3分别作为电子传输层材料(ETM)和磷光掺杂客体制备绿光PhOLED,所得器件最好的效率为128 lm·W-1(105 cd·A-1,100 cd·m-2)和96 lm·W-1(99 cd·A-1,1000 cd·m-2).随后,同一课题组46报道了一系列以2-甲基嘧啶为核的电子传输材料37-39,它们的Ip分别为7.36、7.81、8.17 eV,均接近或大于常用电子传输材料2,9-二甲基-4,7-二苯基-1,10-菲啰啉(BCP)的Ip(7.40 eV);它们的EA值显著地大于BCP的EA值(0.47 eV),分别为0.90、1.30、1.47 eV.其中电子传输材料39的电子迁移率分别为1.0×10-4cm2·V-1·s-1,比三(8-羟基喹啉)铝(Alq3)的电子迁移率高100倍.在保持相同的器件结构条件下,以37-39作为代替BCP作为电子传输层材料制备多发光层蓝光PhOLED,所得器件在亮度为100和1000 cd·m-2时的效率(包括能量效率、电流效率、外量子效率)均可提高约2-5倍.47Su课题组48设计合成了一系列如图9所示以2,4,6-三取代嘧啶为核的电子传输材料40-43,并以40-43作为电子传输和空穴/激子阻挡层制备结构为ITO/TPDPES/TAPC/CBP:8%(w)Ir(ppy)3/ETM/LiF/Al的绿光PhOLED,所得器件的开启电压为2.1 V(41和43)或2.2 V(40和42),比发射光子能量(hv)·e-1的最小值还低0.2-0.3 V.以43作为ETM的器件在亮度为100、1000和10000 cd·m-2时所需施加电压分别为2.39、2.72和3.88 V,为目前报道最低的操作电压,并且仍保持着很高的外量子效率和能量效率.
由于嘧啶类化合物的优异特性和可修饰性,嘧啶单元常被应用于设计构建主体材料.Wu等14用图8所示的23作为主体材料,制得掺杂了苝的多层蓝光器件,其最大亮度高达80000 cd·m-2.49Son等49报道了如图10所示的三咔唑取代的嘧啶衍生物44,该材料具有高的三线态能级(T1=2.89).在主体材料44中掺杂6%(w)的双(4,6-二氟苯基吡啶-N,C2)吡啶甲酰合铱(FIrpic),得到的薄膜的光致发光量子效率可达到80%±1%,近乎完美地限制了FIrpic的三线态激子.进一步增大FIrpic的掺杂浓度后,可观测到更低的启动电压和更高的外量子效率,说明发光层中电子的注入和传输得到增强.Hudson等50报道了如图10所示的含有嘧啶衍单元的主体材料45,该材料与常用的主体材料CBP具有类似的化学结构.以缺电子的嘧啶单元代替CBP中的苯环,可以在保持材料的最高占有分子轨道能级基本不变的基础上较大幅度降低其最低未占有分子轨道(LUMO)能级,因此相对于CBP,主体材料45在保留原有的空穴传输能力的同时提高了电子注入和传输能力,使得材料45成为双极主体材料.以乙酰丙酮酸二(2-苯
基吡啶)铱(Ir(ppy)2(acac))作为磷光客体,CBP或45作为主体材料制备的单层PhOLED的最高外量子效率分别为13.3%和26.8%,最高电流效率分别为54.4和92.2 cd·A-1,说明基于双极主体材料45的器件性能得到明显的提高.Cai等51以三(2-(4-甲苯基)苯基吡啶)铱(III)(Ir(ppy)3)和三(1-苯基-异喹啉)合铱(Ir(piq)3)作为磷光客体,以如图10所示的46作为主体材料制备的器件的最高外量子效率分别为9.5%和8.5%,最高流明效率分别为32.5和5.5 cd·A-1,说明基于嘧啶单元的引入使得器件性能得到明显的提高.Aizawa等9在46的基础上引入了叔丁基,设计合成了如图10所示的主体材料47,以Ir(ppy)3作为磷光客体,制备的器件在保持较好的发光性能的同时启动电压非常低,这是由于47含有嘧啶单元,具有较高的电子亲和势和较低的LUMO能级,有利于电子的注入.
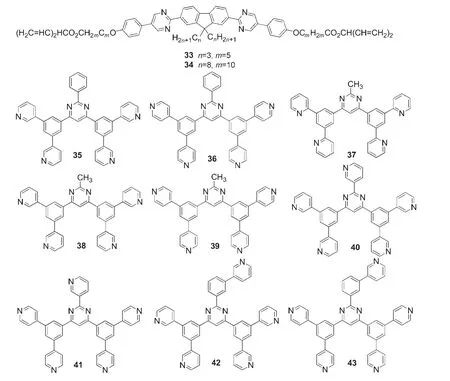
图9 部分含嘧啶单元的电子传输材料44-48Fig.9 Some electron transfer materials containing pyrimidine unit44-48
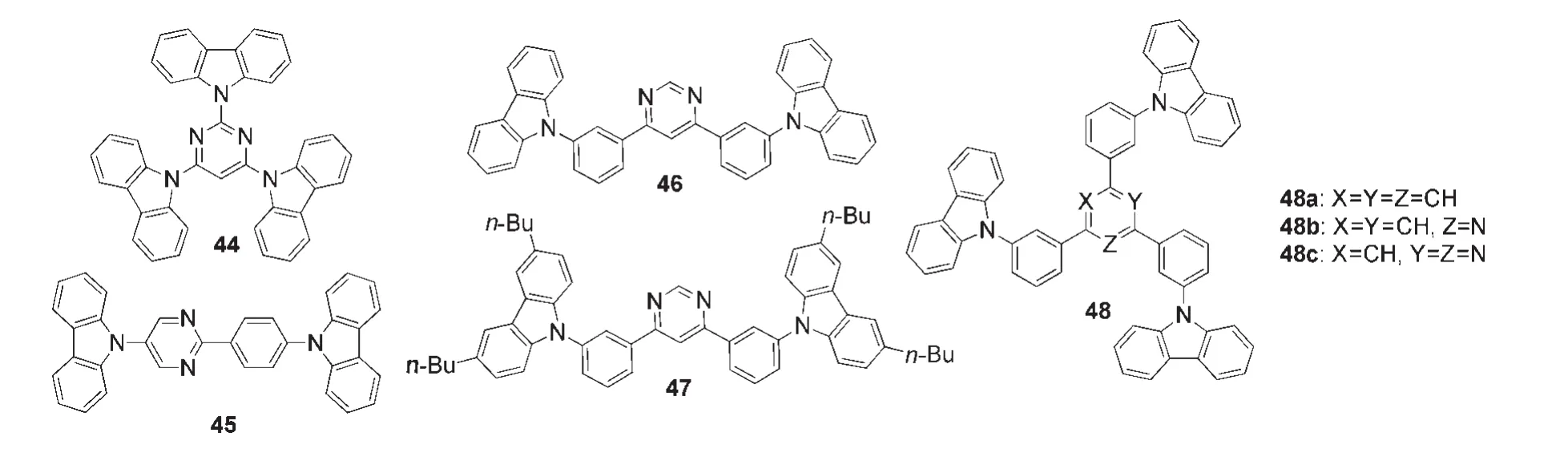
图10 部分含嘧啶单元的主体材料9,49-52Fig.10 Some host materials containing pyrimidine unit9,49-52
Su与其合作者52设计了分别以苯环、吡啶和嘧啶为核的如图10所示的星型主体材料48.杂环核的引入成功地降低材料的LUMO能级和ΔEST,其中嘧啶衍生物48c具有最低的ΔEST.相较于48a和48b,以48c为主体材料制得更高效的绿光和红光PhOLED,并且效率滑落幅度很低,这可能归因于嘧啶核的引入提高了主体材料的双极性从而提高了载流子平衡.
嘧啶环中两个氮原子处于间位关系,一般来说可以在嘧啶环的2,4和6位引入芳香基团使其成为金属配合物的有机配体.目前报道的环金属嘧啶类配体主要为2位单取代或多取代嘧啶衍生物.如北京大学邹德春课题组23报道的如图2所示的铱(III)配合物Ir3-Ir4,分别是以2-苯基嘧啶和2-(2,4-二氟苯基)嘧啶为环金属配体,以乙酰丙酮为O,O辅助配体.在相同结构的器件中,基于Ir3的绿光器件的性能与基于Ir(ppy)2(acac)的器件性能相当.该课题组53还设计合成了发蓝光的嘧啶类铱配合物Ir7,并将其掺杂到聚合物主体材料聚乙烯基咔唑(PVK)中制备了一系列不同掺杂浓度的蓝光PLEDs.当Ir7的掺杂浓度为10%(w)时,所得PLED的最高外量子效率为2.2%,效率为1.9 lm·W-1.Lin等54报道了一系列如图11所示的基于2,5-二芳基取代的嘧啶环金属配体的铱(III)配合物Ir8-Ir14,以配合物Ir9、Ir10或Ir13作为磷光掺杂客体,制备结构为ITO/BPAPF(见图11)/CBP:6%(w)Ir9,Ir10或Ir13/BCP/Alq3/Mg:Ag的器件,所得器件的最大外量子效率分别为8.46%、7.44%和8.02%,最大电流效率分别为30.0、28.8和31.3 cd·A-1,电流密度为100 mA·cm-2时的亮度分别为17481、18704和20942 cd·m-2.Mondal等55合成了如图11所示的以2-(3-甲基-苯基)-嘧啶为环金属配体的黄绿光铱(III)配合物Ir15,其在室温下的二氯甲烷溶液中的光致发光量子效率高达100%.以CzFCN或CzFOXa(见图11)为主体材料,Ir15为磷光客体,可制备得高效的黄绿光PhOLED,最高外量子效率分别为17.4%和16.2%,电流效率分别为60.4和53.6 cd·A-1;在主体CzFCN或CzFOXa材料中同时掺杂FIrpic、Ir15和Os1(见图11),可制备得高效的白光PhOLED,最高外量子效率分别为17.3%和15.7%,电流效率分别为33.4和31.2 cd·A-1.
以上所述嘧啶类铱(III)配合物的环金属配体均是2-取代嘧啶化合物,若以4位单取代嘧啶化合物如4-苯基嘧啶作为环金属配体,由于3位氮原子裸露在外,其孤对电子使得该氮原子与金属原子之间的配位作用也很强,干扰了C,N配体单元与金属原子之间的配位作用,因此在相同的合成条件下难以得到单一的(C,N)2Ir(L)型铱(III)配合物.用位阻基团屏蔽裸露的氮原子,获得的4,6-二取代嘧啶衍生物,是一类非常具有潜力的环金属C,N配体.例如,台湾国立清华大学的宋怡桦56合成了一系列如图12所示的以4,6-二苯基嘧啶或4-苯基-6-三氟甲基-嘧啶为环金属C,N配体的铱(III)配合物Ir16-Ir19.铱(III)配合物Ir16-Ir19的蒸镀薄膜室温下发射波长在582-611 nm范围内,处于橙光到红光的区域,光致发光量子效率分别为0.007、0.38、0.082和0.19.另外,通过改变合成的条件或方法,可利用4,6-二芳基取代嘧啶衍生物中两个C,N单元来合成多金属核的金属配合物.例如,Kozhevnikov等57合成了4,6-二(4-叔丁基苯基)嘧啶配体,不仅利用该配体得到了图12中的单核铱配合物Ir20,还合成了含有两个铂原子和一个铱原子的三金属中心配合物Pt2-Ir.Ir20和Pt2-Ir(图12)在混合溶液(Vether:Visopentane:Vethanol=2:2:1)中的发射波长分别为585和626 nm,光致发光量子效率分别为0.39和0.41.Culham等58以4,6-二芳基取代嘧啶衍生物制备了单核铂(II)配合物Pt1和双核铂(II)配合物Pt2,发射波长分别为521和558 nm,光致发光量子效率分别为0.25和0.36.
以上所述嘧啶类铱(III)配合物的环金属配体中的嘧啶单元都是以含有孤对电子的氮原子参与和铱的配位,若将嘧啶单元作为芳基与铱形成碳金属键,其他的含氮杂环提供氮原子参与配位,可获得性能优异的磷光材料.台湾元智大学的Chang等59制备了吡啶基的嘧啶类衍生物,以此作为环金属配体,制得了如图13所示的由蓝光到红光的铱配合物Ir21-Ir24.嘧啶单元作为取代基与吡啶基团的链接方式不同,分子量完全相同的两个铱配合物Ir22和Ir23的发光颜色有很大的差异,Ir22的最大发射波长为457、489 nm,在521 nm处有一个小的肩峰,而Ir23的最大发射波长为535 nm,这主要是因为Ir23的HOMO基本上都分布在环金属配体的嘧啶部分,而Ir22的HOMO则分布在吡唑和嘧啶基部分.两个铱配合物的环金属配体的主要差异是由于Ir23的环金属配体中的嘧啶的氮原子能进一步加强共振效应,延伸的π共轭.最终引起Ir23的HOMO能级增大,同时该共振效应的结果也减小了对LUMO轨道有贡献的吡啶基部分的π*能量,从而大幅减少在Ir23的HOMO-LUMO能隙,使得发光光谱红移.其中以Ir22和Ir24为磷光客体,制备了高效的蓝光器件,最高外量子效率分别为17.9%和15.5%,电流效率分别为38.0和30.6 cd·A-1.
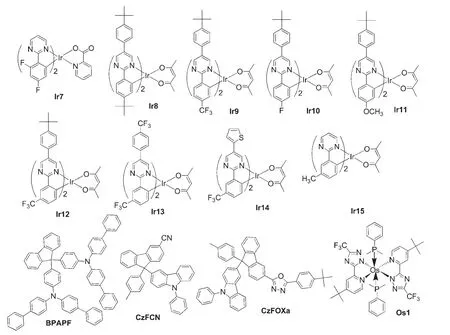
图11 基于2-芳基嘧啶衍生物为C,N配体的铱(III)配合以及文献涉及相关材料53-55Fig.11 Iridium(III)complexes based on 2-diaryl pyrimidine derivatives and other related materials53-55
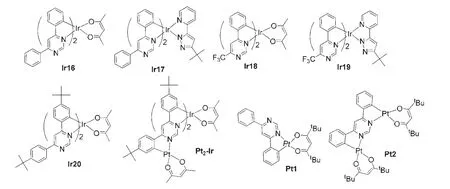
图12 部分以4,6-二芳基嘧啶衍生物为C^N配体的铱(III)和铂(II)配合物56-58Fig.12 Some iridium(III)and platinum(II)complexes based on 4,6-diaryl pyrimidine derivatives56-58

图13 部分以吡啶基嘧啶为C^N配体的铱(III)配合物59Fig.13 Some iridium(III)complexes based on pyridyl pyrimidine cyclometalate C^N ligands59
在环金属铱(III)配合物中,2-吡啶甲酸(pic)和2,2'-联吡啶(bpy)是最十分常见的辅助配体,分别形成如图14所示结构的环金属铱(III)配合物(C^N)2Irpic和(C^N)2Irbpy+.相对于吡啶类辅助配体,由于嘧啶环中含有两个氮原子,引入嘧啶类辅助配体可能形成双核或多核金属配合物.例如,2-嘧啶甲酸(pmc)和2,2'-联嘧啶(bpm)与金属铱(III)形成如图14所示结构的配合物(C^N)2Irpmc和(C^N)2Irbpm+后,未配位的氮原子可进一步与金属铱(III)或其他金属离子进行配位,赋予配合物更丰富的光电物理性质.Lian等60以2-嘧啶甲酸为辅助配体的铱(III)配合物进一步与三氯化铕反应生成如图14所示的四金属配合物Ir3-Eu1和Ir3-Eu2,其中蓝光发射的二氟苯基吡啶铱配合物能更好地敏化铕(III)离子的发光.Chen等61以bpm作为连接金属中心的桥配体,合成了如图14所示的Ir(III)-Ln(III)(Ln=Nd,Yb,,Er)双核配合物Ir-Nd1、Ir-Yb、Ir-Er.这些Ir(III)-Ln(III)双核配合物中的Ir(III)配合物Ir23可有效地敏化来至Nd,Yb和Er的近红外发射.黄春晖课题组62以嘧啶基咪唑衍生物作为连接金属中心的桥配体,合成了如图14所示的Ir-Nd2和Ir-Nd3双金属中心的配合物,光物理研究表明铱配合物具有合适的三重态能级能有效的敏化Nd(III),溶液下和薄膜下能量都能从Ir(III)部分有效的转移到Nd(III),制作的器件外量子效率达到0.3%.

图14 部分以嘧啶衍生物为辅助配体的铱(III)配合物60-62Fig.14 Some iridium(III)complexes based on pyrimidine derivatives as auxiliary ligands60-62
Kubota等63以β酮取代的嘧啶衍生物为配体制备了如图15所示的新型强荧光发射的单硼配合物B1和双硼配合物B2.其中未取代的和三氟甲基取代的单硼配合物B1在固态下比在溶液中表现出更高的荧光量子产率,在溶液下量子效率仅分别为0.02和0.01,在固态下却分别达到0.13和0.15,这可能是因为单硼配合物的分子内的芳基取代基的旋转被抑制,限制非辐射过程.相似结构的对二甲氨基取代的单硼配合物却有着相反的结果,溶液下有较高的荧光量子效率(0.78),不仅出现了较大程度的红移,最大发射到了529 nm,还呈现出较强的溶致变色现象.而双硼配合物B2则有很高的摩尔吸光系数,相比于未取代的单硼配合物,吸收光谱和发射光谱出现较大的红移,最大发射波长在490 nm,红移了79 nm,这可能是因为配位和两个末端的取代苯基使得π共轭进一步增大所致.
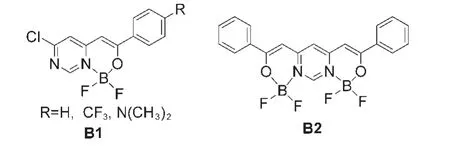
图15 基于嘧啶衍生物的硼配合物63Fig.15 Bisboron complexes based on pyrimidine derivatives63
3.2 含有嘧啶单元的OFET材料
相对于嘧啶单元在OLED功能材料中的应用,嘧啶衍生物作为OFET材料并不多见.如图16所示的4,6-嘧啶均聚物49是第一例见于报道的嘧啶类电荷传输材料.64Ortiz等16通过Still偶联合成了如图16所示的噻吩-嘧啶寡聚物50-53.嘧啶单元的存在提高了材料的电子亲和性,并且可以稳定材料的HOMO能级.但是半导体50和51的电荷传输性质仍取决于噻吩核,基于50和51的OFET仍为p-型OFET.它们的最大空穴迁移率分别1.0×10-4和3.0×10-3cm2·V-1·s-1.寡聚物50和51在固态下具有较高的荧光量子效率,并不受其强烈的分子内电荷转移效应的影响,因此它们还可能作为发光晶体管材料.然而,与50和51结构类似的寡聚物52和53在OFET器件中显示出典型的n-型电荷传输性能,这可能归因于三氟甲基苯基单元的引入进一步增强了吸电子性能.
3.3 含有嘧啶单元的太阳能电池材料
尽管含嘧啶的π-体系利于形成平面的结构并且能够提供有效的ICT,但是极少被应用于设计太阳能电池材料.Lin等12首次将以嘧啶环作为π-共轭间隔基团(spacer)的如图17所示的有机光敏化剂54应用于染料敏化太阳能电池(DSSC)中.与图17中的55相比较,含嘧啶的54在太阳光谱的红光部分的响应增强.基于54c的DSSC的能量转化效率(PCE)为7.64%(在AM 1.5 G光照辐射下).该课题组与其合作者13还研究了如图17所示的含嘧啶基的分子56,并利用真空沉积工艺制备了以56和C70分别为给体和受体的异质结太阳能电池,PCE为6.4%(在AM 1.5G光照辐射下).相对于图17中的含苯并噻唑单元的57,由于嘧啶基的引入,其吸电子特性使得56的HOMO能级更低,器件的开路电压(Voc)增大,同时提高了器件的PCE.然而,在Wu等14报道的一系列如图17所示的用芳香基修饰的卟啉锌58中,基于嘧啶环的58e和58f的DSSC总体效率低于其他芳香基取代的卟啉锌(58a-58d).
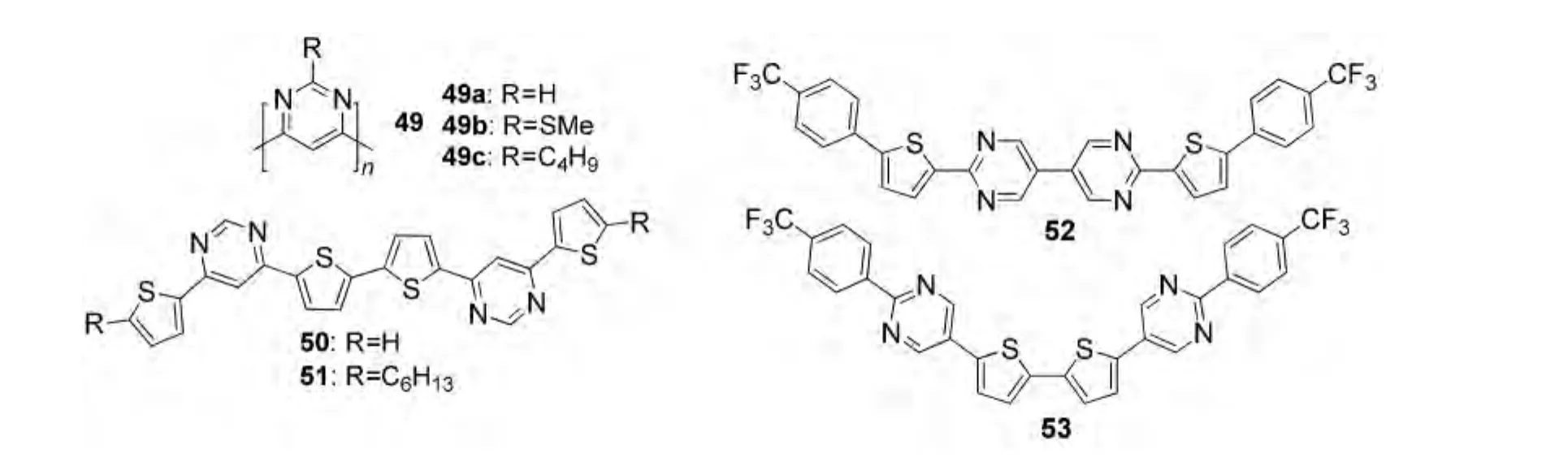
图16 部分含嘧啶单元的OFET材料16,64Fig.16 Some organic thin film transistor(OFET)materials containing pyrimidine unit16,64
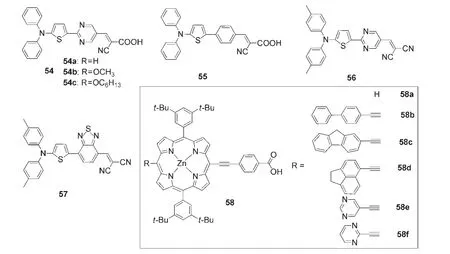
图17 部分含嘧啶单元的太阳能电池材料12-14Fig.17 Some solar cell materials containing pyrimidine unit12-14
3.4 含有嘧啶单元的液晶材料
嘧啶衍生物常用作液晶材料的构建单元.65如图18所示,2-苯基嘧啶衍生物59-62皆是近晶C相液晶材料,可作为铁电混合物的主体材料,不足之处是这类材料的近晶C相稳定性较低.66,67图18中的含嘧啶核的液晶63a的相变温度范围较之含1,4-苯撑和吡啶的类似物质63b和63c宽.68Shen等69合成了一系列如图18所示的弯曲型液晶材料64,除了64e的中间相是单变的,其他均具有互变的中间相.图18中的近晶C相液晶65是具有较高电子迁移率的,在25 °C下的电子迁移率为1.5×10-5cm2·V-1·s-1),这可能是由于嘧啶环含有电负性的氮原子.70Yoshizawa等71将两个含嘧啶单元的介晶基团通过邻苯二酚相连,设计了一种如图18所示的U型二聚体的液晶材料66.加热66使其从单变的近晶C相转变为向列相,在该过程中可观察到不寻常的焓变.该课题组72还设计了如图18所示的以手性联萘酚为链接单元的液晶材料67,其中n为基数的化合物67b、67d和67f可直接从蓝相转变为近晶A相.近年来,Robert和Lemieux课题组73-75报道了一系列如图18所示的含硅氧烷端基和2/5-苯基嘧啶核的材料68-71,这些材料可形成部分双层的近晶A相和近晶C相液晶.如图18所示的以嘧啶为核的化合物72和73是碟形液晶材料,比以苯基为核的材料具有更好的介晶性质,归因于嘧啶环具有更大的极化作用.76
3.5 含有嘧啶单元的双光子吸收材料
近年来的研究已经证明双光子吸收(TPA)材料可作为半皮秒脉冲激光材料,至此,双光子吸收染料在显微镜学、三维数据存储、光限幅、光动力治疗等领域受到关注.772007年,Liu等78报道了第一例基于4,6-二芳基乙烯基嘧啶的双光子吸收分子,如图19所示的化合物74的甲苯溶液在800 nm处的双光子吸收截面(σTPA)处于475到819 GM范围内,而且可以通过质子化和去质子化的方法调节这些分子的单光子和双光子荧光光谱.该课题组79还研究了另一系列如图19所示的V型嘧啶类双光子吸收材料75,它们的σTPA处于300到700 GM范围内.而由于分子间的氢键作用,图19的嘧啶核上2-位取代基为羟基的76在氯仿溶液中溶液聚集,该聚集使得74的双光子吸收和双光子诱导荧光增强.80在氯仿溶液中,76a和76b在850 nm处的σTPA分别为1531和1279 GM.Li等81报道了如图19所示的一系列基于2-硫代甲基嘧啶的弯曲型双光子吸收材料77,这些材料在700-900 nm范围内均具有较高的双光子吸收截面并具有高量子效率,其中77h在甲苯溶液中的σTPA高达2280 GM.基于掺杂77e的PMMA薄膜的光存储实验成功证明77e是具有潜质的光存储材料.Chen等82以二(噻吩基)-嘧啶为核,合成了如图19所示的双光子吸收材料78和79,其σTPA值分别为1702和1879 GM.田玉鹏课题组83报道了两个新颖的基于吡唑和咪唑取代的嘧啶衍生物的弯曲形双光子吸收材料80和81(见图19),两个材料都呈现出有趣荧光和溶致变色性能,这些材料在700-1000 nm范围内都有较大的双光子吸收截面,并具有高量子效率,其中80在强极性的二甲基甲酰胺溶液中的σTPA高达840 GM,而咪唑基取代的81在苯溶液中的σTPA高达1879 GM.将两个材料应用于双光子生物成像实验,也获得了较好的结果.
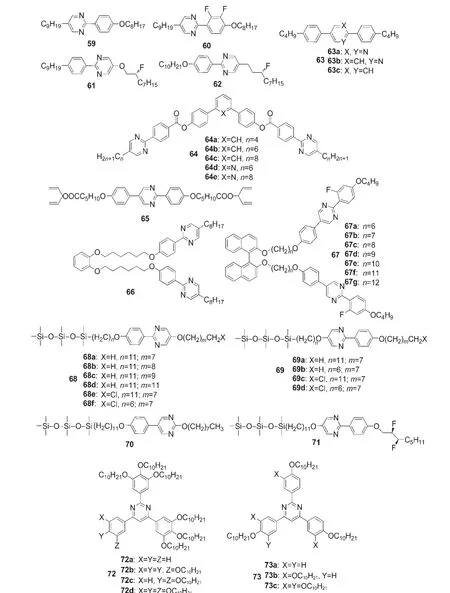
图18 部分含嘧啶单元的液晶材料66-76Fig.18 Some liquid crystal materials containing pyrimidine unit66-76
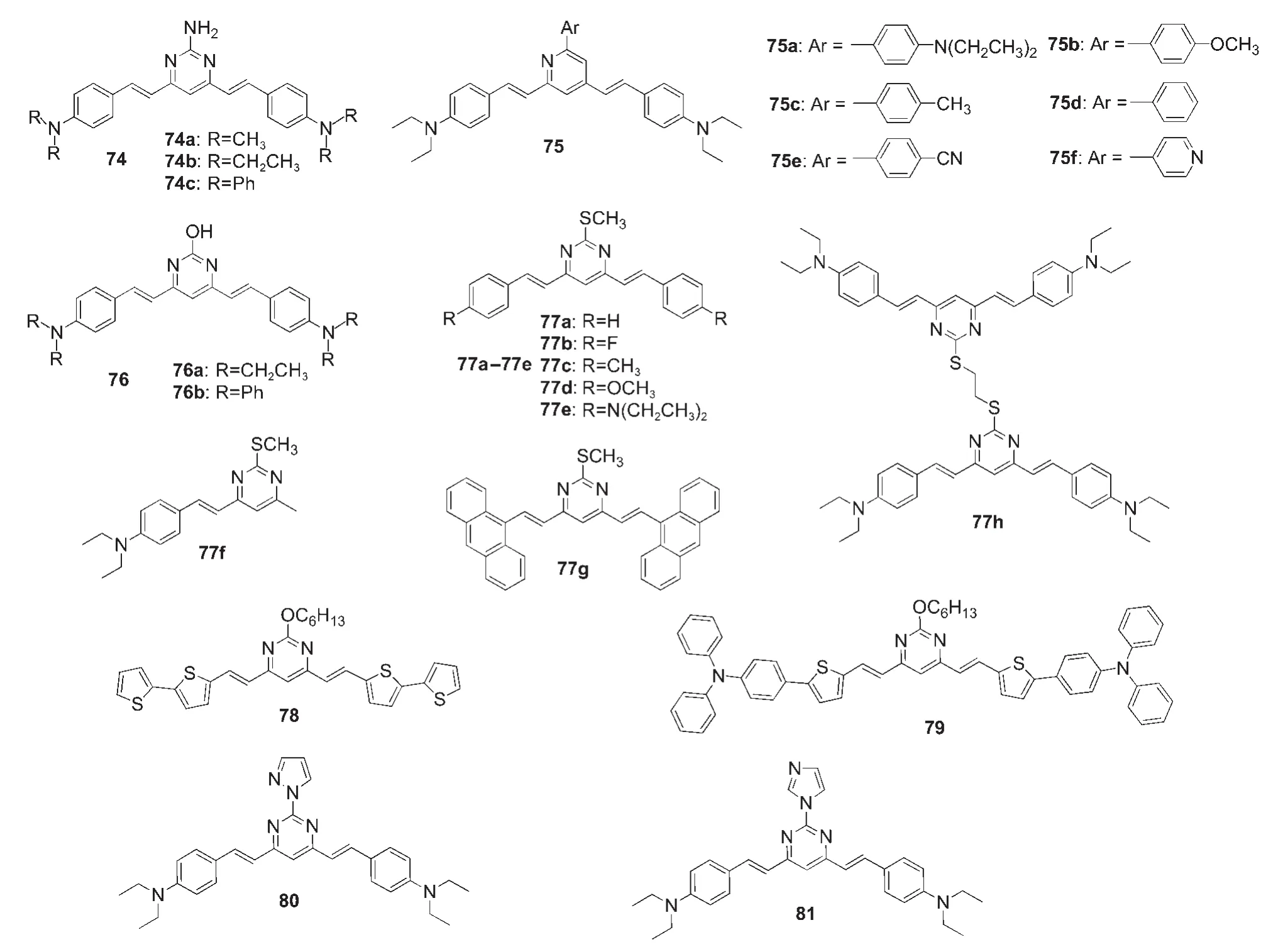
图19 部分含嘧啶单元的双光子吸收材料77-83Fig.19 Some two-photon absorption materials containing pyrimidine unit77-83
3.6 含有嘧啶单元的荧光探针
由于嘧啶单元的氮原子是碱性中心,在酸性条件下可以被质子化,可作为潜在的比色和荧光pH探针.19,84Achelle等19,84通过羟醛缩合反应合成了如图20所示的一系列对称的V型嘧啶衍生物82和不对称的嘧啶衍生物83.这些分子也表现出加酸显色的性质,在82或83的二氯甲烷溶液中加入三氟乙酸(TFA),溶液的吸收光谱发射光谱发生红移,荧光发射部分或完全被淬灭,是裸眼可视的比色和荧光淬灭型pH探针.图20中以三苯胺为核的嘧啶-吡啶衍生物84在酸性环境中被质子化后发生明显的颜色和发光改变,可作为裸眼可视的比色和比率荧光pH探针.85
基于非线性光学(NLO)响应的金属离子小分子探针具有独特的光物理性质,例如激发波长在近红外区域、良好的细胞渗透性和化学结构柔性.利用双光子荧光显微技术,如图19所示的基于嘧啶的NLO材料77f可在活细胞中作为检测铜离子的探针.86我们课题组20,21也开发了如图19所示的基于4-芳基嘧啶衍生物的荧光探针85和86.其中,化合物85可作为检测汞离子的裸眼可视的并可用作比率法荧光探针,不仅具有良好的金属离子选择性和抗干扰性,还是可重复多次利用的荧光探针.化合物86是一种非常有趣的多功能荧光探针,可在乙腈溶液中分别作为检测汞(II)离子的荧光淬灭型探针和检测铜离子的比率法荧光探针,以及在中性溶液中作为检测次氯酸根离子的荧光增强型探针.
4 基于吡嗪的光电材料
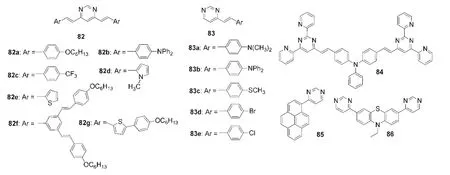
图20 部分含嘧啶单元的化学传感器19-21,84-86Fig.20 Some chemosensors containing pyrimidine unit19-21,84-86
吡嗪类化合物常常作为医药的重要结构单元广泛应用于医疗领域,由于吡嗪类化合物同样具有吡嗪类化合物电子传输性能,也可以作为设计光电材料的结构单元,但是相对于嘧啶类化合物,有关吡嗪在光电材料方面的应用报道并不多.近年来吡嗪衍生物作为电子传输材料、有机半导体材料和电致发光材料应用于光电子领域.图21给出了几个应用于OLED研究的吡嗪类电子传输材料.1997年,Grimsdale等87报道了一系列如图21所示的具有不同取代基的苯乙烯基吡嗪衍生物87,并且证明通过改变苯环上的取代基可以将其发射从蓝光调节至绿光.Liu等88制备了器件结构为ITO/NPB(N,N′-二(萘-1-基)-N,N′-二(苯基)联苯胺)/TPBI:88/Mg:Ag 的多层蓝光OLED.器件结构为ITO/PEDOT/89/Ca的单层OLED的电致发光峰为444 nm,而且没有出现来源于π-聚集或者激基复合物的发射,其启动电压为6.5 V,但是最大外量子效率仅为0.09%.89相对于以MEH-PPV([聚2-甲氧基-5-(2-乙基己氧基)-1,4-苯乙炔])作为发光层的单层OLED,在不改变器件其他结构的条件下,将20%(w)的如图21所示的吡嗪衍生物90掺杂到MEH-PPV发光层中可提高器件的外量子效率,表明吡嗪体系具有增强电子传输的特性.90图21中含有强电子受体2,3-二氰基吡嗪的蓝光材料91具有非常稳定的热稳定性,2,3-二氰基吡嗪基团的引入利于电子的注入和传输.以如图21所示的91为发光层可制得高效的非掺杂蓝光OLED,最大亮度为6230 cd·m-2,最大电流效率为5.2 cd·A-1.10关于含有吡嗪单元的聚合物的研究也很少.Wu等91用如图21所示的含有2,5-二苯乙烯基吡嗪单元的共轭聚合物92制备了结构为ITO/92/Mg:Al的Langmuir-Blodgett薄膜,该器件发橙红色光,启动电压为7 V.Peng和Galvin92报道了如图21所示的具有强荧光的聚合物93,结构为ITO/93/Al的单层OLED在电流密度为1 mA·mm-2时,外量子效率只有0.012%,而结构为ITO/PPV/93/Al的双层OLED的外量子效率略微提高,为0.015%.
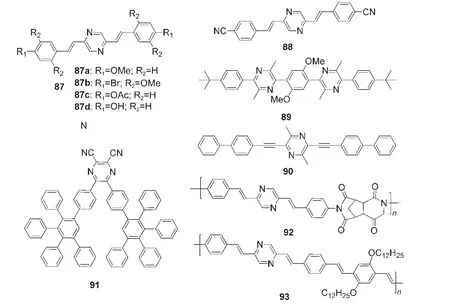
图21 部分含吡嗪单元的电子传输材料10,87-92Fig.21 Some electron transfer materials containing pyrazine unit10,87-92
在OFET的研究中,并五苯和噻吩寡聚物是典型的p-型半导体,但是这些材料在空气中比较不稳定,因此Kojima等17设计合成了含有吡嗪单元的p-型OFET材料94.相对于苯基,吡嗪单元的两个氮原子上没有氢原子,减少空间排斥力,利于形成共平面.而且吡嗪环是电子受体杂环,它的引入能够降低材料的HOMO能级,从而提高p-型OFET在空气中的稳定性.图22中含有三氟甲基的吡嗪衍生物95可作为n-型OFET材料.基于94和95的OFET在50°C下测得的迁移率分别为1.0×10-3和3.0×10-3cm2·V-1·s-1,阈值电压分别为-126和+41 V.
吡嗪衍生物与哒嗪、嘧啶衍生物一样具有与金属离子配位的能力.吡嗪单元中两个氮原子处于对位,更适合作为多核配合物的桥联配体.例如图23所示的吡嗪-吡啶衍生物96可与铂93、钌94和铼95等过渡金属配位生成多种具有有趣的电化学性质和光谱性质的单核或双核配合物.近来,Wu等96以吡嗪-吡啶衍生物96和97为配体合成了如图23所示的四核钌配合物Ru6和Ru7.相对于Ru7,Ru6具有较窄的能隙,吸收光谱红移并且吸收强度增强.然而,对基于吡嗪类配体的铱(III)配合物的研究并不多见,对基于吡嗪类配体的铱(III)配合物的研究主要有张国林等97,98报道的如图23所示的基于2,3-二苯基吡嗪的中性铱(III)配合物Ir25和Ir26,以及何静等99报道的如图23所示的吡嗪嘧啶铱(III)配合物Ir27,近来,Chandrasekhar等100合成了如图23所示的以萘啶-吡嗪为N^N辅助配体的铱(III)配合物Ir28.在420 nm的激发波长下,Ir28在二氯甲烷溶液中具有强绿光发射(508 nm),光致发光量子效率为0.32,激发态寿命为1.7 μs.
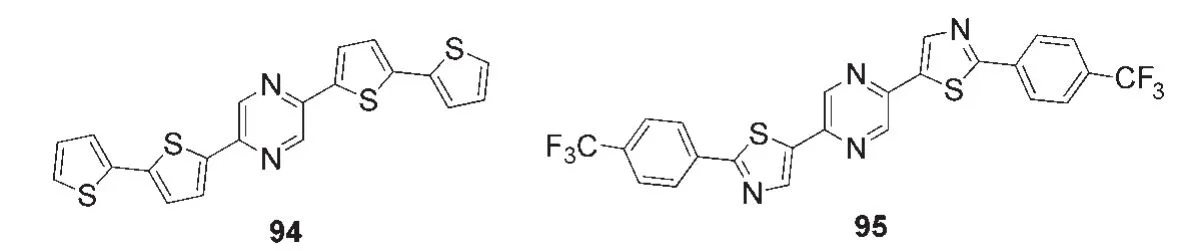
图22 部分含吡嗪单元的OFET材料17Fig.22 Some OFET materials containing pyrazine unit17
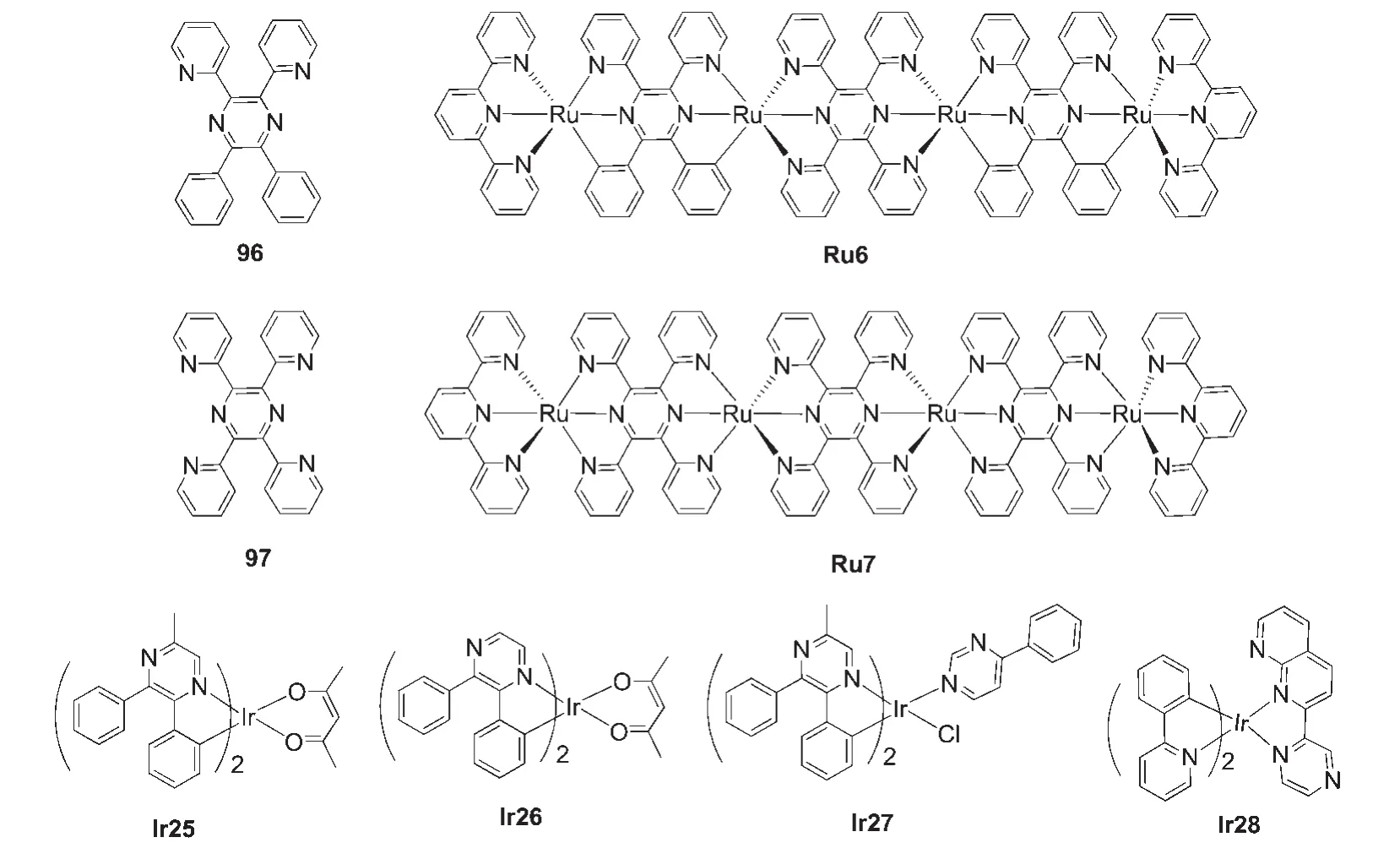
图23 基于吡嗪类衍生物的钌(II)和铱(III)配合物93-100Fig.23 Ruthenium(II)and iridium(III)complexes based on pyrazine derivatives93-100
5 结论与展望
有机光电功能材料在近几年里倍受关注,得到了很大的发展,各种性质优良的有机类光电材料相继被开发出来,并应用到各类电子器件中.器件的效率和寿命越来越高,逐步达到和满足商业化的需求.二嗪类化合物因其优越的性能在光电功能材料中被广泛应用,在有机光电功能材料中显示出了巨大的应用潜力.随着对二嗪类化合物研究的不断深入,其在有机合成、材料学、生物学、医学等领域将拥有十分广泛的应用前景.全面了解二嗪类化合物有效的合成方法有助于研究者针对不同的目标化合物设计和选择最为高效简洁的合成策略,从而推动先导化合物的发现与结构优化.此外,近年来研究发现,大多数的二嗪类化合物都能显示出良好的光电化学性能,使其在光电子器件、传感器等方面有广泛的应用前景.目前二嗪的制备主要是通过直接取代法和间接关环法制备,近几年虽然二嗪类光电材料的研究取得了一些进步,随着材料的不断功能化,丰富了二嗪类化合物的种类,但还有许多问题有待解决,如嘧啶成环产率较低,取代基嘧啶材料合成困难;二嗪类化合物种类较多,但能够实际应用于器件的备选材料不多.今后对于二嗪类光电材料的研究,要进一步探讨二嗪衍生物的结构与性能之间的关系,如二嗪的三种异构体各自的配位能力、堆积方式以及影响光电性能的原因,以此为依据通过计算机辅助设计、高斯计算等手段,模拟开发新型二嗪类电材料,在材料的基础上获得性能优异的有机光电器件.此外,目前二嗪类化合物在OTFT和太阳能电池的应用还较少,这主要是由于二嗪单元核是n型的,而且二嗪类化合物半导体材料大多是n型,而在有机半导体领域,n型半导体材料才是真正最值得发展的,因为不管是从迁移率还是材料种类,n型半导体材料都落后于p型半导体材料的发展.怎样结合其他的功能单元,设计新的具有高迁移率和高稳定性的二嗪类n型半导体,对于拓展二嗪类光电材料的应用有重要意义.二嗪类光电材料的应用存在众多问题,但功能基团的灵活性修饰开阔了我们解决问题的思路,促进了其实用化和商品化进程.对二嗪类光电材料的研究有望成为杂环类有机光电功能材料研究、发展的新方向之一.
(1)Chaskar,A.;Chen,H.F.;Wong,K.T.Adv.Mater.2011,23(34),3876.doi:10.1002/adma.v23.34
(2) Duan,L.A.;Qiao,J.A.;Sun,Y.D.;Qiu,Y.Adv.Mater.2011,23(9),1137.doi:10.1002/adma.201003816
(3) Tao,Y.T.;Yang,C.L.;Qin,J.G.Chem.Soc.Rev.2011,40(5),2943.doi:10.1039/c0cs00160k
(4) Shirota,Y.;Kageyama,H.Chem.Rev.2007,107(4),953.doi:10.1021/cr050143+
(5)Wang,C.L.;Dong,H.L.;Hu,W.P.;Liu,Y.Q.;Zhu,D.B.Chem.Rev.2012,112(4),2208.doi:10.1021/cr100380z
(6)Hains,A.W.;Liang,Z.Q.;Woodhouse,M.A.;Gregg,B.A.Chem.Rev.2010,110(11),6689.doi:10.1021/cr9002984
(7) Hughes,G.;Bryce,M.R.J.Mater.Chem.2005,15(1),94.doi:10.1039/b413249c
(8) Su,S.J.;Cai,C.;Kido,J.Chem.Mater.2011,23(2),274.doi:10.1021/cm102975d
(9)Aizawa,N.;Pu,Y.J.;Sasabe,H.;Kido,J.Org.Electron.2012,13(11),2235.doi:10.1016/j.orgel.2012.06.036
(10) Xu,X.J.;Chen,S.Y.;Yu,G.;Di,C.A.;You,H.;Ma,D.G.;Liu,Y.Q.Adv.Mater.2007,19(9),1281.
(11)Gao,Z.Q.;Mi,B.X.;Tam,H.L.;Cheah,K.W.;Chen,C.H.;Wong,M.S.;Lee,S.T.;Lee,C.S.Adv.Mater.2008,20(4),774.
(12) Lin,L.Y.;Tsai,C.H.;Wong,K.T.;Huang,T.W.;Wu,C.C.;Chou,S.H.;Lin,F.;Chen,S.H.;Tsai,A.I.J.Mater.Chem.2011,21(16),5950.
(13) Chiu,S.W.;Lin,L.Y.;Lin,H.W.;Chen,Y.H.;Huang,Z.Y.;Lin,Y.T.;Lin,F.;Liu,Y.H.;Wong,K.T.Chem.Commun.2012,48(13),1857.doi:10.1039/c2cc16390j
(14)Wu,C.H.;Pan,T.Y.;Hong,S.H.;Wang,C.L.;Kuo,H.H.;Chu,Y.Y.;Diau,E.;Lin,C.Y.Chem.Commun.2012,48(36),4329.doi:10.1039/c2cc30892d
(15)Yasuda,T.;Sakai,Y.;Aramaki,S.;Yamamoto,T.Chem.Mater.2005,17(24),6060.doi:10.1021/cm051561y
(16) Ortiz,R.P.;Casado,J.;Hernandez,V.;Navarrete,J.;Letizia,J.A.;Ratner,M.A.;Facchetti,A.;Marks,T.J.Chem.-Eur.J.2009,15(20),5023.doi:10.1002/chem.v15:20
(17) Kojima,T.;Nishida,J.;Tokito,S.;Tada,H.;Yamashita,Y.Chem.Commun.2007,(14),1430.
(18) Schmitt,V.;Glang,S.;Preis,J.;Detert,H.Sens.Lett.2008,6(4),524.doi:10.1166/sl.2008.420
(19)Achelle,S.;Barsella,A.;Baudequin,C.;Caro,B.;Guen,F.J.Org.Chem.2012,77(8),4087.doi:10.1021/jo3004919
(20)Weng,J.;Mei,Q.;Ling,Q.;Fan,Q.;Huang,W.Tetrahedron2012,68(14),3129.doi:10.1016/j.tet.2011.12.071
(21) Weng,J.;Mei,Q.;Zhang,B.;Jiang,Y.;Tong,B.;Fan,Q.;Ling,Q.;Huang,W.Analyst2013,138(21),6607.doi:10.1039/c3an01214j
(22) Achelle,S.;Ple,N.Curr.Org.Synth.2012,9(2),163.doi:10.2174/157017912799829067
(23) Ge,G.P.;He,J.;Guo,H.Q.;Wang,F.Z.;Zou,D.C.J.Organomet.Chem.2009,694(19),3050.doi:10.1016/j.jorganchem.2009.05.037
(24) Lowry,M.S.;Bernhard,S.Chem.-Eur.J.2006,12(31),7970.
(25) Brown,D.;Muranjan,S.;Jang,Y.;Thummel,R.Org.Lett.2002,4(8),1253.doi:10.1021/ol0172572
(26) Achelle,S.;Ple,N.;Turck,A.RSC Adv.2011,1(3),364.doi:10.1039/c1ra00207d
(27)Wu,W.;Xu,H.B.;Shen,D.Z.;Qiu,T.;Fan,L.J.J.Polym.Sci.Pol.Chem.2013,51(7),1636.doi:10.1002/pola.26535
(28) Hadad,C.;Fiol-Petit,C.;Cornec,A.;Dupas,G.;Ramondenc,Y.;Plé,N.Heterocycles2010,81(6),1445.doi:10.3987/COM-10-11934
(29) Do,J.;Huh,J.;Kim,E.Langmuir2009,25(16),9405.doi:10.1021/la901476q
(30) Paschke,R.;Rosenfeld,U.;Zaschke,H.Liq.Cryst.1992,11(1),145.doi:10.1080/02678299208028978
(31) Achelle,S.;Ple,N.;Kreher,D.;Mathevet,F.;Turck,A.;Attias,A.J.Heterocycles2008,75(2),357.doi:10.3987/COM-07-11220
(32) Achelle,S.;Plé,N.;Turck,A.;Bouillon,J.;Portella,C.J.Heterocycl.Chem.2006,43(5),1243.doi:10.1002/jhet.v43:5
(33) Wild,J.H.;Bartle,K.;Kirkman,N.T.;Kelly,S.M.;O'Neill,M.;Stirner,T.;Tuffin,R.P.Chem.Mater.2005,17(25),6354.doi:10.1021/cm051682y
(34) Park,Y.S.;Kim,D.;Lee,H.;Moon,B.Org.Lett.2006,8(21),4699.doi:10.1021/ol061711q
(35) Mi,B.X.;Wang,P.F.;Gao,Z.Q.;Lee,C.S.;Lee,S.T.;Hong,H.L.;Chen,X.M.;Wong,M.S.;Xia,P.F.;Cheah,K.W.;Chen,C.H.;Huang,W.Adv.Mater.2009,21(3),339.doi:10.1002/adma.v21:3
(36)Yang,C.H.;Cheng,Y.M.;Chi,Y.;Hsu,C.J.;Fang,F.C.;Wong,K.T.;Chou,P.T.;Chang,C.H.;Tsai,M.H.;Wu,C.C.Angew.Chem.Int.Edit.2007,46(14),2418.
(37) Fang,Y.;Li,Y.H.;Wang,S.J.;Meng,Y.Z.;Peng,J.B.;Wang,B.Synth.Met.2010,160(21-22),2231.doi:10.1016/j.synthmet.2010.07.035
(38) Gompper,R.;Mair,H.J.;Polborn,K.Synthesis-Stuttgart1997,No.6,696.
(39) Kanbara,T.;Kushida,T.;Saito,N.;Kuwajima,I.;Kubota,K.;Yamamoto,T.Chem.Lett.1992,21(4),583.
(40)Wong,K.T.;Hung,T.S.;Lin,Y.T.;Wu,C.C.;Lee,G.H.;Peng,S.M.;Chou,C.H.;Su,Y.Org.Lett.2002,4(4),513.doi:10.1021/ol017066z
(41)Wu,C.C.;Lin,Y.T.;Chiang,H.H.;Cho,T.Y.;Chen,C.W.;Wong,K.T.;Liao,Y.L.;Lee,G.H.;Peng,S.M.Appl.Phys.Lett.2002,81(4),577.doi:10.1063/1.1493669
(42) Gunathilake,S.S.;Magurudeniya,H.D.;Huang,P.;Nguyen,H.;Rainbolt,E.A.;Stefan,M.C.;Biewer,M.C.Polym.Chem.2013,4(20),5216.doi:10.1039/c3py00137g
(43)Weng,J.;Mei,Q.;Fan,Q.;Ling,Q.;Tong,B.;Huang,W.RSC Adv.2013,3(44),21877.doi:10.1039/c3ra43631d
(44) Aldred,M.P.;Eastwood,A.J.;Kelly,S.M.;Vlachos,P.;Contoret,A.;Farrar,S.R.;Mansoor,B.;O'Neill,M.;Tsoi,W.C.Chem.Mater.2004,16(24),4928.doi:10.1021/cm0351893
(45) Sasabe,H.;Chiba,T.;Su,S.J.;Pu,Y.J.;Nakayama,K.I.;Kido,J.Chem.Commun.2008,No.44,5821.
(46) Sasabe,H.;Tanaka,D.;Yokoyama,D.;Chiba,T.;Pu,Y.J.;Nakayama,K.;Yokoyama,M.;Kido,J.Adv.Funct.Mater.2011,21(2),336.doi:10.1002/adfm.201001252
(47) Sasabe,H.;Minamoto,K.;Pu,Y.J.;Hirasawa,M.;Kido,J.Org.Electron.2012,13(11),2615.doi:10.1016/j.orgel.2012.07.019
(48) Liu,M.;Su,S.J.;Jung,M.C.;Qi,Y.B.;Zhao,W.M.;Kido,J.Chem.Mater.2012,24(20),3817.doi:10.1021/cm303075m
(49) Son,K.S.;Yahiro,M.;Imai,T.;Yoshizaki,H.;Adachi,C.J.Photopolym.Sci.Tec.2007,20(1),47.doi:10.2494/photopolymer.20.47
(50) Hudson,Z.M.;Wang,Z.B.;Helander,M.G.;Lu,Z.H.;Wang,S.N.Adv.Mater.2012,24(21),2922.doi:10.1002/adma.v24.21
(51) Cai,C.;Su,S.J.;Chiba,T.;Sasabe,H.;Pu,Y.J.;Nakayama,K.;Kido,J.Org.Electron.2011,12(5),843.doi:10.1016/j.orgel.2011.01.021
(52) Su,S.J.;Cai,C.;Kido,J.J.Mater.Chem.2012,22(8),3447.doi:10.1039/c2jm14151e
(53)Ge,G.P.;Yu,X.H.;Guo,H.Q.;Wang,F.Z.;Zou,D.C.Synth.Met.2009,159(12),1178.doi:10.1016/j.synthmet.2009.02.007
(54) Lin,C.F.;Huang,W.S.;Chou,H.H.;Lin,J.T.J.Organomet.Chem.2009,694(17),2757.doi:10.1016/j.jorganchem.2009.04.011
(55)Mondal,E.;Hung,W.Y.;Dai,H.C.;Wong,K.T.Adv.Funct.Mater.2013,23(24),3096.doi:10.1002/adfm.v23.24
(56) Song,Y.H.First,Design and Synthesis of New Ruthenium Complexes and Fabrication of Films and Nano-Materials of Metal&Oxide by Chemical Vapor Deposition;Second,Synthesis and Photophysical Properties Study of Red Phosphorescent Iridium Complexes.Ph.D.Dissertation,National Tsing Hua University,Taiwan,2005.[宋怡桦.一,新型钌金属前驱物之设计合成及利用化学气相沉积法制备金属及氧化物薄膜与纳米材料;二,红色磷光铱金属错合物之合成及其光物理性质探讨[D].台湾:国立清华大学,2005.]
(57) Kozhevnikov,V.N.;Durrant,M.C.;Williams,J.Inorg.Chem.2011,50(13),6304.doi:10.1021/ic200706e
(58) Culham,S.;Lanoë,P.;Whittle,V.L.;Durrant,M.C.;Williams,J.A.G.;Kozhevnikov,V.N.Inorg.Chem.2013,52(19),10992.doi:10.1021/ic401131x
(59) Chang,C.;Wu,Z.;Chiu,C.;Liang,Y.;Tsai,Y.;Liao,J.;Chi,Y.;Hsieh,H.;Kuo,T.;Lee,G.;Pan,H.;Chou,P.;Lin,J.;Tseng,M.ACS Appl.Mater.Interfaces2013,5(15),7341.doi:10.1021/am401694s
(60) Lian,P.;Wei,H.B.;Zheng,C.;Nie,Y.F.;Bian,J.;Bian,Z.Q.;Huang,C.H.Dalton Trans.2011,40(20),5476.doi:10.1039/c0dt01592j
(61) Chen,F.F.;Jiang,W.L.;Lou,B.;Bian,Z.Q.;Huang,C.H.Sci.China Ser.B2009,52(11SI),1808.
(62) Chen,Z.;Ding,F.;Bian,Z.;Huang,C.Org.Electron.2010,11(3),369.
(63) Kubota,Y.;Ozaki,Y.;Funabiki,K.;Matsui,M.J.Org.Chem.2013,78(14),7058.doi:10.1021/jo400879g
(64) Maud,J.M.;Cooper,M.E.;Bolton,E.C.;Haynes,D.M.Synth.Met.1995,71(1-3),1935.doi:10.1016/0379-6779(94)03114-L
(65) Petrov,V.F.Mol.Cryst.Liq.Cryst.2006,457(1),121.doi:10.1080/15421400600598545
(66) Geelhaar,T.Ferroelectrics1988,85(1),329.doi:10.1080/00150198808007667
(67) Kusumoto,T.;Ogino,K.;Sato,K.;Hiyama,T.;Takehara,S.;Nakamura,K.Chem.Lett.1993,22(7),1243.
(68) Schubert,H.;Zaschke,H.J.Prakt.Chem.1970,312(3),494.
(69) Shen,D.;Diele,S.;Pelzl,G.;Wirth,I.;Tschierske,C.J.Mater.Chem.1999,9(3),661.doi:10.1039/a808275h
(70)Vlachos,P.;Kelly,S.M.;Mansoor,B.;O'Neill,M.Chem.Commun.2002,No.8,874.
(71)Yoshizawa,A.;Yamaguchi,A.Chem.Commun.2002,No.18,2060.
(72) Rokunohe,J.;Yoshizawa,A.J.Mater.Chem.2005,15(2),275.doi:10.1039/b410931g
(73) Roberts,J.C.;Kapernaum,N.;Giesselmann,F.;Lemieux,R.P.J.Am.Chem.Soc.2008,130(42),13842.doi:10.1021/ja805672q
(74) Li,L.;Jones,C.D.;Magolan,J.;Lemieux,R.P.J.Mater.Chem.2007,17(22),2313.doi:10.1039/b700972k
(75) Roberts,J.C.;Kapernaum,N.;Song,Q.X.;Nonnenmacher,D.;Ayub,K.;Giesselmann,F.;Lemieux,R.P.J.Am.Chem.Soc.2010,132(1),364.doi:10.1021/ja9087727
(76) Lin,Y.C.;Lai,C.K.;Chang,Y.C.;Liu,K.T.Liq.Cryst.2002,29(2),237.doi:10.1080/02678290110097800
(77) He,G.S.;Tan,L.S.;Zheng,Q.;Prasad,P.N.Chem.Rev.2008,108(4),1245.doi:10.1021/cr050054x
(78) Liu,B.;Hu,X.L.;Liu,J.;Zhao,Y.D.;Huang,Z.L.Tetrahedron Lett.2007,48(34),5958.doi:10.1016/j.tetlet.2007.06.122
(79) Liu,Z.J.;Chen,T.;Liu,B.;Huang,Z.L.;Huang,T.;Li,S.Y.;Xu,Y.X.;Qin,J.G.J.Mater.Chem.2007,17(44),4685.doi:10.1039/b707909e
(80) Liu,Z.J.;Shao,P.;Huang,Z.L.;Liu,B.;Chen,T.;Qin,J.G.Chem.Commun.2008,No.19,2260.
(81) Li,L.;Tian,Y.P.;Yang,J.X.;Sun,P.P.;Wu,J.Y.;Zhou,H.P.;Zhang,S.Y.;Jin,B.K.;Xing,X.J.;Wang,C.K.;Li,M.;Cheng,G.H.;Tang,H.H.;Huang,W.H.;Tao,X.T.;Jiang,M.H.Chem.-Asian J.2009,4(5),668.doi:10.1002/asia.v4:5
(82) Chen,D.G.;Zhong,C.;Dong,X.H.;Liu,Z.H.;Qin,J.G.J.Mater.Chem.2012,22(10),4343.doi:10.1039/c2jm14766a
(83) Tang,C.;Zhang,Q.;Li,D.;Zhang,J.;Shi,P.;Li,S.;Wu,J.;Tian,Y.Dyes Pigments2013,99(1),20.doi:10.1016/j.dyepig.2013.04.016
(84) Achelle,S.;Nouira,I.;Pfaffinger,B.;Ramondenc,Y.;Ple,N.;Rodriguez-Lopez,J.J.Org.Chem.2009,74(10),3711.doi:10.1021/jo900107u
(85) Hadad,C.;Achelle,S.;Garcia-Martinez,J.C.;Rodriguez-Lopez,J.J.Org.Chem.2011,76(10),3837.doi:10.1021/jo200204u
(86) Zhang,Q.;Li,L.;Zhang,M.;Liu,Z.D.;Wu,J.Y.;Zhou,H.P.;Yang,J.X.;Zhang,S.Y.;Tian,Y.P.Dalton Trans.2013,42(24),8848.doi:10.1039/c3dt50582k
(87) Grimsdale,A.C.;Cervini,R.;Friend,R.H.;Holmes,A.B.;Kim,S.T.;Moratti,S.C.Synth.Met.1997,85(1-3),1257.doi:10.1016/S0379-6779(97)80229-9
(88)Liu,M.W.;Zhang,X.H.;Lai,W.Y.;Lin,X.Q.;Wong,F.L.;Gao,Z.Q.;Lee,C.S.;Hung,L.S.;Lee,S.T.;Kwong,H.L.Phys.Status Solidi A2001,185(2),203.
(89)Turksoy,F.;Hughes,G.;Batsanov,A.S.;Bryce,M.R.J.Mater.Chem.2003,13(7),1554.doi:10.1039/b303472k
(90) Zhao,L.;Perepichka,I.F.;Turksoy,F.;Batsanov,A.S.;Beeby,A.;Findlay,K.S.;Bryce,M.R.New J.Chem.2004,28(8),912.doi:10.1039/b401867m
(91) Wu,A.P.;Akagi,T.;Jikei,M.;Kakimoto,M.;Imai,Y.;Ukishima,S.;Takahashi,Y.Thin Solid Films1996,273(1-2),214.doi:10.1016/0040-6090(95)06780-9
(92) Peng,Z.H.;Galvin,M.E.Chem.Mater.1998,10(7),1785.doi:10.1021/cm970697w
(93) Wu,S.;Burkhardt,S.E.;Yao,J.;Zhong,Y.;Abrûna,H.D.Inorg.Chem.2011,50(9),3959.doi:10.1021/ic1023696
(94) Zhong,Y.;Wu,S.I.;Burkhardt,S.N.E.;Yao,C.;Abruña,H.D.Inorg.Chem.2011,50(2),517.doi:10.1021/ic101629w
(95)Wu,S.H.;Abruna,H.D.;Zhong,Y.W.Organometallics2012,31(3),1161.doi:10.1021/om201240c
(96)Wu,S.H.;Burkhardt,S.E.;Zhong,Y.W.;Abruña,H.D.Inorg.Chem.2012,51(24),13312.doi:10.1021/ic3019666
(97) Zhang,G.L.;Liu,Z.H.,Guo,H.Q.Acta Phys.-Chim.Sin.2003,19(10),889.[张国林,刘泽华,郭海清.物理化学学报,2003,19(10),889.]doi:10.3866/PKU.WHXB20031001
(98) Zhang,G.L.,Liu,Z.H.;Guo,H.Q.;Chuai,Y.T.;Zhen,C.G.;Zou,D.C.Chem.J.Chin.Univ.2004,25(3),397.[张国林,刘泽华,郭海清,啜玉涛,甄常刮,邹德春.高等学校化学学报,2004,25(3),397.]
(99) He,J.;Ge,G.P.;Xu,K.;Guo,H.Q.;Yin,N.Journal of Beijing Forestry University2006,28(Supp.2),137.[何静,葛国平,徐 凯,郭海清,殷 宁.北京林业大学学报,2006,28(增刊2),137.]
(100) Chandrasekhar,V.;Rahaman,S.M.W.;Hajra,T.;Das,D.;Ghatak,T.;Rafiq,S.;Sen,P.;Bera,J.K.Chem.Commun.2011,47(38),10836.doi:10.1039/c1cc12830b

