肾动脉内套法建立大鼠肾移植模型
曾启洪 朱毅 叶少军 周威 邵明杰 李偲 明英姿
大鼠模型是器官移植实验研究中常用的动物模型之一,广泛应用于肾移植及免疫学相关的实验研究[1-3]。目前,国内外建立大鼠肾移植模型的手术方法有多种[4-6],但大部分方法操作复杂、难度高且成功率低,一定程度上限制了大鼠肾移植模型的推广应用。本研究成功建立了一种构建大鼠肾移植模型的新方法,具有手术操作简单及成功率高的特点,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验动物
成年雄性SD 大鼠24 只,成年雄性Wistar 大鼠48 只,体质量300 ~350 g,12 ~15 周龄。实验动物均由中南大学湘雅三医院动物实验中心提供,饲养于无特定病原体环境。SD 大鼠作为供体,术前正常饮食。Wistar 大鼠作为受体,术前禁食(不禁水)12 h。供体大鼠接受左侧原位肾移植,自体右肾于术中切除。
1.1.2 手术器械及药品
手术器械:显微外科手术器械(上海手术器械厂)、冷光单孔手术灯(江苏医邦医疗器械科技有限公司)、手术放大镜(天津医用光学仪器厂)、电动剃毛器(海德创业生物科技有限公司)、医用10-0、11-0无损伤缝合线及医用0 号丝线(上海医用缝合针厂)。
套管制备:利用正压无针连接式留置针(苏州林华医疗)制备套管,针头用于制备动脉套管(直径0.6 mm,长2 mm),套管侧壁剪开。透明管道用于制备静脉套管(直径1.5 mm,长3 mm)。外包装透明塑料片用于制备撑开器(5 cm×1 cm)。
实验药品:10% 水合氯醛(西安悦来医药科技)、肝素钠(南京新百药业有限公司)、0.9%氯化钠注射液及5%葡萄糖注射液(湖南科伦制药有限公司)、头孢米诺(1 g/支,海南卫康制药有限公司)、离体供肾保存用枸橼酸盐嘌呤溶液(上海长征医院)。
1.2 手术方法
1.2.1 供体大鼠手术
SD 大鼠腹腔注射10%水合氯醛(3.0 mL/kg)行诱导麻醉,麻醉起效后,取仰卧位固定于实验操作台上。电动剃毛器剃去腹部毛发,络合碘消毒后,沿腹部正中切口切开皮肤,切口范围从剑突到耻骨联合,自制拉钩拉开双侧皮肤,充分暴露手术视野。将肠管用温湿生理盐水(25 ℃~35 ℃)纱布包裹并置于大鼠右侧,游离腹主动脉及后腔静脉间脂肪囊。钝性分离腹主动脉,结扎前肠系膜动脉,于腹主动脉与前肠系膜动脉分叉处上方留置丝线,暂不拉紧,打一松结备用,继续向下游离至髂总动脉分叉处,丝线结扎。游离后腔静脉,上至肝下后腔静脉,下至髂腰静脉分叉处,丝线结扎。充分暴露左肾及左肾动、静脉,先游离膀胱及输尿管至肾门,注意保留周围滋养血管及脂肪组织,钝性分离左肾动、静脉,分别结扎精索内静脉及肾上腺静脉,采用相同方法游离右肾及右肾输尿管。在腹主动脉上端拉紧留置丝线,将灌注针插入腹主动脉,同时将后腔静脉靠近结扎处剪一破口,匀速灌注含肝素钠的枸橼酸盐嘌呤溶液(400 U/mL),直至双肾颜色变灰白色、肾静脉流出液变澄清。剪断腹主动脉两端结扎处、于后腔静脉结扎处及肝下后腔静脉结扎处,平均剪断腹主动脉及后腔静脉,分离出双肾输尿管及膀胱,放入4 ℃生理盐水保存。
1.2.2 供肾修整
将供肾置于4 ℃生理盐水中进行修整,盛有供肾的器皿置于无菌冰块中保持低温。借助手术放大镜,游离肾动、静脉壁上脂肪组织,注意肾门区脂肪组织尽量保留。肾动脉处修剪为保留腹主动脉瓣的圆形瓣口,肾静脉处修剪为保留后腔静脉的T 形血管,以输尿管口为中心剪一直径约0.5 cm 的圆形膀胱瓣,修整完毕,继续低温保存。
1.2.3 受体大鼠手术
受体Wistar 大鼠接受左侧原位肾移植,自体右肾于术中切除。术前麻醉、消毒同前,取腹部正中切口,上至剑突,下至膀胱,自制拉钩拉开皮肤。温湿生理盐水纱布包裹肠管并置于大鼠右侧,自制撑开器充分暴露左肾,游离左肾动、静脉。结扎左肾上腺静脉及左精索内静脉,于肾门区结扎左输尿管,在肾动、静脉近心端用血管夹夹闭,切除左肾。含肝素钠的生理盐水冲洗受体肾动、静脉残端,将供肾置入左肾窝,覆盖薄棉球及冰屑,保持低温。借助手术放大镜,先将自制动脉套管置入供肾动脉内,在受体肾动脉壁一侧以11-0 线缝合打结1 针,针头沿套管穿入供肾动脉并穿出,另一针头同法穿出,两针穿出点尽量靠近,退出套管,完成肾动脉壁一侧的吊线(图1a)。将受体肾动脉牵入供肾动脉,拉紧缝合线并打结(图1b)。供肾动脉瓣与受体动脉外膜固定3 针(图1c)。受体肾静脉与供体后腔静脉近心端吻合(图1d),自供体后腔静脉远心端插入自制静脉套管,近心端穿出,将供体后腔静脉内近心端侧套管套入受体肾静脉内,2 根10-0 线分别固定2 个点,双侧连续缝合并打结(图1e),缝合完毕退出套管,同时结扎供体后腔静脉远心端(图1f)。结扎前向管腔内注入含肝素钠的生理盐水,先开放动脉后开放静脉,棉球压迫止血,温盐水复温,移植肾颜色红润,输尿管膀胱瓣口可见尿液流出(图2)。将受体膀胱修剪一瓣口,同供体膀胱瓣口大小,并以10-0 线间断缝合8 针。缝合完毕后检查有无出血及漏尿,将受体脂肪囊包裹固定移植肾,依据出血量情况从髂腰静脉适当补充20 ℃含肝素钠的5%葡萄糖溶液。分离右肾,沿右肾肾门切除右肾并丝线结扎,腹腔内注入头孢米诺10 mg,关腹。
1.2.4 术后处理
受体大鼠术后灯照保温1 h,苏醒后放入笼中单独饲养,并喂食5%葡萄糖溶液。术后第1 天恢复正常饮食,并鼻饲他克莫司0.1 mg/kg,1 次/d。死亡受体大鼠行常规尸检探查[7]。
1.3 观察指标
以受体大鼠术后存活3 d 为建模成功的标准[8]。记录手术时间及缺血时间,观察受体大鼠术后存活情况。
2 结 果
2.1 手术时间及缺血时间
本研究共实施48 例大鼠肾移植术。24 只供体大鼠平均手术时间(35±6)min,供肾修整时间(3.9±1.2)min。供肾热缺血时间(5.7±1.5)s,冷缺血时间(52 ±6)min。受体大鼠平均手术时间(39±6)min,动脉吻合时间(6.9±2.5)min,静脉吻合时间(14.2±2.3)min,尿路重建时间(6.6 ±1.1)min。
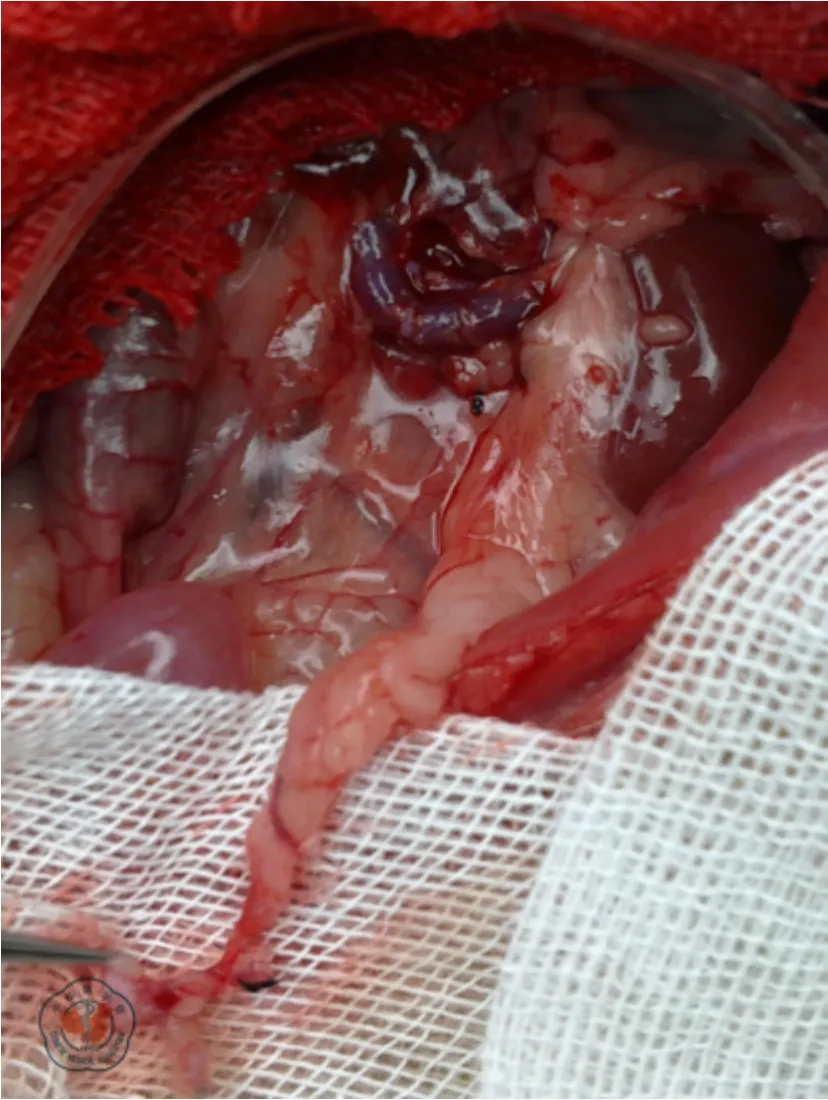
图2 供肾移植成功后,输尿管膀胱瓣口可见尿液流出

图1 受体大鼠肾动、静脉吻合要点
2.2 受体大鼠存活情况
48 只受体大鼠中位存活时间为6 d。术后3 d内,2 只大鼠因血管吻合口出血死亡,2 只因移植肾动脉内血栓形成死亡,1 只因尿瘘致腹膜炎死亡,其余43 只大鼠均获手术成功,成功率89.6%。截至术后14 d,共7 只受体大鼠存活。
3 讨 论
大鼠具有经济、便于饲养、体型适宜以及易于实施手术的优点,因此大鼠肾移植模型是肾移植及免疫耐受等研究的首选动物模型。尽管大鼠肾移植模型有许多优点,但这一模型的应用还是受到限制,主要原因为建模过程尤其是血管重建过程需要难度较大的显微外科技术,对于非显微外科专业的初级外科医生或从事实验研究的科研人员,难以完成这些操作[9]。
目前建立大鼠肾移植模型的手术方式有多种,其中血管重建的方法有:端-端吻合法[10]、端-侧吻合法[11]、袖套法吻合法[12]和Cuff 套管吻合法[13],以前二者应用最广泛。本研究团队经过近1 年的研究,对多种手术方式进行了尝试、比较,并对术中的某些操作进行了改进,摸索出一种操作简便、易于掌握、术后存活率较高的大鼠肾移植模型建立方法。本研究采用肾动脉内套法(受体肾动脉内套入供体肾动脉)重建肾动脉,受体肾静脉与供体后腔静脉近心端行端-端吻合,供体输尿管膀胱瓣与受体膀胱吻合进行尿路重建。肾动脉内套法有以下优点:(1)不需要阻断体循环,对大鼠其他脏器影响较小;(2)降低了手术难度,不需要显微镜下操作,无需考虑动脉吻合闭塞;(3)借助自制动脉套管,使动脉套入相对简单,缝线固定及3 点外膜加固使得动脉吻合良好。
在构建大鼠肾移植模型的过程中,本中心有以下心得体会:(1)肾动脉内套法成功的关键在于供肾动脉必须保持血流通畅,需在修肾及置入套管前验证;(2)因静脉壁较薄,肾静脉吻合时易出现前后壁的缝闭,而通过后腔静脉置入导管,可发挥支架作用,使静脉吻合非常便捷;(3)静脉吻合完毕需拔出套管并注入含肝素钠的生理盐水预防空气栓塞,同时可以检查是否存在吻合口瘘;(4)开放血供后若有出血,用棉球轻压出血点即可,必要时可补针;(5)若移植肾灌注不佳,可以通过髂腰静脉补充少量含肝素钠的生理盐水;(6)肾移植成功后,建议立即切除自体右肾,因行二期手术切除右肾会增加手术风险和死亡率,且体外留线结扎法会增加感染机会,右肾缺血坏死亦会增加受体死亡率。
大鼠肾移植模型的成功建立依赖于简便的操作方法、较短的手术时间以及对其他脏器功能的较小影响。本研究报道的肾动脉内套法满足上述要求,初学者能快速掌握,可为今后大鼠肾移植模型的研究提供参考。
1 Jiga L,Ionac M,Bordos D. Experiental model of hetero topic renal transplantation in rat[J]. Chirurgia,2001,96(1):105-111.
2 Martins PN,Filatenkov A. Microsurgical techniques for experimental kidney transplantation and general guidelines to establish studies about transplantation immunology[J]. Acta Cir Bras,2003,18(1):355-359.
3 陈金芝,夏穗生. 大白鼠异体肾移植术[J]. 中华器官移植杂志,1981,2(2):72-76.
4 Pahlavan PS, Smallegange C, Adams MA, et al. Kidney transplantation procedures in rats:assessments,complications,and management[J]. Microsurgery,2006,26(5):404-411.
5 Karatzas T,Santiago S,Xanthos T,et al. An easy and safe model of kidney transplantation in rats[J]. Microsurgery,2007,27(8):668-672.
6 王金国,臧崇森,王远涛,等. 大鼠肾移植急性排斥模型的建立[J]. 中国实验诊断学,2010,14(3):369-371.
7 李偲,朱毅,叶少军,等. 大鼠肾移植模型手术改良技巧探讨[J]. 器官移植,2014,5(3):157-160.
8 刘皎林,周洪澜,王医术,等. 改良的血管端端吻合法建立大鼠原位肾移植模型[J]. 中国实验诊断学,2012,16(2):229-232.
9 张博,龙刚,王洪波,等. 经改进同种异体大鼠原位肾移植模型的建立[J]. 中国组织工程研究与临床康复,2009,13(53):10413-10416.
10 Weight SC,Furness PN,Nicholson ML. New model of renal warm ischemia-reperfusion injury for comparative functional morphological and path physiological studies[J]. Br J Surg,1998,85(12):1669-1673.
11 潘浩,温端改,欧阳骏,等. 同种异体大鼠肾移植实验动物模型的建立[J].苏州大学学报:医学版,2007,17(3):354-355.
12 Lopez-Neblina F,Toledo-Pereyra LH,Suzuki S. Ultrarapid orthotopic technique for renal transplantation in the rat[J]. Microsurgery,1994,15(4):274-278.
13 Kamada N. A description of cuff techniques for renal transplantation in the rat. Use in studies of tolerance induction during combined liver grafting[J]. Transplantation,1985,39(1):93-95.

