利用拟南芥鉴定双孢蘑菇Hsp20和Adcs基因的耐温功能
邓立新,卢钟磊,沈月毛,宋思扬*
(1.厦门大学生命科学学院,福建 厦门 361102;2.山东大学药学院,山东 济南 250012)
双孢蘑菇[AgaricusbisporusLange(Imbach)]是目前世界上栽培最广泛、产量最高、消费量最大的食用菌,属于稳温结实性的菌类,在炎热的夏季,菌丝体几乎无法存活,培育耐高温的菌株具有十分重要的经济意义[1-2].由于双孢蘑菇遗传上相当保守,传统的育种技术,已经逐渐无法满足人们对双孢蘑菇现代育种的要求.双孢蘑菇不同菌株间存在着种质差异,通常抗逆性好的不优质、而优质的抗逆性差:02菌株是典型的高产菌株,其耐热性也比较好,可在25~28 ℃下栽培,但其子实体质量较差,易开伞,制罐得率低;商业化菌株8213菌株与02菌株亲缘关系非常近,为优质型菌株,但耐热能力差,只能在16~22 ℃下栽培.比较02菌株和8213菌株的差异基因,将有希望从分子水平阐明02菌株的耐温本质,为耐热优质转基因蘑菇的育种奠定基础[3].
我们实验室前期从02菌株中克隆了数十条差异表达基因cDNA全长[4].为了确定哪些基因真正与耐温有关,需要建立一种耐温基因的鉴定方法.通过模式生物拟南芥(Arabidopsisthaliana)鉴定耐热基因是一种成熟的方法[5-7].真菌的耐热基因分析基本上以模式生物酿酒酵母为主,利用模式植物拟南芥鉴定双孢蘑菇的耐温基因尚未见报道.本文挑选02菌株相对8213菌株组成性上调表达基因4-氨基-4-脱氧分支酸合成酶基因(Adcs)和02菌株热胁迫后诱导性上调表达基因热休克蛋白20基因(Hsp20),探讨利用转基因拟南芥耐热表型鉴定双孢蘑菇耐温基因.
1 材料与方法
1.1 实验材料
转化双孢蘑菇Adcs基因的农杆菌(Agrobacterium) ATEG5(GV3101)由卢钟磊提供[4];载体pDONR207、pEarleygate 201和大肠杆菌(Escherichiacoli)菌株DB3.1为本实验室保存;哥伦比亚野生型拟南芥(Col-0)由陶懿老师实验室提供;attB和attP位点之间的重组(BP)克隆酶和attL和attR位点之间的重组(LR)克隆酶购自美国 Invitrogen 公司;Taq DNA聚合酶,DNA Marker购自宝生物工程(大连)有限公司;蛋白质Marker、ECL发光液购自厦门鹭隆生物有限公司;草铵磷购自上海生工生物工程股份有限公司;羊抗鼠二抗购自杰克逊免疫研究实验室(Jackson Immuno Research Laboratories,INC);流感病毒血凝素标签抗体购自美国Origene公司;引物合成及DNA样品测序委托广州英潍捷基公司;Murashige and Skoog 基础培养基购自美国Sigma Aldrich公司.
1.2 ATEG2载体构建
根据Gateway 克隆原理构建ATEG2载体,构建流程图如图1.采用两轮PCR将BP克隆酶识别的attB位点构建入Hsp20基因ORF的两侧,酶用ExTaq.第一轮PCR,引物为attB1-2F111:5′-AAAAAGCAGGCTTCATGTCTACTTTCTTCTACGA-3′和attB2-2F111:5′-AGAAAGCTGGGTTTCAATGCCTCAGCTGGGCATC-3′,扩增条件为95 ℃预变性2 min;95 ℃变性30 s,68 ℃延伸30 s,15个循环;最后 72 ℃延伸2 min;第二轮PCR,引物为attB1-接头:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTTC-3′和attB2-接头:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTT-3′,扩增条件为95 ℃预变性1 min;94 ℃变性30 s,55 ℃退火30 s,68 ℃延伸30 s,25个循环;最后 68 ℃延伸2 min;PCR产物电泳,切胶回收500 bp目的片段.BP 反应 (5 μL):attB-PCR产物 (25 fmol/L),pDONR-207 质粒 (25 fmol/L),BP克隆酶1 μL,补超纯水至5 μL;25 ℃反应过夜;1 μL 蛋白酶K,37 ℃处理10 min;稀释至10 μL,取1 μL 转化大肠杆菌DB3.1感受态细胞,涂布LB 平板 (含庆大霉素10 μg/mL),挑选阳性单克隆,菌液PCR 验证,克隆测序,提取入门克隆(Entry clone)质粒,测定浓度;LR反应 (5 μL):入门克隆 (25 fmol/L),pEarleygate201载体(25 fmol/L),LR克隆酶1 μL,补超纯水至5 μL;25 ℃反应过夜;1 μL 蛋白酶K,37 ℃处理10 min;稀释至10 μL,取1 μL 转化大肠杆菌DB3.1感受态细胞,涂布LB 平板 (含卡那霉素50 μg/mL),挑选阳性单克隆,菌液PCR 验证,克隆测序.提取出最终的表达克隆 (expression clone) 质粒ATEG2,-20 ℃保存.

图1 ATEG2 载体构建流程图Fig.1 A flow chart illustrating construction of ATEG2 vector
1.3 ATEG2载体转化农杆菌
加入1 μL ATEG2质粒(0.1 μg)到50 μL农杆菌感受态细胞GV3101中,冰上混匀放置5 min;转移入2 mm电击转化杯中,设置电转化仪参数(电容:25 μF,电压:2.47 kV,电阻:400 Ω,脉冲时间:9 ms)电击转化;电转化完成,冰上放置5 min,加入 10 mL 新鲜LB培养基,28 ℃活化1 h;涂布质粒抗性LB平板(含福霉素50 μg/mL,庆大霉素 10 μg/mL),28 ℃倒置培养2 d后挑取菌落进行PCR鉴定.成功转化双孢蘑菇Hsp20基因的农杆菌标记为ATEG2(GV3101).
1.4 转基因拟南芥植株的获得
采用花序浸渍法分别使农杆菌ATEG2(GV3101)、ATEG5(GV3101)侵染花器官以转化拟南芥[8].收获T1代种子,幼苗以30 mg/L 草铵磷喷药筛选,每周1次,共3次,抗性植株继续种植到自交T3代,T3代植株用于纯合子鉴定、PCR鉴定、Western blot鉴定以及耐热表型分析.
1.5 转基因拟南芥纯合子的鉴定
转基因拟南芥T3代,在平板上以含10 mg/L草铵磷的1/2 MS培养基筛选,通过T3代抗性性状分离比来判定其对应的T2代株是否为纯合子.单基因交换杂合子经抗生素筛选将有1/4左右小苗白化死亡,而纯合子则全部为正常小苗.收集纯合子种子T3代,扩大种植收种,用于随后的生理、机理实验.
1.6 转基因拟南芥植株PCR鉴定
以拟南芥叶片为材料采用SDS法提取基因组DNA,检测过表达转基因植株所用的PCR引物采用pEarleyGate201载体通用引物attB1-接头:5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTTC-3′和attB2-接头:5′-GGGGACCACTTTGTACAAGAAAGCTGGGTT-3′.ATEG2转基因植株检测使用rTaq酶;扩增条件为95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火35 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸10 min;目的片段500 bp.检测ATEG5转基因植株使用LaTaq酶;扩增条件为95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火35 s,72 ℃延伸2 min,32个循环;最后72 ℃延伸10 min;目的片段 2 200 bp.
1.7 转基因拟南芥植株Western blot鉴定
将拟南芥叶子用液氮研磨至粉末,取10 mg 左右的干粉加入到40 μL磷酸盐缓冲液(含10 mg/L苯甲基磺酰氟和20 mg/Lβ-巯基乙醇)中,漩涡震荡混匀,再冰浴抽提10 min;最后 4 ℃ 20 000g离心15 min,去除不溶性碎片,取上清30 μL 加入10 μL 的4×上样缓冲液混匀,100 ℃煮10 min.ATEG2和ATEG5 样品分别使用质量分数15%和10% SDS-聚丙烯酰胺(PAGE)胶分离蛋白,按40 μg/孔上样.蛋白胶转聚偏二氟乙烯膜(PVDF)后,进行Western blot鉴定.一抗为流感病毒血凝素标签(HA)抗体1∶2 000(体积比);二抗为羊抗鼠二抗1∶5 000(体积比).化学发光(ECL)法显色后,使用Bio-RAD凝胶成像系统印迹成像.

表1 转基因拟南芥T3代苗纯合子鉴定Tab.1 Homozygote identification for transgenic A. thaliana T3 generation seedlings
注:Col-0:哥伦比亚野生型拟南芥;2M-1、2M-2、2S-1、2S-2、2S-3:转基因ATEG2 拟南芥;5F-1、5F-2、5G-1、5G-2、5L-1、5L-2:转基因ATEG5拟南芥.
1.8 转基因拟南芥植株耐热表型分析
下胚轴和根的耐热表型分析:在1/2 MS 平板背面上画一直线,在平板正面线上均匀点种25粒左右已消毒的拟南芥种子,4 ℃避光春化3 d.取出平板,置23 ℃培养箱,避光垂直培养2 d,当观察到至少80% 以上种子萌发长出,根和下胚轴总长度约0.8~1 cm时开始热激.各取15颗幼苗标记根和下胚轴的位置.45 ℃热激1 h后,恢复23 ℃避光垂直培养,热激后3 d 内每天记录根和下胚轴的延伸距离;实验3次重复[4].
幼苗耐热表型分析:经过表面消毒的种子,在1/2 MS平板上均匀点种,4 ℃春化3 d.取出平板,置25 ℃光照培养箱培养7 d 使小苗长出.45 ℃热激1 h后,恢复25 ℃光照培养,热激后7 d内观察并记录小苗的存活情况;实验3次重复[5].
2 结果与分析
2.1 转基因拟南芥植株的获得
成功侵染的T1代拟南芥种子携带pEarleyGate201表达载体的草丁膦乙酰转移酶(phosphinothricin acetyltransferase)基因(bar),具有草铵磷抗性[9].T1代拟南芥种子种植后,经过2~3次草铵磷喷药筛选,再经过7 d的生长,能长出4片以上真叶的存活小苗基本上可确认具有草铵磷抗性,如图2中箭头所示.转基因拟南芥T1代种子种植后,长出小苗经过30 mg/L草铵磷3次喷药筛选,分别保留15棵左右存活小苗,传代获得纯合子.

图2 转基因拟南芥苗草铵磷喷药筛选Fig.2 Basta resistance selection of transgenic A. thaliana seedlings
2.2 转基因拟南芥纯合子鉴定
选择转基因拟南芥T3代种子ATEG-基因-系-株(T3)(以下简化为geneline-strain)用于纯合子鉴定.各转基因植株分别取36粒种子点种1/2 MS培养基(含10 mg/L 草铵磷),25 ℃培养7 d,记录存活的绿苗数(表1).ATEG2中绿苗数超过3/4比例的为2M-2、2S-3,但仍为杂合子.ATEG5有4个植株已经是纯合子,分别是5F-1、5F-2、5G-1、5G-2.
2.3 转基因拟南芥植株PCR鉴定
图3(a)中,ATEG-2(T3代)小苗2M-1、2M-2、2S-1、2S-2、2S-3、2M(2M为ATEG2 T2代样品)分别取叶子,提取DNA,以attB1-接头和attB2-接头为引物PCR均得到500 bp阳性片段,而野生型拟南芥无此特异条带,说明2M-1、2M-2、2S-1、2S-2、2S-3、2M均已成功转化Hsp20基因,阳性对照以ATEG2质粒转化的大肠杆菌DB 3.1菌液为模板同样能扩增到500 bp条带;图3(b)中,ATEG-5(T3代)小苗5F-1、5F-2、5L-1、5L-2、5G-1、5G-2以attB1-接头和attB2-接头为引物PCR均得到2 200 bp左右的阳性片段,而野生型拟南芥无此特异条带,说明5F-1、5F-2、5L-1、5L-2、5G-1、5G-2均已成功转化Adcs基因,阳性对照以ATEG5质粒转化的大肠杆菌DB 3.1菌液为模板同样能扩增到2 200 bp条带.
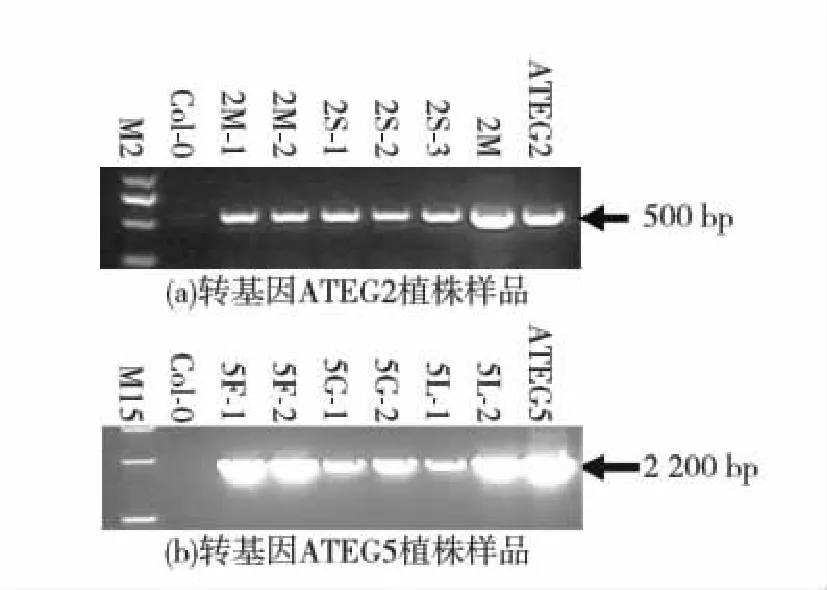
M2:DNA Marker 2000;M15:DNA Marker 15 000;2M:以ATEG2 转基因拟南芥(T2代)基因组DNA为模板的PCR产物;ATEG2、ATEG5:分别转化ATEG2、ATEG5质粒后的大肠杆菌DB 3.1菌液为模板的PCR产物.图3 转基因拟南芥苗PCR反应鉴定Fig.3 PCR identification of transgenic A. thaliana seedlings
2.4 转基因拟南芥植株Western blot鉴定
抗HA标签抗体Western blot实验表明:转基因拟南芥ATEG-2(T3代)2M-1、2M-2、2M均有较明显的特异条带,2S-1、2S-2、2S-3则条带较弱(本图中未能显示)(图4(a)),因此优先选用ATEG-2M-2用于耐热表型分析;转基因拟南芥ATEG-5(T3代)5L-2、5G-2均有较明显的特异条带,5F-2、5L-1、5G-1条带较弱,5F-1可能未表达(图4(b)),因此优先选用ATEG-5L-2、ATEG-5G-2 种子用于耐热表型分析.在供试的转基因菌株中目的基因的表达出现较明显差异可能是由于不同菌株目的基因插入位置和拷贝数不同,导致蛋白表达差异.

蛋白质样品:1:Col-0;2:2M-1;3:2M-2;4:2S-1;5:2S-2;6:2S-3;7:2M;8:Col-0;9:5F-1;10:5F-2;11:5G-1;12:5G-2;13:5L-1;14:5L-2.图4 转基因拟南芥苗蛋白质印迹验证Fig.4 Western blot verification of transgenic A. thaliana seedlings
2.5 转基因拟南芥植株耐热表型分析
下胚轴热激实验表明,经过45 ℃热激1 h处理后,再23 ℃恢复培养3 d,转基因拟南芥ATEG-2M-2的下胚轴明显继续延伸,而野生型和转基因拟南芥ATEG-5L-2不再延伸;说明过表达HSP20蛋白具有恢复拟南芥下胚轴伸长能力,但过表达4-氨基-4-脱氧分支酸合成酶(ADCS)蛋白不具有此能力(图5(a)).幼苗热激实验同时表明:经过45 ℃热激1 h 处理后,ATEG-2M-2还有部分存活苗,野生型和ATEG-5L-2则几乎没有存活苗,提示过表达HSP20蛋白可以提高幼苗的耐热能力,但过表达ADCS蛋白并不能提高幼苗的耐热能力(图5(b)).
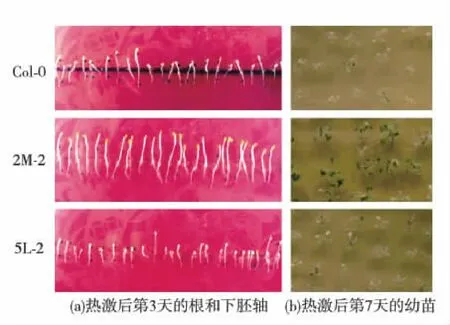
图5 转基因拟南芥苗耐热表型鉴定Fig.5 Thermotolerance phenotype identification of transgenic A. thaliana seedlings
3 讨 论
我们前期通过构建2个双孢蘑菇抑制性差减杂交文库,获得了一批与热胁迫相关的差异表达基因[4].通过抑制性差减杂交文库Ⅰ(对照:热处理8213菌株,样品:热处理02菌株),富集了热胁迫后02菌株相对8213菌株的差异表达基因;通过抑制性差减杂交文库Ⅱ(对照:常温培养02菌株,样品:热处理02菌株),富集了02菌株自身热胁迫差异表达基因.双孢蘑菇作为食用真菌形态上比酵母复杂,推测其适应环境温度的变化可能进化为更复杂的调控系统,与植物可能有些相似之处.为了分析这些差异表达基因是否与耐温有关,本文建立了一种基于转基因拟南芥耐热表型的方法用于耐温基因鉴定.通常来讲,利用模式生物酿酒酵母鉴定耐温基因方法比较简单易行,使用拟南芥鉴定耐温基因方法则相对复杂,本文使用拟南芥来鉴定双孢蘑菇的耐温基因是基于本实验室卢钟磊的研究基础之上,特别之处在于其可用于今后评价转基因蘑菇品种对农作物等高等植物的影响,同时也可以探索耐温基因在进化上是否具有保守性,并借鉴模式植物拟南芥成熟的耐热机制促进食用菌类的耐温机制研究.
本文分别选用文库I和文库II中的显著上调基因Adcs和Hsp20基因,分别鉴定其是否与耐温有关.通过抗性筛选,转基因拟南芥幼苗的侵染率在0.02%左右(数据未显示),自交传代至T3代.又分别选择ATEG2和ATEG5几个转基因植株进行纯合子、PCR和Western blot鉴定.挑选接近纯合子并且明确表达标签蛋白ATEG2M-2和ATEG5L-2植株用于耐热表型分析.
热激蛋白(heat shock proteins,HSP),又称热休克蛋白或应激蛋白(heat stress proteins),是生物在高温刺激下产生的一组蛋白.研究表明,热激蛋白普遍存在于从细菌到高等生物的整个生物界,而且它们几乎在所有的活细胞中都起着重要的作用.根据其分子质量大小可分为HSP100、HSP90、HSP70、HSP60和小分子HSP.大量研究表明,将小分子热激蛋白相关基因转入生物体后,能提高生物的耐热性[7,10].通过在野生型拟南芥中过表达双孢蘑菇热休克蛋白基因Hsp20发现,转Hsp20基因拟南芥正常培养时下胚轴延伸与野生型及转Adcs基因拟南芥大致相同(见图6(a)左侧部分3个NC柱形图),但在高温胁迫后仅转Hsp20基因拟南芥下胚轴能够恢复生长,提示双孢蘑菇Hsp20基因具有抗热胁迫的功能(见图6(a)右侧部分3个HS柱形图).
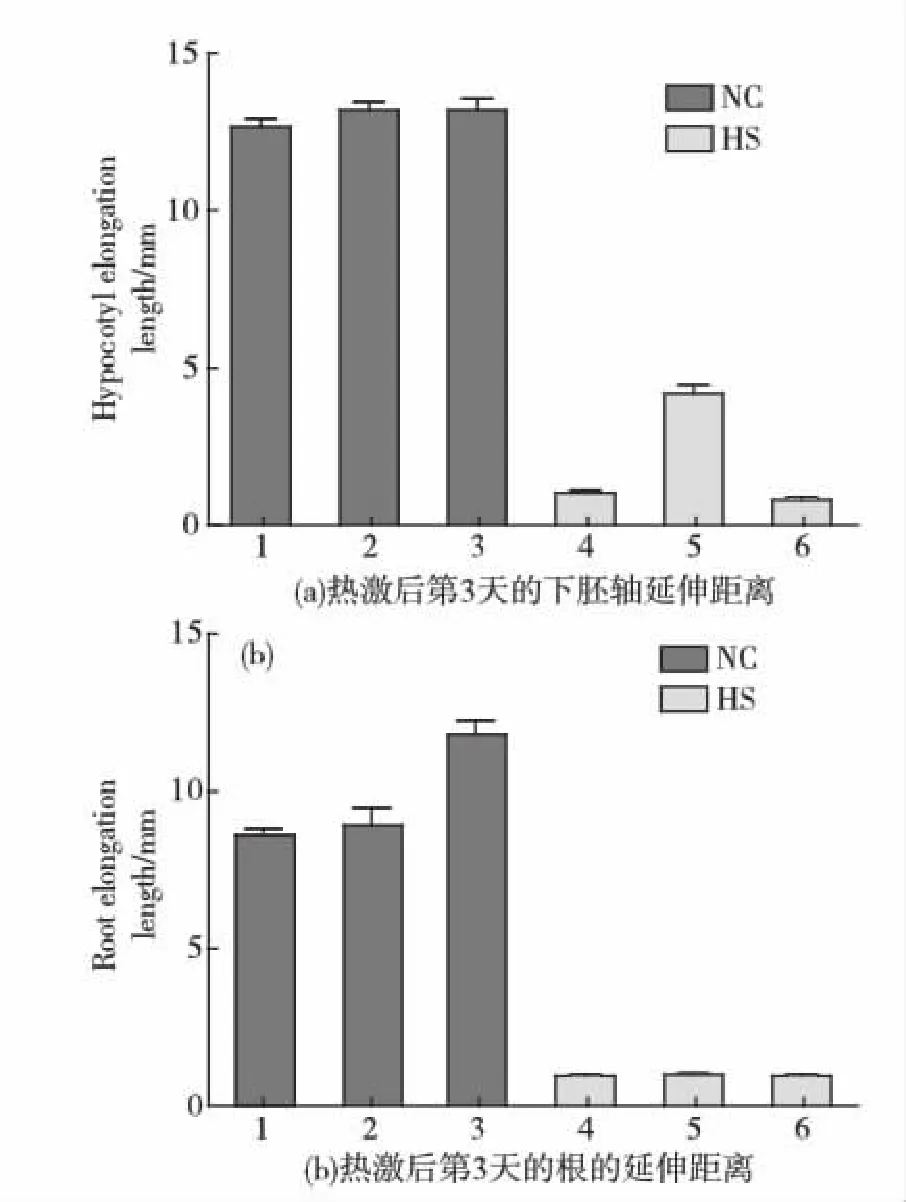
幼苗:1:Col-0;2:2M-2;3:5L-2;4:Col-0;5:2M-2;6:5L-2.1~3:NC,未经热激处理组;4~6:HS,热激处理组.图6 转基因拟南芥热激后根和下胚轴延伸距离Fig.6 Roots and hypocotyls elongation length of transgenic Arabidopsis thaliana after heat-stress
本实验室前期发现Pab基因(本文中表示为Adcs基因)在02菌株中组成性高表达并受热诱导,通过转基因蘑菇发现,在高温协迫下,高表达该基因的热敏感8213菌株菌丝延伸距离明显快于出发菌株8213,因此推测Adcs基因可能与02菌株的耐温密切相关[4].体外功能实验表明,Adcs基因表达蛋白预测为ADCS,ADCS催化分支酸和谷氨酰胺转氨基反应得到ADC,后者经过酶促或自发裂解后得到对氨基苯甲酸(文章投稿中).对氨基苯甲酸是叶酸的前体,四氢叶酸由3个部分组成:分别称为蝶啶环,对氨基苯甲酸,以及长度多变的多聚谷氨酸链(1~8个残基),其结合、运输以及贡献一碳单位的功能随氧化状态而不同(从最还原的状态到最氧化的状态:甲基、亚甲基、次甲基、甲酰基)[11].由于叶酸辅酶的看家功能,在幼苗的发育过程中叶酸可能具有关键作用,满足种子发芽以及发芽后生长对甲基,也即甲基-四氢叶酸的巨大需求[12].在我们的实验过程中,正常培养条件下,转基因拟南芥ATEG5根的延伸略快于野生型和转基因ATEG2植株(见图6(b)左侧部分3个NC柱形图),可能正是由于过表达ADCS促进了叶酸的生成,但是经过热胁迫处理,转基因ATEG5植株与野生型植株一样不能恢复下胚轴和根的生长(见图6(a)和(b)右侧部分HS柱形图).分析其可能原因有:1)45 ℃热激后ADCS完全失活,无法在随后的23 ℃正常培养下恢复酶活(通过大肠杆菌中表达双孢蘑菇ADCS酶,体外活性分析其最适温度在25 ℃,一旦温度超过30 ℃时,酶活力就迅速下降);2)ADCS酶本身可能与耐热无关.因此认为转基因拟南芥耐热表型结果尚未能说明Pab基因(本文以Adcs表示)与蘑菇耐温直接相关.卢钟磊[4]提到:“如图3.32所示,对照组(未热处理)中野生型植株和Pab转基因株的下胚轴延伸长度基本相同;而在实验组中(45 ℃高温处理),野生型与转基因株的下胚轴延伸距离呈极显著的差异性,转基因株(如ATEG-5A、AT25-L7)的下胚轴长度为10~13 mm,而野生型的下胚轴延伸要短得多,约5 mm.”这里的转基因株下胚轴长度为10~13 mm可能是以下胚轴实际距离表示的.因为我们发现,经过45 ℃ 1 h后恢复正常培养3 d,下胚轴基本不延伸,即使是ATEG2转基因株下胚轴延伸距离也仅仅在5 mm左右.当然不同的转基因株系(本文使用ATEG-5L)会存在一定的差别.综上所述,本文研究提示,在高温胁迫过程中,与大多数生物一样,双孢蘑菇体内蛋白要保持正常的活性,关键是需要HSP这一类分子伴侣协助蛋白质正常折叠,以维持其功能.
致谢:感谢厦门大学生命科学学院植物发育实验室陶懿老师和中科院昆明植物研究所胡向阳老师为本实验提供条件!
[1] 蔡衍山,吕作舟,蔡耿新.食用菌无公害生产技术手册[M].北京:中国农业出版社,2003.
[2] Goltapeh E M,Danesh Y,Kamal S,et al.Biology and molecular approaches in genetic improvement of cultivated button mushroom (Agaricusbisporus)[J].Symbiotic Fungi,Berlin Heidelberg,Germany:Springer,2009:403-421.
[3] Romaine C.Transgenic breeding ofAgaricusbisporus:the next frontier[J].Acta Edulis Fungi,2005,12:174-184.
[4] 卢钟磊.双孢蘑菇耐热分子机理研究及相关基因的克隆与功能验证[D].厦门:厦门大学,2010.
[5] Hong S W,Vierling E.Mutants ofArabidopsisthalianadefective in the acquisition of tolerance to high temperature stress[J].Proceedings of the National Academy of Sciences,2000,97(8):4392-4397.
[6] 李春光,陈其军,高新起,等.拟南芥热激转录因子 AtHsfA2 调节胁迫反应基因的表达并提高热和氧化胁迫耐性[J].中国科学:C辑,2005,35(5):398-407.
[7] 张路,胡伟娟,张启翔,等.报春 PF sHSP 17-1 基因转化拟南芥及耐热鉴定[J].生物技术通报,2011(11):177-181.
[8] Clough S J,Bent A F.Floral dip:a simplified method forAgrobacterium-mediated transformation ofArabidopsisthaliana[J].The Plant Journal,1998,16(6):735-743.
[9] Earley K W,Haag J R,Pontes O,et al.Gateway-compatible vectors for plant functional genomics and proteomics[J].Plant Journal,2006,45(4):616-629.
[10] Sanmiya K,Suzuki K,Egawa Y,et al.Mitochondrial small heat-shock protein enhances thermotolerance in tobacco plants[J].FEBS letters,2004,557(1):265-268.
[11] Scott J,Rébeillé F,Fletcher J.Folic acid and folates:the feasibility for nutritional enhancement in plant foods[J].J Sci Food Agric,2000,80(7):795-824.
[12] Jabrin S,Ravanel S,Gambonnet B,et al.One-carbon metabolism in plants.Regulation of tetrahydrofolate synthesis during germination and seedling development[J].Plant Physiol,2003,131(3):1431-1439.
——记上海志磊食用菌种植专业合作社

