广东不同地区柑橘黄龙病菌的遗传多样性分析
黄永辉,程保平,彭埃天,宋晓兵,凌金锋,陈 霞
(广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室,广州 510640)
广东不同地区柑橘黄龙病菌的遗传多样性分析
黄永辉,程保平,彭埃天*,宋晓兵,凌金锋,陈 霞
(广东省农业科学院植物保护研究所,广东省植物保护新技术重点实验室,广州 510640)
不同基因型的黄龙病菌可能具有不同的致病模式,为了探明广东省不同基因型黄龙病菌的分布特点,为该病害的流行学研究提供重要依据,本研究利用PCR-RFLP的方法研究了广东省柑橘产区7个市县黄龙病菌外膜蛋白(outer membrane protein, OMP)基因的遗传多样性,并对各地黄龙病菌的omp基因进行克隆测序,构建了系统发育树。采用4种限制性内切酶消化各地区的柑橘黄龙病菌omp基因分别产生了不同的RFLP指纹图谱,每种限制性内切酶均产生了2种类型的酶切谱带;系统进化分析结果显示:广东地区的柑橘黄龙病菌属于韧皮部杆菌亚洲种,且亲缘关系非常近。广东地区黄龙病菌在omp基因水平上未见显著差异,未发现其他优势种类。
柑橘黄龙病菌;omp; RFLP; 遗传多样性
柑橘黄龙病(citrus Huanglongbing,简称HLB)是一种世界性的柑橘病害,在我国及东南亚、非洲、阿拉伯半岛、印度、巴西和美国佛罗里达州等地区均有发生[1],严重制约着柑橘产业的发展。
柑橘黄龙病的病原过去曾一度被认为是类菌原体或类立克次氏体,但Garnier在1984年发现黄龙病病原的膜结构外壁和内壁间存在着肽聚糖层,这与革兰氏阴性细菌的细胞壁结构非常相似,因此认为黄龙病的病原是一种革兰氏阴性细菌[2]。普遍认为该病原属于韧皮部杆菌属,有亚洲种、非洲种和美洲种3个种[3]。目前在我国仅发现有亚洲种[4],该病菌主要由接穗、苗木和柑橘木虱传播。该病原菌易于传播的特性使其分布范围较广[5]。 而近期在多种植物病原菌的研究中发现:病原菌可能会针对不同地域进化出不同的适生基因型,因此检测广东省黄龙病菌不同的基因型并分析其地域分布规律对该菌的流行病学研究有着重要意义。有研究发现:来自不同地区的黄龙病菌存在多种不同的血清型,用采自不同地区的黄龙病菌制备的单克隆抗体对不同黄龙病菌株表现出不同的专一性[6]。说明来自不同地域的黄龙病菌,存在一定的差异。但用血清型来区分不同的黄龙病菌多样性非常繁琐,用基因多态性来区分其多样性是更为经济简便的选择。前人已证实:16S rDNA和核糖体蛋白基因由于太保守,难以用于区分来自不同地域的柑橘黄龙病菌的基因多态性[7],而最近的研究发现一种外膜基因omp对多种微生物的种内基因多态性均能很好地区分,对来自不同地域黄龙病菌的基因多态性亦可区分[6, 8]。王中康等也利用该菌的omp基因探索了中国6个省份亚洲韧皮部杆菌的遗传多样性,但对广东省内不同地区的亚洲韧皮部杆菌的遗传多样性尚需进一步明确和补充[9]。PCR-RFLP技术简单、直观、可靠,因此本研究利用该技术和构建系统发育树对广东省7个市县的柑橘黄龙病菌omp基因进行研究和分析,旨在探明广东省不同地理区域柑橘黄龙病菌的遗传多样性。
1 材料与方法
1.1 样品采集
在广东省内的7个市县采集感染了柑橘黄龙病菌的6个柑橘品种的样品材料,分别为采自广州市从化的‘马水橘’叶片、惠州市龙门的‘年橘’叶片、揭阳市揭东的‘椪柑’叶片、普宁市里湖的‘蕉柑’叶片、普宁市云落的‘蕉柑’叶片、肇庆市德庆的‘贡柑’叶片和肇庆市高要的‘砂糖橘’叶片。
1.2 样品总DNA提取
以“裂解-过滤法”提取样品总DNA,参考Wang等的方法[10]。具体操作步骤:称取0.2 g柑橘叶片中脉于研钵中,加入少量石英砂后用液氮研磨成粉末,加入350 μL PBS缓冲液及0.9 μL RNA酶,研磨30 s;转移到2 mL离心管中,加入150 μL裂解液和20 μL蛋白酶K,涡旋振荡混合均匀,于56 ℃水浴10 min;加入350 μL蛋白去除液,涡旋振荡混合均匀,于12 000 r/min离心10 min;将上清液转移到DNA过滤柱(Axygen)中,12 000 r/min离心1 min,弃滤液;用500 μL洗涤液洗涤1次,再用700 μL脱盐液洗涤2次;在过滤柱中加入100 μL预热的2.5 mmol/L Tris-HCl或ddH2O室温静置1 min,12 000 r/min离心1 min,所得溶液即为样品总DNA溶液。
1.3 目的基因的PCR扩增
分别以不同来源的样品DNA为模板,以上游引物omp5:GATGATAGGTGCATAAAAG TACAGAAG和下游引物omp3:AATACCCTTATGGGATACAAAAA[6]扩增黄龙病菌外膜蛋白omp基因。PCR反应体系为:Ex Taq-Mix DNA聚合酶25 μL(含dNTP),上下游引物(20 μmol/L)各1 μL,DNA模板2 μL,无菌水补足至总体积50 μL。反应条件为:94 ℃ 5 min;94 ℃ 1 min,55 ℃1 min,72 ℃ 3 min,40个循环;最后72 ℃延伸10 min。PCR产物于1%琼脂糖凝胶上电泳检测。
1.4 目的基因的克隆、测序及RFLP分析
将PCR产物上样于含有Goldview染料的琼脂糖凝胶中电泳,并于凝胶成像系统中观察拍照。将琼脂糖凝胶上的目的条带切割回收,用凝胶回收试剂盒(Axygen)回收纯化,具体操作按照试剂盒说明书进行。
将回收纯化的目的片段与pMD19-T克隆载体连接,连接产物转化大肠杆菌DH5α感受态细胞,涂布于含Amp抗生素的LB平板上,于37 ℃培养后挑取平板上的单克隆菌落,用引物omp5和omp3进行菌落PCR鉴定。对于每个转化子挑选3个经鉴定为阳性的克隆,送交生物公司进行双向测序。
序列用BioEdit软件分析(http:∥www.mbio.ncsu.edu/bioedit/bioedit.html),找出各样品间omp基因序列的碱基差异位点以及对应的内切酶位点,该软件能自动计算出可区分各样品中omp基因序列差异的内切酶。阳性克隆重组子用质粒提取试剂盒(Axygen)抽提后,质粒经电泳验证为单一目的重组质粒,然后分别用限制性内切酶BspCNⅠ、NdeⅠ、BamHⅠ和ClaⅠ在各自适宜的温度下进行酶切。酶切产物经2%的琼脂糖凝胶电泳分离后,进行RFLP指纹图谱分析。
1.5 系统发育树的构建
用NCBI中的Blast工具对所测序列进行比对,分析其与数据库中已有的柑橘黄龙病菌外膜蛋白基因序列的同源性。对广东省7个市县样品的外膜蛋白基因核苷酸序列和氨基酸序列通过生物学软件DNAman进行多重比对,比较不同地区样品间基因的碱基差异和氨基酸差异。为了便于全面分析,除了采用本研究中7个柑橘黄龙病样品的基因序列外,另选取了数据库中其他国家和地区的柑橘黄龙病菌亚洲种的外膜蛋白基因序列一并用于构建系统发育树。其中本研究获得的7个菌株序列为:Guangdong-CH (KC473155)、Guangdong-LM (KC473156)、Guangdong-JD (KC473157)、Guangdong-LH (KC473158)、Guangdong-YL (KC473159)、Guangdong-DQ (KC473160)、Guangdong-GY (KC473161)。选取的数据库中其他菌株有:China-Beihai (AY842429)、Taiwan(AB480106)、Thailand-Nakhompathom (AY842432)、Japan(AB480103)、Indonesia(AB480132),以及柑橘黄龙病菌非洲种的外膜蛋白基因序列South Africa-Nelspruit(AY642158),另外,其他一些α变形菌纲细菌Sinorhizobiummeliloti(NP385608)和Bartonellahenselae(AAL66374),β变形菌纲的BetaproteobacteriumKB13(EDZ64793),以及γ变形菌纲Escherichiacoli(NP_285871)的外膜蛋白基因序列也被采用。先用Cluxtal X软件对上述基因序列进行多重比对,然后利用MEGA软件的最大简约法构建系统发育树,设置自举检验重复抽样次数为1 000。
2 结果与分析
2.1 外膜蛋白基因的扩增
以omp5/omp3为引物,从感染柑橘黄龙病菌的广州市从化的‘马水橘’叶片、惠州市龙门的‘年橘’叶片、揭阳市揭东的‘椪柑’叶片、普宁市里湖的‘蕉柑’叶片、普宁市云落的‘蕉柑’叶片、肇庆市德庆的‘贡柑’叶片和肇庆市高要的‘砂糖橘’叶片材料中均可扩增获得大小为2 300 bp左右的条带(图1),与预期扩增片段大小一致。

图1 柑橘黄龙病菌外膜蛋白omp基因的PCR产物电泳检测结果Fig.1 Electrophoresis analysis of PCR products of omp gene
2.2 PCR产物的RFLP分析
对广东省7个不同地区的柑橘样品黄龙病菌外膜蛋白基因,用选取的4个内切酶进行消化,酶切图谱均得到2种类型的谱带,其中BspCNⅠ酶切产物产生的电泳谱带,广州市从化样品有别于其他地区(图2-a);NdeⅠ酶切产物的电泳谱带,惠州市龙门样品不同于其他地区(图2-b);BamHⅠ和ClaⅠ的酶切产物电泳谱带分别是肇庆市德庆和高要的样品与其他样品有差异(图2-c和d)。以上结果初步表明广东省不同地区的柑橘黄龙病菌之间存在一定的遗传多样性。
2.3 外膜蛋白基因的序列分析
用BioEdit软件对广东省7个市县的柑橘黄龙病菌外膜蛋白omp的核苷酸序列和氨基酸序列进行多重比对,结果表明各地区的外膜蛋白核苷酸序列均存在一定的差异,氨基酸序列除广州市从化地区和普宁市里湖地区的样品完全一致外,其余也都存在差异,详见表1和表2。
测序结果显示,扩增得到的黄龙病菌外膜蛋白omp基因的核苷酸序列全长为2 346 bp,对其进行Blast多重比对分析发现,本试验中7个样品外膜蛋白基因的核苷酸序列与数据库中其他地区柑橘黄龙病菌亚洲种的外膜蛋白基因核苷酸序列的相似性均达到99%,与非洲种外膜蛋白基因核苷酸序列的相似性为72%左右。由外膜蛋白基因核苷酸序列推导出的氨基酸序列进行比对发现,本研究所得到的外膜蛋白基因编码的氨基酸序列与其他地区亚洲种黄龙病菌外膜蛋白基因所编码的氨基酸序列相似性也达到99%,与非洲种外膜蛋白基因编码的氨基酸序列相似性仅为59%左右。
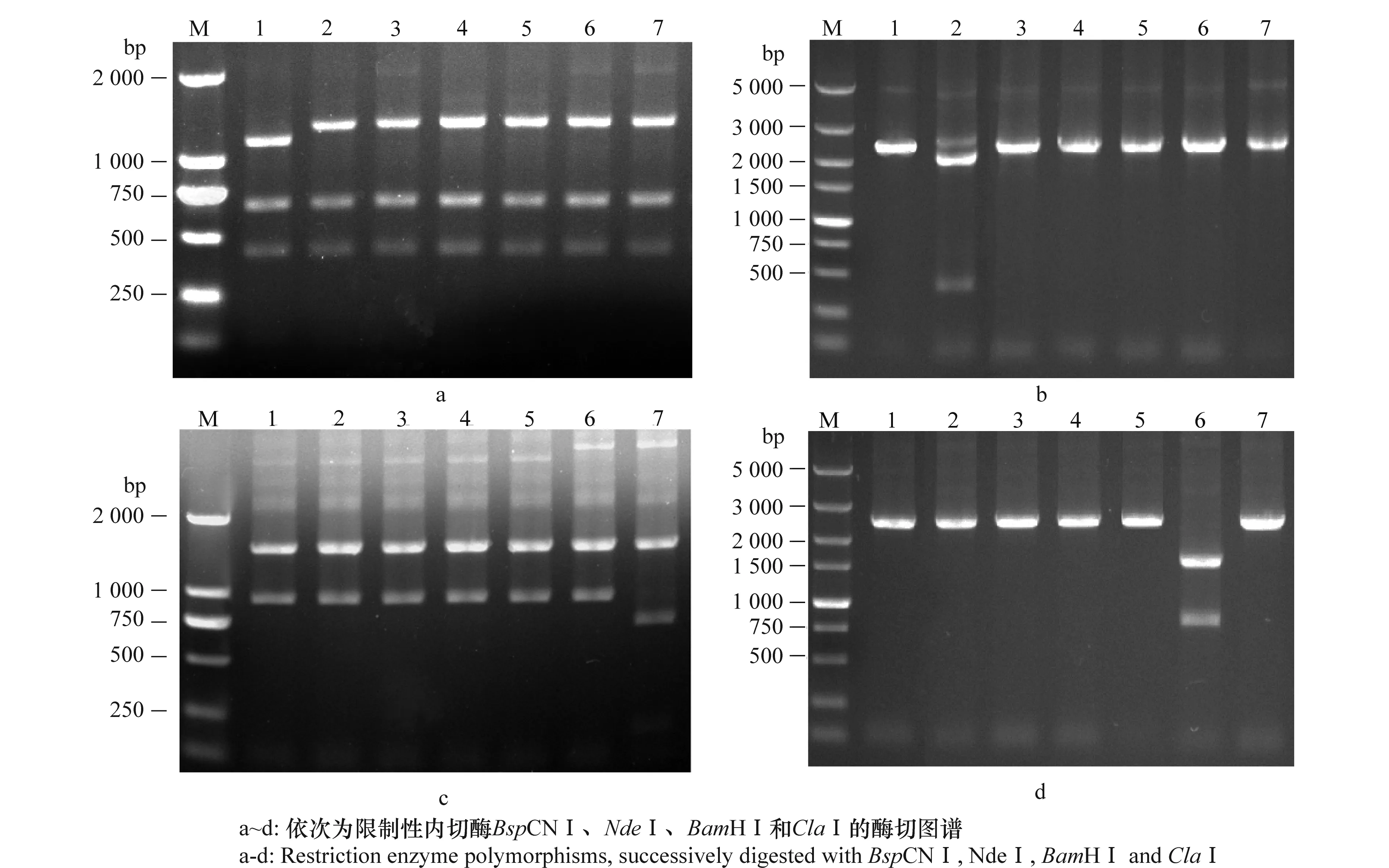
图2 柑橘黄龙病菌外膜蛋白基因的RFLP图谱Fig.2 Restrictive endonuclease polymorphisms of omp gene of Candidatus Liberibacter asiaticus
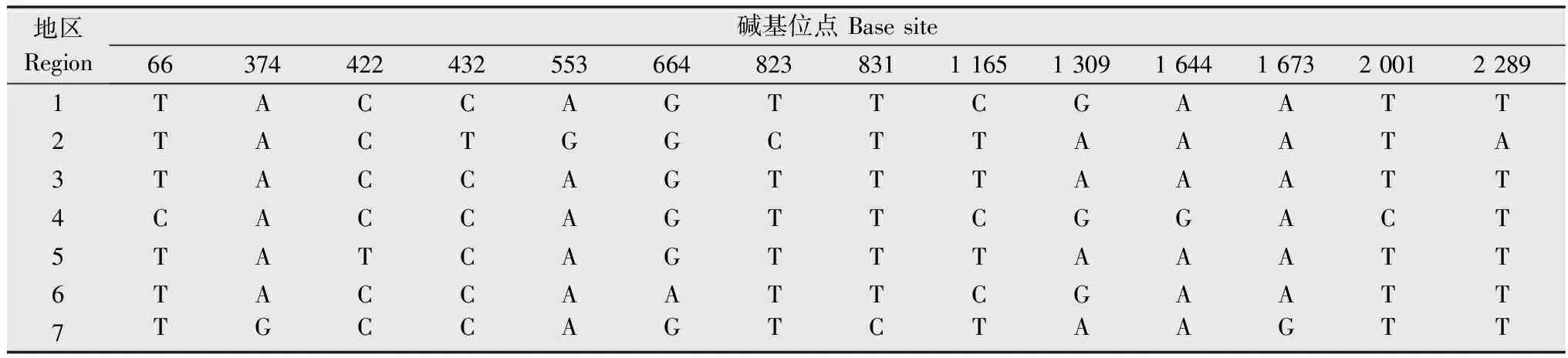
表1 不同地区之间样品外膜蛋白基因的碱基差异Table 1 Base differences among omp genes derived from samples collected from different regions
表2不同地区之间样品外膜蛋白基因的氨基酸差异
Table2Differencesofaminoacidamongompgenesfromdifferentregions

地区Region氨基酸位点Aminoacidsite1251411852222754375581NATGFEK2NAAGLKK3NATGFKK4NATGFEK5NVTGFKK6NATSFEK
2.4 系统进化分析
基于柑橘黄龙病菌omp基因序列采用最大简约法构建的系统发育树显示,广东省7个不同地区的黄龙病菌株和α变形菌纲聚于一类,均属于韧皮部杆菌亚洲种,和已报道的中国北海及泰国的亚洲种菌株的亲缘关系非常近,在进化树上难以区分。但是与我国台湾、日本和印尼的菌株却有较大差异。因此推断,广东地区的亚洲韧皮部杆菌具有很高的同源性,同时也存在一定的遗传变异。
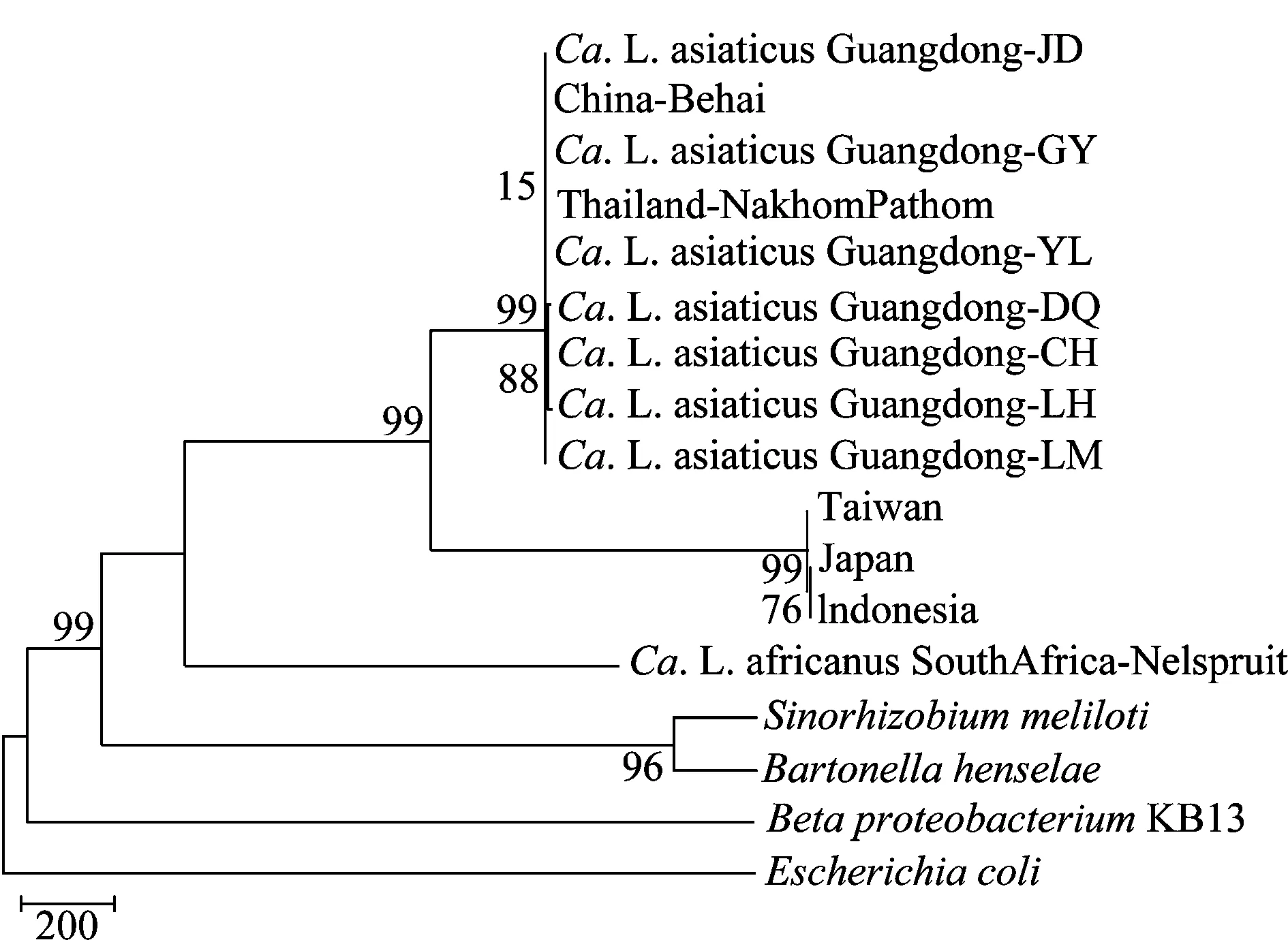
图3 基于omp基因构建的柑橘黄龙病菌系统发育树Fig.3 Phylogenetic tree of Candidatus Liberibacter asiaticus base on omp gene
3 讨论
柑橘黄龙病是目前柑橘产业的最大威胁,该病原菌寄主繁多[11-12],其在不同的寄主品种中可能存在不同的适生基因型,因此分析广东省黄龙病菌不同的基因型并检测其地域性分布规律对该病菌的流行病学研究有着重要意义。近年来研究发现柑橘黄龙病菌存在丰富的遗传多样性[6,9],广东省是中国柑橘主产区,也是受黄龙病危害最为严重的地区,但该省各地区柑橘黄龙病菌的遗传多样性却较少被研究。
本文系统分析了广东省柑橘主产区柑橘黄龙病菌的遗传多态性,研究表明广东省的柑橘黄龙病菌具有较为丰富的遗传多态性。这一研究结果与前人的研究结果相似[9,13-14],前人分析了各地区的一些黄龙病菌菌株,也显示出丰富的多态性,这就表明不同地域的黄龙病菌都具有一定的序列变异度。从系统发育树结果来看,黄龙病菌类群的划分与菌株的地理来源存在一定的相关性,说明各地病原菌存在一定的亲缘关系,但同时也存在一定的遗传变异,基因组的变化最终可能反映在菌株的生理和毒力变化方面,这就警示我们要注意监控广东省黄龙病菌的变种情况。因此,黄龙病菌株的致病性与菌株相互间遗传亲疏的相关性还有待进一步深入研究。
序列及系统进化分析结果显示,广东省的柑橘黄龙病菌属于亚洲种,与黄龙病菌非洲种有一定的序列差异,可能暗示着这两类菌株的致病力和寄主范围有一定差异,这就需要对其他国家的黄龙病菌进行及时检验检疫,以免不同的致病种传入广东省,造成更大的危害。
此外,omp基因已被证实可作为细菌生物多样性研究的一个很有潜力的候选基因[6,13],本研究在分析了广东省柑橘黄龙病菌遗传多样性的基础上,还深入分析了其omp基因的其他相关信息,为今后开发黄龙病菌omp抗体技术打下坚实的基础,对制定科学有效的黄龙病防治策略具有重要的指导意义。
[1] Gottwald T R.Current epidemiological understanding of citrus[J].Annual Review of Phytopathology, 2010, 48: 119-139.
[2] Garnier M, Bové J M.The greening organism is a gram-negative bacterium[C]∥Garnsev S M, Timmer L W, Dodds J A, eds.Proc 9th Conf Int Org, Citrus Virol Riverside, 1984: 115-124.
[3] Bové J M.Huanglongbing: A destructive newly-emerging century-old disease of citrus[J].Plant Pathology, 2006, 88: 7-37.
[4] Teixeira D A, Danet J L.Citrus Huanglongbing in Sao Paulo State, Brazil: PCR detection of theCandidatusLiberibacter species associated with the disease[J].Molecular and Cellular Probes, 2005, 19: 173-179.
[5] 柯冲, 林先沾, 陈辉, 等.柑桔黄龙病与类立克次体及线状病毒的研究初报[J].科学通报, 1979(10): 463-466.
[6] Bastianel C, Garnier-Semancik M, Renaudin J, et al.Diversity of “CandidatusLiberibacter asiaticus” based on theompgene sequence[J].Applied and Environmental Microbiology,2005, 71(11): 6473-6478.
[7] Hocquellet A, Bové J M, Garnier M.Isolation of DNA from uncultured ‘CandidatusLiberobacter’ species associated with citrus Huanglongbing by RAPD[J].Current Microbiology, 1999, 38: 176-182.
[8] Cloeckaert A, Verger J M, Grayon M, et al.Restriction site polymorphism of the genes encoding the major 25 kDa and 36 kDa outer-membrane proteins ofBrucella[J].Microbiology, 1995, 141:2111-2121.
[9] 王中康, 周彬彬, 田圣超, 等.中国不同地区亚洲韧皮杆菌遗传多样性分析[J].植物病理学报, 2009, 39(6): 593-599.
[10]Wang Z K, Gast T C, Molin J M.Rapid detection of liberibacter asiaticus in citrus by PCR amplification of 16s rDNA and ribosomal protein[C]∥Proceedings of the First Asian Conference on Plant Pathology, 2000, 8: 180.
[11]Tirtawidjaja S.Insect, dodder and seed transmission of citrus vein phloem degeneration (CVPD)[C]∥Proceeding of the 4thInternational Congress on Citrus, International Society of Citriculture Tokyo, Japan, 1981: 469-471.
[12]李韬, 柯冲.应用NestedPCR技术检测柑桔木虱及其寄主九里香的柑桔黄龙病带菌率[J].植物保护学报, 2002, 29(1): 31-35.
[13]Cheng C, Paddock C D, Ganta R R.Molecular heterogeneity of Echreichia chaffensis isolates determined by sequence analysis of the 28 kilodalton outer membrane protein genes and other regions of the genome[J].Infection and Immunity, 2003, 71: 187-195.
[14]Deng X, Chen J, Feng Z, et al.Identification and characterization of the Huanglongbing bacterium in pummelo from multiple locations in Guangdong, P.R.China[J].Plant Disease, 2008, 92: 513-518.
GeneticdiversityofCandidatusLiberibacterisolatesfromdifferentgeographicalregionsofGuangdongProvince
Huang Yonghui,Cheng Baoping,Peng Aitian,Song Xiaobing,Ling Jinfeng,Chen Xia
(InstituteofPlantProtection,GuangdongAcademyofAgriculturalSciences,GuangdongProvincialKeyLaboratoryofHighTechnologyforPlantProtection,Guangzhou510640,China)
Huanglongbing (HLB) is a destructive disease on citrus, and pathogens with different genotypes may possess different pathogenicity.Ascertain the distribution ofCandidatusLiberibacter asiaticus with different genotypes in Guangdong Province could provide an important basis for the studies of disease epidemics.In this study, PCR-RFLP analysis based on the outer membrane protein gene (omp) was conducted with disease samples from different regions.Theseompsequences were further sequenced and phylogenetic tree was constructed.The amplifiedompgenes ofCa.Liberibacter asiaticus were digested with four different restrictive endonucleases and several different gene polymorphisms were produced.Each restrictive endonuclease generated two types of DNA bands, and the pathogen isolates from Guangdong Province all belonged toCa.Liberibacter asiaticus.There existed no obvious distribution feature among HLB pathogens with different genotypes, suggesting that there were no dominant species of HLB pathogen in Guangdong Province.
CandidatusLiberibacter asiaticus;omp; RFLP; genetic diversity
2013-05-13
: 2013-09-17
广东省现代农业产业技术体系建设专项(粤农[2009]380号); 广东省农业科技推广重大技术研究项目(201201127);广东省农业科学院院长基金项目(201305)
S 436.66;S 432.4
: ADOI: 10.3969/j.issn.0529-1542.2014.01.010
* 通信作者 E-mail:pengait@163.com

