AT1受体自身抗体对糖尿病肾病大鼠肾脏细胞凋亡及JNK表达的作用*
徐春艳, 赵林双
(广州军区武汉总医院内分泌科,湖北 武汉 430070)
血管紧张素Ⅱ1型受体自身抗体(angiotensin Ⅱ type 1 receptor autoantibody,AT1-AA)属于G蛋白偶联受体家族,是针对AT1受体(AT1receptor,AT1R)的特异性抗体,具有类似血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)的生物学效应。自AT1-AA首次在先兆子痫患者体内被发现[1]以来,又先后证实其与难治性高血压患者蛋白尿发生率有关[2],并参与了原发性肾小球疾病过程[3],成为独立于高血压之外的致肾脏损害的因素。本课题组前期研究发现,糖尿病肾病(diabetic nephropathy,DN)患者血清AT1-AA阳性率明显高于糖尿病患者和正常对照者[4],提示AT1-AA与DN发病过程有关,但其致DN肾脏损害的具体机制尚不清楚。
研究显示,DN时肾素-血管紧张素系统(renin-angiotensin system, RAS)的活化可引起肾脏内质网应激(endoplasmic reticulum stress,ERS),并可通过JNK凋亡途径诱导肾脏细胞凋亡[5-6]。AT1R是RAS的关键因子,也是AT1-AA发挥效应的特异性受体,但其能否介导AT1-AA而致DN肾脏ERS反应,目前未见报道。因此,我们通过本研究探讨DN大鼠血清AT1-AA与肾脏ERS及其相关的JNK凋亡信号通路的关系,以进一步了解AT1-AA致DN肾脏细胞凋亡的分子机制。
材 料 和 方 法
1 实验动物
36只4周龄雄性SD大鼠,购自武汉大学动物实验中心,实验动物合格证编号为42000500001559。饲养环境:室温20~24 ℃,相对湿度40%~60%,自由摄食饮水,12 h交替照明。
2 主要试剂和仪器
链脲佐菌素(streptozotocin,STZ)(Sigma);TUNEL试剂盒(Promega);BCA蛋白定量试剂盒(碧云天生物技术有限公司);葡萄糖调节蛋白78(glucose-regulated protein 78, GRP78)抗体(Bioworld);磷酸化c-Jun N末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)抗体(Santa Cruz);β-actin抗体、羊抗小鼠Ⅱ抗、羊抗兔Ⅱ抗和兔抗小鼠Ⅱ抗(武汉博士德生物工程有限公司)。全自动生化仪(BECKMAN COULTER UniCelDxC 800);HMIAS-2000高清晰度彩色医学图文分析系统(广州军区武汉总医院医学实验科提供)。
3 主要方法
3.1模型大鼠的建立 所有大鼠适应性喂养1周后随机选取6只为正常对照(NC),选取30只进行造模处理。NC组大鼠以普通饲料食喂养,造模大鼠以高糖高脂饲料喂养。造模大鼠于高糖高脂喂养4周时腹腔注射1%的STZ溶液(35 mg/kg),NC组注射等量的柠檬酸缓冲液。72 h后测尾静脉血糖,随机血糖>16.7 mmol/L认为糖尿病大鼠模型建立成功,继续高糖高脂喂养,每周复测血糖,持续观察12周至其自然进展至DN阶段[7]。 将模型建立成功大鼠统一归为模型组(model组)。
3.2血清AT1-AA的测定及分组 大鼠称重,给予10%水合氯醛(2 mL/kg)腹腔麻醉,腔静脉取血,收集血清,分装后-20 ℃保存。AT1R抗原肽片段的氨基酸序列为5’-IHRNVFFIENTTNITVCAFHYESQNSTL-3'(由华中科技大学附属协和医院心血管研究室人工合成并馈赠)。ELISA法测定血清AT1-AA 的A值[8],根据AT1-AA测定结果,随机选择DN大鼠纳入DN组,并分AT1-AA阳性DN(AT1-AA positive DN,APD)和AT1-AA阴性DN(AT1-AA negative DN,AND)亚组。
3.3血、尿生化指标的检测 实验结束前1 d,用代谢笼收集大鼠24 h尿液并记录尿量,4 ℃保存。应用全自动生化仪检测尿肌酐(urine creatinine,UCr)和尿微量白表达(urine microalbumin,UMA);同时检测血糖(blood glucose,BG)、血肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN),计算肌酐清除率(creatinine clearance rate,CCr)。
3.4TUNEL染色测定肾脏细胞凋亡 制备肾组织石蜡切片,常规脱水,严格按试剂盒说明进行TUNEL染色,DAB显色。光镜下观察,凋亡细胞呈棕褐色。应用MIAS-2000高清晰度彩色医学图文分析系统计数凋亡细胞,计算凋亡率。
3.5Western blotting技术测定肾组织GRP78和p-JNK蛋白表达 提取大鼠肾组织总蛋白,BCA法测定总蛋白浓度。10%的SDS-PAGE分离蛋白,PVDF膜印迹,5%脱脂奶粉封闭,GRP78抗体(1∶600)、p-JNK抗体(1∶3 000)或β-actin抗体(1∶400)浸泡,4 ℃过夜,分别加入辣根过氧化物酶HRP标记的Ⅱ抗(1∶50 000)孵育2 h,滴加ECL底物液,暗视中X光片压片、显影、定影,应用凝胶成像系统分析胶片灰度值比值,进行蛋白的定量分析。
4 统计学处理
数据采用SPSS 19.0软件进行分析。计数资料以构成比表示,采用2检验;计量资料以均数±标准差(mean±SD)表示,组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 Model组和NC组大鼠一般情况比较
实验结束时,造模大鼠5只死亡,1只未成模,成模率为96.7%,死亡率为16.7%。与NC组大鼠比较,model组大鼠体重明显减轻,而血糖及肾脏肥大指数均明显升高,见表1。

表1 NC组和model组大鼠血糖、体重和肾肥大指数的比较
2 大鼠血清AT1-AA阳性率结果及亚组分组
Model组大鼠血清AT1-AA阳性率为62.5%,较NC组16.7%明显升高,差异有统计学意义(P<0.05)。根据AT1-AA结果,在24只Model组大鼠中随机选取8只AT1-AA阳性和4只AT1-AA阴性大鼠纳入DN组,其中AT1-AA阳性DN为APD亚组,AT1-AA阴性DN为AND亚组。
3 APD和AND亚组大鼠肾功能生化指标结果比较
与NC组比较,APD亚组大鼠的BUN和24 h UMA水平明显升高(均P<0.01),CCr显著降低(P<0.05);与APD亚组大鼠比较,前述各生化指标在AND亚组大鼠中变化程度相对较轻,见表2。

表2 各亚组大鼠肾功能生化指标结果比较
4 AT1-AA对DN组大鼠肾脏细胞凋亡的影响
DN组大鼠肾脏细胞凋亡率(16.65±5.01)较NC组大鼠(0.38±0.24)显著增高(P<0.01),其中肾小管上皮细胞和肾小球足细胞均有凋亡,但以肾小管上皮细胞凋亡为主。进一步观察发现,APD亚组大鼠肾脏细胞凋亡率(20.05±1.71)明显高于AND亚组(13.24±4.93)(P<0.01),见图1。

Figure 1. Apoptosis of renal cells in all groups under optical microscope by TUNEL staining assay (×400). Apoptotic cells were brown as indicated by the arrows. Mean±SD. n=4~12. ** P<0.01 vs NC group; ##P<0.01 vs AND sub-group.
5 DN组和NC组大鼠肾组织GRP78及p-JNK蛋白表达比较
Western blotting结果显示,DN组大鼠肾组织GRP78和p-JNK的表达分别为0.750±0.030和0.603±0.048,而NC组大鼠为0.334±0.001和0.209±0.003,2组比较差异有统计学意义(P<0.01),见图2。

Figure 2. The protein levels of GRP78 and p-JNK in DN group and NC group. Mean±SD. n=6~12.**P<0.01 vs NC group.
6 APD和AND亚组大鼠肾组织GRP78及p-JNK蛋白表达比较
进一步研究发现,APD亚组GRP78的表达(0.774±0.026)较AND亚组(0.728±0.003)明显升高(P<0.05);且APD亚组p-JNK的表达(0.643±0.026)亦高于AND亚组(0.562±0.018)(P<0.01),见图3。
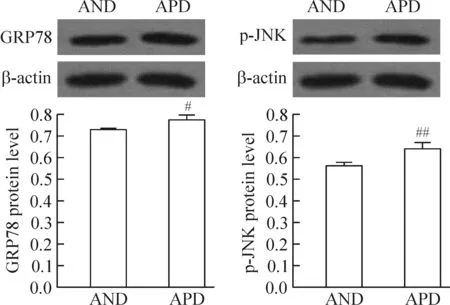
Figure 3. The protein levels of GRP78 and p-JNK in APD and AND sub-groups. Mean±SD. n=4~8. #P<0.05, ##P<0.01 vs AND sub-group.
讨 论
DN是糖尿病危险而严重的微血管并发症,其发病率呈逐年上升趋势,已成为人类健康的重要威胁。但因DN是多因素综合作用的结果,发病机制十分复杂,至今仍未完全明确。本课题组前期大量临床研究发现,G蛋白偶联受体自身抗体相关的自身免疫反应参与了DN的发病过程,并与DN患者蛋白尿水平关系密切[9],因而认为自身免疫机制在DN病程中也起了重要作用。其中,AT1-AA通过与RAS的关键因子AT1R胞外第二环肽上的氨基酸序列特异性结合而发挥AngⅡ样激动效应,且该激动效应不随时间而脱敏。目前普遍认为,各种组织损伤和生理紊乱所致隐蔽抗原暴露,机体自身免疫应答反应激活,均可使机体AT1-AA产生增多[10]。而在DN状态下,高糖毒性和RAS活化等因素可能通过循环或局部组织AngⅡ浓度升高或胞内信号通路变化而致AT1R的构象和密度改变,进而引起血清AT1-AA生成增多,但AT1-AA与DN肾脏结构损害的关系及作用机制,目前未见报道。
肾脏细胞凋亡在DN肾功能恶化过程中起重要作用,是DN肾损害的重要机制。本研究采用高糖高脂饮食联合小剂量STZ腹腔注射,然后继续高糖高脂喂养,任糖尿病大鼠自然进展为DN阶段而得到的DN模型,是目前公认的接近人类2型DN自然病程和代谢特点的大鼠模型。实验中,TUNEL染色检测DN大鼠肾脏细胞凋亡并定位发现,AT1-AA阳性DN大鼠肾脏细胞凋亡率明显高于AT1-AA阴性DN大鼠,表明AT1-AA在DN大鼠肾脏细胞凋亡过程中起到一定作用。大量肾脏细胞凋亡可直接导致尿蛋白水平显著增加,肾功能明显降低,这是本研究中AT1-AA阳性和阴性DN大鼠肾功能生化指标差异显著的原因,但AT1-AA致肾脏细胞凋亡的具体分子机制还需进一步探索。
内质网是蛋白质合成、加工和Ca2+储存及信号转导的重要场所,可通过ERS对各种因素所致的应激反应起调节作用[11]。早期ERS能激活未折叠蛋白反应,减少蛋白质合成,增加蛋白质折/叠降解来维持细胞内环境的稳定,在该反应过程中,内质网中的分子伴侣GRP78起着主要的调控作用而成为ERS的标志性蛋白[12]。然而过度ERS会通过其相关的3条凋亡途径:CHOP/GADD153基因激活转录,JNK磷酸化和caspase-12活化,促进应激受损细胞的凋亡[13]。其中,JNK是丝裂原活化蛋白激酶家族的重要成员,可在各种应激刺激(如高糖,氧化应激,G蛋白偶联受体激活等)作用下磷酸化而活化。p-JNK主要通过调控转录因子c-Jun的活性,上调促凋亡蛋白Bim、Bax等的表达引起细胞凋亡[14]。
研究发现,DN大鼠肾脏ERS反应与肾小管细胞的凋亡有关[15],且高糖可激活足细胞内ERS相关的多条凋亡途径,引起足细胞的损伤和凋亡[16],均表明过度ERS在DN肾脏细胞凋亡过程中起着重要作用。研究证实,AngⅡ能上调心肌细胞GRP78的表达,并介导心肌细胞的凋亡,而AT1R特异性拮抗剂可降低DN大鼠肾组织GRP78及p-JNK蛋白的表达,抑制JNK途径介导的肾脏细胞凋亡[6]。已知AT1-AA与AngⅡ均可通过AT1R而激活下游信号分子,并能经相似的信号通路发挥效应,故假设DN发电时,血清中持续存在的高滴度AT1-AA通过AT1R激活肾脏ERS反应,并活化JNK凋亡信号通路,使p-JNK凋亡蛋白的水平增高,促进肾脏细胞凋亡。但关于血清AT1-AA与肾脏ERS反应的研究,目前尚少。
本实验中,我们利用Western blotting技术对DN组和NC组大鼠肾脏GRP78和p-JNK蛋白进行定量分析。结果显示,DN组大鼠前述蛋白水平较NC组大鼠显著升高,提示DN组大鼠肾脏发生了ERS反应,并激活了ERS相关的凋亡信号通路,与国内外的报道一致。为明确AT1-AA对DN大鼠肾脏ERS的影响,我们进一步研究了AT1-AA阳性和阴性亚组DN大鼠的Western blotting结果,发现AT1-AA阳性DN大鼠ERS标志蛋白GRP78和凋亡蛋白p-JNK的表达均不同程度高于AT1-AA阴性DN大鼠。据此我们认为,DN大鼠血清AT1-AA与肾脏ERS关系密切,AT1-AA可调控ERS标志蛋白GRP78的转录,且持续存在的AT1-AA的病理性刺激,又能激活ERS相关的JNK凋亡通路;与AT1-AA阴性DN大鼠比较,AT1-AA阳性大鼠肾组织p-JNK蛋白表达上调,肾脏细胞凋亡增加,也说明AT1-AA能通过ERS的JNK凋亡途径促进肾脏细胞凋亡,证实了我们的假设。
综上所述,血清AT1-AA的肾脏损害作用与其所致的肾脏细胞凋亡有关;AT1-AA可诱导DN大鼠肾脏ERS反应,并上调p-JNK凋亡蛋白的表达,通过JNK通路促进肾脏细胞凋亡。这些研究结果可为进一步完善DN的免疫机制及通过干扰ERS中的自身免疫环节来防治DN提供全新的理论支持。
[参 考 文 献]
[1] Wallukat G, Homuth V, Fischer T, et al. Patients with preeclampsia develop agonistic antibodies against the angiotensin AT1receptor[J]. J Clin Invest, 1999, 103(7): 945-952.
[2] Fu ML, Herlitz H, Schulze W, et al. Autoantibodies against the angiotensin receptor (AT1) in patients with hypertension[J]. J Hypertens, 2000, 18(7): 945-953.
[3] 熊 京, 杨慧敏, 朱 峰, 等. 血管紧张素Ⅱ1型受体自身抗体在原发性肾小球疾病患者血清中的表达及意义[J]. 中国病理生理杂志, 2013, 29(8):1487-1491.
[4] 赵林双, 向光大, 乐 岭, 等. 糖尿病肾病患者血清抗AT1和α1受体抗体与肾小球滤过率的关系[J]. 华南国防医学杂志, 2012, 26(5):448-451.
[5] Arora MK, Singh UK. Molecular mechanisms in the pathogenesis of diabetic nephropathy: an update[J]. Vascul Pharmacol, 2013, 58(4):259-271.
[6] Lakshmanan AP, Thandavarayan RA, Palaniyandi SS, et al. Modulation of AT-1R/CHOP-JNK-Caspase12 pathway by olmesartan treatment attenuates ER stress-induced renal apoptosis in streptozotocin-induced diabetic mice[J]. Eur J Pharm Sci, 2011, 44(5):627-634.
[7] 杨 峰, 唐丽琴, 王风玲, 等.大鼠糖尿病肾病模型建立影响因素研究[J]. 安徽医药, 2012, 16(6):735-738.
[8] Liao YH, Wei YM, Wang M. Autoantibodies against AT1-receptor and α1-adrenergic receptor in patients with hypertension[J]. Hypertens Res, 2002, 25(4):641-646.
[9] 赵林双, 孙慧伶,向光大, 等. 美托洛尔联合贝那普利对β1、AT1受体自身抗体阳性的糖尿病肾病患者尿白蛋白的影响[J]. 中国糖尿病杂志, 2011,19(4): 260-262.
[10] Wang B, Liao YH, Zhou ZH, et al. Arterial structural changes in rats immunized by AT1-receptor peptide[J]. Heart Vessels, 2005, 20(4):153-158.
[11] 姚树桐,秦树存. 内质网应激在动脉粥样硬化发生、发展和防治中的作用[J]. 中国病理生理杂志, 2014, 30(2):364-368,384.
[12] Kim R, Emi M, Tanabe K, et al. Role of the unfolded protein response in cell death[J]. Apoptosis, 2006,11(1):5-13.
[13] Fribley A, Zhang K, Kaufman RJ. Regulation of apoptosis by the unfolded protein response[J]. Methods Mol Biol, 2009, 559:191-204.
[14] Okuno S, Saito A, Hayashi T, et al. The c-Jun N-terminal protein kinase signaling pathway mediates Bax activation and subsequent neuronal apoptosis through interaction with Bim after transient focal cerebral ischemia[J]. J Neurosci, 2004, 24(36):7879-7887.
[15] Sun HL, Sun L, Li YY, et al. ACE-inhibitor suppresses the apoptosis induced by endoplasmic reticulum stress in renal tubular in experimental diabetic rats[J]. Exp Clin Endocrinol Diabetes, 2009, 117(7):336-344.
[16] Cao Y, Hao Y, Li H, et al. Role of endoplasmic reticulum stress in apoptosis of differentiated mouse podocytes induced by high glucose[J]. Int J Mol Med, 2014, 33(4):809-816.

