植物生长物质对蓝猪耳二长雄蕊运动的影响
蔡 丹, 孙姝兰
(华南师范大学生命科学学院,广东植物发育生物工程重点实验室,广州 510631)
同一朵花的雄蕊在形态、大小、颜色以及功能等方面有显著的区别,称为异型雄蕊[1].异型雄蕊的作用包括保护繁殖用的花粉,促进异花授粉[2].在开花过程中,异型雄蕊也会出现相应的花部运动行为,即雄蕊向上弯曲和花丝伸长等.在对异型雄蕊运动的适应性意义的探究上,有学者认为花发育过程中通过花部运动这种行为具有实现延迟自交的意义[3].延迟自交是一种被广泛报道的具有生殖适应性的繁殖机制,其保证了植物在传粉者稀少情况下的种子生产,但传粉者丰富时,又允许异交优先发生[4].雄蕊运动指在自身能量支持下雄蕊发生的主动运动.研究发现,大根槽舌兰雄蕊的花丝能主动旋转360°,将花药和花粉带到自花柱头上实现自交授粉[5].在玄参科Collinsia中开花晚期雄蕊弯向柱头的运动,实现“延迟自交”,能够达到生殖保障的目的[6].
蓝猪耳是玄参科紫色翼萼属的一年生草本植物,是研究胚囊受精的模式植物同时也是场地布置的花卉品种之一. 作者发现室内培养的蓝猪耳在自然条件下不能结实; 而且开花后二长雄蕊存在伸长翻转的运动现象.
在拟南芥中花丝和花柱的伸长与生长素和赤霉素2种激素信号途径密切相关.比如在影响生长素极性运输的双突变体atmdr1/atpgp1中,花丝不能正常伸长到与柱头触碰,无法正常进行自花授粉[7].在抗生长素突变体axr1中,花丝不能正常伸长导致了突变体的育性降低[8].GA缺乏的拟南芥突变体gal-3其雌雄蕊皆变短,雄蕊过短无法进行自交授粉[9].GAI(GA信号途径中的一个负调控因子,属于DELLA基因)功能获得性突变基因在拟南芥和烟草雄蕊中的异源定位表达延迟花丝伸长引起不育[10].
本文通过施加外源GA和 NAA,探索其对蓝猪耳二长雄蕊的伸长和翻转的影响,进一步探讨内源GA的作用. 利用PAC进行处理,PAC是GA生物合成的抑制剂,抑制植物的生长[11-13].为了探究NAA的作用方式,利用生长素运输抑制剂TIBA外施处理,通过施加植物生长物质和相关抑制剂的作用,为揭示蓝猪耳二长雄蕊翻转的生理生化机制提供依据.
1 材料与方法
1.1 实验材料
蓝猪耳(ToreniafournieriLinden)种子由华南师范大学生命科学院宾金华教授惠赠.将华南师范大学生命科学院兰花中心种植的深蓝色蓝猪耳植株单株收种.
种子播种在含有培养土(购自广东省顺德市翠药有限公司)的小花盆中,培养室光周期为16 h光照/8 h黑暗,湿度70%~80%,温度23 ℃±1 ℃,光照强度60 μmol/(m2·s).播种2周内每天浇水1次;2周后,把幼苗单株移栽至含有混合土(蛙石+培养土)的花盆中,放在光照培养室中继续种植,每2~3 d浇水1次.
1.2 实验方法
1.2.1 植物生长物质和相关抑制剂的处理 随机选取即将开放的花蕾(苞片微裂,刚见蓝) 各取8~10朵为一组,共取5组,分别用GA3(20 μmol/L)、NAA(0.1 μmol/L)、PAC(20 μmol/L)和TIBA(20 μmol/L)及H2O(对照组)每3 h喷洒花蕾,开花后喷洒花朵内的雄蕊.GA3、NAA和PAC购于Sigma公司,TIBA为广州鼎国产品.
1.2.2 记录二长雄蕊伸长和翻转所需时间统计 从花朵(四瓣均展开)开放时进行拍照,记录开花时间,剪除翼瓣后,将数码相机固定位置进行每间隔 30 min侧面拍照, 图象采用photoshop软件进行分析.根据图像记录的二长雄蕊与柱头的相对位置关系来确定伸长期和翻转期,从开花起始至二长雄蕊的花药与花丝基本平行,且花丝伸长变慢时(图1 A-E)界定为伸长期,之后花药开始快速翻转直到完成,此时花丝基本不伸长(图1 F-H),界定这段时间为翻转期,根据照片计算二长雄蕊伸长和翻转所需时间.
1.2.3 数据分析 用Excel进行数据的统计,用T检验进行显著性分析.
2 结果与分析
2.1 蓝猪耳在开花过程中二长雄蕊的翻转运动
蓝猪耳初始开花时柱头位于二长雄蕊后方,二短雄蕊与二长雄蕊以及花冠管平行,而且从高度上二长雄蕊在最上方,雌蕊柱头位于中间,最下方则是二短雄蕊(图1A).从花蕾完全开放到二长雄蕊翻转前,二长雄蕊快速伸长,雄蕊进行翻转(图1A-E),在此时期,虽然雄蕊同时具备翻转和伸长,但其长度增加较快,而且翻转角度较小,故将此时期定为雄蕊整个翻转过程的伸长期,平均为26 h左右.当二长雄蕊伸长到一定长度后,雄蕊开始迅速翻转(图1F-H),同时伴随着雌蕊的伸长.当雄蕊翻转到雌蕊上方时,雌蕊已不再伸长,但二长雄蕊仍能继续翻转,长度继续增加,等二长雄蕊的长度与角度都不发生改变时,雄蕊完成翻转(图1H),这个时期,雄蕊长度增加较小,翻转速度较快,将此时期定为翻转期.从二长雄蕊翻转期平均为20 h左右.
2.2 GA3促进蓝猪耳二长雄蕊翻转运动
GA3在蓝猪耳二长雄蕊的伸长期和翻转期起促进作用(图2),使其翻转所用总时间缩短.GA3处理后,二长雄蕊的伸长期平均用时为13.7 h,相比于对照组(26.9 h)缩短了49.1%; GA3处理的二长雄蕊的翻转期平均用时为12.61 h,比对照组(19.42 h)显著缩短了35.1%.说明GA3明显促进开花后二长雄蕊伸长和二长雄蕊翻转的整个过程.
用GA生物合成抑制剂PAC处理蓝猪耳后,其二长雄蕊伸长期平均时间为60.01 h(图3),明显使伸长期比对照延长了123.1%.同时,翻转期平均用时为51.5 h(其中处理后不再翻转的二长雄蕊没有计算在内),比对照组显著延长了165.3%.PAC明显抑制蓝猪耳开花乃至翻转结束的整个过程.
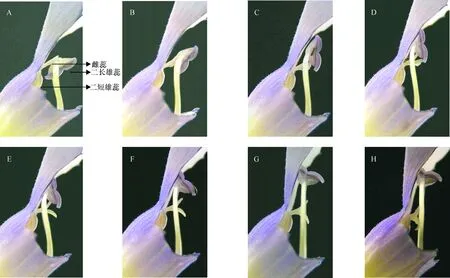
A-E:伸长期;F-H:翻转期
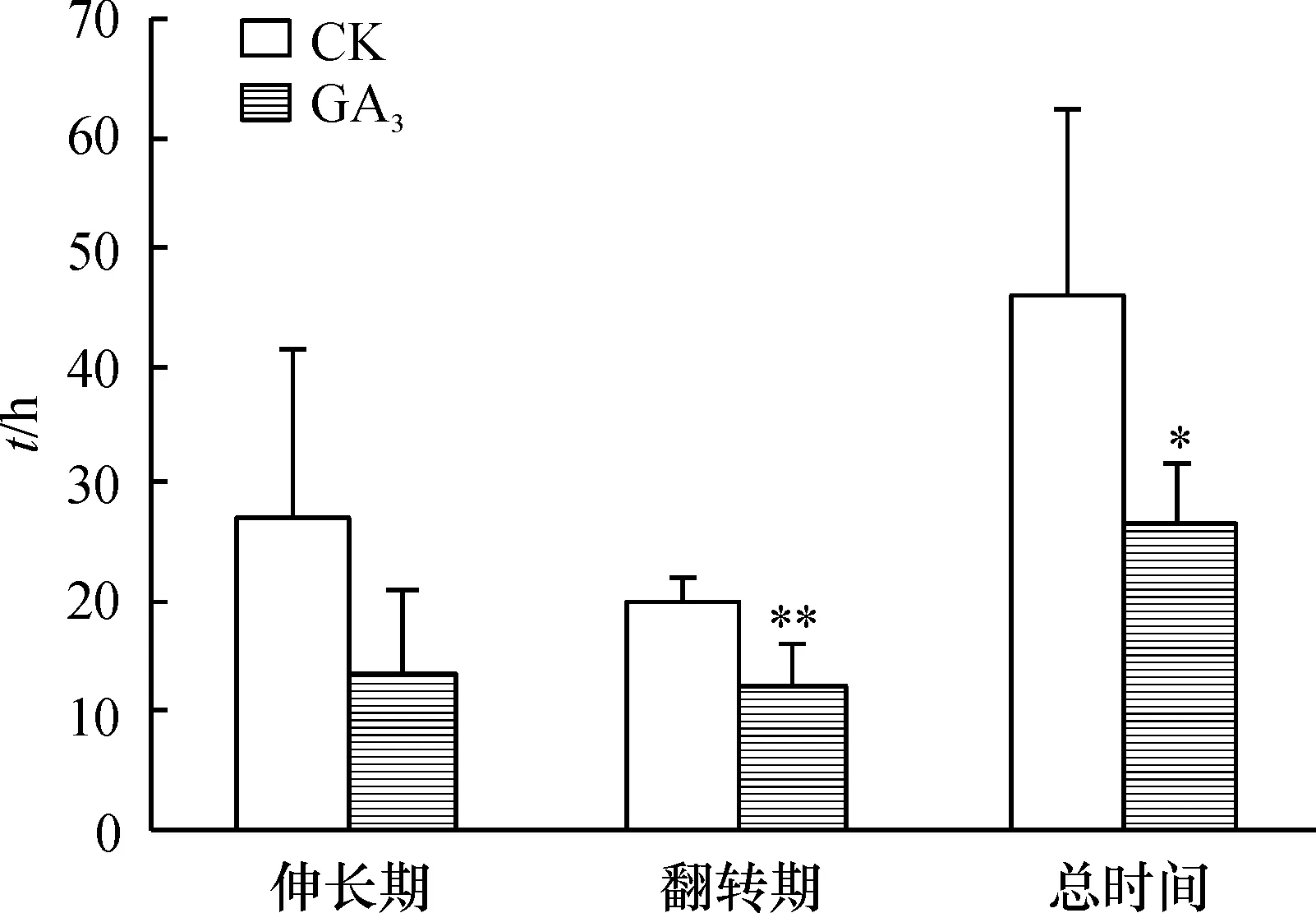
图2 GA3促进蓝猪耳二长雄蕊翻转的作用
Figure 2 The promotion effect of GA3on didynamous retroflexion
注:*P<0.05;**P<0.01,下图同
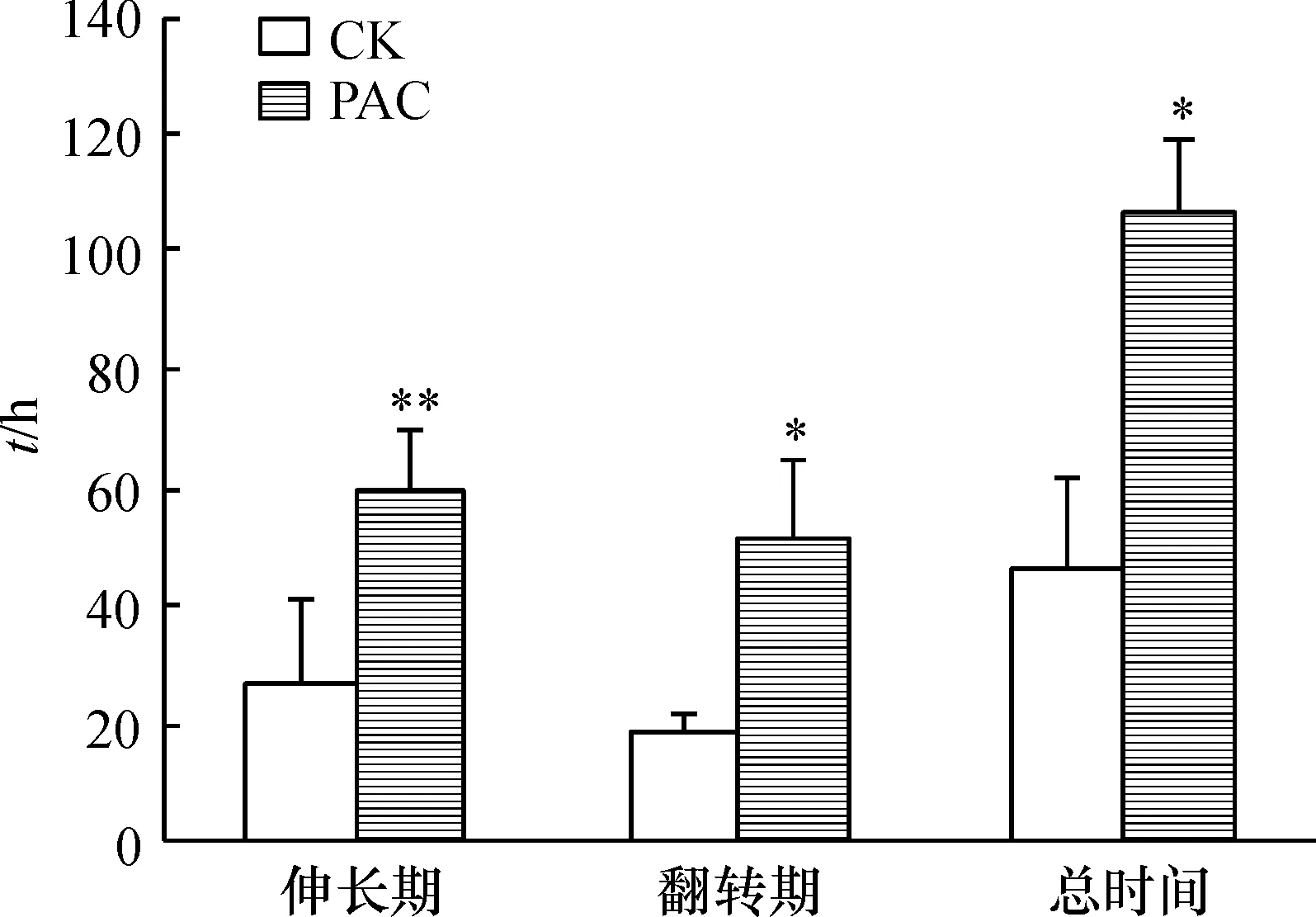
图3 PAC对蓝猪耳二长雄蕊翻转的影响
同时约有25%的蓝猪耳经PAC处理后,二长雄蕊的伸长速度慢.在雄蕊花丝发生大幅度伸长后,其花药仍未翻转.当花瓣开始枯萎与凋落时,其二长雄蕊始终未发生翻转.
以上结果说明内源GA水平可能促进二长雄蕊的伸长和翻转.
2.3 NAA对蓝猪耳二长雄蕊翻转运动的作用
NAA处理蓝猪耳使得二长雄蕊翻转伸长期所用时间比对照组缩短了35.43%(图4).而二长雄蕊翻转期,NAA处理后(平均用时9.02 h)缩短该过程所用时间的53.6%,具有显著性差异.总体来说,NAA使整个过程所用时间缩短到平均26.39 h,缩短幅度也较大,缩短为原来的57%,差异显著.说明NAA对蓝猪耳二长雄蕊的翻转具有促进作用.
为了进一步了解NAA促进蓝猪耳二长雄蕊翻转的作用,用生长素运输抑制剂TIBA处理蓝猪耳,观察其对雄蕊翻转的作用.结果表明,TIBA对二长雄蕊的伸长具有抑制作用,使伸长期平均时间延长到40.95 h, TIBA使雄蕊翻转期延长幅度达到了对照组的69.7% (图5),说明TIBA的作用主要集中于抑制二长雄蕊的翻转.
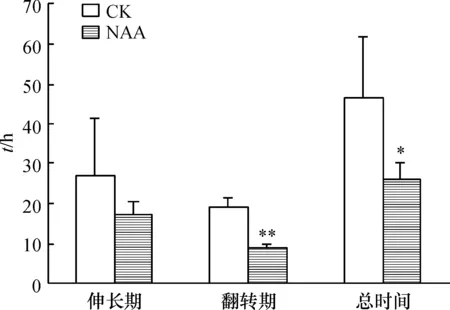
图4 NAA促进蓝猪耳二长雄蕊翻转的影响
Figure 4 The promotion effect of NAA on didynamous retroflexion

图5 TIBA对蓝猪耳二长雄蕊翻转的影响
3 讨论
有报道表明在玄参科以及其他科中存在雄蕊和雌蕊的运动现象[6,14],但是在蓝猪耳中这种雄蕊伸长并花药翻转的现象未见报道.这种运动在生物学上主要是为了促进异交,有些物种中也为了实现延迟自交,在蓝猪耳中通过二长雄蕊的翻转运动使得花药暂时远离柱头,推测与促进异交有关.目前,对于雌雄蕊的运动现象了解较少.
赤霉素促进细胞扩展和细胞分裂,生长素也促进细胞扩展,而且生长素的不均分布促进根茎等侧向或者弯曲生长[15],因此二长雄蕊的伸长与翻转很有可能与这2种激素密切相关. 结果表明,GA3和NAA单独处理对蓝猪耳二长雄蕊的运动过程都起到促进作用,但两者促进二长雄蕊运动的主要作用时期有所不同.在伸长期,NAA处理后平均用时为17.37 h,而GA3处理则只需要13.7 h,相比对照处理的二长雄蕊伸长时间26.9 h,两者之间的促进效果有显著差异,其中GA3对雄蕊伸长的作用较大.而在翻转期,NAA对雄蕊花药翻转作用更大, NAA 与GA3影响的效果之间具有显著性差异,说明GA3促进翻转可能在伸长期,而NAA促进翻转的主要作用在于雄蕊的翻转期.
NAA处理明显促进雄蕊翻转期,可能是内源IAA在雄蕊翻转部位上下两侧分布不均,外施NAA可能使上下两侧IAA含量的浓度差加大,导致上下两侧伸长速率差异更大,其中上面一侧浓度更高生长更慢,下面一侧浓度较低生长更快,表现为其翻转速率也加快.与此相一致,生长素诱导的SAUR32/AAM1过量表达能够下胚轴顶端弯钩打开[16],而SAUR63能够促进花丝伸长[17].TIBA处理导致伸长期和翻转期都延长,其中翻转期的延长幅度更大,说明生长素的运输对蓝猪耳二长雄蕊的翻转非常重要,NAA的作用可能与运输有关.
已知PAC抑制GA的生物合成,通过阻碍贝壳杉烯向贝壳杉烯醇的氧化.经PAC处理后的蓝猪耳二长雄蕊其翻转期延长,甚至部分材料不翻转,说明PAC能够抑制雄蕊的翻转.可能的原因是PAC除阻抑内源GA的生物合成而延缓其生长外,从而达到其延缓翻转的目的.
植物激素调控花器官的发育相互作用,如GA和生长素分别在调节细胞扩大和组织分化两方面有相互叠加的作用[18].同时,生长素促进GA合成和 GA信号转导[19],GA在发育过程中也调控生长[20].激素对雄蕊翻转的调控不仅取决于某种激素含量变化,更重要的在于激素间平衡.对蓝猪耳用外源植物生长调节剂处理,可能改变植物内源激素间平衡,影响雄蕊翻转的表现.对其作用机制有待进一步认识,结合转录组表达谱分析将有助于揭示其分子机制.
参考文献:
[1] Dulberger R. The floral biology of Cassia didymobotrya andC.auriculata(Caesalpinoideae)[J]. American Journal of Botany, 1981, 68(10): 1350-1360.
[2] 罗中莱,张奠湘.异型雄蕊的研究进展[J].热带亚热带植物学报,2005, 13(6): 536-542.
Luo Z L, Zhang D X. A review of heteranthery in flowering plant[J]. Journal of Tropical and Subtropical Botany, 2005, 13(6):536-542.
[3] 任明迅.花内雄蕊分化及其适应性意义[J].植物生态学报, 2005, 33(1): 222-236.
Ren M X. Intrafloral stamen differentiations and their adaptive significances[J]. Chinese Journal of Plant Ecology, 2009, 33(1): 222-236.
[4] 阮成江,钦佩,尹增芳.繁殖保障和延迟自交的研究进展[J].生态学报,2006, 26(1): 195-204.
Ruan C J, Qin P, Yin Z F. Advancements in reproductive assurance and delayed selfing[J]. Acta Ecologica Sinica, 2006, 26(1): 195-204.
[5] Liu K W, Liu Z J, Huang L Q, et al. Self-fertilization strategy in an orchid[J]. Nature, 2006, 441: 945-946.
[6] Kalisz S, Vogler D W, Finer M, et al. The mechanism of delayed selfing inCollinsiaverna(Scrophulariaceae)[J]. American Journal of Botany, 1999, 86: 1239-1247.
[7] Noh B, Murphy A S, Spalding E P. Multidrug resistance-like genes ofArabidopsisrequired for auxin transport and auxin-mediated development[J]. Plant Cell, 2001, 13:2441-2454.
[8] Lincoln C, Britton J H, Estelle M. Growth and development of theaxr1 mutants ofArabidopsis[J]. Plant Cell, 1990, 2:1071-1080.
[9] Cheng H, Qin L, Lee S, et al. Gibberellin regulatesArabidopsisfloral development via suppression of DELLA protein function[J]. Development, 2004, 131:1055-1064.
[10] Huang S, Cerny R E, Qi Y L, et al. Transgenic studies on the involvement in of cytokinin and gibberellin in male development[J]. Plant Physiology, 2003, 131: 1270-1282.
[11] Davis T D, Steffens G L, Sankhla N. Triazol plant growth regulators[J]. Horticultural Reviews, 1988, 10:151-188.
[12] 唐兵,李庆平,龙伟,等. 植物生长抑制剂对烤烟烟苗生理主成分的影响分析[J].华南师范大学学报:自然科学版,2013,45(2):92-96.
Tang B, Li Q P, Long W, et al. Analysis of plant growth regulation on the physiological principal Components in flue-cured tobacco seedings[J]. Journal of South China Normal University: Natural Science Edition, 2013,45(2):92-96.
[13] 李春俭. 生长素极性运输抑制剂[J].北京农业大学学报,1995,21(S1):89-93.
Li C J. Polar auxin transport inhibitors[J]. Acta Agriculturae Universitatis Pekinensis, 1995,21(S1):89-93.
[14] Li Q J, Xu Z F, Kress W J, et al. Flexible style that encourages outcrossing[J]. Nature, 2001, 410: 432
[15] Frigerio M, Alabadi D, Perez-Gomez J. et al. Transcriptional regulation of gibberellin metabolism genes by auxin signaling in Arabidopsis[J]. Plant Physiology, 2006, 142: 553-563.
[16] Park J E, Kim Y S, Yoon H K, et al. Functional charac-terization of a small auxin-up RNA gene in apical hook development in Arabidopsis[J]. Plant Science, 2007, 172: 150-157.
[17] Chae K, Isaacs C G, Reeves P H, et al. Arabidopsis SMALL AUXIN UP RNA63 promotes hypocotyl and stamen filament elongation[J]. The Plant Journal, 2012, 71: 684-697.
[18] Frigerio M, Alabadi D,Perez-gomez J, et al. Transcriptional regulation of gibberellin metabolism genes by auxin signaling inArabidopsis[J].Plant Physiology,2006, 142: 553-563.
[19] 张国华,张艳洁,丛日晨,等.赤霉素作用机制研究进展[J].西北植物学报,2009, 29(2): 412-419.
Zhang G H, Zhang Y J, Cong R C, et al. Advances on gibberellins mechanism[J]. Acta Botanica Boreali Occidentalia Sinica, 2009, 29(2): 412-419.
[20] Carrera E, Ruiz-Rivero O, Peres L E, et al. Characterization of theproceratomato mutant shows novel functions of the SlDELLA protein in the control of flower morphology, cell division and expansion, and the auxin-signaling pathway during fruit-set and development[J]. Plant Physiology, 2012, 160: 1581-1596.

