形觉剥夺性近视/弱视对小鼠高血糖视网膜微血管病变影响的形态学观察
,
(1.成都军区总医院眼科,四川 成都 610083;2.第三军医大学西南医院西南眼科医院,重庆 400038)
高度近视合并糖尿病的患者一般不易发生糖尿病视网膜病变(DR),或不会进展成为增值性糖尿病视网膜病变。目前,高度近视所致视网膜血管网微结构改变尚缺少相关研究报道。而高度近视是否通过稳定血-视网膜内屏障而影响DR早期改变,也有待动物实验研究证实。因此,本研究拟观察单纯高血糖动物及高血糖合并形觉剥夺性近视/弱视动物模型眼视网膜在DR早期表现(血-视网膜内屏障损伤)中的变化。本研究通过过碘酸-雪夫氏液(PAS)染色、免疫荧光标记观察比较高血糖小鼠与高血糖合并形觉剥夺的小鼠视网膜微血管形态学的改变。
1 材料与方法
1.1 实验材料
链脲菌素(STZ)由美国Invitrogen公司提供,胰蛋白酶由美国Alexis公司提供,雪夫氏液、过碘酸、HE试剂均由美国BBI公司提供,鬼笔环肽-FITC由美国Sigma公司提供,DAPI试剂由北京碧云天公司提供,血糖仪及试纸均为罗氏公司产品,共聚焦荧光显微镜为Leica公司产品,光学显微镜为日本Olympus公司产品。
1.2 实验方法
1.2.1 形觉剥夺性近视/弱视小鼠模型的建立及分组 BALB/cJ小鼠(1月龄)10只(购自第三军医大学实验动物中心),作为正常对照组(Ⅰ组),BALB/cJ乳鼠(生后10 d)40只,分为2组,每组20只,其中10只用于PAS染色,10只用于鬼笔环肽-FITC免疫荧光双标观察。Ⅱ组为高血糖组,Ⅲ组为高血糖合并形觉剥夺性近视/弱视组。乳鼠均由母鼠喂养,成年后(生后30 d)即给予正常饲养;高血糖组小鼠于出生后30 d经左下腹小量、多次注射STZ;高血糖合并形觉剥夺性近视/弱视组于生后10 d缝合右眼睑,生后30 d经左下腹小量、多次注射STZ。3组小鼠自生后37 d起每日1次取尾血测量血糖,生后第72~77天龄时,称量体质量,乙醚麻醉,于暗室下检影验光,获得小鼠眼球屈光度值。完成以上测量后,处死小鼠并取出视网膜置于4%多聚甲醛中固定。
1.2.2 小鼠视网膜血管网铺片及染色 ①视网膜血管网消化和铺片:取固定的视网膜,置于蒸馏水中浸泡;将视网膜置于pH 7.8的3%胰酶-tris缓冲液中,37 ℃消化至视网膜表层组织大部松脱;取出视网膜,浸泡于蒸馏水中,清洗直至仅剩半透明组织;将该组织转移至载玻片上,烘片1 h。②PAS染色实验:配置PAS溶液;0.5%过碘酸氧化视网膜血管网铺片10 min;冲洗2次,蒸馏水冲洗1次;将载玻片浸入schiff液中,避光20 min;亚硫酸钠滴洗铺片2次,蒸馏水洗1次;苏木精淡染15 s后,二甲苯透明;封片保存。③鬼笔环肽-FITC、DAPI荧光双标实验:将鬼笔环肽-FITC加入0.1%PBS中稀释至5 μg/mL;每张铺片滴加1% Triton 20 μl,浸泡破膜1 h;蒸馏水冲洗并晾干;每张铺片滴加稀释的鬼笔环肽-FITC 20 μl,置于避光湿盒中,孵育3 h;避光条件下蒸馏水冲洗铺片并晾干;每张血管网铺片滴加DAPI 20 μl,置于湿盒中,避光,孵育5 min;避光,蒸馏水冲洗血管网铺片并晾干,抗荧光淬灭封片剂封片。
1.2.3 小鼠视网膜血管网内皮细胞、周细胞计数 光学显微镜下周细胞核位于血管外,呈短棒状,染色较深,内皮细胞核位于血管内,呈长梭状,染色较浅。激光共聚焦层扫时,每张视网膜血管网铺片采集9个点,可见周细胞核位于血管周围,呈短棒状或小三角状,有时可与内皮细胞核重叠,内皮细胞核位于血管内,呈长梭状或棒状。
1.3 统计学方法
2 结果
2.1 PAS染色下周细胞与内皮细胞
视网膜血管网铺片上(图1)周细胞核呈短棒状,染色较深,位于血管周围,内皮细胞核呈长梭形,染色较浅,位于管腔内。高血糖组铺片可见无细胞结构血管。高血糖合并形觉剥夺组小鼠视网膜铺片则较少见到无细胞结构血管。
高血糖组小鼠内皮细胞/周细胞比值(图2)较对照组显著增高(P<0.01),说明高血糖组小鼠视网膜血管网周细胞凋亡显著增多,高血糖合并形觉剥夺性近视/弱视组周细胞与内皮细胞比值较单纯高血糖组有统计学差异(P<0.01),说明形觉剥夺性近视/弱视组周细胞凋亡减少。
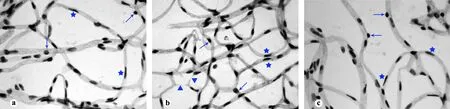
a:正常对照组;b:高血糖组;c:高血糖合并形觉剥夺性近视/弱视组;↑:周细胞核;★:内皮细胞核;▲:无细胞结构血管
图1小鼠视网膜血管网铺片PAS染色形态学观察(×1000)
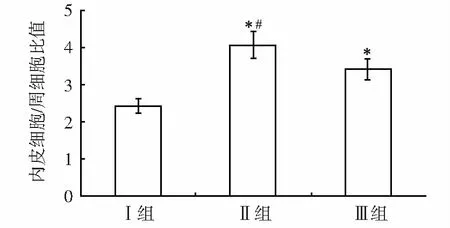
*:与Ⅰ组比较,P<0.01;#:与Ⅲ组比较,P<0.01
2.2 鬼笔环肽-FITC/DAPI染色形态学观察
3小鼠鬼笔环肽-FITC/DAPI染色下视网膜血管网形态学观察见图3。鬼笔环肽-FITC/DAPI染色与PAS染色的形态学比较见图4。图4b中左下方箭头(↑)所指为一个与内皮细胞核平行的周细胞核,形状不典型,为类似于内皮细胞核的梭形,但在共聚焦扫描下可以清晰地看到该细胞突出于血管腔之外;左上方箭头(↑)所指为一个位于血管背面,难以辨认的周细胞核,但通过层扫可以清楚地看到其荧光在血管腔之外,形状呈典型的短棒状;右上方箭头(↑)所指为一个与内皮细胞核重叠的周细胞核,在共聚焦扫描三维重建中可以看到此处实际上有一个较长的内皮细胞核和一个突起的短棒状周细胞核。
3 讨论
血-视网膜内屏障是DR主要的渗漏点[1]。血-视网膜内屏障损伤在DR早期即可出现,主要表现为毛细血管基底膜增厚、周细胞凋亡等[2]。在胚胎血管成熟过程中,周细胞被认为决定着从新生血管成熟的过程,内皮细胞不能单独完成血管形成过程[3]。血管形成后,周细胞通过多种细胞因子途径被募集到新生的血管周围,周细胞募集抑制将引起血管的异常重构[4-5],失去接触抑制的内皮细胞肥大,向管腔突出,堵塞管腔形成无细胞结构血管,进而导致视网膜无灌注区形成[6]。而内皮细胞有丝分裂抑制的减弱,可导致微血管瘤形成。因此,周细胞凋亡被认为是高血糖视网膜损伤的特征性表现。视网膜毛细血管周细胞丧失可表现为血管内皮细胞/周细胞比值升高。因此本研究使用内皮细胞/周细胞比值来间接反映周细胞的凋亡,并观察到内皮细胞/周细胞比值明显上升出现在小鼠实验性高血糖早期。证实了在高血糖早期,已经出现了血-视网膜内屏障损伤。

a:正常对照组;b:高血糖组;c:高血糖合并形觉剥夺性近视/弱视组;↑:周细胞核;★:内皮细胞核;▲:无细胞结构血管
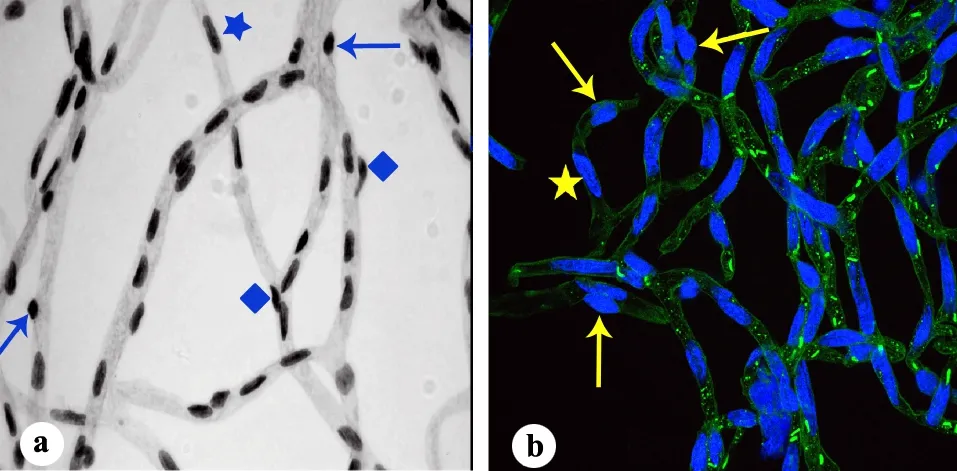
a:PAS染色;b:鬼笔环肽-FITC/DAPI染色;↑:周细胞核;★:内皮细胞核;◆:难以辨别的细胞核
图4小鼠视网膜血管网周细胞、内皮细胞PAS染色及鬼笔环肽-FITC/DAPI染色(×1000)
Lim等[7]通过一项692例的临床观察发现,同时患有高度近视的糖尿病患者,较仅有糖尿病的患者其增殖性DR发生率明显降低,其中,一眼患有高度近视,另一眼无明显屈光不正的糖尿病患者,其患有高度近视的一眼不发生DR或仅发生非增殖性DR,这或许提示高度近视对DR的发生发展有延缓作用。这种作用可能与高度近视患者眼轴增长,视网膜血流量减少,对血管的破坏也相应减少有关,也可能与高度近视患者变薄的视网膜需氧量更少有关[8-9]。然而,另一些临床观察认为,高度近视发病率较高的人群同样也是DR高发的人群,提示高度近视与糖尿病视网膜病变并无相关性[10]。目前,高度近视对糖尿病视网膜病变的保护作用尚缺乏动物实验证实。本研究证实形觉剥夺组小鼠视网膜周细胞丢失轻于高血糖组,提示形觉剥夺性近视/弱视合并高血糖组小鼠血-视网膜内屏障损伤较单纯高血糖组更轻,为进一步研究形觉剥夺性近视/弱视对高血糖视网膜损伤保护作用的可能机制和途径打下基础。但由于小鼠体质量轻,持续高血糖导致其死亡率明显上升。因此,本实验中观察时间短,加长病程的观察还有待进一步研究。另外,经腹腔小量多次注射STZ造成高血糖被认为是Ⅰ型糖尿病的经典模型,而人类糖尿病视网膜病变多发生在Ⅱ型糖尿病患者。因此,Ⅱ型糖尿病合并形觉剥夺性近视/弱视动物模型的视网膜微血管改变尚需进一步研究。
此外,传统实验中周细胞的识别主要依赖于其形态及与血管的毗邻关系,但周细胞的排列、长度、形态多变,因此PAS染色在光镜下不能很好地区分周细胞和内皮细胞。周细胞起源和功能具有多样性,目前也没有特异性的周细胞标志物。因此,本实验采用了肌动蛋白抗体鬼笔环肽和DAPI两种无特异的抗体双标视网膜血管网,并采用激光共聚焦层扫后三维重建来计数周细胞和内皮细胞。有利于观察一些形态和位置不典型的周细胞核。该方法目前尚未见文献报道。
[参考文献]
[1] Kaur C,Foulds WS,Ling EA.Blood-retinal barrier in hypoxic ischaemic conditions:basic concepts,clinical features and management[J].Prog Retin Eye Res,2008,27:622-647.
[2] Laura,Hammes HP.Pericytes and the pathogenesis of diabetic retinopathy[J].Horm Metab Res,2005,37(Suppl 1):39-43.
[3] Frederick Pfister,Yuxi Feng,Hans-Peter Hammes.Pericyte Loss in the Diabetic Retina[J].Contemporary Diabetes:Diabetic Retinopathy,2008,(2):245-264.
[4] Egginton S,Zhou AL,Brown MD,et al.The role of pericytes in controlling angiogenesis in vivo[J].Adv Exp Med Biol,2000,476:81-99.
[5].Wakui S,Yokoo K,Muto T,et al.Localization of Ang-1,-2,Tie-2,and VEGF expression at endothelial-pericyte interdigitation in rat angiogenesis[J].Lab Invest,2006,86(11):1172-1184.
[6] Hammes HP,Lin J,Rennr O,et al.Pericytes and the pathogenes is of diabetic retinopathy[J].Diabetes,2002,51(10):3107-3112.
[7] Lim LS,Lamoureux E,Saw SM,et al.Are myopic eyes less likely to have diabetic retinopathy?[J].Ophthalmology,2010,117:524-530.
[8] Ganesan S,Raman R,Reddy S,et al.Prevalence of myopia and its association with diabetic retinopathy in subjects with type II diabetes mellitus:A population-based study[J].Oman J Ophthalmol,2012,5:91-96.
[9] Yang KJ,Sun CC,Ku WC et al.Axial length and proliferative diabetic retinopathy[J].Optom Vis Sci,2012,89:465-470.
[10] Xie XW,Xu L,Wang YX,et al.Prevalence and associated factors of diabetic retinopathy.The Beijing Eye Study 2006[J].Graefes Arch Clin Exp Ophthalmol,2008,246:1519-1526.

