稻田中扑草净的消解规律及最终残留量研究
王鑫宏,侯志广,赵晓峰,逯忠斌
(吉林农业大学资源与环境学院,吉林 长春 130118)
近年来,随着人们对食品安全及环境问题关注度的逐渐提高,农药在环境及生物中的残留问题也越来越引起人们的关注[1-3].目前,世界各国已开始制定了各种农药在作物中的最大残留限量标准,即MRL值(maximum residue limits),用以规范农药的应用,保障食品安全.同时,农药在环境中的残留也会影响食品安全以及后茬作物的生长.
扑草净(prometryn)是选择性内吸传导型三氮苯类除草剂,杀草谱广,主要用于防除与小麦、棉花、水稻、蔬菜等作物伴生的一年生禾本科杂草及阔叶杂草.中国作为水稻的主要生产国家[4],稻田中应用的农药在环境中的消解规律以及最终残留问题显得尤为重要.目前,有关扑草净的研究多集中于扑草净的分析测定方法、在土壤中的吸附解吸规律以及生物降解等方面[5-7],如Sergio等通过计算扑草净等三嗪类除草剂的拉曼光谱范围发现此类除草剂主要在芳环上N原子处发生反应[8];Evgenidou等则研究了水相中扑草净在紫外光下的降解特性[9].国内对于扑草净的研究特别是其消解动态和最终残留问题尚未见报道,我国也尚未制定扑草净的MRL值.针对上述问题,本文研究了扑草净在水稻田(田水和土壤)及水稻体内的残留变化趋势并对其最终残留量进行了分析,研究结果可为评价扑草净的环境安全性和制定扑草净在水稻中的MRL值等方面提供科学的依据.
1 材料与方法
1.1 仪器与试剂
Agilent 7890A-5975CMSD气相色谱-质谱联用仪,DS-1型组织捣碎机,SHZ-88型恒温水浴振荡机,FW-100型谷物粉碎机,KQ-250DE型超声波清洗器,BUCHI R-200型旋转真空蒸发器;分液漏斗、具塞量筒等各种玻璃器皿.
扑草净标准品(纯度98.8%,Sigma公司出品);乙腈、丙酮、正己烷、石油醚、无水硫酸钠、弗罗里硅土、活性炭均为分析纯;助滤剂为进口分装.
1.2 田间试验方法
选取吉林省长春市、黑龙江省海伦市、湖南省长沙市三地进行田间试验,按照《农药残留试验准则》和《农药登记残留田间试验标准操作规程》设计试验小区[10-11].每个小区面积设定为30m2,试验设3个处理,即25%扑草净(WP)2.250kg/hm2(推荐田间施用剂量)、25%扑草净(WP)3.375kg/hm2(1.5倍推荐剂量)和空白对照,每个处理3次重复.各小区之间设定1m宽的保护行,施药方法为拌细土撒施.
在水稻分蘖期进行消解动态试验,采取3.375kg/hm2的25%扑草净(WP)作为施药剂量,均匀撒施在保留3~5cm水层的水稻田.施药后2h按0,1,3,5,7,14,20,30,40,60d及收获期在每个小区取5个样点采集稻田土壤、水和水稻植株样品,混匀后四分法取样.各样品采集后均贮存于-20℃冰箱中待测.
最终残留试验采用2.250kg/hm2(推荐剂量)和3.375kg/hm2(1.5倍推荐剂量)两个处理,在水稻收获期分别采集土壤、水稻植株和籽粒样品,施药方式和样品采集方法同消解动态试验,其中籽粒样品采集量为500g.
1.3 分析方法
称取一定量的样品(土壤50g,水稻植株、糙米和稻壳均为20g且需粉碎或捣碎)置于具塞三角瓶内,加蒸馏水20mL和乙腈80mL振荡提取(植株样品仅加100mL乙腈),提取时间为60min,在铺有助滤剂的布氏漏斗中减压抽滤,收集滤液转移到装有6g NaCl的具塞量筒中,振荡后静置,使水相和乙腈相充分分层.量取田水50mL,转入分液漏斗.
土壤、植株、糙米及稻壳样品分析:吸取上层清液40mL(植株50mL),于40℃下旋转蒸发至近干,用2mL正己烷定容待净化.用V石油醚/V丙酮=9∶1的混合溶液60mL淋洗层析柱,收集全部淋洗液,在旋转蒸发器上(40℃)减压浓缩至干,土壤用正己烷定容至5mL,其余定容至2mL,待测.
水样分析:在水中加入10%NaCl溶液20mL,然后用三氯甲烷萃取3次,于40℃下旋转蒸发至干,用5mL正己烷定容,待测.
色谱柱:HP-5MS弹性石英毛细管柱,30m×0.25mm×0.25μm;进样口温度:280℃;柱温箱温度:260℃.升温程序为100℃保持1min,之后以25℃/min的速率升至180℃并保持10min,随后仍以25℃/min的速率升至260℃并保持10min.载气类型为He,载气流速1.0mL/min,进样量1μL.
质谱条件:四极杆温度150℃;离子源温度230℃;选择离子扫描(SIM)时以扑草净的特征离子质量数241.1,226.1,199.1,184.1组成离子组;开始分析时间3.75min;质谱结束时间35.0min.
2 结果与讨论
2.1 方法灵敏度、准确度和精密度
在上述设定条件下,测定了0.05,0.1,0.2,0.5,1.0μg/mL系列标准溶液,进样量1μL,进样浓度(X,μg/mL)与色谱峰面积Y线性相关,方程为Y=75344 X-2958.3,相关系数为r=0.9957.仪器最低检出量(LOD)为1.5×10-11g,通过加标回收的方法测定的土壤、植株、糙米、稻壳和稻田水的最低检出浓度(LOQ)为0.01mg/kg.
在0.01,0.05,0.5mg/kg三个浓度水平对土壤、稻田水、植株、糙米和稻壳中的扑草净进行添加回收试验,每个平行重复5次,结果见表1.从表1可以看出,在0.01~0.5mg/kg添加范围内,土壤中的平均回收率变化范围为88.8%~101.5%,植株的平均回收率为78.3%~106.2%,稻田水的平均回收率为85.2%~103.6%,糙米的平均回收率为88.6%~102.6%,稻壳的平均回收率为92.2%~96.2%.精密度(以相对标准偏差RSD表示)范围为2.6%~9.3%,符合农药残留分析要求.
2.2 扑草净的消解动态
扑草净在土壤、植株及田水中的消解动态规律见图1—3及表2.
由图1可知,扑草净在土壤中的原始沉积量分别为2.553mg/kg(吉林),1.250mg/kg(黑龙江)和1.599mg/kg(湖南).施药后第14天,吉林和黑龙江土壤中扑草净的消解率均已超过85%,至第30天开始低于LOQ;而湖南土壤中的扑草净至施药后第40天消解率才达到86%,至第60天扑草净含量低于LOQ.扑草净在土壤中的消解半衰期(见表2)分别为4.9d(吉林),7.2d(黑龙江)和17.4d(湖南).扑草净在湖南土壤环境中的消解速率远低于吉林和黑龙江.
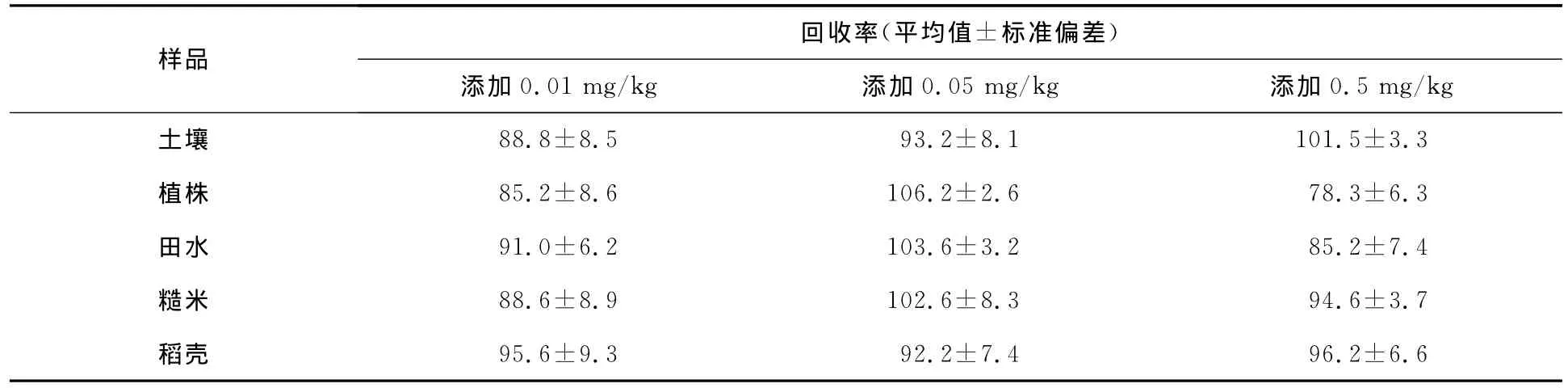
表1 扑草净的添加回收率(n=5) %

图1 扑草净在稻田土壤中的消解动态
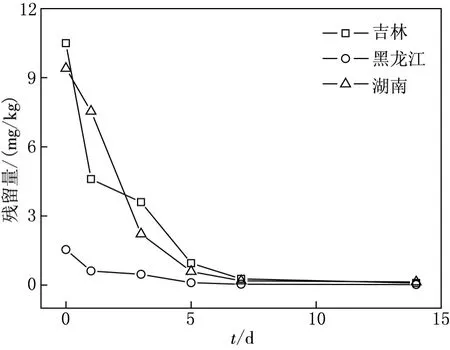
图2 扑草净在水稻植株中的消解动态

表2 扑草净的消解规律
由图2可知,扑草净在植株中的原始沉积量分别为10.5mg/kg(吉林),1.54mg/kg(黑龙江)和9.4mg/kg(湖南).从施药后第5天开始,扑草净的消解率均超过90%;至第20天,植株中扑草净含量均低于LOQ.扑草净在植株中的消解半衰期(见表2)分别为2.0,2.2,2.1d.三个试验地区植株中扑草净的消解速率均较快,且差异不明显.
由图3可知,扑草净在稻田水中的原始沉积量分别为7.67mg/kg(吉林),1.58mg/kg(黑龙江)和1.43mg/kg(湖南).在施药后第7天,田水中扑草净的含量已低于LOQ.扑草净的消解半衰期(见表2)分别为1.9,0.7和0.9d.相对于土壤和植株,田水中的扑草净消解速率最快,三个试验区域的差异不明显.
2.3 扑草净降解的影响因素
扑草净的降解速率与其自身的理化性质、环境因素、气候条件等密切相关,其中土壤性质可能是导致其降解存在差异的主要原因.本试验中,吉林省的土壤类型为草甸黑土,有机质含量为2.8%;黑龙江省土壤类型为黑土,有机质含量为3.5%;湖南省土壤类型为水稻土,有机质含量为2.1%,土壤有机质含量影响扑草净的吸附和降解速率.杨炜春等研究了扑草净在不同土壤中的吸附特性,结果表明土壤有机质是影响扑草净在土壤中吸附的主要因素,有机质含量越高越有利于扑草净在土壤中的吸附[6].吉林和黑龙江的土壤类型同属于黑土,有机质含量明显高于湖南的水稻土,在高有机质含量的土壤中农药的降解速率往往高于有机质含量低的土壤[12],因此,有机质含量低可能是湖南水稻土中扑草净降解速率减缓的原因之一.另外,南北方气候条件的差异也可能会影响扑草净在土壤中的降解速率[13-14].在植株和田水环境中,扑草净的降解速率均较快,且三个区域的差别并不明显,这表明在田水和植株中,扑草净的降解受环境因素影响较小.

图3 扑草净在稻田水中的消解动态
2.4 最大残留量分析
扑草净的最终残留检测结果见表3.由表3可知,扑草净在土壤、植株、糙米和稻壳中的含量均低于检出限,这表明扑草净在作物生长期内能够完全降解(特别是在水稻体内,包括植株和籽粒),且不易在环境中富集.根据国家环保总局《化学农药环境安全评价试验准则》以及POPs国际公约的相关划分规定,依据农药的半衰期将农药降解性划分为5个等级,划分依据见表4.根据扑草净的半衰期及划分依据,由上述结果可知,在本试验剂量范围内,扑草净属于环境友好型农药,在保证药效的同时残留量低,对环境和作物安全.

表3 扑草净的最终残留量

表4 农药降解性划分等级
3 结论
本试验采用的前处理及分析测定方法,具有良好的选择性,灵敏度高,且能够降低基质的干扰并满足扑草净的残留分析要求,可为扑草净在不同环境介质及作物中的残留分析提供依据和参考.
吉林、黑龙江和湖南三地的试验结果表明,扑草净在稻田水和水稻植株中的降解速率较快,半衰期较短;在土壤中的降解速率较慢,半衰期长.在最终残留结果中均未检出扑草净的存在,结果远低于日本规定的扑草净在水稻中的MRL值(0.05mg/kg),因此,在推荐剂量下施用扑草净,不会对环境和作物形成污染和损害,可据此建立扑草净在水稻中MRL标准限值.
[1]MA JIANYI,WANG SHUFENG,WANG PINWEI,et al.Toxicity assessment of 40herbicides to the green algaRaphidocelis subcapitata[J].Ecotoxicol Environ Safe,2006,63:456-462.
[2]杨金川,胡德禹,张钰萍,等.烯啶虫胺在水稻和稻田环境中的残留及消解动态[J].农药学学报,2012,14(5):521-526.
[3]邹容,杨仁斌,傅强,等.恶草酮在水稻及其环境中的残留分析方法[J].农药,2013,52(5):363-365.
[4]ZHANG XIAO,SHEN YAN,YU XIANGYANG,et al.Dissipation of chlorpyrifos and residue analysis in rice,soil and water under paddy field conditions[J].Ecotoxicol Environ Safe,2012,78:276-280.
[5]ZHOU QINGXIANG,XIAO JUNPING,DING YUJIE.Sensitive determination of fungicides and prometryn in environmental water samples using multiwalled carbon nanotubes solid-phase extraction cartridge[J].Analytica Chimica Acta,2007,602(2):223-228.
[6]杨炜春,刘维屏,马云,等.扑草净和扑灭通在土壤中吸附及其与色谱热力学函数的相关性[J].土壤学报,2002,39(5):693-698.
[7]周际海,孙向武,胡锋,等.扑草净降解菌的分离、筛选与鉴定及降解特性初步研究[J].环境科学,2013,34(7):2894-2898.
[8]SERGIO BONORA,ENRICO BENASSI,ASSIMO MARIS,et al.Raman and SERS study on atrazine,prometryn and simetryn triazine herbicides[J].Journal of Molecular Structure,2013,1040:139-148.
[9]EVGENIDOU E,BIZANI E,CHRISTOPHORIDIS C,et al.Heterogeneous photocatalytic degradation of prometryn in aqueous solutions under UV-Vis irradiation[J].2007,68(10):1877-1882.
[10]中华人民共和国农业行业标准NY/T 788-2004.农药残留试验准则[S].北京:中国农业出版社,2004.
[11]农业部农药检定所.农药登记残留田间试验标准操作规程[M].北京:中国标准出版社,2007.
[12]石利利,单正军,蔡道基.三唑磷农药在土壤中的降解与吸附特性研究[J].农业环境科学学报,2006,25(3):733-736.
[13]KANRAR B,BHATTACHARYYA A.Photolysis of the herbicide bispyribac sodium in aqueous medium under the influence of UV and sunlight in presence or absence of sensitizers[J].J EnvironSci Heal B,2009,44(8):788-797.
[14]BHAGIRATH SINGH CHAUHAN.Crowfootgrass(Dactyloctenium aegyptium)germination and response to herbicides in the Philippines[J].Weed Sci,2011,59(4):512-516.

