纳豆芽孢杆菌B4对Caco-2细胞活性、黏附与细胞因子分泌的影响
尚沁沁 黄 琴 徐 歆 史艳云 李卫芬 余东游
(浙江大学动物科学学院饲料科学研究所,农业部华东动物营养与饲料重点实验室,杭州 310058)
益生菌是指对人畜有益的活体微生物[1]。外源性益生菌进入肠道后,通过促进机体肠道微生态平衡、增强机体免疫力、维持养殖生态平衡,最终达到促生长和提高抗病力等益生作用,并具有无毒性、无残留、无耐药性以及无环境污染等优点[2]。益生菌主要通过免疫调节(增强肠道免疫、活化全身免疫系统及减轻炎症反应)[3]和非免疫调节(改善肠道微生态平衡和肠道形态结构)[4]2种途径改善动物肠道健康,从而促进动物生长。纳豆芽孢杆菌(Bacillus subtilis var.natto)B4是枯草芽孢杆菌的一个亚种[5],可分解大分子物质如蛋白质、碳水化合物、脂肪等,促进营养物质的消化吸收,同时具有抗癌、抗菌、抗氧化、降低胆固醇等功能[6-7]。研究表明,在饲粮中添加纳豆芽孢杆菌B4可提高肉鸡的平均日采食量和平均日增重[8],促进仔猪肠道乳酸菌定植[9],提高鱼的非特异性免疫[10]等。目前,关于益生菌对机体免疫影响的研究多集中于乳酸菌,而针对纳豆芽孢杆菌的研究较少。因此,有必要系统、深入地研究饲用纳豆芽孢杆菌的作用机理,特别是其提高动物免疫功能的机理。本试验拟研究纳豆芽孢杆菌B4对Caco-2细胞活性、黏附与细胞因子分泌的影响,旨在探索该菌株对肠黏膜免疫功能的调控机理,从而为纳豆芽孢杆菌在畜牧生产中的应用提供科学依据。
1 材料与方法
1.1 试验材料
纳豆芽孢杆菌B4菌株由浙江大学饲料科学研究所农业部华东动物营养与饲料重点实验室提供;大肠杆菌(Escherichia coli)K88和霍乱沙门氏菌(Salmonella choleraesuis)均购自国家兽医微生物菌种保藏管理中心;Caco-2细胞购自中国科学院上海生命科学研究院细胞资源中心。
1.2 主要试剂和设备
Luria-Bertani(LB)培养基(英国 Oxoid公司);麦康凯琼脂培养基和SS琼脂培养基(杭州天和微生物试剂有限公司);DMEM培养液、0.25%胰酶[含 0.02%乙二胺四乙酸(EDTA)]、D-Hank’s平衡盐溶液、胎牛血清(FBS)(美国Gibco公司);青、链霉素(碧云天生物技术研究所);TritonX-100和台盼蓝染色液(美国Ameresco公司);增殖诱导配体(APRIL)、白细胞介素 -6(IL-6)、白细胞介素-8(IL-8)和白细胞介素-10(IL-10)酶联免疫吸附法(ELISA)测试盒(美国R&D systems公司);乳酸脱氢酶(LDH)测试盒(南京建成生物工程研究所);其他试剂均为分析纯。
5804R高速冷冻离心机(德国Eppendorf公司);HERAcell 150 CO2细胞培养箱(美国Thermo Electron公司);CX41-12C02奥林巴斯倒置显微镜(日本Olympus公司);SpectraMax M5多功能酶标仪(美国Molecular Devices公司);UV-2100紫外可见分光光度计(尤尼柯上海仪器有限公司);XSZ-N107CCD光学显微镜(宁波永新光学股份有限公司);DK-8D恒温水浴锅(上海森信实验仪器有限公司);SPX-250BS-Ⅱ生化培养箱(上海新苗医疗器械制造有限公司);THZ-C恒温振荡器(江苏太仓市实验设备厂)。
1.3 试验方法
1.3.1 试验细胞及菌株的培养
按照文献[11]的方法培养细胞及试验菌株。Caco-2细胞接种在75 cm2细胞培养瓶,以含10%FBS和双抗(100 U/mL青霉素和100μg/mL链霉素)的DMEM 培养基,于37℃,5%CO2的培养箱中培养,每2 d换液1次,待细胞贴壁生长为单层细胞后(5~7 d),加入0.5 mL 0.25%的胰酶消化传代。
-80℃保存的纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌分别经LB培养基、麦康凯琼脂培养基和SS琼脂培养基活化后,接种于LB液体培养基,37℃,200 r/min摇床培养至对数生长期,4 000 r/min离心10 min,收集菌体,用无菌磷酸盐缓冲液(PBS,pH 7.4)洗涤2次,最后重悬于含10%FBS的DMEM培养基中,调节细菌的浓度为2×108CFU/mL。
1.3.2 细胞活性检测[12]
Caco-2细胞以1×106个/mL接种于细胞培养板,37℃,5%CO2培养箱中培养12 h使细胞重新贴壁,试验组分别加入纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌液(1×108CFU/mL),对照组加等量含10%FBS的DMEM培养基,置于37℃,5%CO2培养箱中继续共培养,分别进行台盼蓝排斥试验和LDH细胞毒性检测。
台盼蓝排斥试验:分别在共培养1、3、6 h后,以0.25%胰蛋白酶消化收集细胞,细胞悬液与0.4%台盼蓝溶液以体积比9∶1混合均匀,取少量以细胞计数板计数活细胞(未着色细胞)数、细胞总数,计算细胞存活率。

LDH细胞毒性检测:共培养12 h后,收集细胞培养上清,以LDH测试盒检测胞外LDH活性,以此确定细胞的损伤程度。
1.3.3 细菌黏附试验
按照文献[13]和[14]的方法荧光标记细菌:试验菌(1×109CFU/mL)悬浮于1 mg/mL异硫氰酸荧光素(FITC)中,37℃暗处作用2 h,PBS洗涤数次去除未结合的FITC,重新悬浮于含10%FBS的DMEM培养基中,并调整菌液浓度至2×108CFU/mL。Caco-2细胞以1×106个/mL接种于细胞培养板,37℃,5%CO2培养箱中培养12 h使细胞重新贴壁,分别进行单菌黏附和黏附抑制试验[11]。
单菌黏附试验:FITC标记的大肠杆菌K88或霍乱沙门氏菌(1×108CFU/mL)处理Caco-2细胞1 h,无菌PBS洗涤3次,胰酶消化收集细胞,酶标仪测定其相对荧光强度(RFU),激发光波长为494 nm,发射光波长为520 nm,计算黏附率。
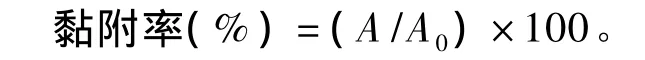
式中:A为每毫升细胞悬液的RFU;A0为每毫升FITC标记菌液的RFU。
黏附抑制试验:1)竞争试验,同时加入未荧光标记的纳豆芽孢杆菌B4与FITC标记的大肠菌K88或者霍乱沙门氏菌(均为1×108CFU/mL)处理Caco-2细胞1 h后,无菌PBS洗涤3次,胰酶消化收集细胞,酶标仪测定其RFU,计算黏附率。2)排斥试验,未标记荧光的纳豆芽孢杆菌B4(1×108CFU/mL)先处理 Caco-2细胞 1 h后,无菌PBS洗涤3次,再加入FITC标记的大肠菌K88或者霍乱沙门氏菌(1×108CFU/mL)处理1 h,无菌PBS洗涤3次,胰酶消化收集细胞,酶标仪测定其RFU,计算黏附率。3)置换试验,FITC标记的大肠菌K88或者霍乱沙门氏菌(1×108CFU/mL)处理Caco-2细胞1 h,无菌PBS洗涤3次,再加入未荧光标记的纳豆芽孢杆菌B4处理1 h,胰酶消化收集细胞,酶标仪测定其RFU,计算黏附率。
1.3.4 细胞因子分泌检测
Caco-2细胞以1×106个/mL接种于细胞培养板,37℃,5%CO2培养箱中培养12 h使细胞重新贴壁,试验组分别以纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌液(1×108CFU/mL)处理12 h,对照组加等量含10%FBS的 DMEM 培养基,收集细胞培养上清,以ELISA测试盒检测其中促炎细胞因子(APRIL、IL-6、IL-8)和抗炎细胞因子(IL-10)的含量,按说明书操作。
1.4 数据统计与分析
试验数据以平均值±标准差表示,采用SPSS 16.0软件作统计学分析,用Duncan氏法进行多重比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 纳豆芽孢杆菌B4对Caco-2细胞活性的影响
由表1可知,大肠杆菌K88和霍乱沙门氏菌与Caco-2细胞共培养后,随共培养时间的延长,细胞存活率逐渐降低,分别从1 h的88.17%和88.67%降低到6 h的72.83%和72.50%,大肠杆菌K88和霍乱沙门氏菌组Caco-2细胞的存活率极显著低于对照组(P<0.01);纳豆芽孢杆菌B4与Caco-2细胞共培养1、3、6 h后,对Caco-2细胞的存活率无显著影响(P>0.05),且Caco-2细胞的存活率极显著高于上述2株病原菌(P<0.01)。

表1 纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌对Caco-2细胞存活率的影响Table 1 Effects of Bacillus subtilis var.natto B4,Escherichia coli K88 and Salmonella choleraesuis on survival rate of Caco-2 cells %
由表2可知,大肠杆菌K88和霍乱沙门氏菌与Caco-2细胞共培养12 h后胞外LDH活性分别是对照组的8.1倍和7.9倍,差异均极显著(P<0.01)。纳豆芽孢杆菌B4与Caco-2细胞共培养12 h后胞外LDH活性极显著高于对照组(P<0.01),但极显著低于大肠杆菌K88和霍乱沙门氏菌组(P<0.01)。
2.2 纳豆芽孢杆菌B4对大肠杆菌K88和霍乱沙门氏菌黏附Caco-2细胞的影响
由表3和表4可知,在竞争试验、排斥试验和置换试验中,纳豆芽孢杆菌B4对大肠杆菌K88和霍乱沙门氏菌黏附Caco-2细胞的黏附率无显著影响(P>0.05),表明该芽孢杆菌对大肠杆菌K88和霍乱沙门氏菌黏附Caco-2细胞没有明显的阻断作用。

表2 纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌对Caco-2细胞胞外LDH活性的影响Table 2 Effects of Bacillus subtilis var.natto B4,Escherichia coli K88 and Salmonella choleraesuis on extracellular LDH activity of Caco-2 cells U/L

表3 纳豆芽孢杆菌B4对大肠杆菌K88黏附Caco-2细胞的影响Table 3 Effects of Bacillus subtilis var.natto B4 on adhesion of Escherichia coli K88 to Caco-2 cells %

表4 纳豆芽孢杆菌B4对霍乱沙门氏菌黏附Caco-2细胞的影响Table 4 Effects of Bacillus subtilis var.natto B4 on adhesion of Salmonella choleraesuis to Caco-2 cells%
2.3 纳豆芽孢杆菌B4对Caco-2细胞细胞因子分泌的影响
由表5可知,纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌组Caco-2细胞分泌APRIL含量极显著高于对照组(P<0.01),而促炎细胞因子IL-6和IL-8含量与对照组无显著差异(P>0.05),抗炎细胞因子IL-10含量极显著低于对照组(P<0.01)。
3 讨论
3.1 纳豆芽孢杆菌B4对Caco-2细胞活性的影响
益生菌的安全性是其筛选过程中的基本要求,菌株在最终应用于畜牧生产之前,都必须经严格的毒性试验,证明其安全无毒,方可进一步推广使用。本研究通过联合运用台盼蓝排斥试验和LDH细胞毒性检测2种方法,分析纳豆芽孢杆菌B4对Caco-2细胞活性的影响,以此评估该菌株的安全性。LDH仅存在于细胞内,当细胞受到损伤时,细胞膜完整性受损,导致其通透性增加,使LDH由胞内泄漏至胞外。因此,胞外LDH活性成为衡量细胞破损的指标之一[15]。本试验结果显示,大肠杆菌K88和霍乱沙门氏菌对Caco-2细胞造成严重的细胞损伤,引起胞外LDH活性的极显著升高,而纳豆芽孢杆菌B4对Caco-2细胞存在一定的细胞毒性,但远远低于大肠杆菌K88和霍乱沙门氏菌。台盼蓝排斥试验结果显示,大肠杆菌K88和霍乱沙门氏菌极显著降低Caco-2细胞的存活率,而纳豆芽孢杆菌B4对Caco-2细胞的存活率没有显著的影响。上述2个试验结果均表明,纳豆芽孢杆菌B4对Caco-2细胞无显著毒性作用,而大肠杆菌K88和霍乱沙门氏菌对Caco-2细胞具有毒性作用。由此可知该芽孢杆菌具有安全性,可选为益生菌。近年来,通过对芽孢杆菌进行安全评估得出有4株芽孢杆菌未发现具有致病特点[16-17],本研究结果与这些研究相似。

表5 纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌对Caco-2细胞细胞因子分泌的影响Table 5 Effects of Bacillus subtilis var.natto B4,Escherichia coli K88 and Salmonella choleraesuis on cytokine secretion of Caco-2 cells
3.2 纳豆芽孢杆菌B4对致病菌黏附的影响
芽孢杆菌制剂具有防病抗病、提高动物生产性能及对动物无毒无害、无残留等特点,是一种优质、高效、低残留、无污染、绿色环保的新型饲料添加剂。对于益生菌的作用机理,目前普遍认为黏附是其发挥益生作用的前提,也是细菌与宿主相互作用的第1步[18-19]。Caco-2细胞是体外培养的肠上皮细胞,来源于人结肠腺癌细胞,在体外培养时,可自发进行形态学和生化学上的分化,其结构、形态学、标志酶的功能表达与肠上皮细胞类似,表现出成熟的肠上皮细胞的特性[20],现普遍以Caco-2细胞为模型进行体外模拟试验,并以此来近似反映益生菌在体内肠黏膜的黏附特性[21-24]。郭彤等[25]研究表明,大肠杆菌K88和霍乱沙门氏菌均对Caco-2细胞有很强的黏附性。因此,阻止大肠杆菌K88和霍乱沙门氏菌黏附是抵抗其入侵的重要途径之一。本研究表明,在竞争试验、排斥试验和置换试验中,纳豆芽孢杆菌B4对大肠杆菌K88和霍乱沙门氏菌黏附Caco-2细胞的黏附率无显著影响,对大肠杆菌K88和霍乱沙门氏菌黏附Caco-2细胞未显示显著的阻断作用。Matijašic'等[26]研究表明,格氏乳杆菌能通过排斥作用和竞争作用抑制大肠杆菌K88黏附Caco-2细胞,但不影响大肠杆菌K88对猪的空肠组织黏附能力。魏银萍[27]研究表明,嗜酸乳杆菌、长双歧杆菌和粪肠球菌能够抑制大肠杆菌和沙门氏菌对HT-29细胞的黏附能力,但益生菌的黏附力大小并不能决定其抑制致病菌对HT-29细胞黏附作用的强弱,嗜酸乳杆菌的黏附能力比长双歧杆菌强,但前者对致病菌的黏附抑制作用却不如后者。Nissena等[18]研究同样表明,黏附能力高的益生菌不一定具有更强的抵抗致病菌的作用。Wang等[28]研究发现,在肠道定植能力弱的乳酸菌,同样可以减少肠道大肠杆菌的数量。可见,益生菌的黏附能力及其对致病菌的抗黏附作用并不是其抑制致病菌生长的必要条件,益生菌抑制肠道病原菌的机理比较复杂,涉及黏附、占位以外的其他机理,这些机理有待于我们进一步讨论。
3.3 纳豆芽孢杆菌B4对Caco-2细胞细胞因子分泌的影响
细胞因子在免疫应答与免疫调节中发挥着重要作用[29]。受细菌或者病毒刺激的组织或细胞可通过释放细胞因子来活化局部免疫和系统免疫,并调节免疫应答的类型和强度。根据细胞因子和趋化因子在炎症反应过程中的不同作用,可将细胞因子分为促炎细胞因子和抗炎细胞因子2类,前者包括白细胞介素-1(IL-1)、白细胞介素-2(IL-2)、IL-6、白细胞介素-12(IL-12)、干扰素 -γ(IFN-γ)和肿瘤坏死因子 -α(TNF-α)以及趋化因子IL-8等,主要介导炎症反应的产生和加剧,提高机体抗感染能力的作用。而白细胞介素-4(IL-4)、白细胞介素 -5(IL-5)、IL-10、白细胞介素-13(IL-13)和转化生长因子 -β(TGF-β)属于后者,具有抑制和消除炎症反应,维持免疫平衡的作用[30]。
APRIL是TNF家族新成员,具有增强抵抗外来抗原、毒素以及病原微生物入侵的作用。He等[31]和 Macpherson 等[32]研究发现,APRIL 是活化肠黏膜免疫应答中重要的促炎细胞因子,在正常组织中低表达或不表达,受细菌抗原(整个菌体内、毒素或鞭毛)刺激的Caco-2细胞则表达 APRIL。本研究结果显示,纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌均可极显著提高Caco-2细胞分泌APRIL的含量,而未受刺激的Caco-2细胞则低表达APRIL。因此,纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌均能刺激Caco-2细胞分泌APRIL,从而增强机体对抗外来抗原、毒素以及病原微生物的入侵。Hosoi等[33]研究表明,不同试验条件会影响纳豆芽孢杆菌和大肠杆菌刺激Caco-2细胞分泌IL-6和IL-8。但本试验未能发现纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌刺激Caco-2细胞分泌IL-6和IL-8,可能是由于菌株特异性或试验条件不一样引起的。抗炎细胞因子IL-10能够抑制炎症应答,使免疫应答转向耐受模式,从而能有效控制或治疗严重的炎症疾病,具有限制肠上皮细胞对致病菌的免疫应答和维持对共生细菌稳态的作用[34]。本试验表明,纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌均可极显著抑制Caco-2细胞分泌IL-10,从而进一步增强Caco-2细胞的促炎反应。因此,纳豆芽孢杆菌B4、大肠杆菌K88和霍乱沙门氏菌对促炎细胞因子IL-6和IL-8含量无显著影响,但能通过显著提高促炎细胞因子APRIL的含量活化Caco-2细胞促炎反应,同时能通过抑制Caco-2细胞分泌IL-10,进一步增强Caco-2细胞的促炎反应。
4 结论
①纳豆芽孢杆菌B4对Caco-2细胞无显著毒害作用,具有安全性。
②纳豆芽孢杆菌B4对大肠杆菌K88和霍乱沙门氏菌黏附Caco-2细胞无阻断作用。
③纳豆芽孢杆菌B4能够显著诱导Caco-2细胞分泌促炎细胞因子APRIL并抑制抗炎细胞因子IL-10的产生,表明该芽孢杆菌可通过调节Caco-2细胞的细胞因子分泌发挥一定的免疫作用。
[1]FULLER R.Probiotics in man and animals[J].The Journal of Applied Bacteriology,1989,66(5):365-378.
[2]ALEXOPOULOS C,GEORGOULAKIS I E,TZIVARA A,et al.Field evaluation of the efficacy of a probiotic containing Bacillus licheniformis and Bacillus subtilis spores,on the health status and performance of sows and their litters[J].Journal of Animal Physiology and Animal Nutrition,2004,88(11/12):381-392.
[3]BODERA P,CHCIALOWSKI A.Immunomodulatory effect of probiotic bacteria[J].Recent Patents Inflammation & Allergy Drug Discovery,2009,3(1):58-64.
[4]PAGNINI C,SAEED R,BAMIAS G,et al.Probiotics promote gut health through stimulation of epithelial innate immunity[J].Proceeding of the National Academy of Sciences of the United States of America,2010,107(1):454-459.
[5]SAMANYA M,YAMAUCHI K.Histological alterations of intestinal villi in chickens fed dried Bacillus subtilis var.natto[J].Comparative Biochemistry and Physiology-Part A:Molecular&Integrative Physiology,2002,133(1):95-104.
[6]SUMI H.Accumulation of vitamin K(menaquinone-7)in plasma after ingestion of natto and natto bacilli(B.subtilis natto)[J].Food Science and Technology Research,1999,5(1):48-50.
[7]SUMI H,HAMADA H,TSUSHIMA H,et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese Natto;a typical and popular soybean food in the Japanese diet[J].Experientia,1987,43(10):1110-1111.
[8]FUJIWARA K,YAMAZAKI M,ABE H,et al.Effect of Bacillus subtilis var.natto fermented soybean on growth performance,microbial activity in the caeca and cytokine gene expression of domestic meat type chickens[J].The Journal of Poultry Science,2009,46(2):116-122.
[9]OZAWA K,YOKOTA H,KIMURA M,et al.Effects of administration of Bacillus subtilis strain BN on intestinal flora of weanling piglets[J].Nippon Juigaku Zasshi.The Japanese Journal of Veterinary Science,1981,43(5):771-775.
[10]周国勤,杜宣,吴伟.纳豆芽孢杆菌对鱼类非特异性免疫功能的影响[J].水利渔业,2006,26(1):101-103.
[11]黄琴,白洁,汪启翰,等.芽孢杆菌对体外肠上皮细胞黏附和细胞膜完整性的影响[J].中国兽医学报,2013,33(3):376-380.
[12]XU X,HUANG Q,MAO Y L,et al.Immunomodula-tory effects of Bacillus subtilis(natto)B4 spores on murine macrophages[J].Microbiology and Immunology,2012,56(12):817-824.
[13]VINDEROLA C G,MEDICI M,PERDIGÓN G.Relationship between interaction sites in the gut,hydrophobicity,mucosal immunomodulating capacities and cell wall protein profiles in indigenous and exogenous bacteria[J].Journal of Applied Microbiology,2004,96(2):230-243.
[14]BONAR A,CHMIELA A,RUDNICKA W,et al.Mannose-binding lectin enhances the attachment and phagocytosis of mycobacteria in vitro[J].Archivum Immunologiae Et Therapiae Experimentalis,2005,53(5):437-441.
[15]PATLOLLA A,PATLOLLA B,TCHOUNWOU P.E-valuation of cell viability,DNA damage,and cell death in normal human dermal fibroblast cells induced by functionalized multiwalled carbon nanotube[J].Molecular and Cellular Biochemistry,2010,338(1/2):225-232.
[16]HONG H A,HUANG J M,KHANEJA R,et al.The safety of Bacillus subtilis and Bacillus indicus as food probiotics[J].Journal of Applied Microbiology,2008,105(2):510-520.
[17]TOMPKINS T A,HAGEN K E,WALLACE T D,et al.Safety evaluation of two bacterial strains used in A-sian probiotic products[J].Canadian Journal of Microbiology,2008,54(5):391-400.
[18]NISSENA L,CHINGWARU W,SGORBATI B,et al.Gut health promoting activity of new putative probiotic/protective Lactobacillus spp.strains:a functional study in the small intestinal cell model[J].International Journal of Food Microbiology,2009,135(3):288-294.
[19]BIBILONI R,FERNANDO PÉREZ P,LILIANA DE ANTONI G.Will a high adhering capacity in a probiotic strain guarantee exclusion of pathogens from intestinal epithelia?[J].Anaerobe,1999,5(5):519-524.
[20]CANDELA M,PERNA F,CARNEVALI P,et al.Interaction of probiotic Lactobacillus and Bifidobacterium strains with human intestinal epithelial cells:adhesion properties,competition against enteropathogens and modulation of IL-8 production[J].International Journal of Food Microbiology,2008,125(3):286-292.
[21]熊涛,黄巧芬,李萍,等.植物乳杆菌 NCU116的模拟人体肠道上皮细胞黏附性能[J].食品科学,2013,34(15):252-255.
[22]刘刚,任文凯,熊霞,等.肠道与微生物相互作用体外研究模型进展与应用[J].动物营养学报,2013,25(8):1677-1682.
[23]GAGNON M,ZIHLER B A,CHERVET N,et al.Comparison of the Caco-2,HT-29 and the mucus-secreting HT29-MTX intestinal cell models to investigate Salmonella adhesion and invasion[J].Journal of Microbiological Methods,2013,94(3):274-279.
[24]MOUSSAVI M,ADAMS M C.An in vitro study on bacterial growth interactions and intestinal epithelial cell adhesion characteristics of probiotic combinations[J].Current Microbiology,2010,60(5):327-335.
[25]郭彤,胥保华,马玉龙,等.嗜酸乳杆菌和双歧杆菌体外粘附Caco-2细胞及其对病原菌粘附性能的影响[J].中国兽医学报,2008,28(5):527-531.
[26]MATIJAŠIC'B B,NARAT M,PETERNEL M Z,et al.Ability of Lactobacillus gasseri K7 to inhibit Escherichia coli adhesion in vitro on Caco-2 cells and ex vivo on pigs’jejunal tissue[J].International Journal of Food Microbiology,2006,107(1):92-96.
[27]魏银萍.国内5种市售微生态制剂益生菌株的粘附性能研究[D].硕士学位论文.重庆:西南大学,2006:23-26.
[28]WANG J Q,YIN F G,ZHU C,et al.Evaluation of probiotic bacteria for their effects on the growth performance and intestinal microbiota of newly-weaned pigs fed fermented high-moisture maize[J].Livestock Science,2012,145(1):79-86.
[29]TOSI M F.Innate immune responses to infection[J].Journal of Allergy and Clinical Immunology,2005,116(2):241-249.
[30]STOYCHEVA M,MURDJEVA M.Dynamics of serum pro-inflammatory cytokines in patients with salmonella infection[J].Trakia Journal of Sciences,2005,3(3):56-60.
[31]HE B,XU W F,SANTINI P A,et al.Intestinal bacteria trigger T cell-independent immunoglobulin A2class switching by inducing epithelial-cell secretion of the cytokine APRIL[J].Immunity,2007,26(6):812-826.
[32]MACPHERSON A J,MCCOY K.APRIL in the intestine:a good destination for immunoglobulin A2[J].Immunity,2007,26(6):755-757.
[33]HOSOI T,HIROSE R,SAEGUSA S,et al.Cytokine responses of human intestinal epithelial-like Caco-2 cells to the nonpathogenic bacterium Bacillus subtilis(natto)[J].International Journal of Food Microbiology,2003,82(3):255-264.
[34]SARAIVA M,O’GARRA A.The regulation of IL-10 production by immune cells[J].Nature Reviews Immunology,2010,10(3):170-181.

