24-表油菜素内酯对龙须菜抗高温胁迫的研究
李静,王俏俏,徐年军*,孙雪,范美华
(1.宁波大学 应用海洋生物技术教育部重点实验室,浙江 宁波315211;2.宁波大学 海洋学院 海洋生物工程重点实验室,浙江 宁波,315211)
1 引言
龙须菜Gracilarialemaneifor mis是一种重要的产琼胶大型经济海藻。由于其具有较强吸收氮、磷的能力,可用于推广栽培来修复富营养化海水和减轻海区养殖污染[1]。龙须菜中的多糖和蛋白含有多种营养成分和免疫活性物质,可作为海洋药物资源和名贵海产品鲍鱼的饵料[2]。龙须菜原产于山东半岛,如今在我国南部的福建和广东等海域也有大规模栽培[3],高温胁迫是龙须菜栽培面临的关键问题。
油菜素内酯是一种新型植物激素,在植物体内含量微少,而且提取成本高、工艺复杂[4],人工合成油菜素内酯成为世界各地有机化学专家研究的热点。目前已经合成20多种油菜素甾醇类化合物,其中以油菜甾醇为原料大规模合成24-表油菜素内酯和高油菜素内酯应用于研究生产[5]。24-表油菜素内酯作为人工合成的油菜素内酯类似物,有着和油菜素内酯一样极高的生理活性,广泛应用于农业生产。研究证明,24-表油菜素内酯可以改善植物生理代谢功能,调节植物生长发育的许多过程,如促进植物细胞伸长生长,促进藻细胞分裂、有机物累积,微观组织分化等,从而提高植物的品质和产量。在高温、高盐度、重金属等逆境下能调节细胞的生理生化环境,促进其恢复正常的生理代谢过程,增强植物的抗逆性[6]。
本文根据龙须菜栽培过程中对高温的不适应性,测定高温胁迫下不同浓度24-表油菜素内酯处理组龙须菜的生长速率、叶绿素荧光参数、抗氧化酶活性、渗透调节物质甘露醇含量、氧化产物丙二醛含量、藻胆蛋白含量、蛋白质合成伴侣热激蛋白70基因(HSP70)表达量、抗氧化酶谷胱甘肽还原酶基因(GR)表达量以及光合色素藻红蛋白基因(PE)表达量的变化。研究24-表油菜内酯对高温胁迫下龙须菜的生理及分子水平影响,探讨24-表油菜素内酯对提高龙须菜抵抗高温逆境能力的作用机制。
2 材料与方法
2.1 材料
供试材料为龙须菜981品系,采于福建宁德,实验室保种培养1个月以上。将2 mg 24-表油菜素内酯(Sigma)溶于2 mL 95%乙醇中配成母液,充分摇匀后,4℃保存备用。
2.2 处理方法
于培养瓶中分别加入等量龙须菜和不同量的24-表油菜素内酯母液,配制成0、0.004、0.02、0.1、0.5 mg/L 5个不同浓度,每个浓度3次平行,其中0浓度为对照组。常温下培养24 h后进行31℃高温胁迫。培养条件:光照强度40μmol/(m2·s),盐度25,光周期L∶D(12 h∶12 h),每隔3 d加一次Provasoli培养基。生理实验分别于高温胁迫第0~6 d的同一时间点取样,样品用去离子水快速冲洗后吸干水分,液氮快速处理后于-20℃保存,冷冻干燥后备用。分子实验分别于高温胁迫第24 h、48 h的同一时间点取样,液氮冻存备用。
2.3 生长速率测定
通过测定龙须菜培养6 d后藻体鲜质量的变化来计算龙须菜的相对生长速率RGR[7]:
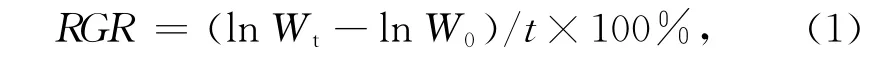
式中,W0为实验开始时藻的鲜质量,单位是g,Wt为实验结束时藻的鲜质量,单位是g,t为实验天数,单位是d。
2.4 叶绿素荧光参数的测定
用水样叶绿素荧光仪MINI-PAM测定叶绿素荧光参数。实验组为0.1 mg/L处理组,对照组不添加24-表油菜素内酯。测量前藻体先进行暗适应15 min,使用弱测量光测定F0,然后用饱和脉冲激发测出最大荧光值Fm。荧光参数PSⅡ最大光能转换效率(Fv/Fm)、实际光能转换效率(ΦPSⅡ)、非光化学淬灭(NPQ)和光化学淬灭(q P)可以通过数据输出直接获得[8]。
2.5 抗氧化酶活性测定
超氧化物歧化酶(SOD)测试盒(A001);植物过氧化物酶(POD)测定试剂盒(A084)均购自南京建成生物工程研究所。实验过程按照试剂盒说明书操作。
2.6 甘露醇含量测定
准确称取干藻样0.05 g,加入4 mL去离子水匀浆后3 000 r/min离心5 min。接着取2 mL上清液,加入3.75 mL 0.1 mol/L CuSO4溶液和2.5 mL 3.8 mol/L Na OH溶液,涡旋振荡混匀后立即置于沸水浴中加热5 min,待样品冷却,3 000 r/min离心5 min,取得上清液测定OD640。每个样品取3个平行[8]。
2.7 丙二醛(MDA)含量的测定
采用硫酸巴比妥法测定,

根据提取液计算样品中所含MDA的量,单位为μmol/g。
2.8 藻胆蛋白含量的测定
采用硫酸铵沉淀法测定,准确称取0.05 g干藻样,液氮研磨。在离心管中加入4 mL l mol/L p H6.8的PBS,先离心得到粉红色上清液,然后加入饱和度55%的硫酸铵充分搅匀,放置于冰箱4℃下避光过夜,沉淀得藻胆蛋白粗提物,测定上清液在D565nm、D615nm、D650nm的值,具体计算方法参照朱招波等[8]。
2.9 HSP70、PE、GR基因的定量表达分析
龙须菜31℃不同时间处理后,液氮冻存研磨,用plant kit试剂盒提取RNA。然后用PrimeScriptTMReverse Transcriptase(takara公司)试剂盒反转录成c DNA,-20℃保存。
RT-PCR所用的特异性引物为:HSP70正向引物(5’-ACCTCCACCTAAATCAAA-3’)和反向引物(5’-CTCAGCGTCAAGCAACTA-3’);PE正向引物(5’-AGACGCTGTATCAGGAAT-3’)和反向引物(5’-AGCCATACGACGGTTACT -3’);GR正向引物(5’-TACAACTGGGCAGAACGG-3’)和反向引物(5’AAACACTGCGGTGGGAAT-3’);参照基因18s正向引物(5’-TGCCGCCACCGTTTACTG-3’)和反向引物(5’-ACCCGATTCAAACAAACCAA-3’)。
RT-PCR:反应体系为:SYBR Premix Ex TaqⅡ(2×)缓冲液12.5μL,正向和反向引物 (10μmol/L)各0.5μL,c DNA模版1μL,d H2O 10.5μL。仪器为Eppendorf荧光定量PCR仪。程序采用:95℃30 s(1 cycle);然后40 cycle(95℃15 s,55℃30 s,68℃30 s),荧光信号收集;接着对扩增产物进行溶解曲线分析,程序为95℃30 s,55℃30 s,95℃15 s(1 cycle),55~95℃,+0.5℃/cycle。
2.10 统计分析
数据处理采用Excel 2007、SPSS16.0统计软件进行数据处理及统计分析.用one-way ANOVA检验差异的显著水平(p),设显著水平为p<0.05。
3 结果与分析
3.1 表油菜素内酯对高温下龙须菜生长速率的影响
藻体生长是其生理过程的综合表现。图1显示,实验过程中,龙须菜相对生长速率随着24-表油菜素内酯处理浓度的升高呈现先上升后下降的趋势。当24-表油菜素内酯浓度为0.1 mg/L时生长速率达到最大值3.36%,比对照组2.51%增加了36.64%,显著高于其他浓度处理(p<0.05)。说明高温环境下添加适当浓度的24-表油菜素内酯有利于龙须菜生长。
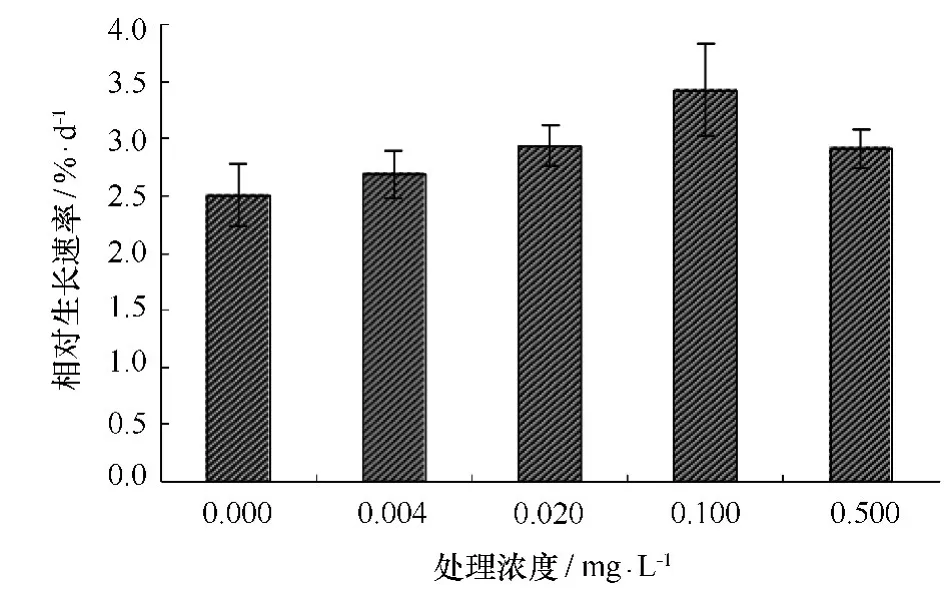
图1 不同浓度24-表油菜素内酯对高温下龙须菜相对生长速率的影响Fig.1 Effects of different concentration of 24-epibrassinolide on the RGR of G.lemaneifor mis under high temperature stress(mean±SD)
3.2 表油菜素内酯对高温下龙须菜叶绿素荧光参数的影响
由图2可知,龙须菜的荧光参数Fv/Fm、ΦPSⅡ、q P均呈现下降趋势,且经24-表油菜素内酯处理后各个荧光参数都有所提高。其中处理组和对照组的Fv/Fm在第一天均有所下降。第二天开始24-表油菜素内酯处理组下降幅度减缓,比对照组减缓了5.72%。且在整个高温胁迫实验过程中Fv/Fm都高于对照组。ΦPSⅡ和qP与Fv/Fm下降趋势一致,从第二天开始24-表油菜素内酯处理组下降幅度减缓,第二天比对照组分别减缓了25.81%、10.18%。NPQ与其他荧光参数不同,处理组和对照组都随着高温逆境时间的延长大致呈现先上升后下降的趋势。24-表油菜素内酯处理组NPQ第二天、第三天分别上升了7.16%、17.32%,比对照组减缓了 6.71%、8.85%。由此可见,24-表油菜素内酯能提高龙须菜的光合作用能力,从而增强其抗高温逆境能力。
3.3 表油菜素内酯对高温下龙须菜抗氧化酶活性的影响
图3a显示,各组龙须菜SOD酶均呈现先上升后下降的趋势,前三天各组SOD酶活性持续上升,在3天均达到最大值,其中0.1 mg/L、0.02 mg/L处理组与对照组差异显著(p<0.05)。在下降过程中除0.004 mg/L处理组外其他各组均高于对照组。POD酶活性变化趋势同SOD,如图3(b),先逐步上升在第三天0.1 mg/L处理组POD活性达到最高,比对照组增加37.56%,与其他处理组差异显著(p<0.05)。第四天其他各组POD仍持续上升,但只有0.1 mg/L处理组与对照组差异显著(p<0.05)。实验后两天各组POD均下降,但经24-表油菜素内酯处理的龙须菜POD活性仍高于对照组。推测表24-油菜素内酯诱导龙须菜耐热性提高与高温下保持龙须菜体内较高的抗氧化酶活性有关。
3.4 表油菜素内酯对高温下龙须菜甘露醇和丙二醛含量的影响
由图4a可见,高温下第一天对照组甘露醇含量下降,处理组相对于对照组都有不同程度的提高,且都和对照组差异显著(p<0.05)。第二、三天各处理组甘露醇含量都有增长,第三天都达到最大值,其中0.1 mg/L比对照组增加了15.09%,与对照差异显著(p<0.05)。之后甘露醇含量开始下降,但处理组一直处于高于对照组水平。说明适当浓度的24-表油菜素内酯有利于龙须菜体内甘露醇含量的积累。
由图4b可见,高温第一、二天各组龙须菜MDA大量积累,第三天0.1 mg/L和0.02 mg/L处理组MDA含量开始下降,分别比对照下降了20.76%、18.22%,与对照组差异极显著(p<0.01)。且在整体变化趋势中对照组MDA含量一直高于处理组。说明高温下添加24-表油菜素内酯处理可以减缓MDA在藻体细胞内的积累。
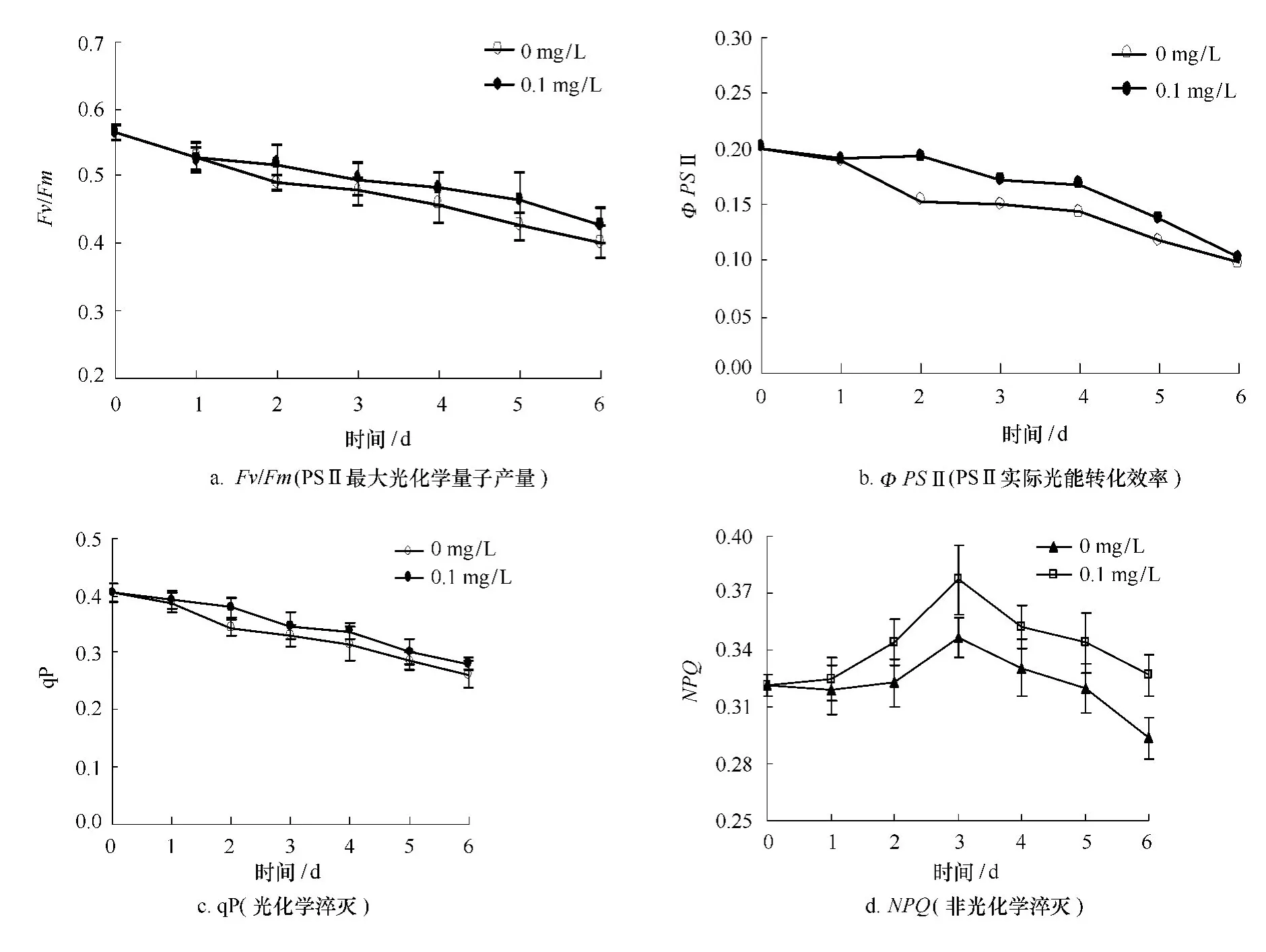
图2 24-表油菜素内酯对高温下龙须菜叶绿素荧光参数的影响Fig.2 Effects of 24-epibrassinolide on the chlorophyll fluorescence parameters of G.lemaneifor mis under high temperature(mean±SD)
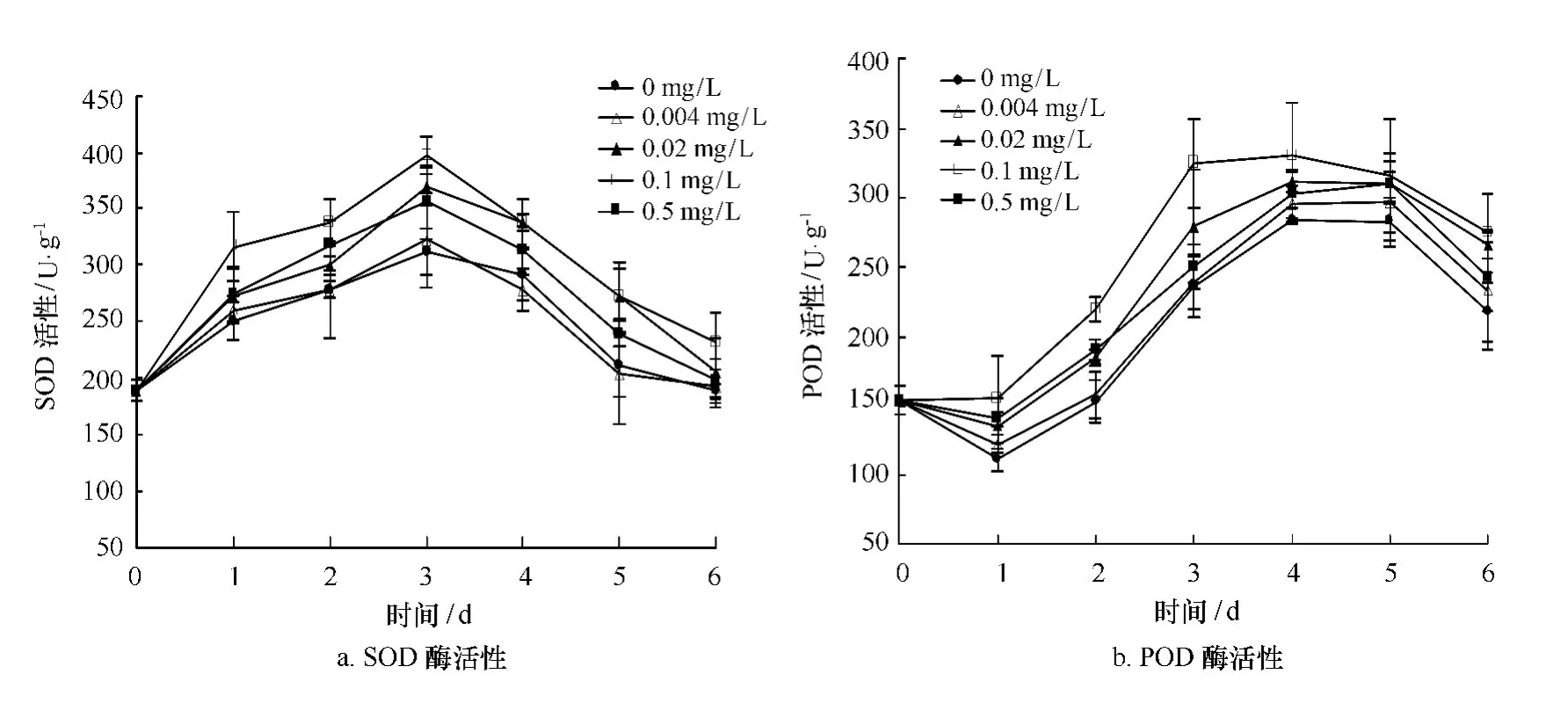
图3 不同浓度24-表油菜素内酯对高温下龙须菜抗氧化酶活性的影响Fig.3 Effects of different concentration of 24-epibrassinolide on antioxidant enzy mes activity of G.lemaneifor mis under high temperature stress(mean±SD)
3.5 表油菜素内酯对高温下龙须菜藻胆蛋白含量的影响
由图5可知,藻红蛋白在处理第一天,除了0.1 mg/L浓度处理组外,其他各组的都有所下降,各组藻红蛋白含量在第三天达到最大值,其中0.1 mg/L处理组含量最高,比对照组高出31.18%,与对照组差异显著(p<0.05)。第三天之后各组藻红蛋白含量虽然都在下降,但处理组均高于对照组。藻蓝蛋白(PC)在处理第一天,除对照组和0.004 mg/L处理组有所下降外,其余各组含量均增加,其中0.1 mg/L处理组的藻蓝蛋白比对照组多28.16%,与对照组差异显著(p<0.05)。第二含量均开始增加,除0.004 mg/L处理组外其他各组在第三天达到峰值后开始下降,但24-表油菜素内酯处理组都高于对照组。
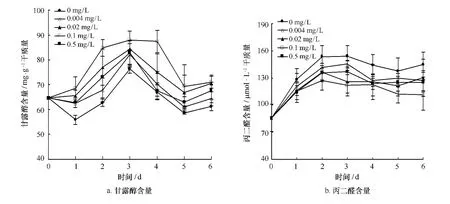
图4 不同浓度24-表油菜素内酯对高温下龙须菜甘露醇和丙二醛含量的影响Fig.4 Effects of different concentration of 24-epibrassinolide on the mannitol and MDA content of G.lemaneifor mis under high temperature stress(mean±SD)
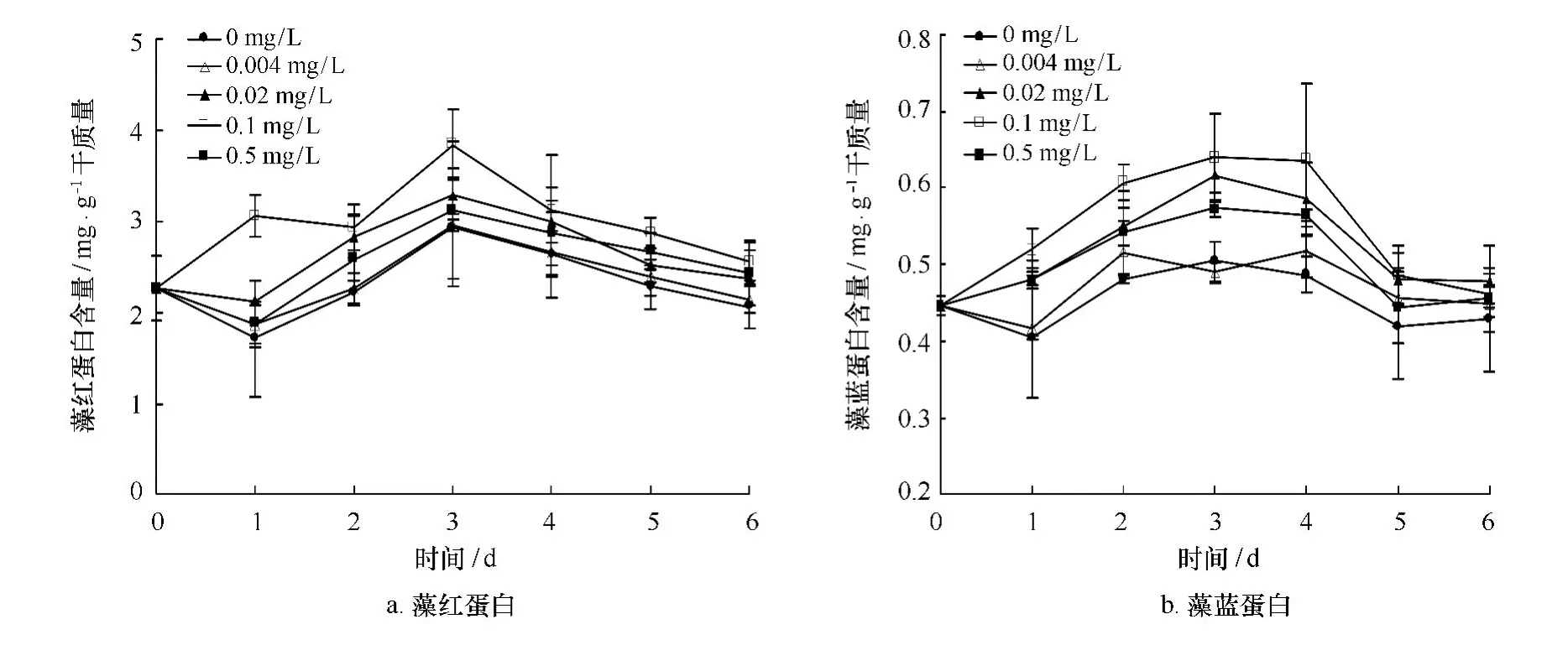
图5 不同浓度24-表油菜素内酯对高温下龙须菜藻红蛋白和藻蓝蛋白含量的影响Fig.5 Effects of different concentration of 24-epibrassinolide on the R-PE and R-PC content of G.lemaneifor mis under high temperature stress(mean±SD)
3.6 表油菜素内酯对高温下龙须菜HSP70、PE、GR基因表达的影响
图6a显示,24 h热激处理后,HSP70基因表达量呈现先下降后上升趋势,由高到低依次为:0.1 mg/L处理组、0.5 mg/L处理组、0.02 mg/L处理组、0.004 mg/L处理组、对照组,处理组表达量均高于对照组。如6b显示,热激处理48 h后,表达量由高到低依次为:0.1 mg/L处理组、0.02 mg/L处理组、0.5 mg/L处理组、0.004 mg/L处理组、对照组。该结果表明处理组HSP70基因的表达量均高于对照组,且0.1 mg/L浓度与对照组差异显著(p<0.05)。
24 h热激后PE基因相对表达量趋势如图7a,由高到低依次为:0.1 mg/L处理组、0.02 mg/L处理组、0.5 mg/L处理组、0.004 mg/L处理组、对照组,浓度为0.1 mg/L处理组表达量与除0.02 mg/L处理组外其他各组差异性显著 (p<0.05)。48 h热激后的相对表达量如图7b,由高到低依次为:0.1 mg/L处理组、0.5 mg/L处理组、0.02 mg/L处理组、0.004 mg/L处理组、对照组,同样浓度为0.1 mg/L处理组表达量与对照组差异性显著 (p<0.05)。结果表明处理组PE基因的表达量均高于对照组,在0.1 mg/L浓度最显著。
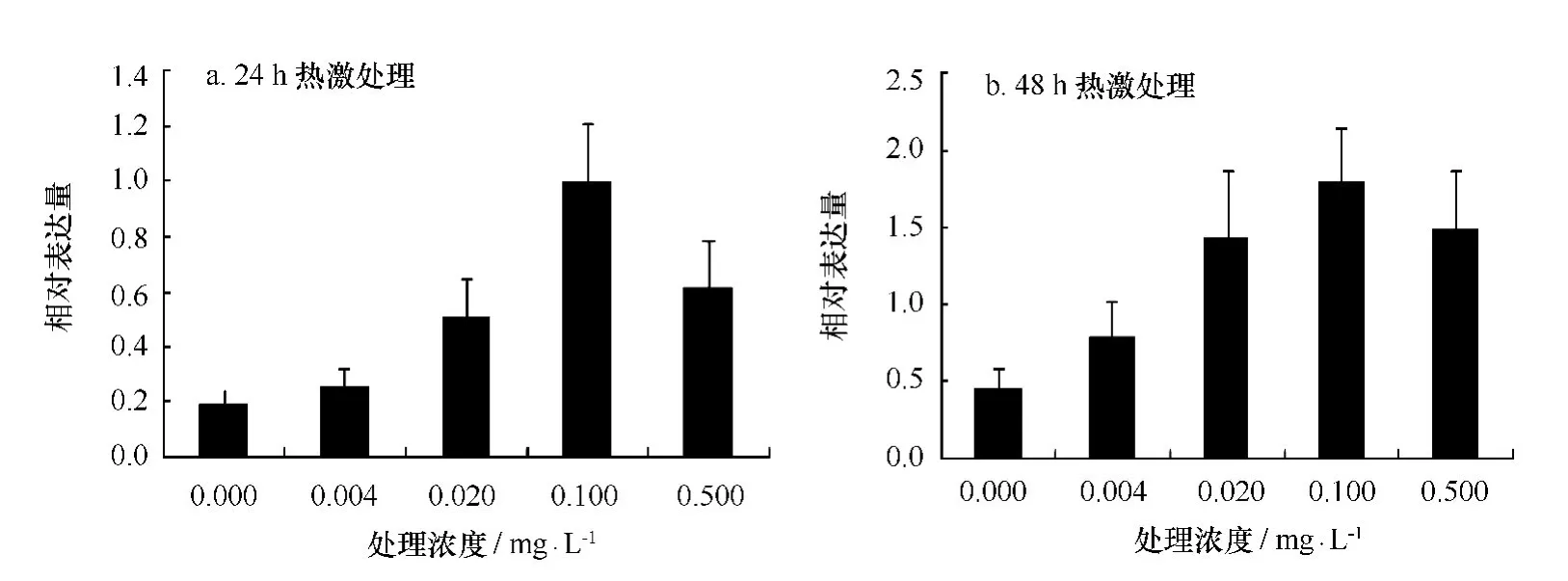
图6 不同浓度24-表油菜素内酯对高温下龙须菜HSP70基因相对表达的影响Fig.6 Effects of different concentration of 24-epibrassinolide on the relative expression of HSP70 of G.lemaneifor mis under high temperature(mean±SD)
龙须菜在热激处理24 h后,不同处理组GR相对表达量情况如图8a,由高到低依次为:0.1 mg/L处理组、0.5 mg/L 处 理 组、0.002 mg/L 处 理 组、0.004 mg/L处理组、对照组,浓度为0.1 mg/L处理组表达量最高,与对照组差异性显著 (p<0.05)。48 h热激后,GR相对表达量情况如图8b,由高到低依次为:0.1 mg/L处理组、0.5 mg/L处理组、0.02 mg/L处理组、0.004 mg/L处理组、对照组,以0.1 mg/L处理组表达最高,与对照组差异性显著 (p<0.05)。结果表明处理组GR基因的表达量均高于对照组,在0.1 mg/L浓度最显著。
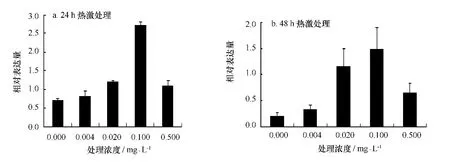
图7 不同浓度24-表油菜素内酯对高温下龙须菜PE基因相对表达的影响Fig.7 Effects of different concentration of 24-epibrassinolide on the relative expression of PE of G.lemaneifor mis under high temperature(mean±SD)
4 讨论
高温胁迫下,植物会打破体系原有的动态平衡,导致氧代谢失调,造成活性氧、丙二醛的积累,改变膜的透性,严重时对植物可造成致死性伤害[9];藻体中的藻胆蛋白是PSⅡ捕光色素复合体,能够直接吸收光能,作为天线色素参与光合作用,而且还可以作为藻体细胞的贮存蛋白,有利于藻类在自然界中的生存竞争,但高温极易导致藻体内色素蛋白复合体PSⅡ失活,藻胆蛋白降解[10],使逆境下藻类的光合活性降低,影响藻体生长。
研究结果显示油菜素内酯能提高小球藻细胞内核酸和蛋白质的合成量,从而促进小球藻的生长和生物量的合成[11];表油菜素内酯还能影响硅藻卡尔文循环的关键酶,改善硅藻的生长生理[12];在油菜素内酯对莱茵衣藻生物量积累和生长速度影响的研究中发现,表油菜素内酯能够加速藻细胞的生长速度[13];在高温胁迫下用表油菜素内酯处理甜瓜幼苗,结果提高了甜瓜幼苗抗氧化酶活性,加强其对光能的捕获、转换,促进幼苗的生长,降低高温胁迫的抑制作用[14]。
张慎好等研究发现在发芽期用油菜素内酯浸种能提高种子的发芽率并促进侧根生长、胚根生长[15]。本实验结果显示添加24-表油菜素内酯的处理组生长速率均高于对照组,24-表油菜素内酯提高了龙须菜的生长速率。
曹云英和赵华发现表油菜素内酯能够增强稻苗体内活性氧保护酶系统SOD和POD的活性和诱导其表达,有效减轻高温对秧苗的伤害[16]。本实验中,SOD、POD均随着高温逆境时间的增加而呈先上升后下降的趋势。高温逆境刚开始时,龙须菜体内的抗氧化酶系统受高温逆境诱导而启动,随着自由基的增多,酶的活性不断上升以清除自由基,使其维持在平衡状态。但处理组与对照组相比能显著地提高龙须菜体内的SOD、POD,尤其以0.1 mg/L和0.02 mg/L对龙须菜抗氧化酶的提高最为显著,与对照差异显著。且以0.1 mg/L 24-表油菜素内酯处理的龙须菜SOD、POD活性最大。
高温逆境下藻类的光合活性会降低[17]。本实验结果显示经高温逆境后,龙须菜的各个荧光参数Fv/Fm、ΦPSⅡ和q P均下降。但是经过24-表油菜素内酯处理后,各荧光参数的下降幅度都比对照要慢,说明添加24-表油菜素内酯能在一定程度上改善高温逆境下龙须菜的光合生理状态。Fv/Fm下降说明高温损伤PSⅡ反应中心,而添加24-表油菜素内酯能够抑制高温对PSⅡ反应中心的损伤,减缓高温对光合作用原初反应的抑制,减轻对光合电子传递过程的阻碍。高温能影响藻细胞对碳的固定与同化,ΦPSⅡ在高温下随时间的延长逐渐下降,而本实验中添加24-表油菜素内酯能显著提高PSⅡ实际光能转化效率,提高光合能力。PSⅡ实际光能转化效率光化学淬灭qp的下降说明用于进行光合作用的电子减少,与ΦPSⅡ的下降相一致。24-表油菜素内酯处理组与对照组相比q P值有了一定的提高,增强了光适应状态下PSⅡ进行光化学反应的能力。非光化学淬灭NPQ在高温逆境下有所升高表明PSⅡ吸收的光能以热的形式耗散的部分增多,避免过多光能损伤光合器官,保护藻体[18],而24-表油菜素内酯能在一定程度上显著提高NPQ,从而更好地提高PSⅡ的热耗散能力,保护藻体的光合结构。
在一定胁迫范围内,植物能通过自身细胞的渗透调节作用表现出抵抗外界渗透胁迫的能力。甘露醇作为植物一种重要的渗透调节物质,不仅对细胞渗透压起到调节作用,还对活性氧特别是O2-和·OH的产生有抑制作用,而且对已生成的·OH则有清除作用,对植物抗逆性有双重作用[19]。有研究证明藻类能通过调节藻体内甘露醇的含量来适应渗透压的改变[20]。本试验中0.10 mg/L的24-表油菜素内酯处理组能显著提高龙须菜在高温下的甘露醇含量,甘露醇的积累不仅提高了龙须菜细胞的渗透调节能力,而且通过清除·OH而使龙须菜免受高温氧化伤害。
高温逆境下,藻体活性氧自由基的积累会引起膜脂过氧化,而丙二醛是膜脂过氧化的主要产物之一,研究中常以丙二醛含量来反映植物膜脂过氧化水平和对细胞膜的伤害程度,其含量大小与逆境的耐性密切相关。张元等研究认为高温逆境会提高坛紫菜体内的丙二醛含量,引起膜脂过氧化[21]。本实验中,龙须菜体内的丙二醛随着时间的延长而呈上升趋势,膜脂过氧化程度加重。各浓度24-表油菜素内酯处理组的龙须菜丙二醛含量都低于对照,其中0.10 mg/L 24-表油菜素内酯处理的龙须菜丙二醛含量最低,细胞膜酯过氧化程度最低,从而使藻体能维持正常的生理生化代谢过程。
红藻中的光合色素除了叶绿素a外主要是藻胆蛋白,包括藻红蛋白、藻蓝蛋白和别藻蓝蛋白。藻胆蛋白是PSⅡ捕光色素复合体,能够直接吸收光能并传递给PSⅡ,但是却容易受到高温等外界环境的影响[22],本实验研究发现,在高温逆境初期(1 d)龙须菜藻胆蛋白含量开始下降,这一结果应证了高温逆境对藻体内藻胆蛋白的破坏。在实验整个过程中,各个24-表油菜素内酯处理组的藻胆蛋白都高于对照组,其中0.1 mg/L处理组的藻胆蛋白显著高于对照。藻红蛋白荧光定量表达研究结果同样显示,处理组表达量高于对照组,尤其0.1 mg/L浓度处理组显著高于对照组。24-表油菜素内酯缓解了高温对藻红蛋白的破坏。
热激蛋白的表达是细胞受高温胁迫后在分子水平上最主要的响应之一。热激蛋白可以通过阻止蛋白质的变性以及促使变性蛋白复性,保护胁迫条件下的细胞少受损伤。有研究表明在无芒雀麦中加入24-表油菜素内酯能增加热激蛋白基因表达从而提高抗热力[23]。本实验显示,24-表油菜素内酯可显著提高热激胁迫下HSP70的表达水平,以提高在高温下龙须菜的耐受性,尤其在0.1 mg/L浓度处理组有显著性差异。
谷胱甘肽还原酶是植物细胞抗氧化酶系统中重要的一员,它通过参与抗坏血酸-谷胱甘肽循环而在细胞活性氧的清除中起重要作用[24],郭丽红等研究也表明谷胱甘肽还原酶在抗氧化系统和植物对逆境的适应中起重要作用[25]。本实验研究显示加入24-表油菜素内酯处理组的GR相对表达量比对照组有所增加,以0.1 mg/L浓度处理组表达量最为显著,从而提高龙须菜在高温逆境时的抗氧化酶活性。
综上所述24-表油菜素内酯通过提高SOD、POD酶活性、HSP70、GR基因相对表达量,清除细胞在高温逆境中增加的活性氧、变性蛋白,降低MDA含量,稳定膜结构;同时能提高体内渗透调节物质甘露醇含量,促进藻胆蛋白的合成,促进PSⅡ的光合作用活性从而使龙须菜在高温下能维持正常的生理功能,提高高温耐受力。
[1]Nelson S G,Glenn E P,Conn J,et al.Cultivation ofGracilariaparvispora(Rhodophyta)in shri mp-far m effluent ditches and floating cages in Hawaii:a two-phase polyculture system[J].Aquaculture,2001,193(3/4):239-248.
[2]刘朝阳,刘晓庆.龙须菜的生物学作用及应用前景[J].养殖与饲料,2007(5):55-58.
[3]Zhou Y,Yang H S,Hu H Y,et al.Bioremediation potential of the macroalgaGracilarialemaneifor mis(Rhodophyta)integrated into fed fish culture in coastal waters of north China[J].Aquaculture,2006,252(2/4):264-276.
[4]郭奇珍.新型植物激素-油菜素内酯[J].植物生理学通讯,1983(2):7-13.
[5]王广聚,董服灿,董建军,等.24-表油菜素内酯的合成及应用研究[J].农药,2001,40(6):12-15.
[6]Sasse J M.Physiological actions of brassinosteroids:an update[J].Journal of Plant Growth Regulation,2003,22(4):276-288.
[7]Abreu M H,Varela D A,Henríquez L,et al.Traditional vs.integrated multi-trophic aquaculture ofGracilariachilensisC.J.Bird,J.Mc Lachlan&E.C.Oliveira:productivity and physiological perfor mance[J].Aquaculture,2009,293(3/4):211-220.
[8]朱招波,孙雪,徐年军,等.水杨酸对龙须菜抗高温生理的影响[J].水产学报,2012,36(8):1304-1312.
[9]Wahid A,Gelani S,Ashraf M,et al.Heat tolerance in plants:An overview[J].Environ mental and Experi mental Botany,2007,61(3):199-223.
[10]Morgan-Kiss R,Ivanov A G,Williams J,et al.Differential ther mal effects on the energy distribution bet ween photosystemⅡand photosystemⅠin thylakoid membranes of a psychrophilic and a mesophilic alga[J].Biochi mica et Biophysica Acta(BBA)-Biomembranes,2002,1561(2):251-265.
[11]Bajguz A.Effect of brassinosteroids on nucleic acids and protein content in cultured cells ofChlorellavul garis[J].Plant Physiology and Biochemistry,2000,38(3):209-215.
[12]Mekhalfi M,Avilan L,Lebrun R,et al.Consequences of the presence of 24-epibrassinolide,on cultures of a diatom,AsterionellaFor mosa[J].Bio-chi mie,2012,94(5):1213-1220.
[13]Chang A,Chang M,Feng P,et al.Characterization and analysis of the exogenous application of selected phytohor mones onC.reinhar dtiimetabolism[D].Washington:University of Maryland,2011.
[14]张永平,杨少军,陈幼源.2,4-表油菜素内酯对高温胁迫下甜瓜幼苗抗氧化酶活性和光合作用的影响[J].西北植物学报,2011,31(7):1347-1354.
[15]张慎好,武春成,赵振忠,等.油菜素内酯在黄瓜上的应用效果研究[J].种子,2009,28(6):98-101.
[16]曹云英,赵华.高温胁迫下油菜素内酯对水稻幼苗的保护作用[J].中国水稻科学,2007,21(5):525-529.
[17]赵素芬,何培民.高温对两种卡帕藻的酶活性、色素含量与叶绿素荧光的影响[J].生态学报,2011,31(22):6845-6852.
[18]梁英,冯力霞,田传远.高温胁迫对球等鞭金藻3011和8701叶绿素荧光特性的影响[J].水产学报,2009,33(1):37-44.
[19]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[20]Iwamoto K,Shiraiwa Y.Salt-regulated mannitol metabolism in algae[J].Marine Biotechnology,2005,7(5):407-415.
[21]张元,谢潮添,陈昌生,等.高温胁迫下坛紫菜叶状体的生理响应[J].水产学报,2011,35(3):379-386.
[22]Al mesel mani M,Desh mukh P S,Sairam R K,et al.Protective role of antioxidant enzy mes under high temperature stress[J].Plant Science,2006,171(3):382-388.
[23]Wilen R W,Saccom,Gusta L V,et al.Effects of 24-epibrassinolide on freezing and ther motolerance of bromegrass(Bromusiner mis)cell cultures[J].Physiologia Plantar um,1995,95(2):195-202.
[24]Mallick N,Mohn FH.Reactive oxygen species:response of algal cells[J].Journal of Plant Physiology,2000,157(2):183-193.
[25]郭丽红,陈善娜,龚明.钙对玉米幼苗谷胱甘肽还原酶活性的影响[J].植物生理学通讯,2002,38(2):115-117.

