CYP3A4/5、ABCB1基因单倍型与中国肾移植患者他克莫司血药谷浓度相关性的研究*
李丹滢,方 芸
南京大学医学院附属鼓楼医院药学部,南京 210008
他克莫司(tacrolimus,FK506)是从土壤放线菌中分离出来的一种具有大环内酯结构的新型强力免疫抑制剂。从1984年发现至今,己在临床广泛应用于各类器官移植和自身免疫系统疾病。FK506在体内主要经CYP3A4/5药物代谢酶代谢,再由P糖蛋白(P-glycoprotein,P-gp)转运。P-gp是由 ATP 结合蛋白(ABC)亚科 B运载体1基因(ABCB1),亦称多药耐药基因1(MDR1)编码之产物。
药物基因组学认为,CYP3A4/5及P-gp的基因突变是造成FK506临床疗效个体差异显著的原因之一[1-2]。目前仅明确CYP3A5*3基因多态性与FK506代谢相关,而ABCB1基因多态性对FK506的影响尚存争议[3-5]。CYP3A4*18B是近几年被发现的,在亚洲人群中具有较高突变频率的基因多态位点[6]。若干研究已证实该位点可导致CYP3A4酶活性的上升,并与FK506和环孢素(cyclosporine,CsA)体内代谢个体差异有关。
本研究旨在联合考察CYP3A4*18B、CYP3A5*3及ABCB1单倍型与患者术后1个月内FK506血药谷浓度的相关性,进而在预测FK506最佳初始剂量的同时,也为用药后剂量调整提供新的依据。
1 仪器与试剂
Viva-E型血药浓度分析仪(Dade Behring Company Ltd.,Germany);EDC-810 型基因扩增仪(东胜创新生物科技有限公司)。
FK506质控试剂盒、标准曲线试剂盒及药品试剂盒均为Dade Behring公司专用试剂。
FK506胶囊为沈阳安斯泰来有限公司产品;引物由上海英骏生物技术有限公司合成。
血液基因组DNA提取试剂盒(北京天根生物技术有限公司);RsaI限制性内切酶及PCR试剂(Promega,上海)。
2 方 法
2.1 研究对象
2006年4月至2011年11月,在我院泌尿外科行肾移植术后服用FK506的患者46例(男30例,女 16例),年龄为 14岁~57岁,平均年龄(34.8±8.1)岁;体重 34.0 kg~93.0 kg,平均体重(59.5±10.1)kg。患者均为首次接受肾移植手术,术后均采用常规三联免疫抑制方案:FK506+吗替麦考酚酯+糖皮质激素,术后3~7天或消化道反应消失后开始给予FK506,分 2 次口服。吗替麦考酚酯 2 g·d-1,分 2 次口服。糖皮质激素术后第一天给药96 mg,随后每天减16 mg至16 mg维持。此研究已经过本院伦理委员会批准,患者均自愿参加并已签署知情同意书。
2.2 血样采集与血药浓度测定
口服FK506患者血药浓度达稳态后,于清晨给药前采静脉血1 mL,置肝素抗凝管中,采用酶增强免疫测定技术(EMIT)测定全血FK506谷浓度。
2.3 等位基因型测定
抗凝血标本在-25℃条件下保存。取抗凝血200 μL,按照试剂盒说明书从血样中提取患者基因组DNA。 采 用 PCR-RFLP法 对 CYP3A4*18B、CYP3A5*3、ABCB1(C1236T、G2677A/T、C3435T)共5个位点进行等位基因检测,扩增引物见表1。实验条件参考文献[7]。

表 1 CYP3A4*18B、CYP3A5*3 及 ABCB1(C1236T,G2677A/T,C3435T)等位基因扩增引物及限制性内切酶
2.4 数据分析
分别计算患者5个等位基因的基因频率并进行Hardy-Weinberg遗传平衡检验。利用SHEsis软件[8-9]分析患者5个等位基因间的连锁不平衡关系,找出主要单倍型并计算频率。Stata 10.0软件则用于分析不同单倍型组间血药浓度的差异。经Shapiro-Wilk W检验呈非正态分布的数据,采用Mann-Whitney U检验进行比较;呈正态分布的数据则采用unpaired-T或one way ANOVA检验进行2组或3组间比较。P<0.05认为具有统计学差异。
3 实验结果
3.1 CYP3A4*18B,CYP3A5*3 及 ABCB1(C1236T、G2677A/T、C3435T)等位基因频率
46例肾移植患者CYP3A4*18B、CYP3A5*3及ABCB1(C1236T、G2677A/T、C3435T)基因型频率及等位基因频率见表2。对基因型分布进行Hardy-Weinberg遗传平衡吻合度计算,结果显示P>0.05,基因频率达到遗传平衡,研究资料具有群体代表性。
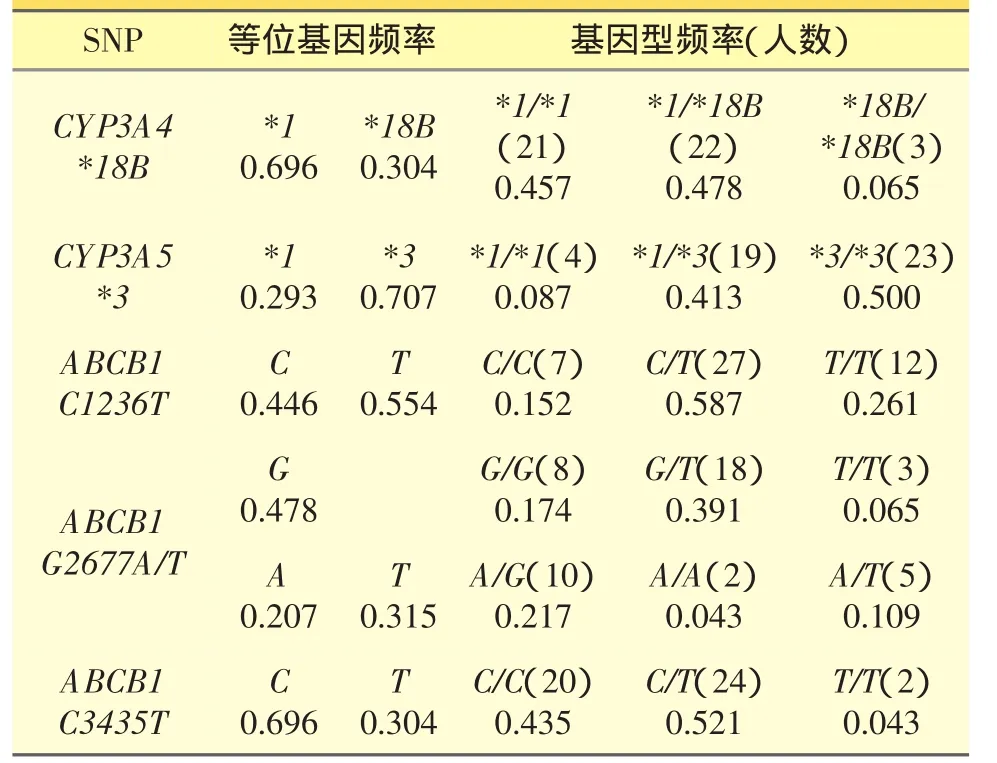
表2 46例中国汉族肾移植患者CYP3A4*18B、CYP3A5*3及ABCB1(C1236T、G2677A/T、C3435T)基因频率计算
连锁不平衡分析结果见图1。3种ABCB1等位基因中仅G2677A/T-C3435T及C1236T-C3435T间存在明确的连锁不平衡关系,D’分别为0.94和0.71。对ABCB1单倍型作进一步分析后发现4种主要单倍型及4种次要单倍型。这4种主要单倍型及其频率(1236-2677-3435)分别为:TGC(26.2%)、TTT(26.0%)、CGC(21.0%)、CAC(20.2%)。4 种次要单倍型共占6.8%(见图2)。

图1 CYP3A4*18B,CYP3A5*3,ABCB1 C1236T,G2677T/A及C3435T连锁不平衡关系
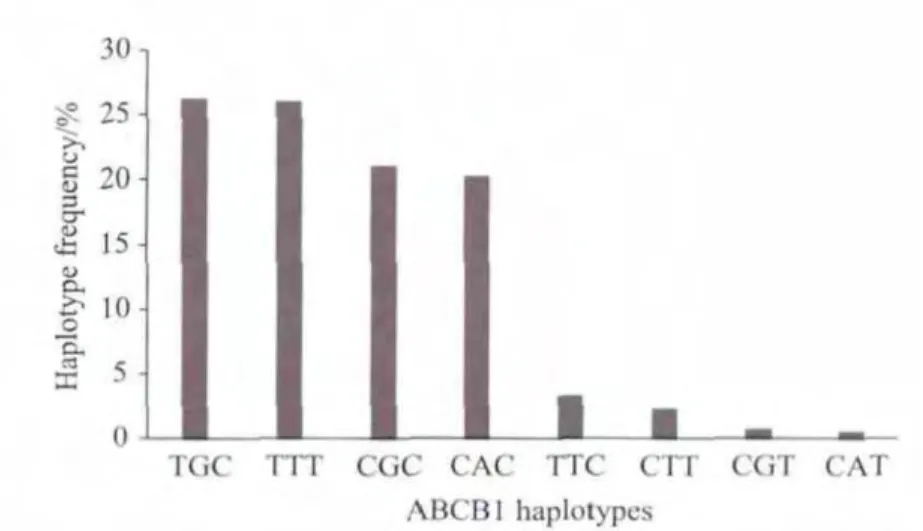
图2 46例中国汉族肾移植患者ABCB1单倍型及其频率
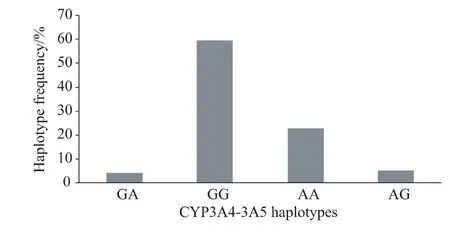
图3 46例中国汉族肾移植患者CYP3A4/5单倍型及其频率
CYP3A4*18B及CYP3A5*3之间也存在明确的连锁不平衡(D’=0.77)。CYP3A5表达患者携带CYP3A4*18B(A)等位基因的概率远大于CYP3A4*1(G)。4种CYP3A4/5单倍型及频率见图3。
3.2 CYP3A4*18B,CYP3A5*3 及 ABCB1(C1236T、G2677A/T、C3435T)等位基因对FK506药物浓度监测结果的影响
为便于比较,根据个体给药剂量和体重将血药浓度标准化,以此观察基因多态性对血药浓度的影响。肾移植术后1个月内(见表3),CYP3A5*3基因对患者FK506 C0/D值存在显著性影响。突变纯合型患者C0/D值在移植术后1~7、8~15及16~30天时分别为野生型患者的1.56、1.98及1.99倍。与CYP3A5*3等位基因不同,CYP3A4*18B基因仅在移植术后8~15及16~30天时对患者FK506 C0/D值有显著性影响。野生纯合型患者C0/D值分别为突变型患者的1.34及1.67倍。仅C3435T等位基因在移植术后8~15天与患者FK506 C0/D值显著相关,其余2种ABCB1等位基因对患者FK506 C0/D值无显著性影响。
3.3 单倍型对FK506药物浓度监测结果的影响
根据连锁不平衡分析结果,对1种CYP3A4/5单倍型及2种主要ABCB1单倍型与FK506 C0/D值的相关性进行了研究。表4给出CYP3A4/5主要单倍型GG型对FK506血药浓度的影响。GG型携带者与非携带者FK506 C0/D值在移植术后8~15、1~30天时存在显著性差异,GG型携带者的C0/D为非携带者的1.43及1.77倍。未观察到ABCB1基因主要单倍型TGC及CGC对FK506血药浓度的影响,另外两种ABCB1基因主要单倍型TTT及CAC,由于患者数量少(仅2人),故未作考察。

表3 中国汉族肾移植患者术后1月内5种等位基因对FK506 C0/D值的影响
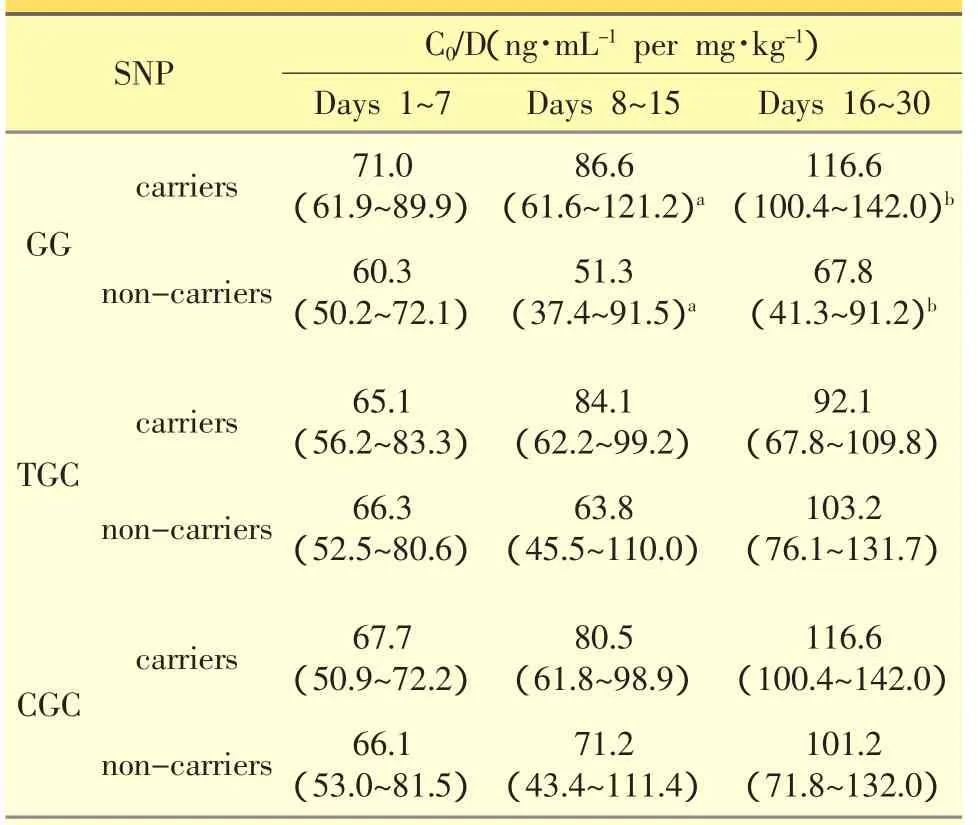
表4 中国汉族肾移植患者术后1月内单倍型对FK506 C0/D值的影响
4 讨论
FK506作为预防和治疗排斥反应的基础用药,具有治疗效果好、肝肾毒性小的特点。但该药治疗窗窄,个体间药动学差异大,必须进行个体化给药。毫无疑问,CYP3A5*3基因多态性与FK506的代谢有很强的相关性。它对FK506效应的影响早在首次剂量时就发生。但是ABCB1基因多态性与FK506的相关性目前仍在争论之中。CYP3A4*18B等位基因是现在所有的CYP3A4等位基因中突变频率最高的一个位点,已有研究发现该位点可使其代谢底物FK506清除率升高,血浆药物浓度降低。
本研究中46例肾移植患者的CYP3A4*18B、CYP3A5*3、ABCB1(C1236T、G2677A/T、C3435T)等位基因频率分别为30.4%、70.7%、55.4%、47.8%及30.4%,均达到遗传平衡,并与文献报道的中国汉族人群各位点突变频率[10]基本吻合。
研究结果显示,移植术后8~15天及16~30天内CYP3A4*18B与患者FK506 C0/D值存在显著相关性,突变型患者C0/D值分别较野生纯合型患者低25.5%和40.1%。这可能是由于该等位基因突变提高了CYP3A4酶活性,使其代谢底物清除率升高,血浆药物浓度降低,从而表现为突变型患者的血药浓度显著降低。该结论与侯明明[11]的研究结果一致,提示该等位基因可能是导致FK506药动学个体差异的又一重要遗传因素。两组不同的CYP3A5*3基因型患者FK506 C0/D值也存在显著性差异,突变纯合型患者C0/D值显著高于野生型患者。该结果进一步支持了现有的结论,即野生型肾移植患者可能需要服用比较高剂量的FK506才能达到治疗靶浓度范围。本研究中,ABCB1基因C1236T位点与G2677T位点与FK506血药浓度间无明显相关性;仅C3435T位点为CC型的患者,在移植术后8~15天时需要更高剂量的FK506。这可能是由于三者间存在连锁关系,对FK506药动学的影响比较复杂,单独一个突变的关系不能确定。
研究新发现,从CYP3A4/5单倍型考虑,GG型携带者与非携带者FK506 C0/D值存在显著性差异。术后8~15天及16~30天内,非携带者C0/D值为携带者的69.9%及56.5%。Shi等[12]也认为,虽然CYP3A4*18B和CYP3A5*3均与FK506药代动力学参数相关,但单倍型的影响更大。他们利用NONMEM软件计算后发现,GG型携带者的CL/F值为10.3 L·h-1,仅为非携带者的48.5%。GG型患者仅需服用较少的FK506,便可达到有效的血药浓度范围。研究并未发现ABCB1基因TGC及CGC单倍型对FK506血药浓度的显著性影响。有观点认为:FK506是CYP3A酶和P-gp的共同底物。胃肠道P-gp的活性能够调整CYP3A5酶对FK506的代谢,故评价P-gp独立的功能应该选择不表达CYP3A5酶的患者,即携带CYP3A5*3/*3基因型的患者[13]。因此Wang J等[14]对91例不表达CYP3A5酶的肺移植患者进行了ABCB1单倍型分析,结果ABCB1单倍型对FK506分布的影响有显著性意义。移植后第1个月CGC-CGC患者FK506 C0/D值明显低于CGC-TTT和TTT-TTT单倍型患者,且移植后3个月和12个月也有相似的发现。本研究由于样本量少,故未作相似的统计分析,这可能是未发现ABCB1单倍型对FK506血药浓度的显著性影响的原因。
综上所述,CYP3A4/5单倍型对肾移植患者术后一个月的FK506药代动力学有影响,单倍型为GG型的患者仅需服用较低的剂量就可达到FK506的靶血药浓度。器官移植前,对这两个位点进行基因型检测可以为FK506的个体化运用提供积极的指导作用。但导致FK506个体化差异的原因除遗传因素之外,还和众多临床因素相关,因此应结合遗传因素和肾移植术后的临床特点,对其进行个体化给药,尽可能地减少排斥反应和不良反应的发生,提高移植患者的生存率和生存质量,同时减少患者的经济负担。
[1]Rosso FC,De Sandes TV,Sampaio EL,et al.Clinical impact of polymorphisms of transport proteins and enzymes involved in the metabolism of immunosuppressive drugs[J].Transplant Proc,2009,41(6):1441-55.
[2]Grenda R,Prokurat S,Ciechanowicz A,et al.Evaluation of the genetic background of standard-immunosuppressant-related toxicity in a cohort of 200 paediatric renal allograft recipients-a retrospective study[J].Ann Transplant,2009,14(3):18-24.
[3]ZhangX,Liu ZH,ZhengJM,etal.Influenceof CYP3A5 and MDR1 polymorphisms on tacrolimus concentration in the early stage after renal transplantation[J].Clin Transplant,2005,19(5):638-643.
[4]Provenzani A,Notarbartolo M,Labbozzetta M,et al.The effect of CYP3A5 and ABCB1 single nucleotide polymorphisms on tacrolimus dose requirements in Caucasian livertransplantpatients[J].Ann Transplant,2009,14(1):23-31.
[5]Dai Y,Hebert MF,Isoherranen N,et al.Effect of CYP3A5 polymorphism on tacrolimus metabolic clearance in vitro[J].Drug Metab Dispos,2006,34(5):836-847.
[6]Fukushima-Uesaka H,Saito Y,Watanabe H,et al.Haplotypes of CYP3A4 and their close linkage with CYP3A5 haplotypes in a Japanese population[J].Hum Mutat,2004,23(1):100-8.
[7]李丹滢,方 芸.CYP3A4*18B基因多态性与他克莫司血药浓度的相关性研究 [J].药学与临床研究,2012,20(1):12-5.
[8]Li Z,Zhang Z,He Z,et al.A partition-ligation-combination-subdivision EM algorithm for haplotype inference with multiallelic markers:update of the SHEsis(http://analysis.bio-x.cn)[J].Cell Res,2009,19(4):519-23.
[9]Shi YY,He L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].Cell Res,2005,15(2):97-8.
[10]Qiu XY,Jiao Z,Zhang M,et al.Association of MDR1,CYP3A4*18B and CYP3A5*3 Polymorphisms with cyclosporine pharmacokinetics in Chinese renal transplant recipients[J].Eur J Clin Pharmacol,2008,64(11):1069-84.
[11]侯明明,侯 颖,宋洪涛,等.肾移植患者CYP3A4基因多态性对他克莫司疗效和不良反应的影响 [J].中国药房,2010,21(26):2427-9.
[12]Shi XJ,Geng F,Jiao Z,et al.Association of ABCB1,CYP3A4*18B and CYP3A5*3 genotypeswith the pharmacokinetics oftacrolimus in healthy Chinese subjects:a population pharmacokinetic analysis[J].J Clin Pharm Ther,2011,36(5):614-24.
[13]朱 琳,华之卉,宋洪涛.他克莫司的药物基因组学与个体化用药 [J].中国临床药理学与治疗学,2011,16(6):710-5.
[14]Wang J,Adriana Z,Kenneth M,et al.Impact of ABCB1 (MDR1)haplotypes on tacrolimus dosing in adult lung transplant patients who are CYP3A5*3/*3 nonexpressors[J].Transplant Immunol,2006,15(3):235-40.

