调节性T细胞在poly I:C/D-GalN诱发的肝脏损伤中的免疫调节作用①
宋 静 王黎丽 侯 昕 沈际佳 (安徽医科大学基础医学院病原生物学教研室,合肥230001)
急性肝损伤指各种原因引起的肝脏功能的损害,肝损伤是急性肝功能衰竭的基础,严重或持续的肝损伤最终导致肝功能衰竭。其中,病毒性肝损伤并不是肝炎病毒在肝细胞内复制造成的直接损伤,而是病毒感染后机体的免疫反应造成的肝脏损伤。由于缺乏足够的人类肝脏病变标本和人力实验操作的困难以及伦理学难题,研究者们建立了模拟人类肝脏病理损伤的动物模型,用来探索肝脏疾病中的免疫致病机理。
1995年,Sakaguchi等人[1]发现在正常人和小鼠外周血及脾脏组织的CD4+T细胞中有一亚群持续高表达CD25分子(IL-2受体α链),去除该群细胞可诱导各种自身免疫性疾病的发生[2],据此表明该群细胞是一类重要的免疫调节细胞,将此类细胞命名为调节性T细胞。该细胞亚群具有显著的免疫抑制作用,可通过不同途径作用于多种靶细胞,从而对机体免疫应答进行精细的负调节。
本试验中我们用病毒模拟物Polyinosinic-polycytidylic acid(poly I:C)和致敏剂D-galactosamine(D-GalN)联合注射建立小鼠爆发性肝炎模型,该损伤主要由天然免疫细胞Kupffer细胞和自然杀伤(NK)细胞介导,天然免疫细胞释放的 IFN-γ和TNF-α等炎性因子参与了肝损伤的发生发展[3]。鉴于该模型的肝脏免疫损伤可以自愈[3],而调节性T细胞是一群具有负调节作用的T细胞亚群,它不仅可以抑制效应T细胞的反应,而且可以缓解天然免疫细胞引发的病理损伤[4]。故我们推测调节性T细胞可能对该肝炎模型中天然免疫细胞有负向调节作用。
1 材料与方法
1.1 实验动物 C57BL/6,SPF级,雄性,4周龄,购于安徽医科大学实验动物中心。C57BL/6遗传背景的Rag1-/-小鼠,SPF级,购于南京大学模式动物遗传中心。实验动物由安徽医科大学寄生虫学教研室动物房饲养(SPF级,22℃,55%湿度,12 h白天/黑夜)。小鼠处理过程和实验流程遵循实验动物管理规范条例。
1.2 主要试剂 血清转氨酶检测试剂盒购于上海荣盛生物技术有限公司。Poly I:C、TRIzol、M-MLV、RT buffer和MDTT购于InvivoGen公司。D-GalN购于Sigma公司。Tag酶、SYBR Premix EX Tag购于大连宝生物工程有限公司。小鼠 IFN-γ和 TNF-α ELISA检测试剂盒购于深圳达科为公司。Anti-FITC磁珠及分选仪购于Miltenyi Biotec公司。
1.3 方法
1.3.1 模型建立及材料收集 从小鼠尾静脉处注射poly I:C(2 μg/只),同时给小鼠腹腔注射 DGalN(10 mg/只),建立小鼠急性肝损伤模型。于药物注射后12、18、24和48 h,剖杀小鼠,收集血清,-80℃冰箱保存,用于血清ALT检测及TNF-α和IFN-γ检测。摘取小鼠肝脏,留取部分放入4%甲醛溶液中固定,石蜡包埋并切片,用于病理分析。余下肝脏放入-80℃冰箱保存,用于RT-PCR检测。
1.3.2 血清转氨酶(ALT)检测 采集小鼠血清样本后,按试剂盒说明书进行检测。通过标准品吸光度值绘制标准曲线,然后计算各个样品的值。
1.3.3 肝脏HE染色 取同一部位肝脏,福尔马林固定,脱水,石蜡包埋,连续切片HE染色,显微镜下随机选择10个低倍视野观察炎性细胞浸润情况及肝组织细胞坏死情况。
1.3.4 实时荧光定量PCR检测肝脏TNF-α和IFN-γ mRNA水平 用TRIzol试剂提取肝脏总RNA,逆转录成互补cDNA,以此为模板RT-PCR扩增片段。RT-PCR按SYBY Premis EX Tag II(TaKaRa Code DRR 041A)试剂盒说明书加样,之后用ABI公司的StepOnePlus Real-time PCR仪检测。目的基因引物序列 β-actin的上游引物:5'-TGG AAT CCT GTG GCA TCC ATG AAA-3',下游引物:5'-TAA AAC GCA GCT CAG TAA CAG TCC G-3'。TNF-α 的上游引物:5'-ACT GGC AGA AGA GGC ACT C-3',下游引物:5'-CTG GCA CCA CTA GTT GGT TG-3'。IFN-γ的上游引物:5'-AAC GCT ACA CAC TGC ATC T-3',下游引物:5'-GAG CTC ATT GAA TGC TTG G-3'。反应条件:95℃ 10 s,95℃ 15 s,60℃ 40 s,40 个循环进行扩增。采用ΔΔCt方法分析结果。
1.3.5 ELISA法检测血清IFN-γ和TNF-α蛋白水平 采集小鼠血清样本后,按试剂盒说明书进行检测。通过标准品吸光度值绘制标准曲线,然后计算各个样品的值。
1.3.6 免疫磁珠法分选CD25+细胞 杀鼠取脾脏,无菌分离脾脏单个核细胞,按照磁珠使用说明书分选CD25+单个核细胞和CD25-单个核细胞。
1.3.7 细胞转输 将免疫磁珠法分选出的CD25+细胞和 CD25-细胞按 1×106个/只鼠分别给Rag1-/-小鼠尾静脉注射,然后立刻尾静脉处注射poly I:C(2 μg/只),腹腔注射 D-GalN(10 mg/只)。
1.4 统计学处理 采用SPSS11.0软件统计,数据以±s表示,两组数据均值,选用独立样本t检验;组间数据比较,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 野生型小鼠较Rag1-/-小鼠的肝脏炎症损伤明显加重
2.1.1 野生型小鼠和Rag1-/-小鼠poly I:C/DGalN注射后血清ALT检测和肝脏H-E染色分析Rag1-/-小鼠在注射poly I:C/D-GalN后注射后18、24和48 h血清ALT水平均高于野生型小鼠(P<0.05),可见Rag1-/-小鼠在同等剂量的poly I:C/DGalN联合注射后肝脏损伤比野生型小鼠更为严重。见图1。肝脏H-E染色可见注射后18和24 h,与野生型小鼠相比Rag1-/-小鼠肝脏呈现严重的充血、肝细胞坏死以及炎症细胞浸润。注射后48 h,野生型小鼠肝脏损伤基本恢复正常,而Rag1-/-小鼠肝脏仍存在轻微损伤。见图2所示。

图1 野生型小鼠和Rag1-/-小鼠poly I:C/D-GalN注射后12、18、24和48 h检测转氨酶水平Fig.1 WT mice and Rag1 -/- mice were injected with poly I:C/D-GalN at 12,18,24 and 48 hours after injection,serum ALT levels were measured
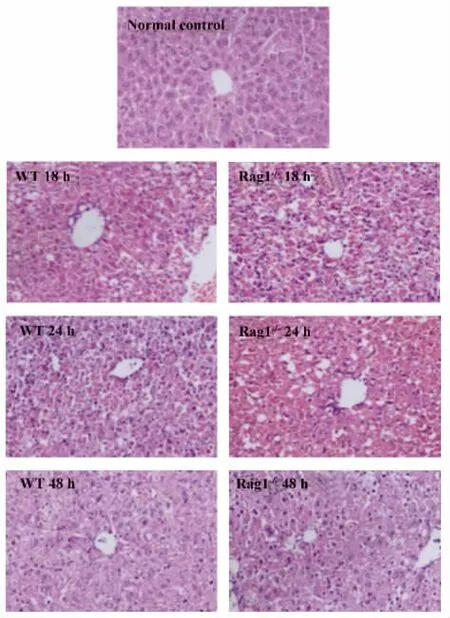
图2 野生型小鼠和Rag1-/-小鼠poly I:C/D-GalN注射后18、24和48 h肝脏H-E染色(×100)Fig.2 WT mice and Rag1 -/- mice were injected with poly I:C/D-GalN at 18,24 and 48 hours after injection,liver samples from mice were analyzed by HE staining(original magnification×100)

图3 RT-PCR检测肝脏中 TNF-α和 IFN-γ的 mRNA水平Fig.3 TNF-α and IFN-γ mRNA expression of hepatic were measured by quantitative real-time RT-PCR
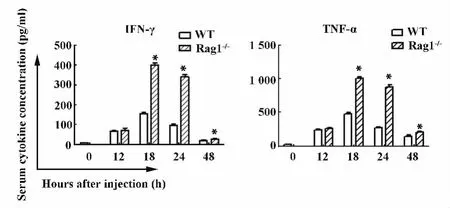
图4 ELISA检测血清中TNF-α和IFN-γ的蛋白水平Fig.4 Serum levels of TNF-α and IFN-γ were measured by ELISA
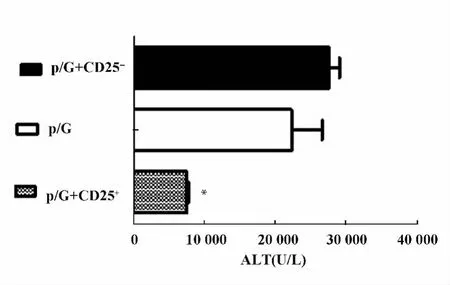
图5 转输CD25+细胞,转输CD25-细胞以及未转输细胞的Rag1-/-小鼠poly I:C/D-GalN注射后18 h检测转氨酶水平Fig.5 Rag1-/- mice with transfer CD25+,transfer CD25-cells and did not transfer cells were injected with poly I:C/D-GalN,at 18 hours after injection,serum ALT levels were measured
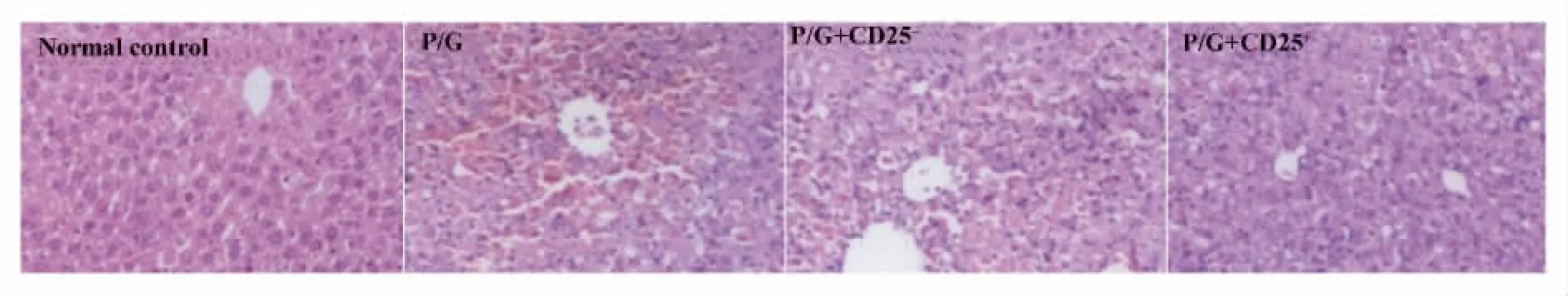
图6 转输CD25+细胞,转输CD25-细胞以及未转输细胞的Rag1-/-小鼠poly I:C/D-GalN注射后18 h肝脏H-E染色(×100)Fig.6 Rag1-/- mice with transfer CD25+,transfer CD25-cells and did not transfer cells were injected with poly I:C/DGalN,at 18 hours after injection,liver samples from mice were analyzed by H-E staining(original magnification×100)
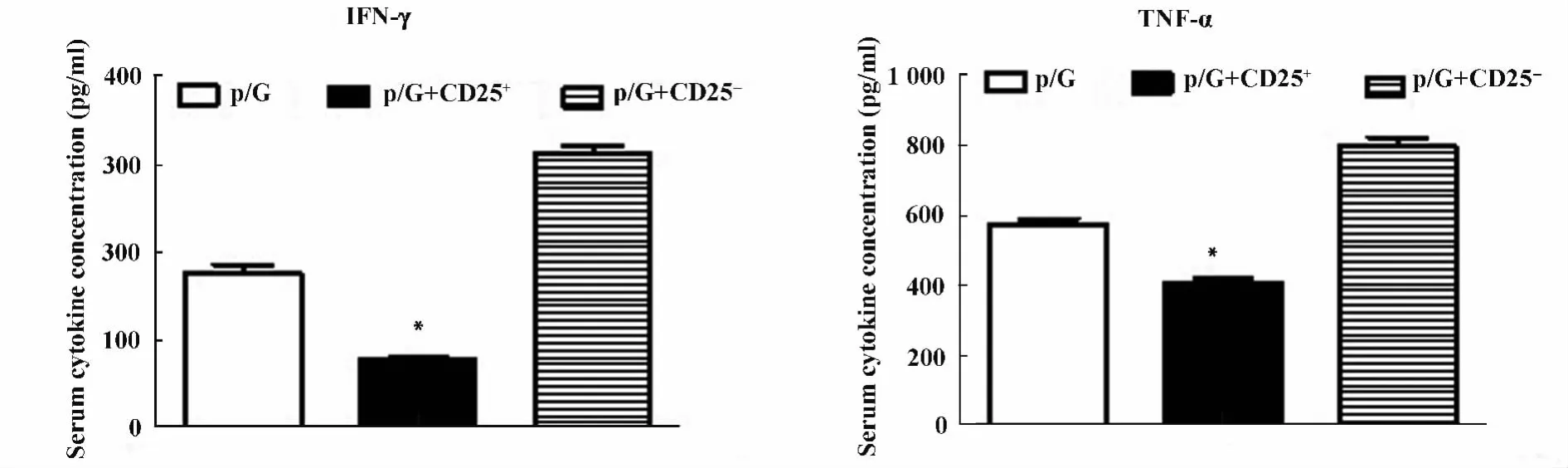
图7 转输CD25+细胞,转输CD25-细胞以及未转输细胞的Rag1-/-小鼠poly I:C/D-GalN注射后18 h ELISA检测血清中TNF-α和IFN-γ的蛋白水平Fig.7 Rag1-/- mice with transfer CD25+,transfer CD25-cells and did not transfer cells were injected with poly I:C/DGalN,at 18 hours after injection,serum levels of TNF-α and IFN-γ were measured by ELISA
2.1.2 野生型小鼠和Rag1-/-小鼠poly I:C/DGalN注射后肝脏炎症损伤相关的炎症因子TNF-α和IFN-γ mRNA水平和蛋白水平的动态表达Poly I:C/D-GalN 注射后12、18、24和48 h Rag1-/-小鼠肝脏IFN-γ的 mRNA水平明显高于 WT小鼠(P<0.05),但是 Rag1-/-小鼠肝脏 TNF-α的 mRNA水平与野生型小鼠相比无统计学意义(P>0.05)。见图3。同野生型小鼠相比,注射后18、24和48 h Rag1-/-小鼠血清 TNF-α和 IFN-γ含量明显升高(P<0.05),而在注射后12 h两种小鼠血清TNF-α和IFN-γ水平均无明显差异(P>0.05)。见图4。
2.2 过继转输调节性T细胞减轻poly I:C/D-GalN诱导的损伤 我们通过免疫磁珠分选细胞系统纯化得到脾脏CD25+单个核细胞纯度大于90%,而且一半以上表达Foxp3,是调节性T细胞。将分离纯化的脾脏CD25+单个核细胞过继转输给Rag1-/-小鼠。同过继转输 CD25-细胞和未转输细胞的Rag1-/-小鼠相比,转输CD25+细胞的Rag1-/-小鼠的血清ALT水平明显降低(P<0.05),见图5。肝脏H-E染色分析转输CD25-细胞和未转输细胞的Rag1-/-小鼠肝脏可见大量充血,肝细胞死亡以及大量炎性细胞浸润。而过继转输了CD25+细胞的Rag1-/-小鼠肝脏充血减轻,仅有小片的坏死区域以及少量的炎性细胞浸润。见图6。而且转输CD25+细胞的Rag1-/-小鼠的血清中炎性因子IFN-γ和TNF-α含量明显下降。见图7。
3 讨论
本研究我们通过给小鼠注射poly I:C/D-GalN诱导急性肝脏损伤模型,重点探讨了调节性T细胞在此模型中的免疫调节作用。在这个模型中我们发现没有调节性T细胞存在的Rag1-/-小鼠由poly I:C/D-GalN诱导的肝脏损伤更为严重,而给Rag1-/-小鼠过继转输调节性T细胞可以减轻poly I:C/DGalN诱导肝脏损伤。
根据前期的研究,我们确定了poly I:C/D-GalN可以诱导小鼠急性爆发性肝损伤模型,而且该损伤在2 d内基本自愈[3]。我们推测调节性T细胞可能限制了poly I:C/D-GalN诱导的急性肝脏损伤。因为调节性T细胞可以调节机体免疫反应,维持自身耐受和避免过度免疫反应。近年来的不少研究证实调节性T细胞在急性炎症损伤如ConA诱导的急性肝炎[5],AdHBV 感染的急性肝炎[2],LPS 诱导的急性肺损伤[6]和肾脏缺血再灌注损伤[7]等早期均可被诱导而且具有免疫调节作用,限制炎症损伤。于是我们首先比较了野生型小鼠和Rag1-/-小鼠在poly I:C/D-GalN注射后肝脏损伤轻重的不同,Rag1-/-小鼠在同等剂量的poly I:C/D-GalN注射后,肝脏炎症损伤加重。同时Rag1-/-小鼠肝脏局部炎性因子IFN-γ,血清中TNF-α和IFN-γ分泌均高于野生型小鼠。将分离纯化的CD25+细胞过继转输给Rag1-/-小鼠,发现同过继转输CD25-细胞以及未转输细胞的Rag1-/-小鼠相比转输调节性T细胞的小鼠肝脏炎症损伤明显减轻。以上结果均证实没有调节性T细胞的存在,poly I:C/D-GalN诱导的急性炎症反应加重,损伤时间延长,且与天然免疫细胞分泌的炎性因子TNF-α和IFN-γ有关,而转输了调节性T细胞后能够明显抑制炎性细胞因子的分泌和肝脏损伤。
调节性T细胞被认为主要通过抑制自身反应性T细胞的活化和扩增,得以限制变态反应疾病、感染、移植、移植物抗宿主反应和癌症中的免疫反应强度,达到调节免疫应答的目的[8-11]。但是近年来越来越多的研究显示调节性T细胞同样可以通过抑制天然免疫细胞来发挥免疫调节作用。如调节性T细胞可以抑制NK细胞的细胞毒作用同时降低NK细胞分泌的IFN-γ[12]。调节性T细胞可以抑制中性粒细胞的功能,促进它们凋亡和死亡[13]。调节性T细胞还可以抑制巨噬细胞促炎因子反应[14]。肿瘤免疫中清除调节性T细胞可以促进依赖IFN-γ的巨噬细胞的聚集和活化从而抑制淋巴瘤细胞[15]。本研究中,poly I:C/D-GalN诱导的肝脏损伤是由天然免疫细胞介导,在缺失获得性免疫细胞的Rag1-/-小鼠中依然能够复制,并且损伤更加严重。而给Rag1-/-小鼠转输调节性T细胞后能够明显抑制肝脏损伤和TNF-α和IFN-γ的分泌。我们以前的研究表明TNF-α和IFN-γ分别是由肝脏中的巨噬细胞和NK细胞分泌。因此我们的结果提示调节性T细胞可以负向调节天然免疫细胞。
另外,有实验证明调节性T细胞行使调节功能需要通过细胞-细胞接触。这种接触可能通过调节性T细胞表面的CTLA-4及其在效应性T细胞的配体相互作用而完成[16]。也有一些实验发现调节性T细胞可以通过分泌免疫抑制细胞分子IL-10和TGF-β以及诱导其他细胞分泌这些细胞因子来发挥调节作用[6,17-19]。在本研究模型中究竟调节性T细胞如何发挥免疫调节作用来抑制poly I:C/D-GalN诱导的急性爆发性肝损伤还需进一步研究。
综上所述,我们的实验结果显示poly I:C/DGalN诱导的急性肝损伤伴随着调节性T细胞的显著上升。调节性T细胞在poly I:C/D-GalN诱导的肝损伤中对限制肝脏免疫损伤起了重要作用。目前急性肝损伤治疗并无特效的药物治疗,多以支持治疗为主,调节性T细胞对肝脏免疫损伤的抑制作用可以为急性肝损伤的临床治疗、药物研发开辟新的视角。
[1]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by actived T cells expressing IL-2 receptor alpha-chains(CD25)breakdown of a single mechanism of self-tolerance causes various auto-immune diseases[J].J Immunol,1995,155(3):1151-1164.
[2]Leonhard Stross,Johannes Gunther,Georg Gasteiger,et al.Foxp3+regulatory T cells protect the liver from immune damage and compromise virus control during acute,experimental hepatitis B virus infection[J].Hepatology,2012,56(3):873-883.
[3]Hou X,Zhou RB,Wei HM,et al.NKG2D-retinoic acid early inducible-1 recognition between natural killer cells and kupffer cells in a novel murine natural killer cell-dependent fulminant hepatitis[J].Hepatology,2009,49(3):940-949.
[4]Fehervari Z,Sakaguchi S.Development and function of CD4+CD25+regulatory T cells [J].Nat Immunol,2004,16(2):203-208.
[5]Wei HX,Chuang YH,Li BF,et al.CD4+CD25+Foxp3+regulatory T cells protect against T cell-mediated fulminant hepatitis in a TGF-β dependent manner in mice[J].J Immunol,2008,181(10):7221-7229.
[6]D’Alessio FR,Kenji Tsushima,Aggarwal NR,et al.CD4+CD25+Foxp3+Tregs resolve experimental lung injury in mice and are present in humans with acute lung injury[J].J Clin Invest,2009,119(10):2898-2913.
[7]Gilbert R Kinsey,Rahul Sharma,Liping huang,et al.Regulatory T cells suppress innate immunity in kidney ischemia-reperfusion injury[J].J Am Soc Nephrol,2009,20(8):1744-1753.
[8]Viglietta V,Baecher-Allan C,Weiner HL,et al.Loss of functional suppression by CD4+CD25+regulatory T cells in patients with multiple sclerosis[J].J Exp Med,2004,199(7):971-979.
[9]Aandahl EM,Michaelsson J,Moretto WJ,et al.Human CD4+CD25+regulatory T cells control T-cell responses to human immunodeficiency virus and cytomegalovirus antigens [J].J Virol,2004,78(5):2454-2459.
[10]Tonkin DR,Kathryn Haskins.Regulatory T cells enter the pancreas during suppression of type 1 diabetes and inhibit effector T cells and macrophages in a TGF-β-dependent manner[J].Eur J Immunol,2009,39(5):1313-1322.
[11]Hisaeda H,Maekawa Y,Iwakawa D,et al.Escape of malaria parasites from host immunity requires CD4+CD25+regulatory T cells[J].Nat Med,2004,10(11):29-30.
[12]Hao Zhou,Li-juan Chen,Yong You,et al.Foxp3-transduced polyclonal regulatory T cells suppress NK cell functions in a TGF-β dependent manner [J].Autoimmunity,2010,43(4):299-307.
[13]Przemyslaw Lewkowicz,Natalia Lewkowicz,Andrzej Sasiak,et al.Lipopolysaccharide-activated CD4+CD25+T regulatory cells inhibit neutrophil function and promote their apoptosis and death[J].J Immunol,2006,177(10):7155-7163.
[14]Li M,Lin J,Wang ZX,et al.Oxidized low-density lipoproteininduced proinflammatory cytokine response in macrophages are suppressed by CD4+CD25+Foxp3+regulatory T cells through downregulating toll like receptor 2-mediated activation of NF-κB[J].Cell Physiol Biochem,2010,25(6):649-656.
[15]Galani IE,Marco Wendel,Ana Stojanovic,et al.Regulatory T cells control macrophage accumulation and activation in lymphoma[J].Int J Cancer,2010,127(5):1131-1140.
[16]von Boehmer H.Mechanisms of suppression by suppressor T cells[J].Nat Immunol,2005,6(4):338-344.
[17]Asseman C,Mauze S,Leach MW,et al.An essential role for interleukin 10 in the function of regulatory T cells that inhibit intestinal inflammation[J].J Exp Med,1999,190(7):995-1004.
[18]Nakamura K,Kitani A,Fuss I,et al.TGF-beta 1 plays an important role in the mechanism of CD25+CD4+regulatory T cells activity in both humans and mice[J].J Immunol,2004,172(2):834-842.
[19]Piccirillo CA,Letterio JJ,Thornton AM,et al.CD25+CD4+regulatory T cells can mediate suppressor function in the absence of transforming growth factor beta 1 production and responsiveness[J].J Exp Med,2002,196(2):237-246.

