兼养对雨生红球藻细胞生长的促进作用及藻株差异性
龙元薷 , 刘建国 , 张立涛
(1.中国科学院 海洋研究所, 山东 青岛 266071; 2.南通中国科学院海洋研究所海洋科学与技术研究与发展中心, 江苏 南通226000; 3.中国科学院大学, 北京100049)
虾青素是迄今为止人类所发现的自然界生物体内最强的抗氧化剂, 在水产养殖、医疗卫生、化妆品和保健品等领域有广泛应用前景[1-2]。在胁迫条件下,雨生红球藻能迅速合成并大量积累虾青素, 是自然界中天然虾青素的最佳生物来源[3]。但是与其他经济微藻相比, 雨生红球藻生长速度较慢、抵御敌害能力较差[4], 如何缩短培养周期、提高藻细胞产量是当前雨生红球藻虾青素生产中需要致力解决的关键问题。雨生红球藻不仅能光合自养, 同时可利用有机碳源进行异养生长及兼养生长。红球藻的兼养生长由自养生长和异养生长两部分组成, 可有效提高红球藻生长速率和细胞产量[5]。在众多有机物质中, 乙酸钠(NaAc)最易红球藻吸收利用, 促进细胞生长效果也最为明显[6]。目前适宜雨生红球藻生长的乙酸钠质量浓度存在很大差异[7-8], 是否与藻株差异有关尚不清楚, 也缺少对兼养促进红球藻生长机理上的深入研究。
叶绿素荧光技术已被广泛应用于高等植物逆境生理研究, 近年来微藻胁迫生理分析也开始应用[9-10]。本研究以 4株不同品系雨生红球藻为实验材料, 在红球藻兼养细胞密度和比生长速率分析基础上, 结合叶绿素荧光技术初步比较研究了兼养对不同红球藻藻株生长的促进作用及其机制, 目的为规模化生产筛选适宜的兼养藻株并寻找最适乙酸钠质量浓度打下基础。
1 材料和方法
1.1 实验藻种与基础培养基
雨生红球藻(Haematococcus pluvialis)藻株H0、H2、H3、H6由中国科学院海洋研究所藻类与藻类生物技术实验室保存, 基础培养基选取MCM修正配方[11]。
1.2 培养方法
在修正 MCM 基础培养基配方基础上, 通过添加0.5和1.5 g/L乙酸钠(每个质量浓度设3个重复)建立兼养培养条件。在100 mL三角瓶中分别加入上述培养液60 mL, 于121℃高温下灭菌15 min, 待冷却后分别接种15 mL处于对数生长期的红球藻H0、H2、H3和 H6藻液, 置于室内培养架上静置培养, 以日光灯为光源, 光照强度1 200 lx, 光照和黑暗周期L∶D为14∶10, 培养温度控制在24℃±1℃。每天随机调换三角瓶位置, 使各处理组藻液所接受的光照尽可能一致, 同时每天充分摇动三角烧瓶3~5次, 以增加藻细胞均匀度, 防止藻细胞发生贴壁生长, 连续培养观察8~10 d, 每隔48 h从各处理组藻液中均匀取样2 mL, 用于细胞生长和叶绿素荧光参数测定。
1.3 细胞计数、OD值测定与比生长速率计算
细胞显微观察计数: 藻液中红球藻细胞数量,采用血球计数板结合显微观察计数的方法测得, 为减少人工带来的可能统计误差, 取样前充分摇匀藻液, 每个样本至少重复统计 20次, 细胞密度以平均值±标准差表示; 细胞比生长速率按照公式:μ=(lnN2-lnN1)/(T2-T1)计算, 式中μ为比生长速率(d-1),N2是T2时的细胞密度,N1是T1时的细胞密度[12]; 光吸收密度变化间接反映藻细胞生物量的变化, 所以藻细胞的生长同时采用 750 nm 波长光吸收值(A)表示, 利用722 型可见分光光度计和1 cm光径比色杯测定。
1.4 叶绿素荧光参数测定
藻液取样反应杯中暗适应15 min后, 利用英国Hansatech 公司Handy Pea 便携式植物效率分析仪,测定相关叶绿素荧光参数。从分析仪上直接读取以吸收光能为基础、可准确反映植物细胞光合机构状态的性能指数 PIABS值[13]。结合细胞生长和 PIABS的变化规律, 进一步分析兼养对 4株红球藻细胞生理状态的影响。
1.5 数据处理
用Sigmaplot软件作图。用SPSS 16.0软件对数据进行相关性分析、方差分析以及多重比较(LSD)。
2 结果
2.1 兼养与光自养条件下红球藻细胞生长对比
在兼养和光自养培养条件下, 4株红球藻细胞密度变化如图1所示。结果表明: 相对于自养而言, 兼养更有利于红球藻细胞密度增加, 实验 4株藻株在兼养条件下细胞密度最高可达到自养的3倍(图1a)。不同藻株对乙酸钠的反应及其适宜生长质量浓度存在明显差异性。在 1.5 g/L乙酸钠质量浓度兼养时,藻株 H0细胞密度相较自养显著上升(P<0.01), 第 6天细胞密度达到 53.2×104个/mL, 而此时自养的 H0细胞只有19.5×104个/mL; 0.5 g/L乙酸钠质量浓度下兼养, 藻株H0细胞生长较自养有一定程度的增加(图1a) 但尚不显著(P>0.05)。相反, 0.5 g/L乙酸钠质量浓度下兼养, 藻株 H2细胞密度相较自养呈现显著增高(P<0.05), 到培养后期甚至超过 1.5 g/L乙酸钠质量浓度下兼养的细胞密度(图1b)。藻株H3细胞密度在第8天达到最大值, 0.5和1.5 g/L乙酸钠质量浓度下兼养的细胞密度分别接近自养的 1.5和 2倍(图1c)。图1中, H0、H2和H3兼养的细胞密度从培养第8天才开始出现明显下降, 而藻株 H6在兼养的第 6天细胞密度达到最高后开始下降(图1d)。此外, H6兼养细胞密度的上升幅度在 4株藻株中最小。尽管适宜于不同藻株生长的乙酸钠质量浓度尚不十分确定,但上述结果至少表明, 适宜红球藻细胞生长的乙酸钠质量浓度大致可在1.5g/L左右。

图1 4株红球藻藻株在自养和兼养(NaAc+光)条件下的细胞密度变化Fig.1 Variation of cell densities in four strains of H. pluvialis under photoautotrophic and mixotrophic (NaAc + light) growth conditions
对比兼养和光自养条件下红球藻比生长速率的变化趋势(图2)可以发现, 4株红球藻比生长速率在兼养条件下均明显高于自养培养, 兼养促进细胞生长效果在培养前期更显著(P<0.05)。其中, 兼养对藻株H2的比生长速率的促进作用最大(图2b), 对藻株H6比生长速率的促进作用最小(图2d); 同时, 随着培养的进行, 兼养促进红球藻细胞生长的效应均呈线性下降趋势, 到培养后期兼养与自养的比生长速率已经比较接近; 另外十分有意思的是, 兼养对生长的促进作用在红球藻藻株之间也存在明显差异, 比生长速率最快的H2藻株的和比生长速率最慢的H6藻株与乙酸钠质量浓度之间(图2b, 图2d) 均未呈现明显的剂量效应, 而比生长速率介于中间的H0和H3藻株与乙酸钠质量浓度之间(图2a, 图2c)表现出明显的剂量效应, 并且其比生长速率皆在 1.5g/L乙酸钠质量浓度下出现进一步的明显上升。可见1.5g/L乙酸钠可作为红球藻生长的适宜质量浓度, 这与细胞密度的分析结果基本一致。

图2 不同乙酸钠剂量下4株红球藻比生长速率的变化Fig.2 Changes in specific growth rate of four strains of H. pluvialis exposed to NaAc at different concentrations
2.2 兼养对红球藻光合综合指数(PIABS)的影响
光合综合性能指数 PIABS=(RC/ABS)·[φPo/(1–φPo)]·[φo/(1–φo)]包含了 RC / ABS、φPo和φo共 3个参数, 其分别代表反应中心的运行效率、光能吸收效率和电子传递效率, 并且3个参数相互独立。所以性能指数PIABS对环境因子更敏感, 能够更准确地反映植物光合机构的状态[13]。4株红球藻在自养和兼养培养条件下的光合综合指数 PIABS值的变化(图3)结果表明: 在培养前期(一般为前 2 d), 兼养培养的藻株(如H0、H2、H6) PIABS值较自养培养的低, 之后开始呈现不同程度上升。到培养后期(一般后2~4 d天),兼养培养藻株的PIABS值较自养培养明显升高, 其中藻株 H0、H2(图3a, 图3b) 分别在1.5和0.5 g/L乙酸钠质量浓度下 PIABS值较其自养显著上升(P<0.05)。与其他3株实验藻株不同, 藻株H3在培养初期兼养生长的 PIABS值与自养基本一致, 在 4~6 d H3兼养生长的PIABS值低于自养培养, 到第8天兼养的PIABS值才明显高于其自养(图3c)。上述结果表明,添加乙酸钠兼养对红球藻生长有促进作用, 该促进作用不仅在于乙酸钠为红球藻提供了异养生长的有机碳源, 同时还改变了红球藻的光合生理状态, 并且可将兼养对红球藻细胞生长的促进作用分为两个阶段: 在兼养前期主要通过乙酸钠异养加快细胞生长; 而培养后期当乙酸钠快要耗尽时, 兼养通过提高藻细胞的光自养能力进一步促进细胞生长。
2.3 不同乙酸钠质量浓度下 4株红球藻生长及生理指标的对比
在不同乙酸钠质量浓度下, 各藻株生长和生理指标(表1)显示, 细胞从自养进入兼养, 红球藻藻株之间呈现出某些共性和差异性变化, 主要包括:
(1) 随乙酸钠质量浓度上升, 反映细胞密度的A750nm均呈逐渐上升趋势, 而在培养前期各藻株的光合性能综合指数PIABS则呈相反的趋势渐次下降, 这表明在培养前期兼养促进细胞密度的增加并非由其中光自养部分贡献的, 而主要是由其中异养作用所导致。

图3 乙酸钠兼养对红球藻光合综合指数(PIABS)的影响Fig.3 Influences of NaAc on photosynthetic performance index (PIABS) in four strains of H. pluvialis under mixotrophic conditions
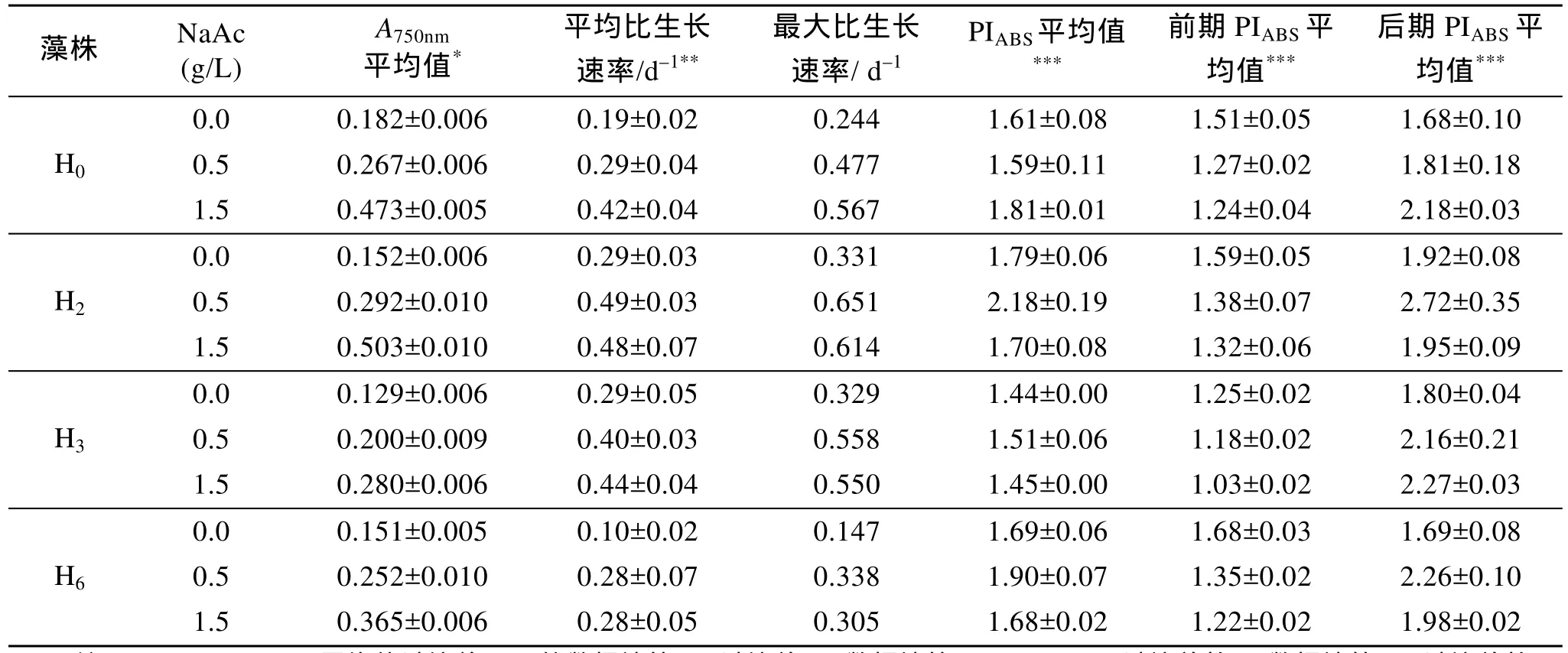
表1 不同乙酸钠质量浓度兼养对4株红球藻生长指标的影响Tab.1 Influences of diverse NaAc concentrations on various growth indexes of four H. pluvialis strains under mixotrophic (NaAc + light) conditions
(2) 在藻株之间, 自养与兼养的平均比生长速率、后期光合性能指数PIABS指标存在明显差异性。藻株H2和藻株H6表现基本一致可划为一组, 而藻株H0和藻株 H3大致类似为另外一组; 后者(藻株 H0、H3)的平均比生长速率和后期光自养综合指数由自养转入兼养后, 随乙酸钠质量浓度增加而增高; 而前者(藻株H2、H6)从自养转入兼养后, 平均比生长速率明显增高, 但此时兼养的平均比生长速率与乙酸钠质量浓度之间不存在明显剂量效应, 只是在后期的PIABS与乙酸钠质量浓度存在剂量关系, 呈现先增高再下降的趋势变化, 皆在 0.5g/L乙酸钠质量浓度下光合性能综合指数最高。
(3) 自养与兼养培养效率反映在最大比生长速率、平均光合性能指数PIABS指标上, 藻株之间也存在出明显的差异性。藻株H2、H3、H6大致一致可划为一组, 主要表现在 0.5g/L质量浓度下最大比生长速率最高、光合性能综合指数最大; 藻株 H0单独为另一组, 1.5g/L乙酸钠质量浓度下其最大比生长速率最高、光合性能综合指数也最大。
3 讨论
微藻高密度培养是获得生物质的基础, 同时也是节约后续生产成本的重要手段[14]。添加有机碳兼养是获得高密度藻细胞生物质的重要方法之一。兼养生长由光合自养及异养两部分构成, 其最大特点是能同时利用光能和有机碳源进行生长[15], 可最大程度地加快藻细胞生长, 有机碳源提供的能量可减轻藻细胞生长对光合作用的依赖。本研究中, 乙酸钠的添加不同程度地提高了 4株实验藻株的比生长速率和细胞产量, 这与前期相关研究基本一致[5,8]。在红球藻兼养研究上, Kobayashi等[5]认为光合生长与乙酸钠异养代谢可同时独立进行, 兼养生长速率是单独自养与异养生长的总和。庄惠如等[6]也进一步证实红球藻兼养生物量几乎等于光养型生长与化能异养的总和。
本研究通过对比多株红球藻兼养与自养的结果发现: 添加乙酸钠兼养提高了红球藻细胞的生长速率, 该促进作用并不是简单地归纳为提供有机碳源进行异养和自养的相加, 事实上乙酸钠还导致藻细胞光合生理状态在前期和后期发生改变(图3、表1),并且该光合生理状态改变可能与乙酸钠消耗程度也存在一定的关联性。基于藻株对乙酸钠的适应性及利用率的差别, 各藻株光合生理状态的转变在时间上以及乙酸钠剂量效应上虽然存在一定差异, 但乙酸钠导致光合生理状态发生改变在不同红球藻藻株都得到了印证。兼养的培养效果并非自养与异养的简单叠加, 其中还存在其他多种综合性效应。关于这方面深一步的研究甚少, 是下一步需要探明的基础科学理论及产业化生产关注的重要应用技术。上述结果与 Yu等[15]在对发状念珠蓝细菌兼养得到的结论基本类似, 即在培养的不同阶段, 兼养生长获得的细胞产量与其对应的自养和异养生长总和的关系是波动的, 并非两者的简单相加。因此, 深入了解兼养下红球藻的生长规律、掌握添加乙酸钠的适宜质量浓度是非常有必要的, 进而有可能获得红球藻快速异养生长同时又显著促进藻细胞光自养生长的双重增益效果, 相反也有可能造成其作用部分抵消。
微藻异养需充足的有机碳源, 但乙酸钠质量浓度过高会严重抑制藻细胞生长[6,16]。本研究中, 添加乙酸钠可获得相对较高的藻细胞生物量, 但不同藻株所需添加的乙酸钠存在差异, 某些藻株(如 H2)在相对低的乙酸钠质量浓度下(0.5g/L)细胞生长更好,细胞密度(图1b、表1)、比生长速率(图2b、表1)和综合光合性能指数(图3b、表1)都达到最大; 而另外一些藻株, 如H0则在较高乙酸钠质量浓度(1.5g/L)下兼养效果更好, 无论细胞密度(图1a、表1), 比生长速率(图2a、表1)和综合光合性能指数(图3a、表1)均在1.5g/L乙酸钠下达到最高值。根据不同藻株, 具体分析选择合适的乙酸钠添加量是获得最佳培养效果的前提, 不能简单地随意添加。
对微藻生长情况的分析, 常通过建立细胞密度与藻液光密度值的相关方程, 以简便快捷的光密度法检测微藻的生长和生物量变化[17]。我们注意到乙酸钠兼养不仅影响红球藻细胞数量而且也影响细胞大小, 单凭光密度法检测藻细胞生物量的变化准确性易受到干扰, 因而产生偏差。这也可能与红球藻生活史复杂[2,7]有关, 在不同培养模式下处于不同生长阶段的红球藻细胞大小差异很大, 有时细胞直径相差1~2倍, 细胞体积变化幅度高达数十倍, 无论光密度还是细胞数量等单一指标都不能准确反应其生物量变化, 应结合多种指标从不同角度全面检测细胞的生长变化才更客观、科学[18]。然而, 多指标测定势必存在工作繁重、耗时长、样本需要量大的问题[6],有时会仅限于宏观和过后结果分析, 很难及时、快速掌握培养过程藻细胞的具体生长状态。叶绿素荧光技术可对红球藻的兼养生长状态进行快速追踪, 通过以吸收光能为基础的性能指数PIABS可及时有效反映不同乙酸钠质量浓度下红球藻细胞的即时生理状态, 并提供细致、全面的数据参考, 从而可对培养条件及时调整, 实现最佳培养效果。叶绿素荧光技术具备快速、灵敏、操作简单、用量少等特点[13], 可作为红球藻等微藻生理机理及生产应用研究有力、便捷的工具。
在兼养培养初期, 藻细胞性能指数PIABS相较自养生长出现下降(图3、表1), 可能是由于实验接种藻细胞来源于自养培养, 在接种后藻细胞对乙酸钠环境需要一段时间进行适应。如果采用乙酸钠兼养培养的藻种有可能避免此问题, 是否如此尚需进一步实验验证。随着培养进行, 藻液中乙酸钠和营养盐不断消耗, 藻细胞生长速率(图2)逐渐下降, 到第 6天细胞增长幅度(图1)呈现出明显拐点。因此, 单就生物产量的有效获得而言, 理论上生产周期维持在一周可保证藻细胞良好的繁殖状态以及生物产量的高效供应, 这也是下一步生产性半连续培养中需要控制的时间节点。
红球藻生长速度相对较慢, 没有小球藻的快速繁殖力, 也不像螺旋藻、杜氏盐藻等其他经济微藻能够在极端环境中生长, 因此其抵抗敌害生物能力较弱[4]。有机碳源(乙酸钠)的添加在促进红球藻生长的同时, 也加大了异养敌害生物的侵染风险。如何控制敌害生物污染, 把控好红球藻细胞快速繁殖与敌害污染问题之间的平衡关系, 是目前红球藻规模化兼养生产虾青素急需突破的难题[3]。而生长速率的提高、培养过程红球藻细胞良好生理状态的维持皆有助于红球藻抵御敌害的污染和竞争。所以在乙酸钠适宜质量浓度的选择上需进行综合考虑, 在保证红球藻快速生长的同时, 还需结合考虑乙酸钠的添加对红球藻光合自养生长促进作用的增益效应、保障藻细胞良好的生理状态。
综上所述, 0.5~1.5g/L乙酸钠兼养对红球藻细胞生长有明显促进作用, 该促进作用在培养的前期主要通过乙酸钠提供红球藻异养生长的物质和能量基础加快细胞生长; 培养后期乙酸钠逐渐耗尽, 兼养通过提高红球藻的光自养能力促进细胞的生长。同时, 兼养对红球藻生长的促进作用存在明显的藻株差异性, 不同藻株对乙酸钠的需求量并不一致, 生产上需针对具体藻株添加适量的乙酸钠, 实现生物量的有效增加。
[1]Kobayashi M, Kakizono T, Nishio N, et al.Antioxidant role of astaxanthin in the green algaHaematococcus pluvialis[J].Applied Microbiology and Biotechnology,1997, 48(3): 351-356.
[2]殷明焱, 刘建国, 张京浦, 等.雨生红球藻和虾青素研究述评[J].海洋湖沼通报, 1998, 2(2): 53-62.
[3]Margalith P Z.Production of ketocarotenoids by microalgae[J].Appl Microbiol Biotechnol, 1999, 51(4):431-438.
[4]Del Campo J A, Garcia-Gonzalez M, Guerrero M G.Outdoor cultivation of microalgae for carotenoid production: current state and perspectives[J].Appl Microbiol Biotechnol, 2007, 74(6): 1163-1174.
[5]Kobayashi M, Kakizono T, Yamaguchi K, et al.Growth and astaxanthin formation ofHaematococcus pluvialisin heterotrophic and mixotrophic conditions[J].Journal of Fermentation and Bioengineering, 1992, 74(1): 17-20.
[6]庄惠如, 陈必链, 王明兹, 等.雨生红球藻混合营养与异养培养研究[J].微生物学通报, 2000, 27(3): 198-201.
[7]Kobayashi M, Kurimura Y, Kakizono T, et al.Morphological changes in the life cycle of the green algaHaematococcus pluvialis[J].Journal of Fermentation and Bioengineering, 1997, 84(1): 94-97.
[8]Gong X, Chen F.Optimization of culture medium for growth ofHaematococcus pluvialis[J].Journal of Applied Phycology, 1997, 9(5): 437-444.
[9]Liu X J, Duan S S, Li A F, et al.Effects of organic carbon sources on growth, photosynthesis, and respiration ofPhaeodactylum tricornutum[J].Journal of Applied Phycology, 2009, 21(2): 239-246.
[10]Wang H C, Cho M G, Riznichenko G, et al.Investigation of the maximum quantum yield of PS II inHaematococcus pluvialiscell cultures during growth: Effects of chemical or high-intensity light treatment[J].J Photochem Photobiol B-Biol, 2011, 104(3): 394-398.
[11]韩春梅, 刘建国, 张勇.红球藻藻株对光强适应及在工程培养中的应用[J].海洋科学, 2010, 34(5): 21-28.
[12]张京浦, 刘建国.营养盐对雨生红球藻光合作用影响的研究[J].工业微生物, 1997, 27(4): 14-17.
[13]李鹏民, 高辉远, Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理与分子生物学学报, 2005, 31(6): 559-566.
[14]Bumbak F, Cook S, Zachleder V, et al.Best practices in heterotrophic high-cell-density microalgal processes:achievements, potential and possible limitations[J].Appl Microbiol Biotechnol, 2011, 91(1): 31-46.
[15]Yu H, Jia S, Dai Y.Growth characteristics of the cyanobacteriumNostoc flagelliformein photoautotrophic, mixotrophic and heterotrophic cultivation[J].Journal of Applied Phycology, 2009, 21(1): 127-133.
[16]Jeon Y C, Cho C W, Yun Y S.Combined effects of light intensity and acetate concentration on the growth of unicellular microalgaHaematococcus pluvialis[J].Enzyme Microb Technol, 2006, 39(3): 490-495.
[17]Cai Z P, Duan S S, Zhu H H.Optical density method and cell count method for determining the growth of three energy microalgae and their correlation and verification[J].Journal of Southern Agriculture, 2012, 43(10): 1480-1484.
[18]张展, 刘建国.微藻高密度培养中的生长指标和适应机制[J].海洋水产研究, 2003, 24(4): 36-43.

