机械加工及油脂对南瓜类胡萝卜素生物接近度的影响
白喜婷 樊金玲 朱文学 孙军杰(河南科技大学食品与生物工程学院,河南 洛阳 471023)
类胡萝卜素具有维生素A源活性,可用于预防和治疗癌症、心血管和眼部疾病,同时具有抗炎、抗紫外线损伤等多种生理功能[1];但食物中的类胡萝卜素在人体的利用率较低[2],原因可能与类胡萝卜素在食物基质中被包被、水溶性差以及化学不稳定等有关[3]。类胡萝卜素生物利用过程包括:从食品基质中释放至消化液,在小肠内形成脂质胶束,被小肠粘膜细胞吸收,被转运至门脉及淋巴循环及在肝脏中转为维生素A或被储存4个步骤[4]。“生物接近度”(bioaccessibility)用于描述其从食品基质中释放到胃肠道或被包被在脂质微粒中的程度;“生物利用度(bioavailability)则为类胡萝卜素其被吸收的程度[5]。
在绿色植物组织中,类胡萝卜素与蛋白质形成复合体存在于叶绿体中,在黄色、橙色和红色的植物组织中则存在于不同类型的有色体中[6,7]。细胞器的膜结构以及细胞壁、细胞膜结构共同构成阻碍类胡萝卜素从食物基质释放至消化液的物理屏障。Tydeman等[8]研究了胡萝卜在人体内消化过程中细胞结构的变化,结果表明,消化液仅使胡萝卜的外层细胞壁略微肿胀,多数细胞在消化后仍保持完整的细胞结构,阻碍了β-胡萝卜素从有色体向消化液中的释放。体内试验[4]则表明,蔬菜中的β-胡萝卜素的生物利用度远低于添加于简单食品基质(如色拉酱调料)中的纯品。由于细胞的破坏仅发生在食品原料的预处理和加工过程中[9],因此,食物的加工(热处理、机械处理、超声处理等)过程对细胞壁及膜等有破坏作用,对于类胡萝卜素从细胞释放至消化液、进而被吸收利用,具有重要意义。
类胡萝卜素是一种脂溶性营养素,通常认为油脂能促进类胡萝卜素的吸收利用,这是因为:① 油脂提供了一个亲脂库,有利于类胡萝卜素在胃消化阶段从食物基质释放至消化液的油滴中;② 油脂水解产物参与并改变胶束的物化性质,可能加强了类胡萝卜素从油滴至胶束的再分配过程[10]。在体内,油脂还可促进胆盐和胰脂酶的分泌,其中胆盐是乳化剂,可促使大油滴裂解形成小油滴,从而有利于脂酶高效水解油脂[3,10-12]。Huo[10]、Colle[12]、Degrou[11]和 Qian等[3]研究了油脂的种类(脂酰基的链长和不饱和度)对生物接近度的影响。诸多研究报道了油脂对橙色肉质红薯[13]、胡萝卜[14]、不同成熟度的芒果[15]、甜瓜[16]、西红柿[7]中类胡萝卜素生物接近度的影响。
南瓜(pumpkin)属葫芦科(cucurbitaceae)南瓜属(Cucuribita),富含类胡萝卜素,是人类摄取类胡萝卜素的重要膳食来源[17,18]。根据产地和植物学性状,南瓜现有5种栽培种:中国南瓜、即倭瓜;印度南瓜、即笋瓜;美洲南瓜、即西葫芦;墨西哥南瓜即黑籽南瓜和灰籽南瓜,其中前4种是可食用南瓜[19]。中国南瓜中主要的类胡萝卜素为β-胡萝卜素,其次为α-胡萝卜素和叶黄素[17,18]。Murkovic[17]报导了4个中国南瓜品种中α-胡萝卜素、β-胡萝卜素和叶黄素含量分别为9.8~59.0,31.0~70.0,0.8~11.0μg/g。宋曙辉等[20]对不同品种鲜南瓜中类胡萝卜素含量做了分析,结果表明,α-胡萝卜素含量为0~31.68μg/g,β-胡萝卜素含量为0.45~55.27μg/g。但迄今为止,未见有关南瓜类胡萝卜素生物接近度的研究报道。
本试验以南瓜为研究对象,拟采用高效液相色谱法测定类胡萝卜素含量,以释放率和胶束化率为指标,采用静态体外消化法评估类胡萝卜素生物接近度,重点研究了机械加工、油脂添加量以及二者交互作用对南瓜中不同种类胡萝卜素生物接近度的影响。旨为南瓜合适加工方式的选择及有效提高其类胡萝卜素生物利用率提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
胡萝卜:购于当地超市;
正己烷:分析纯,天津大茂化学试剂厂;
丙酮:分析纯,洛阳昊华化学试剂厂;
无水乙醇:分析纯,天津德恩化学试剂厂;
甲醇:色谱纯,西陇化工股份有限公司;
甲基叔丁基醚:色谱纯,美国天地高纯溶剂公司;
胃蛋白酶、胰酶、胆盐:生化级,美国Sigma公司;
β-胡萝卜素标准品:纯度98%,美国Sigma公司;
叶黄素标准品:纯度98%,美国Sigma公司;
食用调和油:食品级,益海嘉里公司。
1.1.2 主要仪器设备
电子天平:FA1004型,上海上平仪器公司;
高速台式离心机:LGL-18C型,上海安亭科学仪器厂;
水浴氮吹仪:NPW-12型,合肥艾本科学仪器有限公司;
高效液相色谱仪:Agilent 1260型,美国安捷伦公司;
pH计:PhS-3C型,上海宇隆仪器有限公司。
1.2 方法
1.2.1 样品处理 切丁:南瓜→清洗→削皮→切丁(1×1×1mm3、2×2×2mm3);打浆:南瓜→清洗→削皮→家用打浆机打打成泥浆状。为了研究油脂对β-胡萝卜素生物接近度的影响,在部分样品中加入3%,5%,10%的食用油。
1.2.2 体外消化法 根据文献[7,21,22],修改如下:将1 0g样品、15mL 电解质溶液(50mmol/L NaCl、14mmol/L KCl、3.5mmol/L KH2PO4、10mmol/L CaCl2·2H2O、3.6mmol/L MgCl2·6H2O)放入150mL 三角瓶中,用1 mol/L HCl调节pH 值至2.00±0.05,加2mL胃蛋白酶(50.25mg/mL,胃蛋白酶溶于0.1mol/L HCl)封口放入摇床,于37℃、95r/min消化1h。取出三角瓶,用1mol/L NaHCO3调节pH值至6.90±0.05,加入9mL胆盐—胰酶液(胆盐、胰酶溶于0.1mol/L NaHCO3,浓度分别为31.13,5.00mg/mL)封口放入摇床于37℃、95r/min消化2h。消化结束后,于5 000×g离心10min得到上清液(用于分析类胡萝卜素从食物中释放出来的程度(释放率),按式(1)计算释放率),上清液过0.22μm滤膜得到胶束(用于分析类胡萝卜素可能被小肠吸收的程度(胶束化率),按式(2)计算胶束化率)。酶液和样品需试验当天准备,每个样品重复3次。
式中:
L——释放率,%;
M——胶束化率,%;
m1——上清液中某种类胡萝卜素的含量,μg/g;
m2——胶束中某种类胡萝卜素的含量,μg/g;
m3——南瓜中某种类胡萝卜素的含量,μg/g。
1.2.3 类胡萝卜素的萃取 称1g鲜样品于研钵中,放入少量石英砂,用50mL萃取剂(正己烷、乙醇、丙酮体积比50∶25∶25)分数次研磨提取,直到萃取剂和渣为无色。合并萃取液,加入15mL蒸馏水和1g CaCl2·2H2O,振荡,避光静止分层;取分层后的上层有机相,待测。在上清液或胶束中加入等体积萃取剂,轻微振荡,避光静止分层;重复两次,合并分层后的有机相;用氮吹仪吹干后定容,待测。
1.2.4 类胡萝卜素的测定 采用高效液相色谱外标法定量测定待测样品液中类胡萝卜素含量。
(1)HPLC条件:色谱柱:YMC C30 4.6×250mm,5 μm;柱温:25℃;流速:0.8mL/min;进样量:10μL;流动相A:甲醇,流动相B:甲基叔丁基醚;线性梯度洗脱:0~5min 100%~95%A,5~20min,95%~70%A,20~40min,7 0%~55%A;检测器波长范围:190~550nm;检测波长:450 nm。南瓜类胡萝卜素萃取液的高效液相色谱图见图1。经与标准品等对比,确定峰1为叶黄素,峰3为β-胡萝卜素,峰2为α-胡萝卜素。
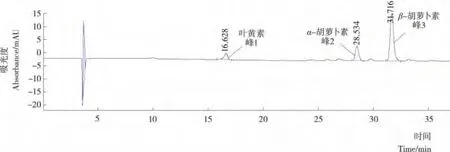
图1 南瓜中类胡萝卜素提取液的HPLC色谱图(检测波长450nm)Figure 1 The HPLC profile of carotenoids from pumpkin recorded at 450nm
(2)标准曲线制作:精密称取β-胡萝卜素、叶黄素标准品各1mg,分别溶于50mL二氯甲烷中,所得β-胡萝卜素、叶黄素标准品储备液浓度均为2 0μg/mL。取等体积的2 0μg/mLβ-胡萝卜素、叶黄标准品储备液混合,得到母液为10μg/mL的混合标准品储备液。用流动相将储备液分别稀释为以下浓度的标准品使用液:0.062 5,0.125,0.25,0.5,1,2,4,6,8,10μg/mL,进行 HPLC检测。以峰面积为纵坐标,以溶液浓度为横坐标,进行线性回归,得到β-胡萝卜素测定的标准曲线方程为y=95.025x-17.710,相关系数R2为0.991 2,线性范围为0.5~10μg/mL;叶黄素测定的标准曲线方程为y=28.888x+4.175 6,相关系数R2为0.995 9,线性范围为0.062 5~4μg/mL。由于α-胡萝卜素的结构与β-胡萝卜素类似,因此,采用β-胡萝卜素含量测定的标准曲线方程计算α-胡萝卜素含量。
(3)样品中类胡萝卜素的含量测定:取待测样品过0.45μm滤膜,进行HPLC分析。通过标准曲线测得样品中类胡萝卜素质量浓度,并计算南瓜、上清液和胶束中类胡萝卜素的含量。
1.2.5 统计分析 用DPS 3.01数据处理软件,对不同样品的释放率和胶束率进行0.01水平上的单因素试验统计分析。
2 结果与分析
将南瓜进行打浆和2种切分处理得到粒度明显不同的物料,添加不同量油脂,经体外消化,测定其中叶黄素、α-胡萝卜素和β-胡萝卜素的释放率和胶束化率,见图2。由图2可知,南瓜类胡萝卜素的释放率和胶束化率随机械加工方式、油脂添加量及类胡萝卜素种类不同而异。释放率的变化范围为0.232%~29.605%;其中,叶黄素的释放率小于30%,α-胡萝卜素和β-胡萝卜素的释放率则小于18%。说明南瓜中只有小部分类胡萝卜素从细胞中释放至消化液中。胶束化率变化范围为0%~5.379%;其中,叶黄素的胶束化率小于6%,α-胡萝卜素和β-胡萝卜素的胶束化率则小于2%。消化液中的叶黄素平均约有35%被包被进入胶束,消化液的α-胡萝卜素和β-胡萝卜素中平均约有11%和9%进入胶束。从细胞释放至消化液中的类胡萝卜素可能以胶束化、非胶束化的可溶性聚集体以及溶于油滴等状态存在[23]。
2.1 机械加工对南瓜类胡萝卜素生物接近度的影响
本试验结果表明,在同一油脂添加量条件下(3%,5%,10%),3种粒度不同的南瓜(打浆处理、1×1×1mm3切丁、2×2×2mm3切丁)中类胡萝卜素释放率/胶束化率之间的差异均显著,见图2。
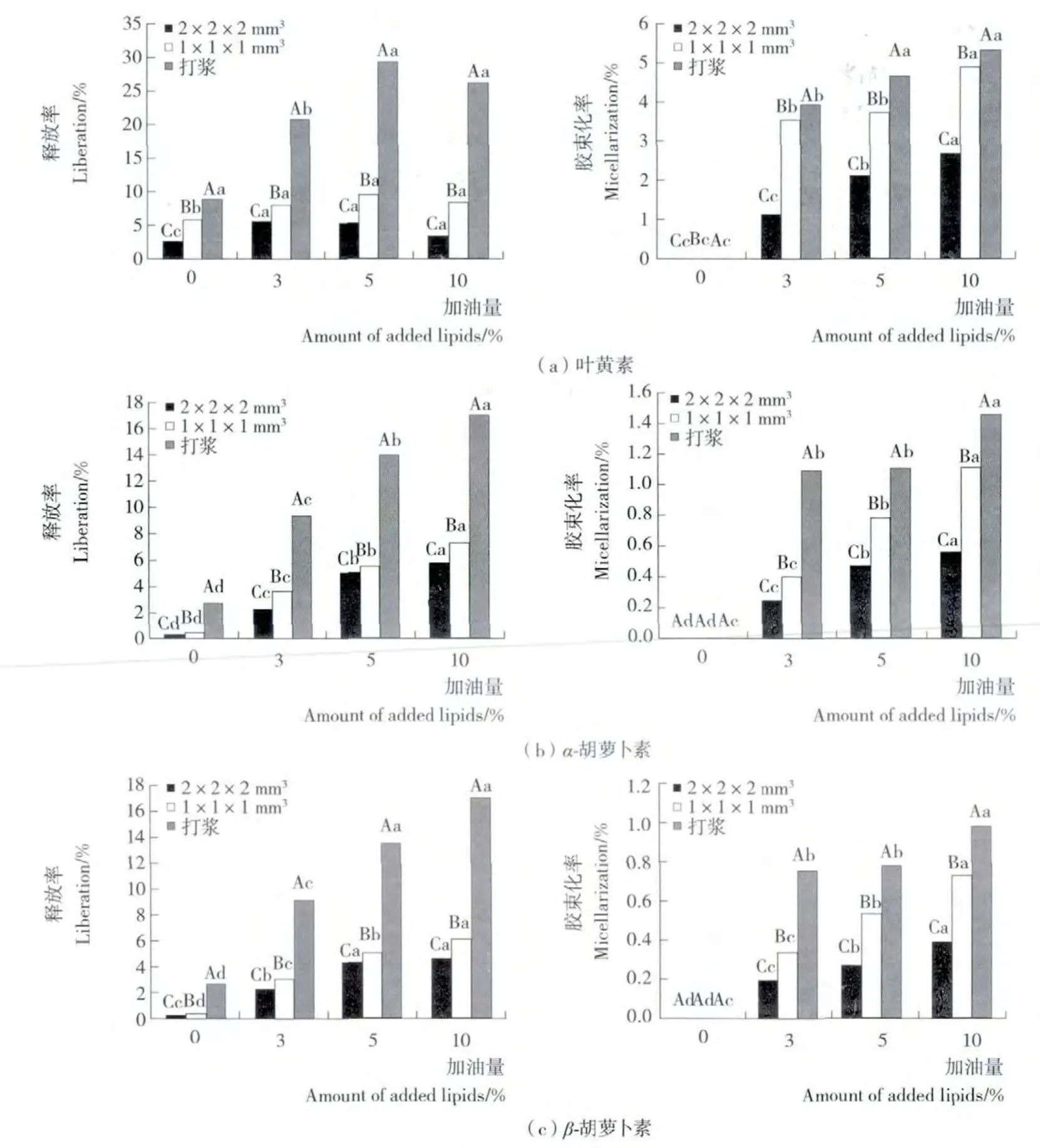
图2 机械加工方式对南瓜中类胡萝卜素生物接近度的影响Figure 2 Effect of different mechanical processing on carotenoid bioaccessibility from pumpkin
机械处理如混合、切分、打浆、均质等,由于减小了颗粒尺寸、去除了物理屏障,增大了消化酶与物料的接触面积,因此,促进了类胡萝卜素从食品基质中释放至消化液。体外试验表明:胡萝卜汁中总胡萝卜素向消化液油相的释放高于擦碎胡萝卜和切成立方块的胡萝卜(3×3×3mm)[5];打成浆状的胡萝卜中β-胡萝卜素和α-胡萝卜素向消化液的释放高于切成片状(10×10×40mm)[24];胡萝卜泥经50MPa和100MPa的高压均质后的释放率均提高[14]。体内试验[4]表明,经打浆或均质处理的番茄中番茄红素和胡萝卜中的β-胡萝卜素的吸收高于未处理。而本试验研究结果表明,南瓜中3种胡萝卜素的释放率和胶束化率随南瓜细胞破碎程度的增大而增大。在新鲜南瓜中,类胡萝卜素存在于细胞(被细胞壁,细胞膜包围)有色体(双分子层)中[7],在机械处理过程中,细胞壁、细胞膜、有色体结构被破坏,从而使类胡萝卜素释放至消化液中。打浆处理相对于切分处理,细胞被破坏的程度高、被破坏细胞的数量多,因此,类胡萝卜素释放至消化液中的数量就多(释放率高),被胶束包被的数量也随之增加(胶束化率高)。本试验结果也表明:α-/β-胡萝卜素的释放率和胶束化率呈较好的线性正相关关系,相关系数分别为0.854和0.817(见图3),叶黄素的释放率和胶束化率的线性相关关系虽然不显著,但基本呈现出相类似的规律(图略)。
2.2 油脂添加量对南瓜类胡萝卜素生物接近度的影响
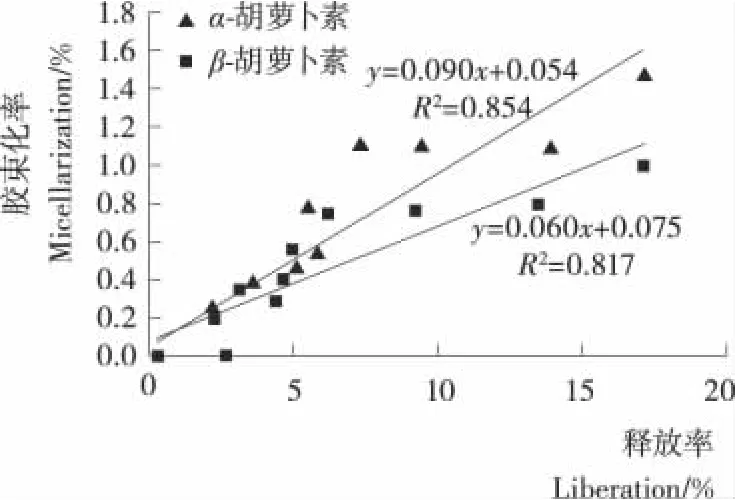
图3 南瓜类胡萝卜素的释放率与胶束化率的相关关系Figure 3 Relationship between release and micellarisation of carotenoids from pumpkin
油脂添加量对类胡萝卜素释放率和胶束化率的影响不仅与油脂添加量的范围有关,而且与物料粒度、类胡萝卜素种类有关(见图2)。总体来讲,在油脂添加量为0%~10%范围内,南瓜叶黄素、α-胡萝卜素和β-胡萝卜素的释放率和胶束化率均随油脂添加量的增大而增大,但增幅随油脂添加量的增加不断减少,预示在一定油脂含量条件下,释放率和胶束化率可能会达到某一极值。回归分析表明(见图4),3种粒度的南瓜中类胡萝卜素的释放率和胶束化率与油脂添加量均呈一元二次方程关系,回归方程的R2均大于0.94。说明方程很好地拟合了油脂添加量为0%~10%时3种粒度南瓜的释放率和胶束化率,可用于此范围内其它油脂添加量时的释放率和胶束化率的预测。对方程求极值的结果表明:粒度越大,南瓜类胡萝卜素的释放率和胶束化率能达到的极值水平越低,这一结果同时说明,当油脂添加量足够大时,物料粒度成为提高类胡萝卜素生物接近度的限制性因素。
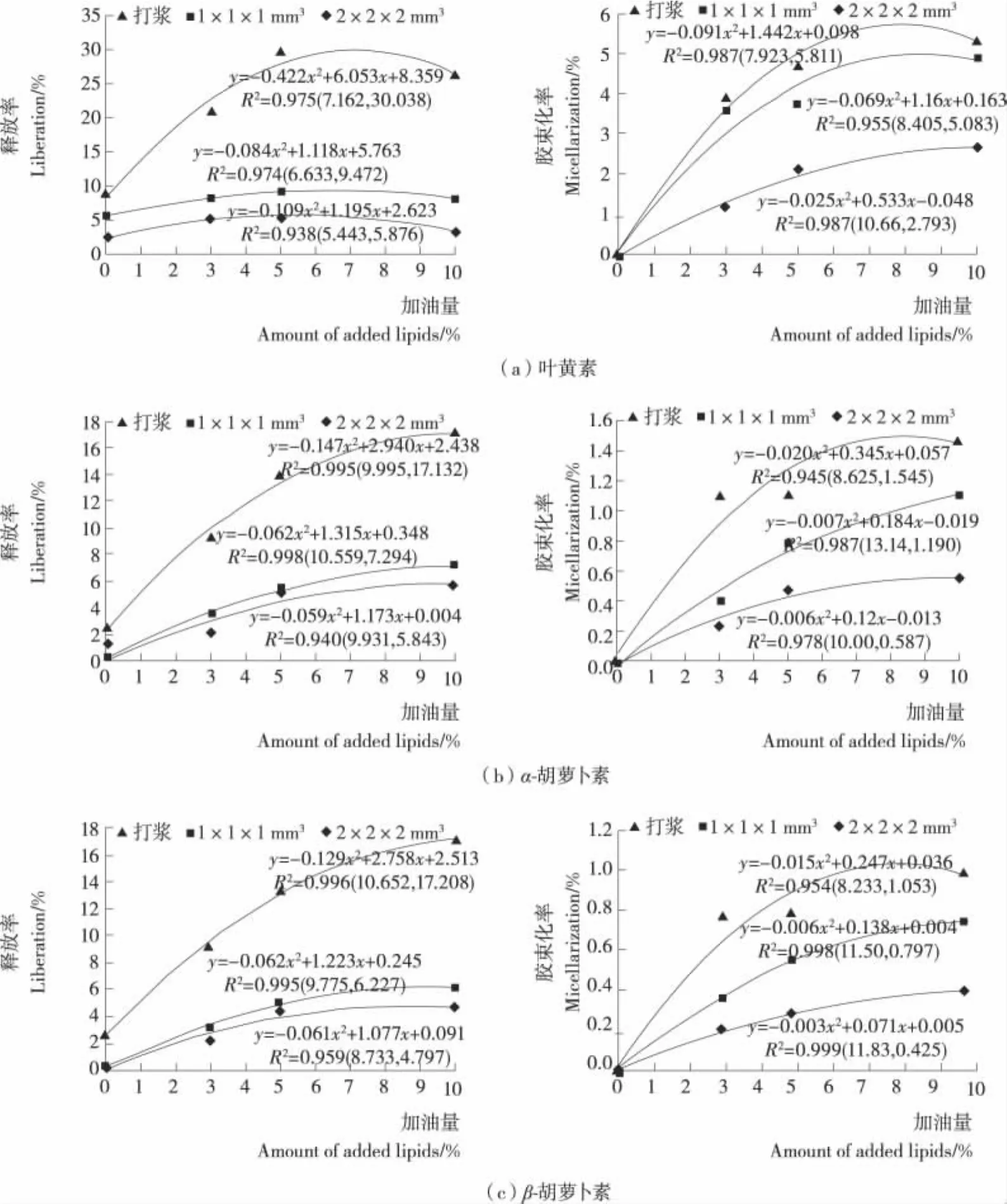
图4 油脂添加量与南瓜中类胡萝卜素生物接近度的相关关系Figure 4 Relationship between the amount of oil and carotenoid bioaccessibility from pumpkin
诸多研究报道了油脂添加量对类胡萝卜素生物接近度的影响,但结论不一。在释放率方面,Knockaert等[14]报道了加入5%(m/m)橄榄油对胡萝卜泥中β-胡萝卜素的释放率无影响,而无论样品是否经过高压均质处理(0.1,10,50,100 MPa)。Bengtsson等[13]则发现:切成圆柱体的橙色肉质红薯经煮、蒸和微波处理后,再经搅拌器制成泥状,加入2.5%(m/m)的葵花籽油后β-胡萝卜素释放率均增加。在胶束化率方面,也有不尽一致的研究结果,如Ornelas-Paz等[15]研究表明:在不同成熟度(早期、中期、完全成熟)的芒果中加入鸡肉,胶束化率分别增加了25.7%,114.4%,2 31.1%;相类似地,Hornero-Méndez等[22]在胡萝卜渣(切碎)中加入油脂(5%,10%橄榄油),胶束化率随油脂添加量的增加而增加;但是Fleshman等[16]的研究表明,添加2.5%~3.0%植物油对打浆处理的甜瓜β-胡萝卜素的胶束化率无显著影响。Schweiggert等[7]的研究表明,西红柿中番茄红素和β-胡萝卜素、木瓜中的β-胡萝卜素、胡萝卜中的叶黄素在油脂添加量(葵花籽油)为2.5%条件下的胶束化率与添加量为1.0%相比,反而有明显的下降趋势。Huo等[10]的研究表明,三油酰甘油脂对色拉中番茄红素胶束化率的影响也呈现先增后降的趋势。造成上述研究结果不一致的原因除了与油脂种类、物料种类有关外,还可能与油脂添加量研究范围较窄、原料处理方面的差异(如切分、打浆等)有关;同时,原料处理与油脂添加量之间还可能存在交互作用。
2.3 南瓜中不同种类胡萝卜素生物接近度的比较
比较相同机械处理和油脂添加量条件下南瓜中3种类胡萝卜素释放率和胶束化率,可看出:叶黄素的释放率和胶束化率均显著高于α-和β-胡萝卜素。Pugliese等[25]报道了红辣椒中叶黄素胶束化率远高于β-胡萝卜素;Courraud等[26]报道了胡萝卜汁的叶黄素胶束化率显著高于α-和β-胡萝卜素,经沸水煮处理的菠菜叶黄素胶束化率远高于β-胡萝卜素。
不同种类胡萝卜素生物接近度差异的原因可能有:①疏水性不同;② 在植物组织中存在的部位及化学形式不同。使其从食物基质向消化液释放以及随后从消化液的油滴向胶束迁移的能力有所不同。诸多研究报导了类胡萝卜素的胶束化率与其疏水性呈负相关关系[7,10,27,28]。含氧胡萝卜素由于极性较大,使其更容易向基质为水的消化液释放;同时,当类胡萝卜素释放至消化液中,通常首先富集在分散的油滴中,烃类结构的胡萝卜素如α-/β-胡萝卜素由于极性较小,因此位于油滴中心,而含氧的极性叶黄素则位于油滴表面,使得其从油脂转移到胶束中所受到阻力较小,这有可能是促进叶黄素更易转移到胶束中的原因[28,29]。本研究结果表明南瓜中叶黄素的释放率显著高于α-/β-胡萝卜素,说明叶黄素比α-/β-胡萝卜素更容易从食物基质释放到消化液中;从物料释放至消化液中的叶黄素平均约有35%进入胶束,而α-胡萝卜素和β-胡萝卜素平均分别只有约11%和9%被包被在胶束中,也证实了叶黄素比α-/β-胡萝卜素更容易从消化液的油滴中转移至胶束中。
打浆处理时,β-胡萝卜素与α-胡萝卜素的释放率无显著差异,但后者的胶束化率显著高于前者。Hornero-Méndez等[22]以胡萝卜渣为材料,在研究热处理对胡萝卜渣中β-胡萝卜素生物接近度影响的过程中发现:在生胡萝卜中,β-胡萝卜素与α-胡萝卜素的比值为1.80,将生胡萝卜渣经体外消化后消化液中β-胡萝卜素与α-胡萝卜素的比值依然为1.80,但被包被到胶束中时β-胡萝卜素与α-胡萝卜素的比值降为1.60,并且这个比值会随油脂添加量的增加而降低;将胡萝卜渣于100℃热水中处理15min,β-胡萝卜素与α-胡萝卜素间这种关系依然存在。说明同种条件下胡萝卜中α-胡萝卜素与β-胡萝卜素相比,释放程度无差异,但更容易被包被至胶束中,与本试验中打浆处理条件下的研究结果相吻合。但是,在2种切丁处理时,α-胡萝卜素的释放率和胶束化率均高于β-胡萝卜素,并在加油量为5%和10%条件下达到显著水平。
3 结论
南瓜中类胡萝卜素的生物接近度因机械加工和油脂添加量而异:机械加工所得物料粒度越小,越有利于提高类胡萝卜素的生物接近度;在一定油脂添加量范围内,类胡萝卜素的生物接近度随油脂添加量增大而增大,但存在极值;物料粒度越小,可达到的极值越高。因此,南瓜加工产品可利用机械加工减少物料粒度和添加适量油脂以提高其类胡萝卜素生物利用率。另外,油脂种类对南瓜类胡萝卜素生物利用率的影响有待进一步研究,以便为油脂在南瓜产品中的应用提供更多的依据。
1 Vílchez C,Forján E,Cuaresma M,et al.Marine carotenoids:Biological functions and commercial applications[J].Marines Drugs,2011,9(3):319~333.
2 Fernández-García E,Carvajal-Lérida I,Jarén-Galán M,et al.Carotenoids bioavailability from foods:from plant pigments to efficient biological activities[J].Food Research International,2012,46(2):438~450.
3 Qian C,Decker E A,Xiao H,et al.Nanoemulsion delivery systems:Influence of carrier oil onβ-carotene bioaccessibility[J].Food Chemistry,2012,135(3):1 440~1 447.
4 Van Het Hof K H,West C E,Weststrate J A,et al.Dietary factors that affect the bioavailability of carotenoids[J].The Journal of Nutrition,2000,130(3):503~506.
5 Tydeman E A,Parker M L,Wickham M S J,et al.Effect of carrot(Daucus carota)microstructure on carotene bioaccessibilty in the upper gastrointestinal tract.1.In vitro simulations of carrot digestion[J].Journal of Agricultural and Food Chemistry,2010,58(17):9 847~9 854.
6 Veda S,Platel K,Srinivasan K.Varietal differences in the bioaccessibility ofβ-carotene from mango(Mangifera indica)and papaya(Carica papaya)fruits[J].Journal of Agricultural and Food Chemistry,2007,55(19):7 931~7 935.
7 Schweiggert R M,Mezger D,Schimpf F,et al.Influence of chromoplast morphology on carotenoid bioaccessibility of carrot,mango,papaya,and tomato[J].Food Chemistry,2012,135(4):2 736~2 742.
8 Tydeman E A,Parker M L,Faulks R M,et al.Effect of carrot(Daucus carota)microstructure on carotene bioaccessibility in the upper gastrointestinal tract.2.In vivo digestions[J].Journal of Agricultural and Food Chemistry,2010,58(17):9 855~9 860.
9 Parada J,Aguilera J M.Food microstructure affects the bioavailability of several nutrients[J].Joural of Food Science,2007,72(2):21~32.
10 Huo T,Ferruzzi M G,Schwartz S J,et al.Impact of fatty acyl composition and quantity of triglycerides on bioaccessibility of dietary carotenoids[J].Journal of Agricultural and Food Chemistry,2007,55(22):8 950~8 957.
11 Degrou A,GeorgéS,Renard C M G C,et al.Physicochemical parameters that influence carotenoids bioaccessibility from a tomato juice[J].Food Chemistry,2013,136(2):435~441.
12 Colle I J P,Van Buggenhout S,Lemmens L,et al.The type and quantity of lipids present during digestion influence the in vitro bioaccessibility of lycopene from raw tomato pulp[J].Food Research International,2012,45(1):250~255.
13 Bengtsson A,Brackmann C,Enejder A,et al.Effects of thermal processing on the in vitro bioaccessibility and microstructure ofβ-carotene in orange-fleshed sweet potato[J].Journal of Agricultural and Food Chemistry,2010,58(20):11 090~11 096.
14 Knockaert G,Lemmens L,Van Buggenhout S,et al.Changes inβ-carotene bioaccessibility and concentration during processing of carrot puree[J].Food Chemistry,2012,133(1):60~67.
15 Ornelas-Paz J D J,Failla M L,Yahia E M,et al.Impact of the stage of ripening and dietary fat on in vitro bioaccessibility ofβcarotene in ‘ataulfo’mango[J].Journal of Agricultural and Food Chemistry,2008,56(4):1 511~1 516.
16 Fleshman M K,Lester G E,Riedl K M,et al.Carotene and novel apocarotenoid concentrations in orange-fleshedCucumis melomelons:Determinations ofβ-carotene bioaccessibility and bioavailability[J].Journal of Agricultural and Food Chemistry,2011,59(9):4 448~4 454.
17 Murkovic M,Mülleder U,Neunteufl H.Carotenoid content in different varieties of pumpkins[J].Journal of Food Composition and Analysis,2002,15(6):633~638.
18 Azevedo-Meleiro C H,Rodriguez-Amaya D B.Qualitative and quantitative differences in carotenoid composition amongCucurbita moschata,Cucurbita maxima,andCucurbita pepo[J].Journal of Agricultural and Food Chemistry,2007,55(10):4 027~4 033.
19 李俊丽.南瓜种质资源遗传多样性与多糖多样性的研究[D].武汉:华中农业大学,2006.
20 宋曙辉,薛颖.高效液相色谱法测定蔬菜中的类胡萝卜素[J].华北农学报,2001,16(3):92~97.
21 Bengtsson A,Alminger M L,Svanberg U.In vitro bioaccessibility ofβ-carotene from heat-processed orange-fleshed sweet potato[J].Journal of Agricultural and Food Chemistry,2009,57(20):9 693~9 698.
22 Hornero-Méndez D,Mínguez-Mosquera M I.Bioaccessibility of carotenes from carrots:Effect of cooking and addition of oil[J].Innovative Food Science & Emerging Technologies,2007,8(3):407~412.
23 Failla M L,Huo T,Thakkar S K.In vitro screening of relative bioaccessibility of carotenoids from foods[J].Asia Pacific Journal of Clinical Nutrition,2008,17(SUPPL.1):200~203.
24 Hedrén E,Diaz V,Svanberg U.Estimation of carotenoid accessibility from carrots determined by an in vitro digestion method[J].European Journal of Clinical Nutrition,2002,56(5):4 25~430.
25 Pugliese A,Loizzo M R,Tundis R,et al.The effect of domestic processing on the content and bioaccessibility of carotenoids from chili peppers(Capsicum species)[J].Food Chemistry,2013,141(3):2 606~2 613.
26 Courraud J,Berger J,Cristol J P,et al.Stability and bioaccessibility of different forms of carotenoids and vitamin A during in vitro digestion[J].Food Chemistry,2013,136(2):871~877.
27 Ryan L,O’Connell O,O’Sullivan L,et al.Micellarisation of carotenoids from raw and cooked vegetables[J].Plant Foods for Human Nutrition,2008,63(3):127~133.
28 Garrett D A,Failla M L,Sarama R J.Estimation of carotenoid bioavailability from fresh stir fried vegetables using an in vitro digestion/Caco-2cell culture model[J].Journal of Agricultural and Food Chemistry,2000,11(11~12):574~580.
29 Borel P,Grolier P,Armand M,et al.Caroteonids in biological emulsions:Solubility,surface-to-core distribution,and release from lipid droplets[J].The Journal of Lipid Research,1996,37(2):250~261.

