海参体壁胶原纤维简化制备方法及其特性分析
商文慧 朱祉默 孙世广 吴海涛
(1.大连工业大学食品学院,辽宁 大连 116034;2.国家海洋食品工程技术研究中心,辽宁 大连 116034)
海参(Stichopusjaponicus)属棘皮动物门,是一种珍贵的海洋无脊椎动物,具有极高的营养价值和药用价值。2012年,中国海参产量已达到17.08万t[1],海参体壁是海参的主要食用部位,体壁中胶原占总蛋白的70%[2],具有极大的开发价值。
研究[3]发现,海参胶原纤维是胶原分子高度交联的聚合体,若不进行特殊的处理,只有很少的胶原能够溶解。本课题组的前期研究[4]也发现:与鱼皮胶原蛋白不同,利用含有β-巯基乙醇、尿素及十二烷基硫酸钠等变性剂的溶液也并不能直接从海参体壁中溶解出胶原蛋白,海参体壁中的胶原成分必需经过化学处理后才能被电泳检测。目前,在海参体壁胶原蛋白的制备过程中,获得胶原纤维是进一步提取的前提,再利用胃蛋白酶水解,从而促进胶原蛋白的溶解[5-7]。传统提取海参胶原纤维的方法步骤繁琐,提取时间长,亟待建立新的简化方法。
本研究在前期提取海参酶促溶性胶原蛋白[6,7]的基础上,对原料预处理方法进行了改进。以十二烷基硫酸钠—聚丙烯酰胺凝胶电泳(SDS—PAGE)为检测手段,考察水洗涤、缓冲溶液洗涤、碱溶液洗涤对海参体壁胶原纤维制备的影响,建立了海参体壁胶原纤维简易提取方法,并对获得胶原纤维进行鉴定,为深入研究海参体壁胶原蛋白的理化特性及开发应用奠定研究基础。
1 材料与方法
1.1 海参
海参购自大连旅顺,新鲜海参经剖杀后,去嘴和内脏,并去除内壁中的肌肉层,取体壁部分贮藏于-80℃。
1.2 仪器与试剂
数显匀浆机:T25型,德国IKA公司;
微量台式离心机:Micro 17R型,美国Thermo Scientific公司;
冷冻离心机:CF 16XⅡ型,日本HITACHI公司;
垂直电泳仪槽:AE-6450型,日本ATTO公司;
凝胶成像仪:MF-ChemiBIS 2.0型,以色列DNR Bio-imaging公司;
pH计:Satorius型,赛多利斯科学仪器(北京)有限公司;
液相色谱:P1201型,大连依利特分析仪器有限公司。
丙烯酰胺、N,N-亚甲基双丙烯酰胺、N,N-四甲基乙二胺(TEMED)、十二烷基硫酸钠、过硫酸铵、甘氨酸、巯基乙醇等生化试剂:上海生工生物工程有限公司;
蛋白质分子量标准品:宝生物工程(大连)有限公司;
2,4-二硝基氟苯(DNFB)、N,N-二甲基甲酰胺:色谱纯,大连依利特分析仪器有限公司;
其他试剂均为分析纯。
为详细说明上文所提的动态过程,我们针对特朗普总统2017年《报告》,从时间、空间和情态三个方面,具体分析《报告》如何采用趋近化策略将中国识解为不断迫近的威胁,从而实现促使美国政府增加军事开支以及实施贸易保护等政治意图。
1.3 方法
1.3.1 海参体壁胶原纤维的提取 如下所有操作除特殊注明外,均在4℃下进行。取100g新鲜海参体壁,切碎后,加入100mL去离子水(0℃)匀浆,控制匀浆机转速为3 000~5 000r/min,为防止匀浆过程中产热对原料的影响,本试验匀浆分多次完成,每次匀浆约30s,间隔时间约15s,待原料均匀后14 500×g离心15min,弃上清,重复水洗步骤1~3次。经水洗的海参匀浆组织加入10倍(m/V)的0.1mol/L pH 8.0Tris—HCl缓冲液(含5mmol/L EDTA 和0.5mol/L NaCl),缓慢搅拌8h,14 500×g离心15min,弃上清。经缓冲液洗涤的海参匀浆组织加入10倍(m/V)4℃0.1mol/L NaOH搅拌72h,14 500×g离心15min,弃上清。沉淀用去离子水洗至中性,得到海参体壁胶原纤维。
1.3.2 各因素对海参体壁胶原纤维电泳检测的影响
(1)水洗次数对海参体壁胶原纤维电泳检测的影响:对海参胶原纤维提取过程中水洗步骤进行考察,逐步进行1,2,3次的水洗流程,分别取沉淀。再按照1.3.1的方法进行提取,NaOH溶液洗涤为72h,分别在Tris—HCl缓冲液洗涤和NaOH溶液洗涤后的离心步骤中收集沉淀。进一步进行SDS—PAGE电泳检测,以研究水洗次数对海参体壁胶原纤维的影响。
(2)碱洗时间对海参体壁胶原纤维电泳检测的影响:对海参胶原纤维提取过程中碱洗步骤进行考察,水洗次数为3次,按照1.3.1的方法进行Tris—HCl缓冲液洗涤,再分别将沉淀用NaOH溶液洗涤24,48,72h后离心,收集沉淀。进一步进行SDS—PAGE电泳检测,以研究碱洗时间对海参体壁胶原纤维的影响。
(3)碱液浓度对海参体壁胶原纤维电泳检测的影响:对海参胶原纤维提取过程中碱洗步骤进行考察,水洗次数为3次,按照1.3.1的方法进行Tris—HCl缓冲液洗涤,再分别将沉淀用不同浓度的 NaOH 溶液(0.05,0.06,0.07,0.08,0.09,0.10mol/L)洗涤24h后离心,收集沉淀。进一步进行SDS—PAGE电泳检测,以研究碱液浓度对海参体壁胶原纤维的影响。
1.3.3 SDS—PAGE电泳检测 取一定待检测的样品,加入等体积5×上样缓冲液(250mM pH 7.5Tris—HCl缓冲液、8 M尿素、5%SDS、5%巯基乙醇),100℃煮沸5min,震荡过夜,16 500×g离心后取上清,进行SDS—PAGE电泳检测。浓缩胶浓度为5%,分离胶浓度为8%,电泳缓冲液采用SDS—Tris—甘氨酸体系。电泳完毕后,进行考马斯亮蓝R-250染色,脱色后成像。
1.3.4 红外光谱分析 取适量冷冻干燥后的海参胶原纤维和干燥后的溴化钾,置于玛瑙研钵中,研磨成粉后,装样压片。采用红外光谱仪对样品在400~4 000cm-1区间进行扫描。
1.3.5 氨基酸分析
(1)样品预处理:取25mg海参体壁胶原纤维,于安醅瓶中加入3mL 6mol/L盐酸,封口后在110℃水解24h。水解后样品转移至蒸发皿,水浴蒸干。衍生缓冲溶液多次洗涤蒸发皿,转入25mL容量瓶定容,0.45μm微孔滤膜过滤,备用。
(2)样品衍生化:取样品液10mL于棕色试剂瓶,加5mL衍生试剂,混匀后60℃水浴,暗处反应60min。反应完毕,冷却至室温,加平衡缓冲溶液定容,0.45μm微孔滤膜过滤,利用依利特P1201液相色谱进行分析。
1.3.6 氨基酸测序 将海参胶原纤维的电泳条带切胶回收,委托国家生物医学分析中心进行序列测定。采用胰蛋白酶进行胶内酶切。采用nanoACQUITY超高液相色谱仪系统(Waters公司)进行纳升级电喷雾分离。使用BEH C18色谱柱,色谱柱参数为:75μm×250mm,1.7μm颗粒大小,并使用99%流动相A(水溶液中含0.1%甲酸)和1%流动相B(乙腈中含有0.1%甲酸)。将nanoACQUITY超高液相色谱仪连接至Synapt G2质谱仪(Waters,Milford,MA)。源温度为100℃,质谱仪采集域为350~1 600,二级质谱仪50~2 000。原始数据使用ProteinLynx Global Server version 2.3(PLG2.3,Waters)处理,将其上传至内部服务器并能够通过Mascot检索软件进行MS/MS离子方式检索数据库。
2 结果与讨论
2.1 水洗次数对海参体壁胶原纤维电泳检测的影响
由图1可知,海参体壁经1~3次的水洗步骤,沉淀中的蛋白质组分并未发生太大的改变,蛋白质分子量主要为2 00kDa。值得注意的是,海参体壁经一次水洗后,电泳污染较为严重,主要为多糖的干扰。经进一步水洗后,多糖对电泳的干扰现象有所缓解,但并未去除。前期的研究[5]已经发现,海参体壁经电泳缓冲液浸提,获得的主要为2 00kDa的非胶原蛋白质,这与本研究结果一致。水洗后的海参体壁匀浆经Tris—HCl缓冲液洗涤后,多糖干扰极大降低,分子量为200,66.4~97.2kDa的非胶原蛋白质也被缓冲液溶解。进一步经NaOH溶液洗涤后,可见清晰的电泳条带,主要位于116~2 00kDa,与典型的胶原蛋白α亚基位置相同。由以上结果可见,不同洗涤步骤可有效地去除海参体壁中非胶原蛋白,且碱洗是去除海参体壁非胶原蛋白和促进胶原组织溶胀的重要步骤,因此,进一步对该步骤进行优化。
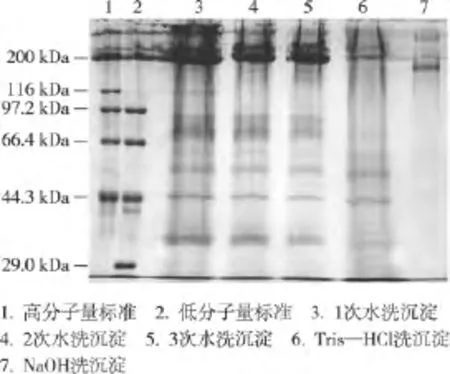
图1 水洗次数对海参体壁胶原纤维电泳检测的影响Figure 1 Effect of rinsing times on electrophoretic analysis of collagen fibers from sea cucumber body wall
2.2 碱洗时间对海参体壁胶原纤维电泳检测的影响
由图2(a)可知,经NaOH溶液洗涤24,48,72h后均有海参胶原蛋白电泳条带检出。而适当缩短洗涤时间后(12,16,20h),电泳检测均未出现胶原条带(图2(b))。NaOH溶液洗涤是提取水产品胶原的常用方法,不仅能够去除原料中的非胶原物质,而且还能够使紧密结合的胶原组织溶胀。浸提时间长短决定了胶原组织的溶胀程度,从而促进胶原纤维蛋白溶解于电泳上样缓冲液中,被SDS—PAGE电泳检出。根据上述结果,选择NaOH洗涤24h为碱处理的适宜洗涤时间。
2.3 碱液浓度对海参体壁胶原纤维电泳检测的影响
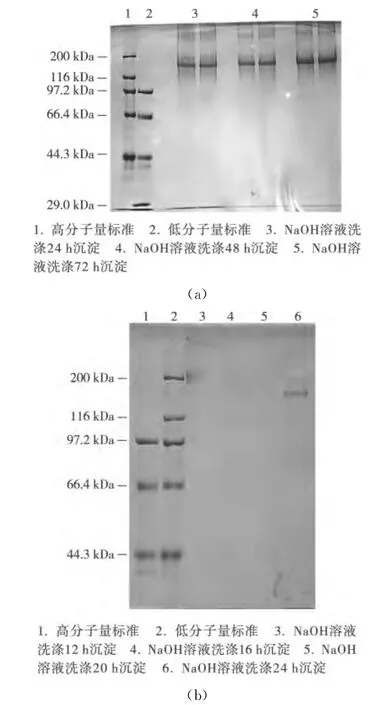
图2 碱洗时间对海参体壁胶原纤维电泳检测的影响Figure 2 Effect of wash time of NaOH solution on electrophoretic analysis of collagen fibers from sea cucumber body wall
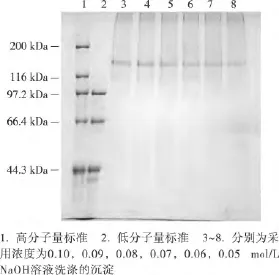
图3 碱液浓度对海参体壁胶原纤维电泳检测的影响Figure 3 Effect of concentration of NaOH solution on electrophoretic analysis of collagen fibers from sea cucumber body wall
由图3可知,采用不同浓度NaOH溶液处理海参体壁胶原纤维,均得到116~200kDa的条带。同时也发现,碱溶液浓度越低,获得的沉淀越疏松,会对沉淀的收集造成一定的影响。因而,采用0.1mol/L NaOH溶液浓度为适宜碱浓度。
2.4 海参体壁胶原纤维的红外光谱分析
采用水洗3次、Tris—HCl洗涤8h和0.1mol/L NaOH溶液洗涤24h的条件,对海参体壁胶原纤维进行提取,经冻干后,呈现白色、纤维状。进一步对海参体壁胶原纤维进行理化分析。由图4可知,海参体壁胶原纤维最主要的吸收带在酰胺带处,包括酰胺 A带(3 340cm-1)、酰胺Ⅰ带(1 661cm-1)、酰胺Ⅱ带(1 557.3cm-1)和酰胺Ⅲ带(1 238.4cm-1),这与海参酶促溶性胶原蛋白的红外光谱相似[6]。酰胺 A带(3 340cm-1)与海参体壁胶原纤维分子N—H的收缩震动有关[8],低于非胶原蛋白(3 400~3 440cm-1)的波数。酰胺Ⅰ带(1 661cm-1)证明海参体壁胶原纤维分子处于交联状态[9]。酰胺Ⅱ带(1 557.3cm-1)与N—H弯曲振动有关,而酰胺Ⅲ带(1 238.4cm-1)与N—H弯曲振动和C—N伸缩振动有关。

图4 海参体壁胶原纤维红外光谱图Figure 4 Infrared spectrogram of collagen fibers from sea cucumber body wall
2.5 海参体壁胶原纤维的氨基酸组成
由表1可知,海参体壁胶原纤维的甘氨酸含量为(3 2.34±0.06)%,约占总氨基酸1/3,这与海参酶促溶性胶原蛋白中的甘氨酸含量相近[6,8]。海参体壁胶原纤维中脯氨酸,羟脯氨酸的含量分别为7.75%,5.10%,其含量略低于海参酶促溶性胶原蛋白[6,8]。
2.6 氨基酸测序
胶原蛋白的定性分析主要包括红外光谱分析、氨基酸组成分析、紫外光谱分析和圆二色谱分析。由于受到海参胶原纤维溶解性的限制,紫外光谱分析和圆二色谱分析无法进行。由于本研究采用SDS—PAGE电泳检测的方法对海参胶原纤维简化提取步骤进行了跟踪,所以对2.2中得到的海参体壁胶原纤维蛋白条带进行切胶,采用氨基酸测序分析方法进一步分析。结果显示,其随机片段 Gly-Leu-Pro-Gly-Ala-Arg-Gly-Ser-Asn-Gly-Asn-Asp-Gly-Pro-Ala-Gly-Pro-Arg-Gly-Phe-Asp-Gly-Pro-Glu-Gly-Pro-Arg与球海胆(Paracentrotuslividus)I型胶原蛋白前体相同。
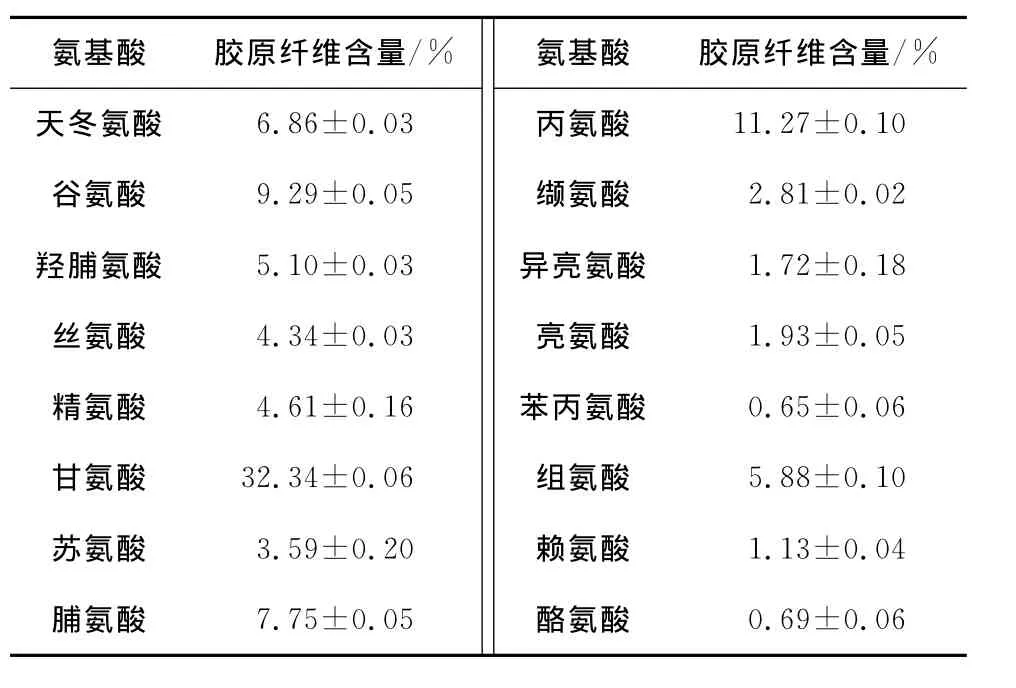
表1 海参体壁胶原纤维氨基酸分析Table 1 Amino acid composition of collagen fibers from sea cucumber body wall
针对海参体壁胶原纤维,Matsumura等[9]采用含有0.5MNaCl、0.05MEDTA、0.2Mβ-巯基乙醇和0.1MTris—HCl缓冲溶液(pH 8.0)处理海参体壁,组织被分解,用酸溶液提取可以获得完整的胶原纤维。Trotter等[10]改进了海参胶原蛋白的提取方法,采用适当的离子强度EDTA溶液实现了海参胶原的提取。Saito等[11]采用β-巯基乙醇,0.1mol/L的NaOH处理海参组织,使胶原纤维溶胀,再加入一定量的胃蛋白酶进行消化,大部分的胶原纤维完全溶解到液体中。本研究利用简易方法,从海参体壁中提取获得胶原纤维,经理化特性分析其具有典型的胶原蛋白特性,其提取时间由传统的7d缩短为2d。
3 结论
(1)采用水洗3次、Tris—HCl洗涤8h和0.1mol/L NaOH溶液洗涤24h的条件可获得海参体壁胶原纤维,其冻干品呈现白色、纤维状。
(2)海参体壁胶原纤维经红外光谱、氨基酸组成及序列分析,具有典型的胶原蛋白特性。利用简易方法获得的海参体壁胶原纤维,针对其溶解性的改善还有待于进一步的研究。
1 农业部渔业局.2013中国渔业统计年鉴[Z].北京:中国农业出版社,2013:29.
2 朱蓓薇.海珍品加工理论与技术的研究[M].北京:科学出版社,2010:32.
3 Trotter JA,Lyons-Levy G,Chino K,et al.Collagen fibril aggregation-inhibitor from sea cucumber dermis[J].Matrix Biology,1999,18(6):569~578.
4 Wu H T,Li D M,Zhu B W,et al.Proteolysis of noncollagenous proteins in sea cucumber,Stichopusjaponicus,body wall:Characterisation and the effects of cysteine protease inhibitors[J].Food Chemistry,2013,141(2):1 287~1 394.
5 Dong X P,Zhu B W,Sun L M,et al.Changes of collagen in sea cucumber(Stichopusjaponicas)during cooking[J].Food Science and Biotechnology,2011,20(4):1 137~1 141.
6 Zhu B W,Dong X P,Zhou D Y,et al.Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumberStichopusjaponicas[J].Food Hydrocolloids,2012,25(1):182~188.
7 Zhang M,Liu W,Li G.Isolation and characterisation of collagens from the skin of largefin longbarbel catfish(Mystusmacropterus)[J].Food Chemistry,2009,115(3):826~831.
8 Prystupa D A,Donald A M.Infrared study of gelatin conformations in the gel and sol states[J].Polymer Gels and Networks,1996,4(2):87~110.
9 Matsumura T.Collagen fibrils of the sea cucumber,Sticliopus japonicus:purification and morphological study[J].Connective Tissue Research,1974,2(2):117~125.
10 Trotter J A,Lyons-Levy G,Luna D,et al.Stiparin:aglycoprotein from sea cucumber dermis that aggregates collagen fibrils[J].Matrix Biology,1996,15(2):99~110.
11 Saito M,Kunisaki N,Urano N,et al.Collagen as the major edible component of sea cucumber (Stichopusjaponicus)[J].Journal of Food Science,2002,67(4):1 319~1 322.

