固相萃取-气相色谱-质谱法同时测定水中9种药品及个人护理用品
贾妍艳, 谭建华,3, 徐 晨, 汤嘉骏, 王赢利, 解启来*
(1.华南农业大学资源环境学院,广东 广州510642;2.土壤环境与废物资源农业利用广东高校重点实验室,广东 广州510642;3.广州市质量监督检测研究院,广东 广州510110)
药品与个人护理品(pharmaceuticals and personal care products,PPCPs)主要包括人用及兽用医药品、化妆品、消毒剂及一些添加剂等物质[1]。近年来,随着医药及洗护行业的大力发展,人们对PPCPs的使用量迅猛增长,这类物质会伴随人类活动直接或间接地进入环境中。由于其具有较强的持久性和生态毒性,容易在水、大气和土壤等介质中残留,给生态环境带来一定风险。PPCPs化合物会在生物体内富集,干扰生物正常生长,造成生物畸变或突变[2-4];同时也对人类的健康产生威胁[5,6]。环境介质中痕量PPCPs化合物的生态安全已引起了人们的广泛关注[4-8],因此建立一个快速、灵敏、可靠的PPCPs化合物定量分析方法是开展相关研究的重要基础。
目前,环境中PPCPs的检测主要采用固相萃取富集[2,9,10],然后 通过高 效液相 色谱(HPLC)[11]、气相色 谱-质 谱(GC-MS)[10,12]、高 效 液 相 色 谱-质 谱(HPLC-MS)[13]、气 相 色 谱-串 联 质 谱(GC-MS/MS)[14]及液 相 色 谱-串 联 质 谱(LC-MS/MS)[15-17]等方法进行定量分析。在各种检测方法中,GC-MS由于具有较高的灵敏度和较强的定性能力而被广泛应 用于PPCPs的 检 测[10,12,18-20]。本 实 验 参 考 文 献并根据目前在我国环境中PPCPs 暴露浓度水平[21-25],选取了4 类9 种水环境中检出率较高的PPCPs(非甾体抗炎镇痛药:水杨酸(salicylic acid,SA)、萘普生(naproxen,NAX)、布洛芬(ibuprofen,IBU)、酮洛芬(ketoprofen,KET)、双氯酚酸(diclofenac,DIC)、对 乙 酰 氨 基 酚(paracetamol,ACE);血 脂 调 节 药:降 固 醇 酸(clofibric acid,CLO);杀菌剂:三氯生(triclosan,TRI);增塑剂:双酚A(bisphenol A,BPA))作为研究对象,利用Oasis HLB固相萃取柱富集净化,三甲基氢氧化硫(TMSH)常温快速衍生化,GC-MS检测,建立了水体中多种PPCPs快速、准确的定量方法,并对东莞市某农田灌溉水中上述9种PPCPs进行了检测。
1 实验部分
1.1 药品与试剂
甲醇、丙酮、乙酸乙酯、乙腈均为色谱纯;实验用水为Milli-Q 超纯水;盐酸、叠氮化钠为分析纯。
9 种PPCPs 标 准 品,内 标 物2,4,5-涕丙酸(fenoprop,FEN),衍生化试剂TMSH、N,O-双三甲基硅基三氟乙酰胺(BSTFA)、N-(叔丁基二甲基硅)-N-甲基三氟乙酰胺(MTBSTFA)均购自德国Dr.Ehrenstorfer公司。
标准溶液的配制:取各标准品适量,溶于甲醇,分别配制成500 mg/L 的标准储备溶液;取上述溶液配制成10 mg/L的9种PPCPs混合标准溶液,置于-20 ℃冰箱中避光保存,使用时稀释成所需的浓度。
1.2 仪器与设备
Agilent 7890A-5975C 气相色谱-质谱联用仪(美国Agilent公司);24孔固相萃取装置(美国Supelco公司);24位氮吹仪(上海安谱科学仪器有限公司);玻璃纤维滤膜(GF/F,直径142 mm,0.7μm孔径,Whatman公司);Oasis HLB 固相萃取柱(200 mg/6 mL,美国Waters公司)。
1.3 GC-MS条件
GC 条件:进样口温度250 ℃;载气为高纯He,恒流模式,流速1 mL/min;不分流进样,进样量1 μL;色谱柱为DB-17MS(30 m×0.25 mm×0.25 μm);柱升温程序:初始温度70 ℃,以20 ℃/min的速率升温至150 ℃,以5 ℃/min的速率升温至200℃,再以60 ℃/min的速率升温至260 ℃,最后以5℃/min的速率升温至280 ℃,保持3 min。
MS 条件:电子轰击电离(EI)源,离子源温度230 ℃,接口温度280 ℃,质量分析器温度150 ℃,选择离子监测(SIM)模式。9 种PPCPs的保留时间、监测离子见表1。
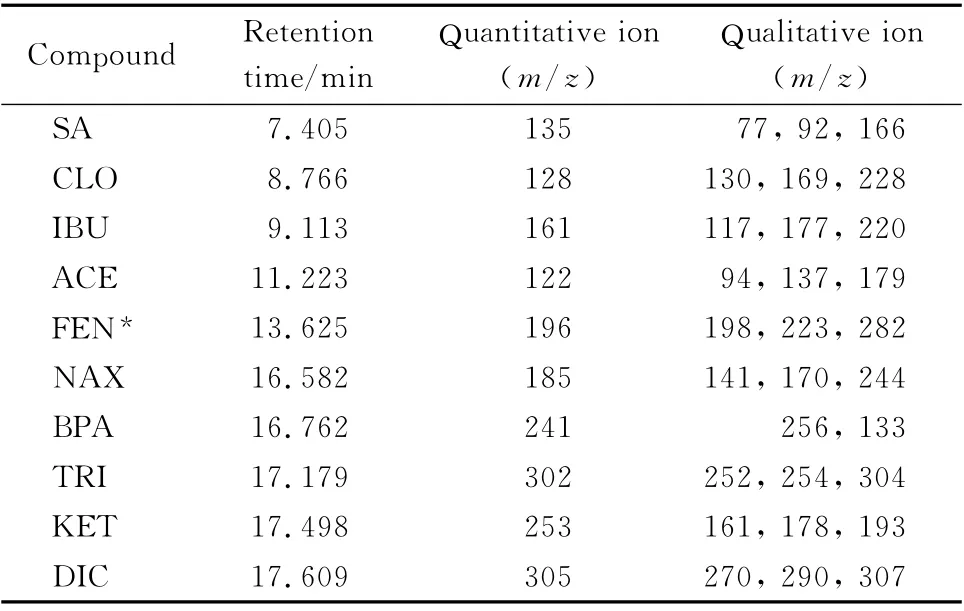
表1 9种PPCPs的GC-MS保留时间、定量及定性离子Table 1 Retention times and quantitative ions and qualitative ions of the nine PPCPs
1.4 样品预处理
在东莞市某农田采集灌溉水(污水处理厂出水为灌溉水)样品10份,分别置于4 L棕色玻璃瓶中,立即加入2 g叠氮化钠以抑制微生物活动,于4 ℃下保存,48 h内进行预处理。取500 mL 由玻璃纤维滤膜过滤后的水样,用5%盐酸溶液调pH=3。将Oasis HLB 固相萃取柱依次经过5 mL 甲醇、5 mL去离子水淋洗活化后,以3~6 mL/min的流速将水样过柱,真空干燥30 min后用10 mL 甲醇洗脱,收集洗脱液,于35℃水浴中用氮气吹扫至近干;加入100 ng内标物2,4,5-涕丙酸,加入1 mL甲醇复溶;取上述复溶溶液100μL,加入20μL衍生化试剂TMSH,于常温下衍生化5 min,待GC-MS分析。
2 结果与讨论
2.1 固相萃取条件的优化
2.1.1 固相萃取柱的选择
萃取水样中PPCPs化合物的常用固相萃取柱有Oasis HLB、Oasis MCX、Strata X、C18和强阴离子交换柱等[10,26,27]。其中Oasis HLB萃取柱的填料是亲水-亲脂聚合物,在较宽的pH 值范围内对酸性、中性和碱性化合物都有较好的萃取效果。本实验对比研究了Strata X(Phenomenex 公司)、Oasis HLB(Waters公司)、C18(Waters公司)3 种固相萃取柱对空白水样加标的萃取回收率。结果(见图1)表明,Strata X 柱和C18柱对9种目标物的萃取回收率为52%~90%,而Oasis HLB 柱对9种PPCPs的萃取回收率为83%~100%,萃取效果较好。同时,由于采用C18柱提取,若柱中的液体流干会严重影响提取效率,对操作要求较高;而Oasis HLB柱操作较为简单,故选择Oasis HLB 柱为本实验的固相萃取柱。
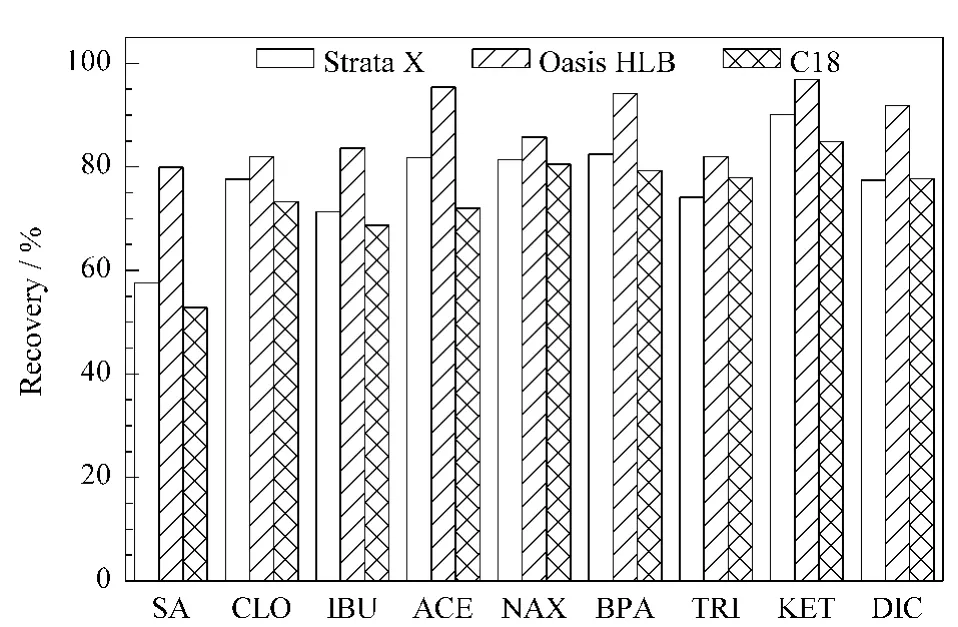
图1 不同固相萃取柱对9种PPCPs的萃取回收率Fig.1 Extraction recoveries of the nine PPCPs with different SPE columns
2.1.2 洗脱溶剂及洗脱体积的确定
实验对比了在不同洗脱溶剂(乙腈、丙酮、甲醇、乙酸乙酯)条件下,Oasis HLB柱对9种PPCPs的萃取效果。结果发现,乙酸乙酯对BPA 和TRI的洗脱效果较好,对其他目标物的洗脱能力较差;而甲醇、乙腈和丙酮对9种目标物的洗脱能力基本相当。但以甲醇为洗脱溶剂时,目标物SA、CLO 和ACE 的回收率更好(见表2),故本实验以甲醇为洗脱溶剂。

表2 4种不同洗脱溶剂下9种PPCPs的萃取回收率Table 2 Extraction recoveries of the nine PPCPs with four elution solvents
本实验还考察了洗脱溶剂的体积对洗脱效果的影响。分别以6、8、10、12 mL 甲醇为洗脱溶剂,比较9 种PPCPs 的萃取回收率(加标水平为100 μg/L)。结果显示,ACE在以6 mL和8 mL甲醇为洗脱溶剂时回收率偏低;以10 mL甲醇为洗脱溶剂时各目标物的回收率最好(见表3);用12 mL 甲醇洗脱时,目标物的回收率没有显著增加。故本实验选择10 mL为洗脱体积。
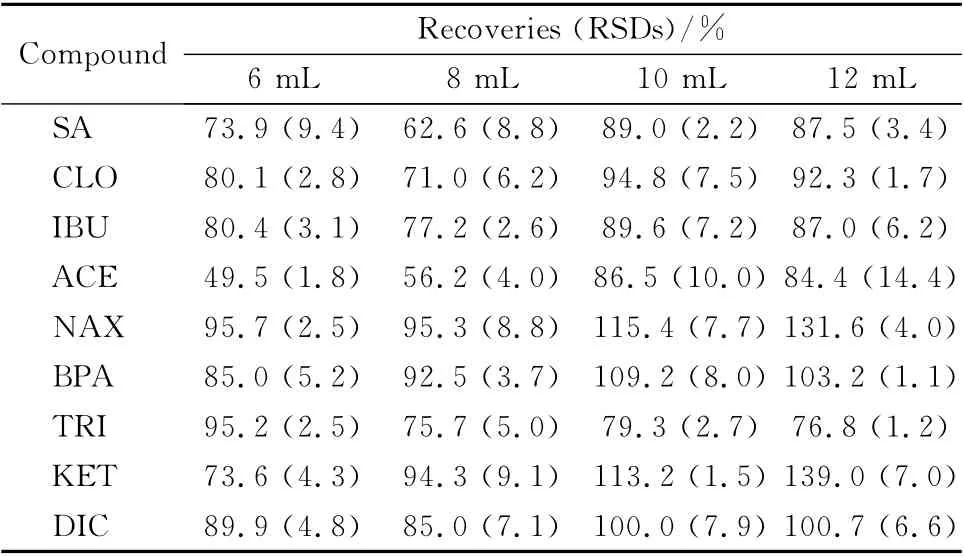
表3 洗脱溶剂体积对9种PPCPs的萃取回收率的影响Table 3 Effect of elution volume of the elution solvent on the extraction recoveries of the nine PPCPs
2.2 衍生化条件的优化
2.2.1 衍生化试剂及温度的选择
本实验选取3种衍生化试剂TMSH、MTBSTFA 和BSTFA 作了对比考察。取100μL 混合标准溶液,分别加入20μL衍生化试剂TMSH、MTBSTFA、BSTFA,分别在常温和75 ℃条件下衍生化60 min。实验结果发现,在常温和75 ℃条件下,ACE的响应面积在TMSH 与MTBSTFA 为衍生化试剂时基本一致,而其余8种目标物的响应面积在TMSH 为衍生化试剂时显著大于MTBSTFA 和BSTFA 时(见图2)。可见,以TMSH 为衍生化试剂各目标物可达到最好的衍生化效果。同时对比常温和75℃条件下各目标物质在TMSH 为衍生化试剂时的响应面积,结果表明升高温度对于目标物的衍生反应影响较小。综合考虑,选择在常温下用TMSH 衍生化。
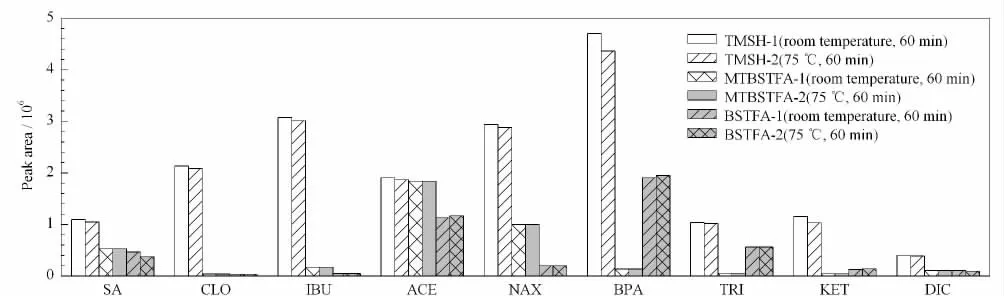
图2 9种PPCPs在不同衍生化试剂条件下的衍生化效果Fig.2 Derivatization effect of the nine PPCPs with different derivatization reagents
2.2.2 衍生化反应时间的选择
本实验考察了反应时间对TMSH 衍生化效果的影响。在常温条件下,比较了不同的衍生时间(5、30、60和90 min)下9 种PPCPs衍生化的响应面积。结果显示,目标物衍生化的响应面积不随时间增长而增加,在5、30、60和90 min时间下目标物衍生化的响应差别较小。从实验结果可知,在5 min时9种PPCPs的衍生化已完全。故本实验选取衍生化时间为5 min。
2.3 回收率、线性关系、检出限和定量限
9种PPCPs在1~1000μg/L 范围内呈现良好的线性关系,相关系数(r2)均在0.995以上。空白样品中9 种PPCPs的加标回收率(分别加标10μg/L和100μg/L)见表4,相对标准偏差(RSD)均不高于10%。在空白样品中添加一定量的标准物质,按照建立的方法处理和测定,以信噪比为3和信噪比为10对应的浓度确定为方法的检出限和定量限,9种PPCPs的检出限和定量限分别为0.03~0.3μg/L和0.15~1.50μg/L。目标物混合标准溶液的选择离子监测谱图见图3。
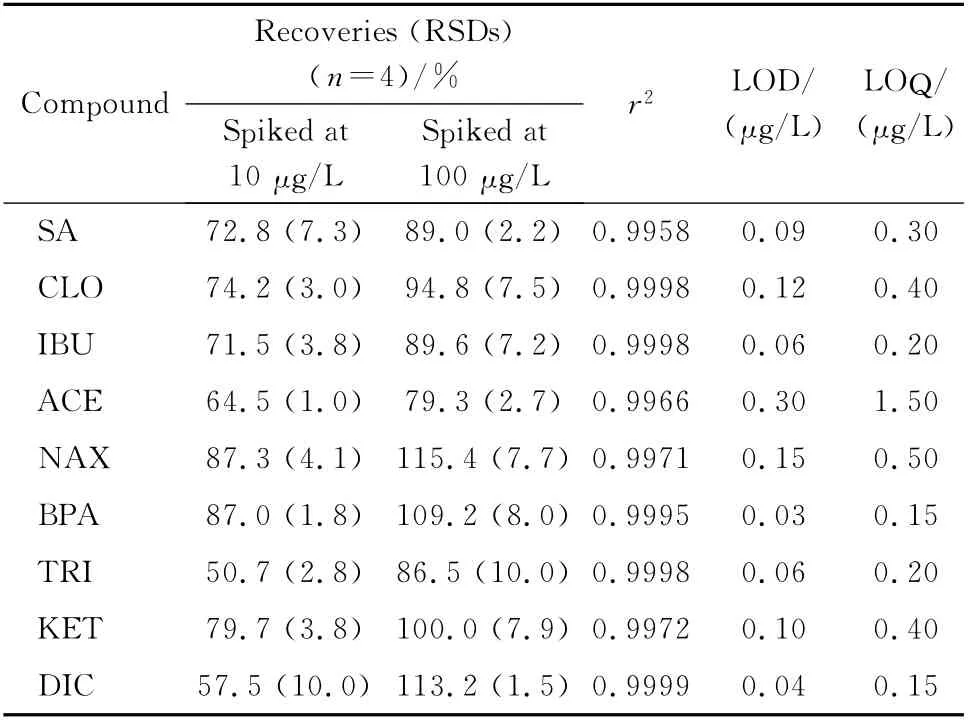
表4 9种PPCPs的加标回收率、线性范围、线性相关系数、方法的检出限和定量限Table 4 Spiked recoveries,correlation coefficients(r2),limits of detection(LODs),limits of quantification(LOQs)of the nine PPCPs
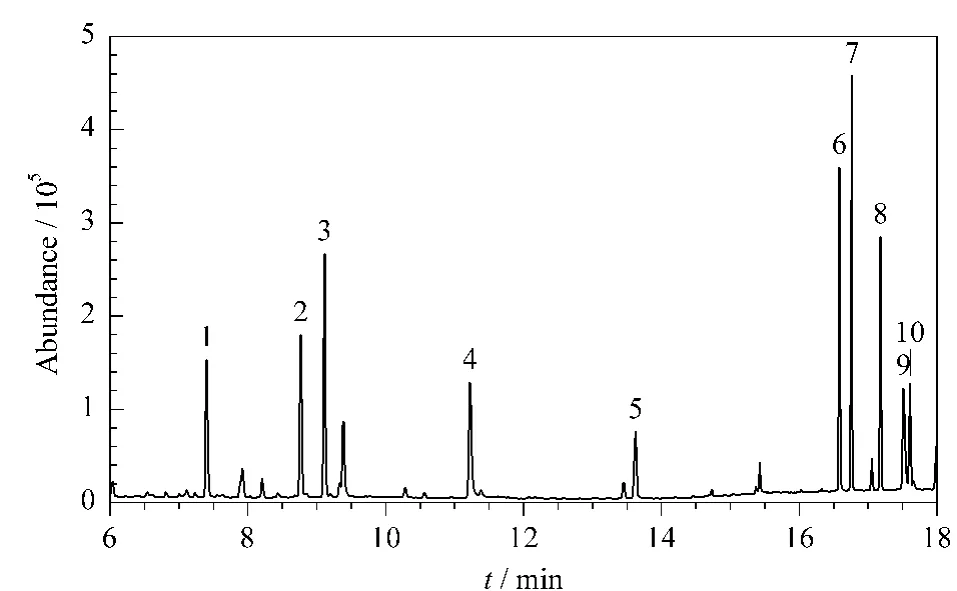
图3 9种PPCPs混合标准溶液的选择离子监测谱图Fig.3 SIM chromatogram of a mixed solution of the nine PPCPs standards
2.4 环境样品分析
采用本文建立的方法对东莞市某农田灌溉水样品中9种PPCPs含量进行了测定。实验结果显示,在10份水样中,ACE、NAX、IBU、CLO 和TRI均未检出;部分水样中SA、BPA、KET和DIC 有检出(见图4)。其中SA 和BPA 的质量浓度较高,分别为<LOQ~0.176μg/L 和<LOQ~0.998μg/L。该农田灌溉水为污水处理厂出水,而污水经过处理后可能仍含有部分未被降解或降解不彻底的PPCPs,故采集的灌溉水样品中有一定的PPCPs残留,这与文献报道[2]相符。
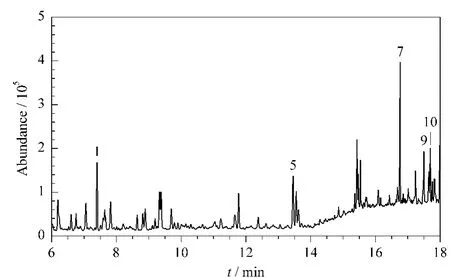
图4 某农田灌溉水样品的色谱图Fig.4 Chromatogram of a farmland irrigation water sample
3 结论
本研究建立了固相萃取-衍生化-气相色谱-质谱测定水样品中9 种PPCPs的方法。样品中9 种PPCPs经HLB 柱浓缩富集,TMSH 常温快速衍生化,GC-MS分析,内标法定量。实验结果表明,该方法操作简便快捷,具有较高的灵敏度和准确性,并已成功应用于东莞市某农田灌溉水的检测,为我国水环境中多种PPCPs的研究提供了可靠的分析检测方法。由于PPCPs在环境中的持久性和难降解性,不仅需要我们关注环境中的PPCPs化合物的浓度水平,还需要关注其在环境中的迁移转化规律及生物毒理性质等。因此,在药品与个人护理品的环境污染研究领域中未来更应注重其迁移转化规律及环境风险方面的研究。
[1] Zou Y M,Wu X Y,Yang L Q.Environmental Monitoring Management and Technology(邹艳敏,吴向阳,仰榴青.环境监测管理与技术),2010,22(6):14
[2] Liu Y,Guan Y T,Mizuno T,et al.Journal of Tsinghua University:Science and Technology(刘莹,管运涛,水野忠雄,等.清华大学学报:自然科学版),2009,49(3):369
[3] Schwaiger J,Ferling H,Mallow U,et al.Aquat Toxicol,2004,68(2):141
[4] An J.Chinese Journal of Ecology(安婧.生态学杂志),2009,28(9):1878
[5] LüY,Yuan T,Wang W H,et al.Journal of Environment and Health(吕妍,袁涛,王文华,等.环境与健康杂志),2007,24(8):650
[6] Dai C M,Zhang Y L,Duan Y P.Environmental Pollution &Control(代朝猛,张亚雷,段艳萍.环境污染与防治),2009,31(2):77
[7] Furlong E T,Meyer M T,Thurman E M,et al.Environ Sci Technol,2002,36(6):1202
[8] Dinsdale R M,Guwy A J.Water Research,2008,42(13):3498
[9] Sousa M A,Goncalves C,Cunha E,et al.Anal Bioanal Chem,2011,399(2):807
[10] Yu J T,Bisceglia K J,Bouwer E J,et al.Anal Bioanal Chem,2012,403(2):583
[11] Weigel S,Kallenborn R,Hühnerfuss H.J Chromatogr A,2004,1023(2):183
[12] Yu Y,Wu L S.Talanta,2012,89:258
[13] Hilton M J,Thomas K V.J Chromatogr A,2003,1015(1/2):129
[14] Gomez M J,Aguera A,Mezcua M,et al.Talanta,2007,73(2):314
[15] Zhu S C,Wang J,Shao W W.Chinese Journal of Chromatography(朱赛嫦,王静,邵卫伟.色谱),2013,31(1):15
[16] Sun G D,Su Z Y,Yuan D X.Chinese Journal of Chromatography(孙广大,苏仲毅,袁东星.色谱),2009,27(1):54
[17] Farr M,Petrovica M,Gros M,et al.Talanta,2008,76:580
[18] Lin W C,Chen H C.J Chromatogr A,2005,1065(2):279
[19] Huang C,Chen J M,Chen X.Chinese Journal of Chromatography(黄成,陈建孟,陈效.色谱),2008,26(5):618
[20] Lishman L,Smyth S A,Sarafin K,et al.Sci Total Environ,2006,367(2/3):544
[21] Nebot C,Gibb S W,Boyd K G.Anal Chim Acta,2007,598(1):87
[22] Chefetz B,Mualem T,Ben-Ari J.Chemosphere,2008,73(8):1335
[23] Chen F,Ying G G,Kong L X,et al.Environ Pollut,2011,159(6):1490
[24] Li X J.[MS Dissertation].Hangzhou:Zhejiang University(李晓娟.[硕士学位论文].杭州:浙江大学),2011
[25] Zhang A T.[MS Dissertation].Xi’an:Xi’an University of Architecture and Technology(张爱涛.[硕士学位论文].西安:西安建筑科技大学),2011
[26] Bisceglia K J,Yu J T,Mehmet C,et al.J Chromatogr A,2010,1217(4):558
[27] Dinsdale R M,Guwy A J.Talanta,2008,74(5):1299

