芡实多糖的抗氧化性及抑菌特性*
李湘利,刘静,燕伟,朱九滨
(济宁学院生命科学与工程系,山东曲阜,273155)
芡实(Euryale ferox)俗称“鸡头米”,为睡莲科(Nymphaeaceae)芡属(Euryale ferox Salisb)水生草本植物[1]。芡实蛋白质含量较高,氨基酸种类齐全,维生素含量较丰富;碳水化合物含量高达77% ~78%,除6%左右为不溶性纤维素外,多数可被消化吸收,是理想的膳食纤维源[2-4]。芡实具有养血安神、去湿健脾、益肾固精、止泻止滞等功效[5],对慢性腹泻、白带崩下、小便失禁、腰腿关节痛等症有治疗作用[6-7]。
多糖是传统中药的主要活性成分,具有清除自由基、调节代谢的作用[8]。目前,多糖生物活性研究多集中于免疫调节和抗肿瘤活性[9-10]。多糖对各类微生物的生长均有不同程度抑制或拮抗作用,无毒副作用,是纯天然食品防腐剂[11]。近年来,芡实多糖提取工艺的研究取得了一定进展[12-13],但关于芡实多糖体外抗氧化性及抑菌特性尚缺乏系统研究。为此,本实验对微波辅助酶法提取芡实多糖的自由基清除作用、抗油脂氧化作用及抑菌特性进行了研究,旨在为芡实多糖的生产与医药应用提供理论数据。
1 材料与方法
1.1 材料与仪器
芡实,购于济宁市微山湖特产批发零售中心;金黄色葡萄球菌(Staphylococcus aureus)、枯草杆菌(Bacillus subtilis)、大肠杆菌(Escherichia coli)、酿酒酵母(Saccharomyces cerevisiae),由本校微生物学实验室提供;Na2HPO4、NaH2PO4、K3Fe(CN)6、三氯乙酸、FeCl3、DPPH、FeSO4、H2O2、三羟甲基氨基甲烷、邻苯三酚、Vc,均为分析纯;蛋白胨、酵母膏、牛肉膏、琼脂为生物试剂。
FA2004N电子天平,上海精密科学仪器有限公司;FCD2000恒温鼓风干燥箱,上海琅玕实验设备有限公司;723PC分光光度计,上海菁华科技仪器有限公司;TD6低速离心机,长沙英泰仪器有限公司;SA300生物显微镜,北京泰克仪器有限公司。
1.2 实验方法
1.2.1 芡实多糖的提取
芡实于60℃烘干至恒重,粉碎过40目筛,用乙酸乙酯脱脂并挥干溶媒;按料液比1∶30(g∶mL)加入蒸馏水,添加 α-淀粉酶进行酶解(α-淀粉酶添加量0.5%、pH 6.0、酶解温度80℃、酶解20 min),采用微波辅助提取(微波功率550 W、时间4 min);用Sevage法除蛋白[14],4 000 r/min 离心20 min,加入体积分数95%乙醇沉淀多糖,4℃静置12 h[14],再经4 000 r/min离心20 min、60℃干燥即得芡实粗多糖。
1.2.2 芡实多糖的清除自由基实验
1.2.2.1 总还原能力的测定
参照文献[15]。取1 mL不同浓度的K3Fe(CN)6溶液于10 mL试管中,加入0.2 mol/L的pH 6.6磷酸缓冲液2.5 mL和1.0%的K3Fe(CN)6溶液2.5 mL,50℃水浴20 min,冷却后加入10 g/100 mL三氯乙酸溶液1 mL,3 000 r/min离心10 min,取上清液2.5 mL,加入0.1%FeCl3溶液0.5 mL和蒸馏水2 mL,静置5 min后于700 nm处测吸光值,以Vc作对照。
1.2.2.2 对O2-·的清除能力测定
参照文献[16]的方法改进。移取0.05 mmol/L Tris-HCl缓冲液(pH 8.2)4.5 mL于10 mL试管中,25℃水浴15 min,再加入1 mL不同浓度的芡实多糖溶液和0.5 mL经25℃预热的3 mmol/L邻苯三酚溶液,25℃水浴5 min;加入2滴8 mmol/L HCl终止反应,于420 nm处测定吸光值A1,同时测以蒸馏水代替芡实多糖溶液的反应液吸光值A0,以Vc为对照。计算芡实多糖对O2-·的清除率:
清除率/%= [(A0-A1)/A0]×100
1.2.2.3 对·OH的清除能力测定
按照文献[17]的方法略作调整。移取6 mmol/L FeSO4溶液2 mL于10 mL试管中,加入6 mmol/L H2O22 mL及6 mmol/L水杨酸溶液2 mL,37℃水浴15 min,冷却,于510 nm测定吸光值 A0;然后加入1 mL不同浓度的芡实多糖溶液,37℃水浴15 min,在510 nm测定吸光值A1,同时以Vc作对照。计算芡实多糖对·OH的清除率:
清除率/%= [(A0-A1)/A0]×100
1.2.2.4 对DPPH的清除能力测定
按文献[18]的方法测定。用无水乙醇配制0.1 mmol/L的DPPH溶液,移取1 mL不同浓度的芡实多糖溶液于10 mL试管中,加入2 mL蒸馏水和2 mL DPPH溶液,摇匀后室温放置20 min,于517 nm测吸光值A1,测定上述相同体积的蒸馏水和DPPH溶液混匀后的吸光值A2,测定1 mL样品溶液和1 mL蒸馏水与2 mL无水乙醇混匀后的吸光值A3,同时以Vc作对照。计算芡实多糖对DPPH·的清除能力:
清除率/%=[1-(A1-A3)/A2]×100
1.2.3 芡实多糖抗油脂氧化实验
以空白油脂为对照,与芡实多糖和Vc处理的油脂对比,采用烘箱强化法[19]。称取新制猪油、芝麻油各20.0 g,加入质量分数0.5%芡实多糖,混匀后于65℃烘箱中强化保存,每隔24 h搅拌5 min并交换试样在烘箱中的位置,定期测定油脂过氧化值(POV),POV测定参照GB/T 5538-2005的碘量法。用POV表示油脂的氧化速度,进而衡量抗氧化活性。
1.2.4 芡实多糖体外抑菌特性研究
1.2.4.1 培养基
细菌培养基:牛肉膏3 g、NaCl 5 g、琼脂15 ~20 g、蛋白胨10 g、水 1 000 mL,pH 7.0 ~7.2,121 ℃灭菌20 min[20];酵母菌培养基:葡萄糖 20 g、蛋白胨 10 g、酵母膏10 g、琼脂15 ~20 g、水1 000 mL,121 ℃灭菌20 min[20]。
1.2.4.2 菌种活化与菌悬液制备
将金黄色葡萄球菌、大肠杆菌、枯草杆菌接种到细菌培养基,37℃培养24 h;酿酒酵母接种到酵母菌培养基,28℃培养48 h。长出菌落后,各挑取1环活化好的菌种放入9 mL无菌生理盐水中,振荡摇匀得菌悬液,浓度约为 106~108CFU/mL,备用[20]。
1.2.4.3 抑菌圈实验
将定性滤纸制成9 mm圆形滤纸片,121℃灭菌20 min。将芡实多糖配成浓度为 2、4、6、8、10 mg/mL的溶液,无菌滤纸片于多糖溶液浸泡30 min[11]。取供试菌悬液0.5 mL加至倒好培养基的培养皿中,涂匀;浸泡过芡实多糖的滤纸片紧贴于含菌平板上,每平板贴3片,之间留有间隙;以浸泡无菌水的滤纸片为对照,细菌于37℃倒置培养48 h,酵母菌28℃倒置培养72 h后测量抑菌圈直径,出现抑菌圈所对应的芡实多糖浓度即为最小抑菌浓度[20-21]。
1.2.5 数据统计方法
采用SPSS 13.0软件对实验结果进行统计分析,应用Microsoft Excel 2003的FORECAST函数计算清除50%自由基所需芡实多糖浓度(IC50)。
2 结果与分析
2.1 芡实多糖清除自由基实验结果
2.1.1 芡实多糖的总还原能力
抗氧化剂通过自身还原给出电子,从而清除自由基;还原能力越强,抗氧化性越强[22]。由图1可知,在0.2~1.0 mg/mL内,芡实多糖经反应后均出现吸收峰,表明芡实多糖具有一定的还原能力;随多糖浓度增加,吸光值增大;当样品浓度为1.0 mg/mL时,芡实多糖吸光度值为0.358。但芡实多糖总还原能力明显低于同浓度的Vc总还原能力(P<0.05)。
2.1.2 芡实多糖对O2-·的清除能力
O2-·是生物体内首个氧自由基,是其他活性氧的前体,对生物细胞、酶、DNA和不饱和脂肪酸等均有影响[11]。由图2可知,0.2~1.0 mg/mL的芡实多糖对O2-·有一定的清除作用,清除能力与样品浓度呈正相关,芡实多糖浓度为1.0 mg/mL时,对O2-·清除率可达26.94%,其IC50为4.8 mg/mL,但明显小于同浓度Vc的清除能力(P<0.05)。
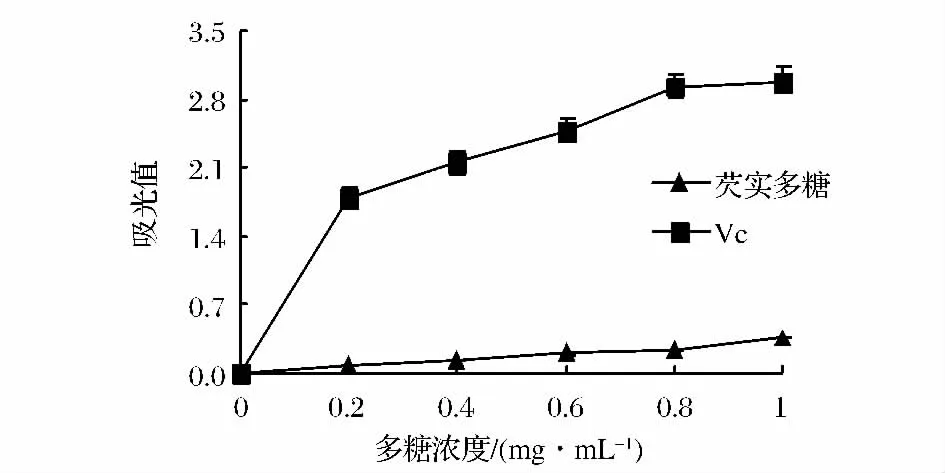
图1 芡实多糖总还原能力Fig.1 Reducing capacity of Euryale ferox polysaccharides
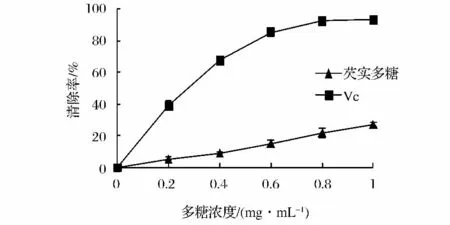
图2 芡实多糖对O2-·清除能力Fig.2 O2-·Scavenging of Euryale ferox polysaccharides
2.1.3 芡实多糖对·OH的清除能力
·OH被认为是活性最强、毒性最大的自由基,是造成机体过氧化损伤的重要因素,辐射损伤等因素会促使其形成,螯合金属离子或使金属离子无反应可清除·OH[9]。由图3可知,芡实多糖浓度为0.2~1.0 mg/mL时,对·OH有清除作用,且随浓度增加,清除率呈升高趋势,浓度为1.0 mg/mL时,清除率达27.13%,其IC50为6.7 mg/mL;但同浓度条件下,清除能力明显小于Vc(P<0.05)。

图3 芡实多糖对·OH清除能力Fig.3 ·OH Scavenging of Euryale ferox ploysaccharides
2.1.4 芡实多糖对DPPH·的清除能力
自由基清除剂对DPPH·的清除程度与所接受的电子数量有相关性,即清除程度与抗氧化剂的供氢能力有关[18]。由图4可知,在0.2~1.0 mg/mL内,芡实多糖对DPPH有较强的清除作用,且清除能力与多糖浓度呈显著正相关,当样品浓度为1.0 mg/mL时,对DPPH·的清除率可达37.10%,其IC50为4.1 mg/mL。但小于同浓度条件下Vc的清除能力(P<0.05)。
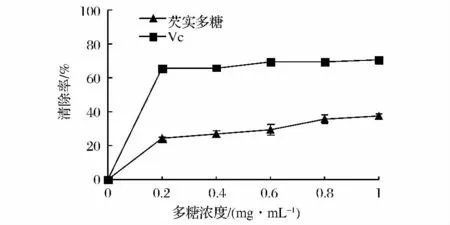
图4 芡实多糖对DPPH·的清除能力Fig.4 DPPH Scavenging of Euryale ferox ploysaccharides
2.2 芡实多糖对油脂氧化的影响
2.2.1 芡实多糖对猪油的抗氧化效果
由图5可知,芡实多糖对猪油有抗氧化作用。在65℃强化48 h内,其抗猪油氧化能力与Vc相近;随着时间的推移,抗氧化能力降低,而Vc仍能有效抑制猪油氧化(P<0.05),这与长时间加温使芡实多糖活性丧失或油脂氧化期间积累的自由基较多有关[19]。
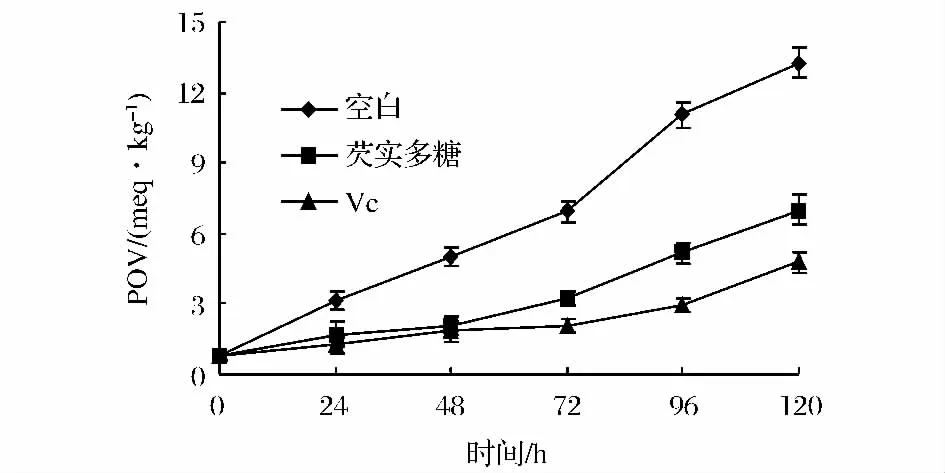
图5 芡实多糖对猪油的抗氧化效果Fig.5 Antioxidant effect of Euryale ferox polysaccharides on lard
2.2.2 芡实多糖对芝麻油的抗氧化效果
由图6可知,芡实多糖对芝麻油的抗氧化作用较强,在强化48 h内与Vc相当;随强化时间的延长,芡实多糖对芝麻油的抗氧化作用减弱,但Vc仍具有明显的抗氧化作用(P<0.05)。这可能是因为油脂氧化可产生大量自由基,多糖的抗氧化活性降低,POV值逐渐增大[10]。多糖和Vc对自由基的清除作用与油脂氧化所得自由基的种类及数量有关[19],故芡实多糖和Vc对猪油和芝麻油的抗氧化性能有显著差异(P<0.05)。
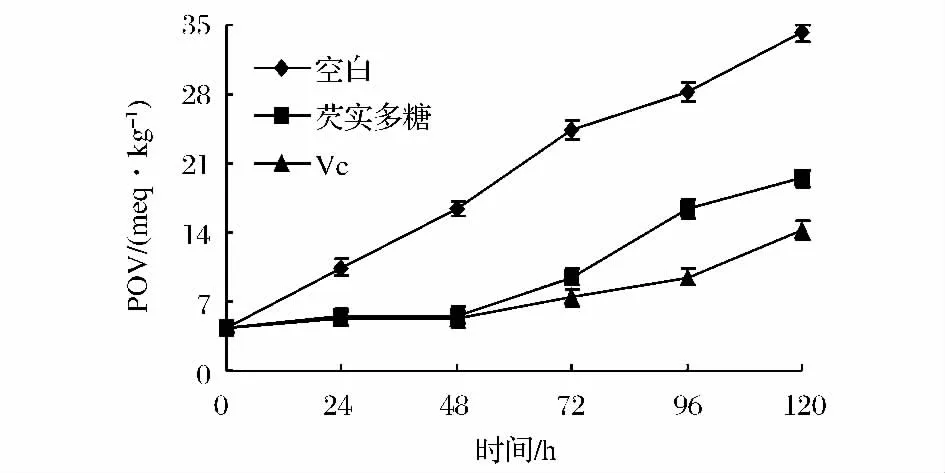
图6 芡实多糖对芝麻油的抗氧化效果Fig.6 Antioxidant effect of Euryale ferox polysaccharides on sesame oil
2.3 芡实多糖抑菌特性实验结果
由表1可知,接种4种供试菌的平板上均出现抑菌圈,故芡实多糖对4种供试菌均有抑制作用。其中,对金黄色葡萄球菌的抑菌圈明显大于其他3种菌(P<0.05),芡实多糖浓度为10 mg/mL时,对金黄色葡萄球菌的抑菌圈最大为16.00 mm,酿酒酵母为13.63 mm,枯草杆菌为12.50 mm和大肠杆菌为11.25 mm。表明芡实多糖对金黄色葡萄球菌的抑制作用最强,对大肠杆菌的抑制作用最弱。芡实多糖对大肠杆菌和枯草杆菌的最小抑菌浓度为4 mg/mL,对金黄色葡萄球菌、酿酒酵母的最小抑菌浓度为2 mg/mL。
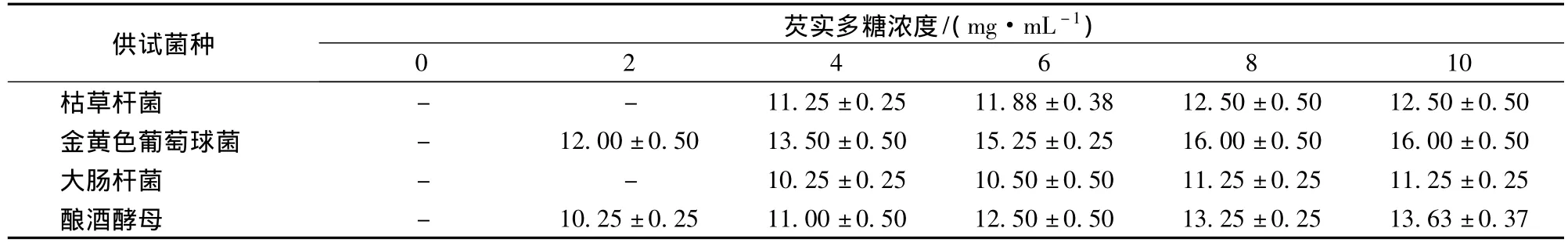
表1 芡实多糖对各菌种的抑菌圈直径 mmTable 1 Inhibitory zone diameters of Euryale ferox polysaccharides against different microorganisms mm
3 讨论
多糖在生物体内的功能不仅是提供能量和参与结构组织,同时还具有多种生物功能,多糖是一种良好的天然抗氧化剂[9,16]。本实验通过研究芡实多糖的总还原能力,对O2-·、·OH和DPPH·三种自由基的清除效果表明,芡实多糖有一定的抗氧化能力,对这3种自由基的清除率随着芡实多糖浓度的增加而增大。多糖体外抗氧化活性与多糖浓度存在量效关系,但其抗氧化能力还有待进一步提高[10]。芡实多糖对猪油和芝麻油均有一定的抗氧化效果,在油脂氧化初期,其抗氧化效果与Vc相近。多糖对各类微生物的生长有不同程度的抑制作用或生长拮抗。
4 结论
芡实多糖具有较强的总还原能力,对O2-·、·OH和DPPH·均具有清除能力,清除能力与芡实多糖浓度呈正相关。其中,芡实多糖浓度为10 mg/mL时,对O2-·的清除率最高为26.94%,对·OH的清除率最高为27.13%,对DPPH·的清除能力最高为37.10%;芡实多糖清除O2-·、·OH和DPPH·三种自由基的IC50分别为4.8、6.7和6.1 mg/mL,但都低于Vc的清除能力。芡实多糖对猪油和芝麻油均有一定的抗氧化效果,在油脂氧化初期,其抗氧化效果与Vc相当。芡实多糖对金黄色葡萄球菌、枯草杆菌、大肠杆菌、酿酒酵母均有抑制作用,对金黄色葡萄球菌的抑制作用最强,对大肠杆菌的抑制作用最弱。芡实多糖浓度为10 mg/mL时,对金黄色葡萄球菌的抑菌圈最大为16.00 mm,酿酒酵母为13.63 mm,枯草杆菌为12.50 mm和大肠杆菌为11.25 mm。对大肠杆菌和枯草杆菌的最低抑菌浓度为4 mg/mL,对金黄色葡萄球菌和酿酒酵母的最低抑菌浓度为2 mg/mL。
[1] Dutta R N,Jha S N,Jha U N.Plant content and quality of makhana(Euryale ferox)[J].Plant and Soil,1986,96(3):429-432.
[2] ZHANG S,CHENG,H,DONG J,et al.Amino-acid and mineral composition of the seeds of Euryale ferox[J].Chemistry of Natural Compounds,2011,47(3):490-491.
[3] 刘静,张爱民,刘开伟.芡实采后加工与功能性的最新研究进展[J].食品工业,2011,32(10):89-91.
[4] Verma A K,Banerji B K,Chakrabarty D,et al.Studies on Makhana(Euryale ferox Salisbury)[J].Current Science,2010,99(6):795-800.
[5] Narayan J S,Sharma R.Physical,gravimetric and functional characterization of various milling fractions of popped gorgon nut[J].Journal of Food Science and Technology,2010,47(5):564-570.
[6] ZHAO H R,ZHAO S X,Dominique G.New cerebrosides from Euryale ferox[J].Journal of Natural Products,1994,57(1):138-142.
[7] Jha S N,Suresh P.Determination of processing conditions for gorgon nut(Euryale ferox)[J].Journal of Agricultural Engineering Research,1996,63(1):103-112.
[8] SUI Z F,LI L,LIU B,et al.Optimum conditions for Radix rehmanniae polysaccharides by RSM and its antioxidant and immunity activity in UVB mice[J].Carbohydrate Polymers,2013,92(1):283-288.
[9] LI R,CHEN W C,WANG W P,et al.Antioxidant activity of Astragalus polysaccharides and antitumour activity of the polysaccharides and siRNA[J].Carbohydrate Polymers,2010,82(2):240-244.
[10] WANG C Y,ZHANG J,WANG F,et al.Extraction of crude polysaccharides from Gomphidius rutilus and their antioxidant activities in vitro[J].Carbohydrate Polymers,2013,94(1):479-486.
[11] 孟宪军,刘晓晶,孙希云,等.蓝莓多糖的抗氧化性与抑菌作用[J].食品科学,2010,31(17):110-114.
[12] 谢燕娟,陈晓丹,王晓波,等.超声波辅助提取芡实多糖条件优化[J].食品研究与开发,2010,31(8):15-19.
[13] 赵翾,李红良,叶倩雯,等.芡实多糖的粗提取及其对羟自由基的清除效果[J].食品与发酵工业,2010,36(11):177-182.
[14] 张萍,贺茂萍,殷力,等.石榴皮多糖的Sevage法除蛋白工艺研究[J].食品科技,2013,38(12):219-222,231.
[15] 孙元琳,陕方,李秀玲,等.苦荞醋及其多糖物质的抗氧化性能研究[J].食品工业科技,2011,32(5):123-125.
[16] LI X M,LI X L,ZHOU A G,et al.Evaluation of antioxidant activity of the polysaccharides extracted from Lycium barbarum fruits in vitro[J].European Polymer Journal,2007,43(2):488-497.
[17] 杨闻.辛夷多糖的分离纯化及抑菌、抗氧化活性研究[D].西安:陕西师范大学,2013:51-56.
[18] YANG B,ZHAO M R,SHI J H,et al.Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit pericarp[J].Food Chemistry,2008,106(2):685-690.
[19] 张艳萍,尤玉如,戴志远,等.山茱萸多糖体外清除自由基和抗氧化作用研究[J].中国食品学报,2008,8(6):18-22.

