假坚强芽孢杆菌丙氨酸脱氢酶的原核表达纯化与结晶
唐昭娜 ,张翠英,胡平雄 ,易秋分 ,杨江丽,董 辉
(1.天津科技大学生物工程学院,天津 300457;2.天津国际生物医药联合研究院,天津 300457)
丙氨酸脱氢酶(alanine dehydrogenase,Ald)是一种NAD+依赖性的氨基酸脱氢酶[1],琥珀酸、苹果酸和丙酮酸等均可诱导其产生[2-3].丙氨酸脱氢酶可以调节酮酸和氨基酸的稳态平衡,它可逆地催化丙氨酸生成丙酮酸和氨,同时NAD+被还原成为NADH.反应产物丙酮酸在食品工业、制药工业、农用化学品、生化研究和减肥保健品等多个方面被广泛的应用[4].
丙氨酸脱氢酶在细菌、藻类和植物中分布较为广泛,影响着微生物的碳氮代谢[5-9].动物体内的丙氨酸脱氢酶影响着机体的氨基酸代谢和糖代谢,能为机体提供能量[10].1990 年,丙氨酸脱氢酶的编码基因被克隆成功[11],来源于席藻(Phormidium lapideum)中丙氨酸脱氢酶的三维空间结构在1998 年首次被解析出来[9],其后多种不同来源的丙氨酸脱氢酶三维空间结构也相继被解析.
目前,尚无关于假坚强芽孢杆菌(Bacillus pseudofirmus)丙氨酸脱氢酶(NCBI 参考序列号:WP_012,959,278.1)表达纯化及结晶的研究报道.本实验对来源于假坚强芽孢杆菌的丙氨酸脱氢酶进行原核表达纯化及结晶,并通过X 射线衍射对其晶体数据进行收集和处理,为蛋白空间结构的解析提供有力的理论依据,可为其催化机制的研究和相关药物的研发奠定基础.
1 材料与方法
1.1 材料
1.1.1 目的基因、表达载体及菌株
含有丙氨酸脱氢酶(Ald)基因的质粒和实验用到的表达载体pET-22b(+)由本实验室保存.感受态细胞E.coli DH5α 和BL21(DE3)购自北京全式金生物技术有限公司.
1.1.2 实验试剂
本实验用到的引物由上海生工生物工程有限公司合成;Pfu DNA 聚合酶、dNTP(10,mmol/L)、限制性核酸内切酶(NdeⅠ和XhoⅠ)、T4,DNA 连接酶,Fermentas 公司;琼脂糖凝胶DNA 回收试剂盒、质粒DNA 小量提取试剂盒,Bioflux 公司;氨苄青霉素(Amp+)、异丙基-β-D-硫代半乳糖苷(IPTG)、丙烯酰胺、十二烷基硫酸钠(SDS)、过硫酸铵(APS)、四甲基乙二胺(TEMED)、咪唑、三羟甲基氨基甲烷(Tris)、氯化钠(NaCl)等,上海生工生物工程有限公司;Ni-NTA sephrose、Resource Q 离子交换柱、Superdex 75凝胶过滤层析柱,GE Healthcare 公司;结晶试剂盒Index、PEG/Ion screen、PEG/Ion 2,screen、Crystal Screen 和Crystal Screen 2,Hampton Research 公司;乙二醇、聚乙二醇(PEG 3350)、甲酸钠等,Sigma 公司;甘油等其他常用试剂均为国产分析纯.
1.2 实验方法
1.2.1 重组质粒的构建
利用引物设计软件Primer Premier 5.0,按照引物设计原则设计引物.本实验选定的酶切位点分别为NdeⅠ与 XhoⅠ,设计出的引物如下:上游:5′-CCCATATG ATGTTAATTGGTGTACC-3′,其中划线部分为NdeⅠ酶切位点;下游:5′-CCTCGAGTCATG ACTGAAGTGTTT-3′,其中划线部分为XhoⅠ酶切位点.
以含有目的基因(1,125,bp)的质粒为模板经PCR后,用限制性核酸内切酶NdeⅠ和XhoⅠ对目的基因和pET-22b(+)进行双酶切,产生相同的黏性末端,构建重组质粒.利用限制性内切酶酶切法和DNA 测序法对重组质粒进行鉴定.
1.2.2 丙氨酸脱氢酶(Ald)的表达
将重组质粒转化到E.coli BL21(DE3)感受态细胞内.挑取长出的单克隆菌落接种于 5,mL 含100,µg/mL 氨苄青霉素的LB 液体培养基内,37,℃、220,r/min 振荡培养过夜.次日,将上述培养液接种于800,mL 含100,µg/mL 氨苄青霉素的LB 液体培养基内,37,℃、220,r/min 振荡培养至600,nm 处吸光度在0.6 左右.将摇床温度降至16,℃,向菌液内加入0.25,mmol/L IPTG,诱导培养16~20,h.将菌液以5,500,r/min 离心 20,min,弃上清液.用缓冲液(50,mmol/L Tris-HCl(pH 7.2),200,mmol/L NaCl 溶液,5%,甘油)对菌体进行重悬并收集.
1.2.3 丙氨酸脱氢酶(Ald)的纯化
收集的菌体利用低温高压破碎,12,000,r/min 离心40,min,收集上清液.将上清液加到已用悬菌缓冲液平衡过的镍离子亲和层析柱(NI-NTA sephrose)上.悬菌缓冲液和洗脱缓冲液(50,mmol/L Tris-HCl(pH 7.2),200,mmol/L NaCl 溶液,5%,甘油,1,mol/L 咪唑)按比例混合,使缓冲液中咪唑浓度分别为20、50、100、200,mmol/L,利用梯度洗脱对蛋白进行初步纯化.洗脱的目的蛋白利用Resource Q 离子交换柱和Superdex 75 凝胶过滤层析柱进行进一步的纯化.
1.2.4 Ald 蛋白结晶条件的初筛及结晶条件的优化
对获得的Ald 蛋白进行结晶条件的筛选.将蛋白稀释成5,mg/mL 和10,mg/mL 两种质量浓度溶液,用Index、PEG/Ion screen、PEG/Ion 2,screen、Crystal Screen 和Crystal Screen 2 等试剂盒以坐滴气相扩散法在16,℃条件下初步筛选蛋白的结晶条件.通过改变结晶初筛条件中温度、缓冲液pH、盐的浓度、沉淀剂的种类和浓度以及蛋白浓度来确定蛋白结晶的最优条件[12].
2 结果与分析
2.1 重组质粒的构建和鉴定
利用质粒提取试剂盒提取重组质粒,使用限制性核酸内切酶NdeⅠ和XhoⅠ对其进行双酶切鉴定,鉴定结果如图1 所示.图中出现的两片段大小约为1,100,bp 和 5,500,bp,初步证实该质粒为重组质粒.测序的结果也表明重组质粒构建成功.
2.2 Ald蛋白的表达与纯化
菌液经高压低温破碎后离心,上清液中的蛋白结合到镍离子亲和层析介质上,用含不同咪唑浓度的缓冲液进行洗脱.洗脱过程取样,进行12%,SDS-PAGE分析,结果如图2 所示.最终得出杂蛋白和目的蛋白洗脱缓冲液中咪唑浓度分别为 20,mmol/L 和200,mmol/L.
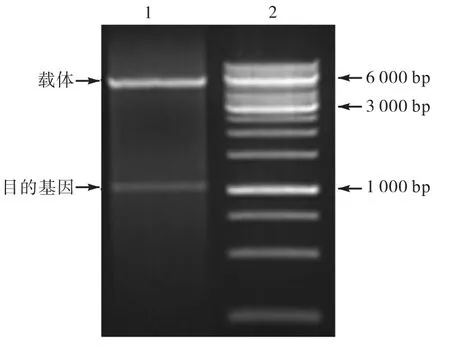
图1 重组质粒的双酶切Fig.1 Enzyme digestion analysis of recombined plasmid

图2 Ald镍离子亲和层析的SDS-PAGE分析Fig.2 SDS-PAGE analysis of Ald after Ni-NTA affinity chromatography
经镍离子亲和层析洗脱下来的目的蛋白,利用Resource Q 离子交换柱和Superdex 75 凝胶过滤层析柱进行进一步纯化,最终得到的Ald 蛋白进行12%,SDS-PAGE 分析,如图3 所示,结果显示得到了纯度较高的蛋白,可进行蛋白晶体筛选.
2.3 Ald蛋白晶体的筛选与优化
经过Hampton Research 公司的蛋白质结晶试剂盒初筛后,多个条件长出晶体,见表1.本实验主要针对晶体生长较好的结晶条件进行温度、缓冲液pH、盐的浓度、沉淀剂的种类和浓度以及蛋白质量浓度的优化,使最初较小的晶体经优化变为较大的块状晶体,如图4 所示.最终得出当结晶温度为16,℃、蛋白质量浓度为10,mg/mL、池液条件为有机酸盐混合物(73.2,mmol/L 丙二酸,10,mmol/L 柠檬酸铵,4.8,mmol/L 丁二酸,12,mmol/L DL-苹果酸,16,mmol/L 三水醋酸钠,20,mmol/L 甲酸钠,6.4,mmol/L 酒石酸氢铵)pH 5.0 和8%,PEG 3350 时,可优化出理想的晶体.

图3 Ald凝胶过滤层析纯化后SDS-PAGE分析Fig.3 SDS-PAGE analysis of Ald after gel filtration chromatography

表1 Ald蛋白的初步结晶条件Tab.1 ,Initial crystallization conditions of Ald
优化后的晶体经X-ray 衍射和数据收集处理,最后得到 Ald 蛋白晶体的分辨率为 0.31 nm(见图5).该晶体参数数据统计结果见表2.

图4 Ald晶体图片Fig.4 Crystal images of Ald

图5 Ald晶体衍射图Fig.5 X-ray diffraction pattern of Ald crystal
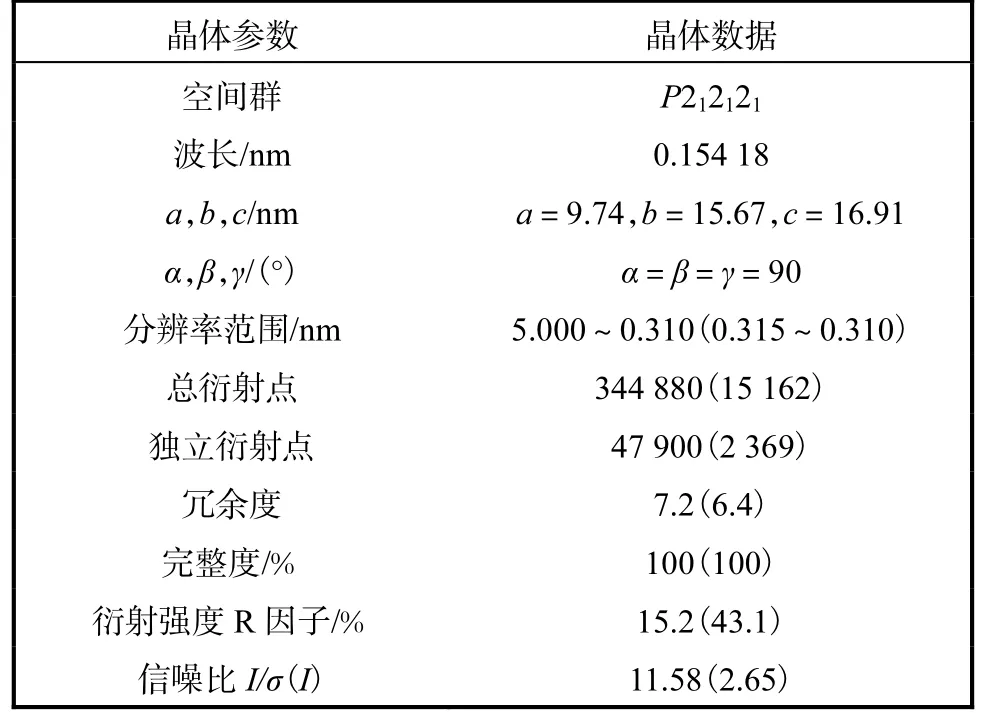
表2 Ald蛋白晶体衍射数据统计表Tab.2 Statistics of the diffraction data of Ald
3 结论
本实验将假坚强芽孢杆菌Bacillus pseudofirmus的Ald 目的基因克隆到原核表达载体pET-22,b(+)上,成功构建了重组质粒,并完成了其在大肠杆菌中的高效表达.通过镍离子亲和层析、Resource Q 离子交换层析和Superdex 75 凝胶过滤层析等方法对目的蛋白进行纯化,将纯化后的蛋白用于蛋白结晶.对蛋白结晶条件进行筛选及优化,最终在结晶温度为16,℃、蛋白质量浓度为10 mg/mL、池液条件为有机酸盐混合物(73.2 mmol/L 丙二酸,10 mmol/L 柠檬酸铵,4.8 mmol/L 丁二酸,12 mmol/L DL-苹果酸,16 mmol/L 三水醋酸钠,20 mmol/L 甲酸钠,6.4 mmol/L酒石酸氢铵)pH 5.0 和8%,PEG3350 时,获得分辨率为0.31 nm 的蛋白晶体.晶体所属空间群为P212121,晶胞参数为a=9.74 nm、b=15.67 nm、c=16.91 nm、α=β=γ=90°.本实验中得到的蛋白晶体的相关数据为蛋白空间结构的解析提供了重要依据,并对深入了解Ald 蛋白的催化机制尤为重要,能为相关药物的研发和疾病的预防奠定基础.
[1]Brunhuber N M,Blanchard J S.The biochemistry and enzymology of amino acid dehydrogenases[J].Critical Reviews in Biochemistry and Molecular Biology,1994,29(6):415-467.
[2]Pernil R,Herrero A,Flores E.Catabolic function of compartmentalized alanine dehydrogenase in the heterocyst-forming cyanobacterium Anabaena sp.strain PCC 7120[J].Journal of Bacteriology,2010,192(19):5165-5172.
[3]Lodwig E,Kumar S,Allaway D,et al.Regulation of Lalanine dehydrogenase in Rhizobium leguminosarum bv.viciae and its role in pea nodules[J].Journal of Bacteriology,2004,186(3):842-849.
[4]何广正,徐书景,马宁,等.丙氨酸脱氢酶研究概况[J].生物技术通报,2011(12):27-32.
[5]Siranosian K J,Ireton K,Grossman A D.Alanine dehydrogenase(ald)is required for normal sporulation in Bacillus subtilis[J].Journal of Bacteriology,1993,175(21):6789-6796.
[6]Baysal S H,Yasa I,Uslan A H.Screening and simple purification of alanine dehydrogenase in Bacillus strains[J].Preparative Biochemistry and Biotechnology,2002,32(3):277-285.
[7]Feng Z,Cáceres N E,Sarath G,et al.Mycobacterium smegmatis L-alanine dehydrogenase(Ald)is required for proficient utilization of alanine as a sole nitrogen source and sustained anaerobic growth[J].Journal of Bacteriology,2002,184(18):5001-5010.
[8]Lahmi R,Sendersky E,Perelman A,et al.Alanine dehydrogenase activity is required for adequate progression of phycobilisome degradation during nitrogen starvation in Synechococcus elongatus PCC 7942[J].Journal of Bacteriology,2006,188(14):5258-5265.
[9]Baker P J,Sawa Y,Shibata H,et al.Analysis of the structure and substrate binding of Phormidium lapideum alanine dehydrogenase[J].Nature Structural &Molecular Biology,1998,5(7):561-567.
[10]Smith N,Mayhew M,Robinson H,et al.Crystallization and phasing of alanine dehydrogenase from Archaeoglobus fulgidus[J].Acta Crystal lographica Section D:Biological Crystallography,2003,59(12):2328-2331.
[11]Kuroda S,Tanizawa K,Tanaka H.Alanine dehydrogenases from two Bacillus species with distinct thermostabilities:Molecular cloning,DNA and protein sequence determination,and structural comparison with other NAD(P)+-dependent dehydrogenases[J].Biochemistry,1990,29(4):1009-1015.
[12]李欣欣,徐晓冬,丹媛媛,等.蛋白质结晶的研究进展[J].生物技术通报,2007(6):44-47.

