Aβ25~35通过激活p38MAPK信号通路促进大鼠心肌细胞凋亡*
卢永浩,吴 昊,张恒谦
(沈阳医学院附属中心医院神经外科,沈阳 110024)
论著·基础研究
Aβ25~35通过激活p38MAPK信号通路促进大鼠心肌细胞凋亡*
卢永浩,吴 昊,张恒谦
(沈阳医学院附属中心医院神经外科,沈阳 110024)
目的 观察β淀粉样蛋白25~35(Aβ25~35)对培养大鼠心肌细胞的毒性作用,并阐明可能的机制。方法体外培养大鼠心肌细胞,给予不同浓度Aβ25~35刺激,采用流式细胞术检查细胞凋亡率,采用Western blot方法测定凋亡相关蛋白Bax和Bcl-2的表达水平。观察Aβ25~35对p38丝裂原活化蛋白激酶(MAPK)磷酸化的影响,并进一步评估p38MAPK特异性抑制剂对Aβ25~35诱导心肌细胞凋亡的影响。结果Aβ25~35可以诱导体外培养大鼠心肌细胞凋亡,升高促凋亡蛋白Bax的表达,下调抗凋亡蛋白Bcl-2的表达,且呈现浓度依赖的关系。同时发现给予Aβ25~35后p38MAPK磷酸化水平增加,而给予p38MAPK特异性抑制剂SB203580减少心肌细胞的凋亡。结论Aβ25~35可以导致体外培养的大鼠心肌细胞发生凋亡,而p38MAPK信号通路可能参与了该过程。本研究探索阿尔兹海默病(AD)患者心肌损伤的可能发病机制,为将来有效防治AD相关性心肌损伤提供新思路。
p38丝裂原活化蛋白激酶类;阿尔兹海默病;细胞凋亡
β-淀粉样蛋白(Amyloid-β,Aβ)作为不可溶性淀粉样物质在大脑中沉积可以导致阿尔兹海默病(AD)。近年来,临床观察发现AD与心功能不全之间存在紧密联系,AD患者心功能不全的发生率明显增加[1-2]。同时,在动物研究中发现与野生型小鼠相比,AD模型小鼠的心肌细胞存在明显收缩功能障碍,Aβ可能是导致模型小鼠心肌细胞收缩功能障碍的原因[3]。而近期在取自患有心脏淀粉样变性的心肌活检标本中结合免疫学方法,通过对心肌超微结构的观察,Fidziańska等[4]发现该患者心肌细胞中含有Aβ,而另一项研究通过放射性标记的正电子发射断层扫描示踪技术同样发现在心肌中Aβ的存在[5]。这些研究结果提示心脏有可能是除中枢神经系统之外另一个Aβ累及的器官,但目前相关研究较少。本研究观察β淀粉样蛋白25~35(Aβ25~35)对体外培养心肌细胞凋亡的影响,并探讨了p38丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号通路在心肌细胞凋亡中的作用。
1 材料与方法
1.1 主要试剂 Aβ25~35(Y-0044,BIOSS,北京),SB203580(Selleck chemicals,Houston,TX,USA),两者购买后溶于DMSO(Sigma,St.Louis,MO,USA),-20 ℃储存,在1个月内使用。BCA试剂盒(Pierce Chemical,Rockford,IL,USA),Annexin V/PI试剂盒购自于BD公司(Franklin,NJ,USA),TUNEL细胞凋亡检测试剂盒(Roche Applied Science)。各种抗体包括:Bax抗体(#BA0315,Boster,Wuhan,China),Bcl-2抗体(#BA0412,Boster,Wuhan,China),p38MAPK抗体(#sc-7149,Santa Cruz),p-p38MAPK抗体(#sc-101759,Santa Cruz),β-actin抗体(LSBio,Seattle,WA,USA)。
1.2 SD大鼠心肌细胞分离与培养 选择健康成年SD大鼠,腹腔注射肝素300 U/kg,30 min后戊巴比妥钠腹腔麻醉(150 mg/kg)。迅速开胸,在主动脉根部处取心脏悬挂,用含钙台式液(NaCl 135 mmol/L,KCl 5.4 mmol/L,MgCl21.0 mmol/L,NaH2PO40.33 mmol/L,Glucose 5 mmol/L,HEPES 10 mmol/L,pH 7.4)以6 mL/min速度逆行灌流5 min。然后,在保持37 ℃条件下用台式液(含CaCl234 mmol/L和胶原酶Ⅱ 300 mg/L)灌流20 min。取出心脏,在含0.1%胰蛋白酶的PBS溶液中将心脏剪成1~3 mm3小块并放置25 min。在1 500 r/min离心7 min,弃上清液,悬浮沉淀用200目滤网过滤后收集心肌细胞,并置于室温至少20 min。最后,用含10% FBS的DMEM培养液悬浮细胞接种于培养皿中。24 h后第1次换液,以后每2天换液1次。
1.3 流式细胞仪检测细胞凋亡情况 大鼠心肌细胞(2×105)接种于含10% FBS培养液的60 mm培养皿中,第2天用不同浓度的Aβ25~35处理24 h。收集细胞,采用Annexin V-FITC流式细胞技术检测细胞凋亡情况,按试剂盒说明书进行操作。
1.4 TUNEL法检测细胞凋亡情况 严格按照TUNEL细胞凋亡检测试剂盒说明书操作步骤检测心肌细胞凋亡情况。光学显微镜下凋亡的细胞核染成棕褐色,每张切片随机选取5个高倍视野,计算凋亡细胞的数量及心肌细胞的总数,凋亡指数(apoptosis index,AI)=凋亡细胞个数/心肌细胞个数×100%,取5个视野平均值。
1.5 Western blot法检测凋亡相关蛋白 使用不同浓度Aβ25~35处理大鼠心肌细胞24 h,收集细胞后用总蛋白提取试剂盒提取蛋白,按照BCA试剂盒说明书操作步骤测定蛋白浓度。蛋白上样量为50~100 μg,经电泳、转膜。封闭后,将膜在一抗中4 ℃孵育过夜。缓冲液冲洗后放入辣根过氧化物酶标记的二抗中室温孵育2 h,用ECL化学发光系统进行检测。实验结果用BIO-RAD凝胶电泳图像分析仪进行采图,采用Quantity One软件包分析。

2 结 果
2.1 不同浓度Aβ25~35促进心肌细胞的凋亡 流式细胞技术分析细胞凋亡率发现,与对照组比较,给予Aβ25~35后心肌细胞的凋亡率明显增加,且呈现浓度依赖的关系(图1)。为进一步证实Aβ25~35引起心肌细胞的凋亡,利用Western blot方法检测了凋亡相关蛋白Bax和Bcl-2的表达量,发现Aβ25~3510 μmol/L组与对照组比较差异无统计学意义(P>0.05),但随着浓度的进一步增大,Aβ25~35升高了促凋亡蛋白Bax的表达,下调了抗凋亡蛋白Bcl-2的表达,且同样呈现浓度依赖的关系,见图2。
2.2 Aβ25~35促进心肌细胞p38MAPK信号通路激活 给予20 μmol/L Aβ25~35刺激心肌细胞24 h,利用Western blot方法检测了p38MAPK的磷酸化,发现给予Aβ25~35后p38MAPK磷酸化水平较对照组明显增加,差异有统计学意义(P<0.05),见图3。
2.3 p38MAPK特异性抑制剂减少心肌细胞的凋亡 在20 μmol/L Aβ25~35刺激心肌细胞前30 min给予p38MAPK特异性抑制剂SB203580,采用TUNEL方法检测细胞凋亡情况,可以发现给予p38MAPK特异性抑制剂组心肌细胞的凋亡程度较未给予组减轻,各组凋亡指数见表1。进一步观察凋亡相关蛋白的表达,提示促凋亡蛋白Bax的表达较未给予p38MAPK特异性抑制剂组有所下降,而抗凋亡蛋白Bcl-2的表达有所上升,见图4。

图1 不同浓度Aβ25~35促进心肌细胞的凋亡

**:P<0.01,与Aβ25~350 μmol/L组比较。
图2 不同浓度Aβ25~35对心肌细胞凋亡蛋白Bax和Bcl-2的影响

*:P<0.05,与Aβ25~350 μmol/L组比较。
图3 Aβ25~35促进心肌细胞p38MAPK磷酸化
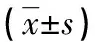
表1 各组TUNEL染色凋亡指数的比较

*:P<0.05,**:P<0.01,与Aβ25~350 μmol/L组比较。
图4 p38MAPK抑制剂SB203580对心肌细胞凋亡蛋白Bax和Blc-2的影响
3 讨 论
AD是老年期痴呆最常见的一种类型。据统计,中国约有600万左右的人患有AD,而且每年新发AD患者180万左右,因此,AD已经成为一个重要的医学和社会问题。近年来,临床观察发现AD患者心功能不全的发生率明显增加,一些研究结果提示可能与淀粉样蛋白Aβ对心肌细胞的毒性有关。但是,目前关于AD患者心脏病变的发病机制尚不明确,Aβ是否参与心肌细胞的损伤,通过何种途径导致心肌细胞的损伤的相关研究较少。
目前,关于AD发病机制的假说很多,其中,以β淀粉样蛋白形成淀粉样结构在脑内沉积为研究者所公认。越来越多的证据表明前体蛋白及其聚集体可以独立于纤维沉积本身而直接造成器官功能的损伤。Lesen等[6]发现细胞外聚集的可溶性Aβ聚集体可以独立于纤维的生成而直接造成AD转基因小鼠记忆功能障碍,近期大量的体内和体外研究也发现Aβ及其活性片段(Aβ1~42,Aβ1~40和Aβ25~35)均具有神经细胞的毒性作用。而Sikkink等[7]研究发现游离的免疫球蛋白轻链对体外培养的心肌细胞也具有独立于纤维本身的细胞毒性。Tsao等[8]最新研究发现Aβ可以在体外直接作用于兔肺静脉心肌细胞,通过调控胞内钙离子平衡,参与心律失常的发生。以上结果均提示可溶性Aβ可能作为主要的致病因子直接导致心肌细胞的损伤。因此,本研究观察了Aβ25~35对体外培养的心肌细胞的毒性作用,发现其确实能够直接引起心肌细胞的凋亡,而且随着浓度的增加,对心肌细胞的毒性作用也逐渐增加。该结果提示Aβ除了累及中枢神经系统外也可以累及心脏,是AD相关性心肌病变的可能原因之一。
在AD的神经退行性病变过程中,神经元细胞的凋亡与一些细胞信号转导途径密切相关,研究信号转导过程、细胞凋亡的调控蛋白及阻断这些转导过程对细胞的保护作用,阐明细胞死亡机制,有助于对AD的治疗提供新的思路和方法。MAPK家族通过影响动物细胞内基因的转录和调控,影响细胞的生物学反应,如增殖、分化、转化及凋亡等。近几年,随着对细胞凋亡相关基因改变及其凋亡信号传导路径的进一步研究,发现MAPK途径在诱导细胞凋亡的过程中发挥了极为重要的作用。目前,在人类研究最多的主要集中在家族的3个成员上:细胞外信号调节激酶1/2(ERK1/2)、c-junN末端激酶(JNK),以及p38MAPK。MAPK家族成员各有特点,能够在不同的刺激因素或细胞种类差异等因素的作用下,产生各种生物学效应。近年来,p38MAPK途径的激活在AD发病中的作用受到越来越多的关注。1998年,Mcdonald等[9]首次在原代培养的大鼠胶质细胞中发现Aβ能活化p38MAPK途径。而与AD的发生、发展密切相关的炎性反应也与p38MAPK途径的活化相关,Aβ通过p38MAPK途径活化NF-κB,诱导PC12细胞的凋亡[10]。而在最近的一项体内研究,同样发现给予Aβ25~35可以激活p38MAPK信号途径引起大鼠海马区神经元细胞的凋亡[11]。因此,p38MAPK途径的干预有望成为治疗AD相关神经病变的靶点之一[12-13]。Shi等[14]研究发现淀粉样蛋白轻链能够通过激活p38MAPK途径诱导心肌细胞收缩功能障碍和促进心肌细胞凋亡。因此,本研究观察p38MAPK途径是否参与Aβ所诱导的心肌细胞凋亡,通过体外培养的心肌细胞发现,给予Aβ25~35刺激后p38MAPK磷酸化水平较对照组明显增加,而给予p38MAPK特异性抑制剂能够减轻Aβ所诱导的心肌细胞凋亡程度,提示p38MAPK信号通路可能参与了Aβ所诱导的心肌细胞凋亡,提示p38MAPK信号通路是AD相关性心肌损伤的可能发病机制之一,也有可能成为今后有效治疗AD相关性心肌损伤的靶点。
综上所述,Aβ25~35可以导致体外培养的大鼠心肌细胞发生凋亡,而且随浓度增加凋亡程度加重。本研究也揭示了p38MAPK信号通路可能参与了Aβ25~35所诱导的心肌细胞凋亡。这些结果支持Aβ在心脏中的沉积可能是造成AD患者心肌损伤的原因之一,为将来有效防治AD相关性心肌损伤提供新方法和实验基础,但更确切的证据还需在今后的工作中,通过动物模型进一步证实。
[1]Martins IJ,Hone E,Foster JK,et al.Apolipoprotein E,cholesterol metabolism,diabetes,and the convergence of risk factors for Alzheimer′s disease and cardiovascular disease[J].Mol Psychiatry,2006,11(8):721-736.
[2]Rosendorff C,Beeri MS,Silverman JM.Cardiovascular risk factors for Alzheimer′s disease[J].Am J Geriatr Cardiol,2007,16(3):143-149.
[3]Turdi S,Guo R,Huff AF,et al.Cardiomyocyte contractile dysfunction in the APPswe/PS1dE9 mouse model of alzheimer′s disease[J].PLoS One,2009,4(6):e6033-e6044.
[4]FidzianskaA,WalczakE,BektaP,etal.
Are cardiomyocytes able to generate pre-amyloid peptides?[J].Folia Neuropathologica,2011,49(1):64-70.
[5]Chen WE,Dilsizian V.Molecular imaging of amyloidosis:will the heart be the next target after the brain?[J].Curr Cardiol Rep,2012,14(2):226-233.
[6]Lesen S,Koh MT,Kotilinek L,et al.A specific amyloid-beta protein assembly in the brain impairs memory[J].Nature,2006,440(782):352-357.
[7]Sikkink LA,Ramirez-Alvarado M.Cytotoxicity of amyloidogenic immunoglobulin light chains in cell culture[J].Cell Death Dis,2010,1:e98.
[8]Tsao HM,Weerateerangkul P,Chen Y,et al.Amyloid peptide regulates Calcium homoeostasis and arrhythmogenesis in pulmonary vein cardiomyocytes[J].Eur J Clin Invest,2012,42(6):589-598.
[9]Mcdonald DR,Bamberger ME,Combs CK,et al.Beta-amyloid fibrils activate parallel mitogen-activated protein kinase pathways in microglia and THP1 monocytes[J].J Neurosci,1998,18(12):4451-4460.
[10]Jang JH,Surh YJ.Beta-amyloid-induced apoptosis is associated with cyclooxygenase-2 up-regulation via the mitogen-activated protein kinase-NF-kappa B signaling pathway[J].Free Radical Biol Med,2005,38(12):1604-1613.
[11]Xu Y,Cao DH,Wu GM,et al.Involvement of P38MAPK activation by NMDA receptors and non-NMDA receptors in amyloid-β peptide-induced neuronal loss in rat hippocampal CA1 and CA3 subfields[J].Neurosci Res,2014,85:51-57.
[12]Munoz L,Ammit AJ.Targeting p38 MAPK pathway for the treatment of Alzheimer′s disease[J].Neuropharmacology,2010,58(3):561-568.
[13]Borders AS,de Almeida L,Van Eldik LJ,et al.The p38 alpha mitogen-activated protein kinase as a central nervous system drug discovery target[J].BMC Neurosci,2008,9(Suppl 2):s12.
[14]Shi J,Guan J,Jiang B,et al.Amyloidogenic light chains induce cardiomyocyte contractile dysfunction and apoptosis via a non-canonical p38alpha MAPK pathway[J].Proc Natl Acad Sci USA,2010,107(9):4188-4193.
Aβ25-35induce the apoptosis of rat cardiomyocytes via p38MAPK pathway*
LuYonghao,WuHao,ZhangHengqian
(DepartmentofNeurosurgery,AffiliatedCentralHospitalofShenyangMedicalCollege,Shenyang,Liaoning110024,China)
Objective To observe the cytotoxicity of Aβ25-35in cultured rat cardiomocytes,and to elucidate the possible mechanism.MethodsThe isolated rat myocardial cells were cultured in vitro.Following the stimulation of Aβ25-35with different dose,the apoptosis of cardiomyocytes were observed by flow cytometry.Bax and Bcl-2 were simultaneously measured by Western blot.The phosphorylated p38 mitogen activated protein kinase(p38MAPK) were evaluated by Western blot under the stimulation of 20 μmol/L Aβ25-35.At the same time,the effect of p38MAPK selective inhibitor SB203580 on the apoptosis of cardiomycytes induced by 20 μmol/L Aβ25-35also was evaluated.ResultsAβ25-35induced the apoptosis of rat myocardial cells.Meanwhile,the expression of Bax increased and the expression of Bcl-2 decreased in dose-dependent mode.The level of phosphorylated p38MAPK in myocardial cells exposed to 20 μmol/L Aβ25-35increased obviously.However,the apoptosis was inhibited by p38MAPK selective inhibitor SB203580.ConclusionAβ25-35could induce the apoptosis of rat cardiomyocytes via p38MAPK pathway.The study will help identify the possible mechanisms of cardiomocytes injury in Alzheimer′s disease(AD) and provide a new strategy for clinical treatment of AD-associated myocardial injury.
p38 mitogen activated protein kinases;alzheimer′s disease;apoptosis
10.3969/j.issn.1671-8348.2015.34.007
辽宁省教育厅科研基金资助项目(L2014413)。
:卢永浩(1973-),副主任医师,博士,主要从事阿尔兹海默病及脑血管疾病研究。
R541.9
A
1671-8348(2015)34-4771-03
2015-05-01
2015-07-16)

