Toll 样受体在高迁移率族蛋白B1诱导严重烧伤后枯否细胞分泌促炎性细胞因子中的作用
陈旭林 孙 立 郭 峰 王 飞 刘 晟 梁 勋 王仁素 王永杰 孙业祥
(安徽医科大学第一附属医院烧伤科,安徽 合肥 230022)
高迁移率族蛋白B1(high mobility group box 1 protein,HMGB1)作为一个重要的促炎性细胞因子,被认为既是炎症早期的启动者,又是炎症晚期的促进者[1],介导了严重烧伤的全身炎症反应过程,参与了烧伤后全身多脏器损伤的发生[2],但其在促进烧伤后肝脏枯否细胞(Kupffer cells, KCs)表达促炎因子中的具体机制尚不清楚。HMGB1主要通过Toll样受体(TLRs)信号途径(特别是TLR2和TLR4)起到引起炎症反应的作用[3]。本文探讨TLRs在HMGB1诱导的严重烧伤大鼠KCs分泌促炎性细胞因子中的作用,以了解HMGB1促炎作用的受体机制。
1 材料和方法
1.1 动物分组与烧伤模型的制备 健康成年雄性SD大鼠32只,体重200~250 g,购自安徽医科大学动物中心。常温下饲养1周,随机分为烫伤组(n=24)和假烫组(n=8)。烫伤组大鼠以戊巴比妥钠(30 mg/kg)腹腔注射麻醉后,背部置于98 ℃水中12 s,造成30%TBSA Ⅲ度烧伤,烧伤后立即给予乳酸林格液(30 ml/kg)腹腔注射进行液体复苏。假烫组大鼠进行相同的麻醉,但给予室温水浴,不行液体复苏。各组大鼠于烫伤或假烫后24 h心脏取血处死,分离肝脏KCs。
1.2 KCs的分离与培养 KCs的分离采用肝脏原位灌注,Nycodenz不连续密度梯度离心和选择性黏附法[4]。KCs活性的判断和鉴定分别采用台盼蓝染色和乳胶微粒吞噬试验,活性和纯度均大于95%。分离后的KCs以每孔1×106的密度接种于24孔板中。为观察HMGB1对烧伤后KCs促炎性细胞因子产生的影响,烫伤组和假烫组大鼠的KCs分别采用不同浓度HMGB1(0、50、100、200 ng/ml,美国Sigma公司)刺激48 h,然后测定细胞培养上清液中TNF-α和IL-1β的含量。为了解HMGB1烧伤后促炎作用的受体机制,另将烫伤组大鼠的KCs分离后随机分为4组:①对照组,RPMI-1640培养液中培养48 h;②HMGB1组,100 ng/ml HMGB1 刺激48 h;③HMGB1+TLR2抗体组,20 μg/ml TLR2抗体(美国Invivogen公司)培养2 h后加入100 ng/ml HMGB1 刺激48 h;④HMGB1+TLR4抗体组, 20μg/ml TLR4抗体(美国Invivogen公司)培养2 h后加入100 ng/ml HMGB1 刺激48 h。检测各组KCs中TNF -α和IL-1β mRNA的表达。
1.3 ELISA法测定KCs上清液中的TNF-α和IL-1β含量 收集细胞培养上清液,使用大鼠TNF-α和IL-1β酶联免疫吸附试剂盒(美国Bio Source公司)检测TNF-α和IL-1β含量,相关操作按照生产商提供的说明书进行。
1.4 Northern blot法检测KCs中TNF -α和 IL-1β mRNA的表达 使用 Trizol法提取KCs的总RNA,测定260和280 nm处 吸光度值以反映RNA 含量和纯度。采用文献[5]的方法将提取的10 μg RNA电泳后,转移到尼龙膜(Hybond-N+,美国Amersham公司),得到的印记分别与(α-32P)d CTP(3000 Ci/mmol,美国Amersha公司)标记的大鼠TNF-α和IL-1β的c DNA探针相杂交,采用GAPDH作为内参照。杂交膜使用Phosphor-Imager成像系统进行吸光度分析。
2 结 果
2.1 HMGB1刺激后烧伤大鼠KCs 上清液TNF-α和IL-1β含量的变化 烫伤组和假烫组大鼠的KCs在HMGB1刺激后,上清液中的TNF-α 和IL-1β含量均明显升高,其升高幅度与HMGB1均呈现剂量依赖性关系。统计学结果显示:HMGB1刺激后,烫伤组大鼠KCs分泌的TNF-α和IL-1β水平显著高于假烫组大鼠的KCs(P<0.05或P <0.01),这种差异在使用100 ng/ml或者更高浓度HMGB1刺激后更为明显。见表1。
2.2 Toll样受体在HMGB1刺激致KCs培养上清液中TNF-α和IL-1β含量变化中的作用100 ng/ml HMGB1刺激后烧伤大鼠KCs分泌TNF-α和IL-1β显著增加,TLR2/4抗体预培养KCs都可以明显减弱HMGB1诱导TNF-α和IL-1β上调的作用(P <0.01)。TLR4抗体抑制HMGB1诱导TNF-α表达的作用比TLR2抗体更明显(73%对53%,P <0.05),加入TLR4抗体预培养的KCs培养液上清中TNF-α水平与对照组之间差异无显著性(P >0.05)。TLR2抗体较TLR4抗体更显著地抑制了HMGB1诱导的IL-1β表达(79%对51%,P <0.05),HMGB1+TLR2组的KCs培养液上清中的IL-1β水平与对照组之间差异无显著性(P >0.05)。见表2。
表1 HMGB1刺激严重烫伤大鼠KCs后培养上清液中TNF-α 和IL-1β含量的变化(±s, n =8)

表1 HMGB1刺激严重烫伤大鼠KCs后培养上清液中TNF-α 和IL-1β含量的变化(±s, n =8)
注:与假烫组比较:* P <0.05,** P <0.01
HMGB 1 (ng/ml) TNF-α (ng/ml) IL-1β (ng/ml)假烫组 烫伤组 假烫组 烫伤组0 0.91±0.06 2.68±0.130 0.18±0.01 0.434±0.05000 50 1.75±0.16 4.41±0.43* 0.35±0.03 0.82±0.08*0 100 4.59±0.45 10.59±1.39** 0.85±0.09 2.49±0.33**200 8.04±0.76 18.69±1.98** 1.40±0.14 3.94±0.45**
表2 ELISA法检测各组大鼠KCs培养上清中TNF-α和IL-1β的含量(±s, n =8)
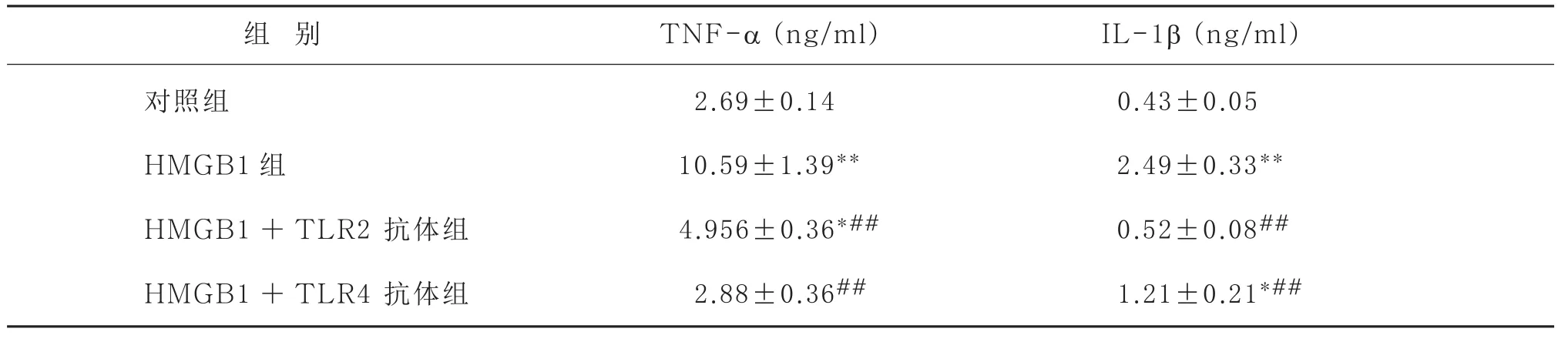
表2 ELISA法检测各组大鼠KCs培养上清中TNF-α和IL-1β的含量(±s, n =8)
注:与对照组比较:* P <0.05,** P <0.01;与 HMGB1 组比较 :#P <0.05,##P <0.01
组 别 TNF-α (ng/ml) IL-1β (ng/ml)对照组 2.69±0.140 0.43±0.0500 HMGB1组 10.59±1.39** 2.49±0.33**HMGB1+TLR2 抗体组 4.956±0.36*## 0.52±0.08##HMGB 1+TLR4 抗体组 2.88±0.36## 1.21±0.21*##
2.3 TLRs在HMGB1诱导严重烧伤大鼠KCs TNF-α和 IL-1β mRNA 表 达 中 的 作 用Northern blot结果表明,100 ng/ml HMGB1刺 激 KCs 48 h后, 细 胞 内 TNF-α和 IL-1β m RNA水平均较对照组明显升高(P <0.01)。与HMGB1单独刺激组比较,使用TLR2/4抗体预培养严重烧伤大鼠KCs明显抑制HMGB1诱导的 TNF-α 和 IL-1β mRNA 表 达(P <0.01)。TLR2抗体抑制IL-1β m RNA表达的作用更为明显,而TLR4抗体抑制TNF-α mRNA表达的作用更为显著。
3 讨 论
枯否细胞存在于肝血窦中,是组成机体单核-巨噬细胞系统最大的群体,占单核-巨噬细胞总数的80%~90%。KCs是重度烧伤早期炎症因子TNF-α和IL-1β释放的重要来源,并且导致了烧伤后的肝损伤,抑制KCs的活化可以减轻烧伤后全身炎症反应的发生。

图1 Northern blot法检测各组大鼠KCs中TNF -α和IL-1β mRNA的表达
HMGB1是一种高度保守的非组蛋白染色体蛋白质,最初认为它是一种参与维护核小体结构和调节基因转录的DNA结合蛋白。HMGB1可由烧伤后损伤的细胞被动释放,也可由应激状态下的单核细胞和巨噬细胞主动分泌,是一种引起烧伤后组织损伤和炎症反应的介质。大面积烧伤患者血浆中HMGB1水平明显升高[6-7]。最新研究发现,HMGB1作为一种强有力的促炎性细胞因子和“晚期”炎症介质参与了全身炎症反应的进程[1]。在本研究中,虽然HMGB1能诱导各实验组KCs中TNF-α和IL-1β表达增高,但是严重烧伤大鼠来源的KCs对于HMGB1诱导的TNF-α和IL-1β表达比假烫组更敏感。HMGB1上调严重烧伤大鼠KCs表达TNF-α和IL-1β呈剂量依赖性的关系。这些结果表明HMGB1可能在烧伤后炎症反应级联放大过程中起到非常重要的作用。
由于100 ng/ml HMGB1上调严重烧伤大鼠KCs 分泌TNF-α和IL-1β的作用最为显著,故在探讨TLRs在HMGB1诱导严重烧伤后KCs促炎性细胞因子产生中的作用时,采用100 ng/ml HMGB1刺激KCs。
Toll样受体是一组高度保守的蛋白,接受各种内源性和外源性刺激后激活固有免疫细胞,在机体免疫应答中发挥着重要作用[8]。HMGB1主要通过Toll样受体信号途径(特别是TLR2和TLR4)起到引起炎症反应的作用[9-10]。本实验中用特异性阻断剂分别阻断TLR2和TLR4的表达,发现阻断TLR4的表达较阻断TLR2的表达能更有效地抑制HMGB1诱导KCs表达TNF-α。另一方面,阻断TLR2的表达比阻断TLR4的表达更显著地抑制了HMGB1诱导KCs表达IL-1β。本研究结果表明,HMGB1通过TLR2和TLR4介导KCs表 达 TNF-α和 IL-1β; TLR4在 HMGB1诱导KCs表达TNF-α的过程中起到更加重要的作用,而HMGB1诱导KCs表达IL-1β主要依靠TLR2介导。TLR2和TLR4在HMGB1诱导烧伤后KCs产生和释放炎性细胞因子的过程中发挥着不同作用。
除TLR2及TLR4外,Toll样受体家族中的TLR9和晚期糖基化终末产物受体(RAGE)同样可以被HMGB1激活[9,11],但其激活在烧伤后HMGB1诱导的KCs活化及炎性细胞因子释放中的作用尚不明确。我们之前的研究发现使用RAGE抗体预培养的KCs并不能降低HMGB1诱导的TNF-α和IL-1β分泌,这意味着绝大多数HMGB1引起的烧伤KCs活化并不依赖RAGE。有关TLR9在严重烧伤后HMGB1介导的KCs激活及炎性细胞因子释放中的作用还有待于进一步研究。
[1]Andersson U, Tracey KJ. HMGB1 is a therapeutic target for sterile inflammation and infection[J]. Annu Rev Immunol, 2011,29:139-162.
[2]Liang X, Wang RS, Wang F, Liu S,Guo F, Sun L, Wang YJ, Sun YX, Chen XL, etal. Sodium butyrate protects against severe burninduced remote acute lung injury in rats[J]. PLoS One, 2013,8(7):e68786.
[3]Yang J, Chen L, Yang J. High mobility group box-1 induces migration of vascular smooth muscle cells via TLR4-dependent PI3K/Akt pathway activation[J]. Mol Biol Rep, 2012, 39(3):3361-3367.
[4]Chen XL, Xia ZF, Wei D. Role of p38 mitogen-activated protein kinase in Kupffer cell secretion of the proinflammatory cytokines after burn trauma[J]. Burns 2003, 29(6):533-539.
[5]Jia YT, Ma B, Wei W. Sustained activation of nuclear factorkappaB by reactive oxygen species is involved in the pathogenesis of stress-induced gastric damage in rats[J]. Crit Care Med, 2007,35(6):1582-1591.
[6]Huang LF, Yao YM, Dong N. Association of high mobility group box-1 protein levels with sepsis and outcome of severely burned patients[J]. Cytokine, 2011, 53(1):29-34.
[7]Lantos J, Földi V, Roth E. Burn trauma induces early HMGB1 release in patients: its correlation with cytokines[J]. Shock, 2010,33(6):562-567.
[8]董宁,姚咏明.Toll样受体免疫学研究新进展[J]. 感染、炎症、修复, 2008, 9(3):177-180.
[9]Yang J, Chen L, Yang J. High mobility group box-1 induces migration of vascular smooth muscle cells via TLR4-dependent PI3K/Akt pathway activation[J]. Mol Biol Rep, 2012, 39(3):3361-3367.
[10] 姚咏明, 刘辉.重视高迁移率族蛋白B1免疫效应的探索[J].感染、炎症、修复, 2009, 10(1):3-5.
[11]Mazarati A, Maroso M, Iori V, Vezzani A, Carli M, etal. Highmobility group box-1 impairs memory in mice through both toll-like receptor 4 and receptor for advanced glycation end products[J]. Exp Neurol, 2011, 232(2):143-148.

