环氧合酶- 2- 1195G/A和锰超氧化物歧化酶9Ala/Val基因多态性与高脂饮食的交互作用及其与溃疡性结肠炎的关系
张超贤,郭李柯,郭晓凤
新乡医学院第一附属医院 1消化内科 2口腔科,河南卫辉 453100
3杭州市第六人民医院肝病科,杭州 310014
环氧合酶- 2- 1195G/A和锰超氧化物歧化酶9Ala/Val基因多态性与高脂饮食的交互作用及其与溃疡性结肠炎的关系
张超贤1,郭李柯2,郭晓凤3
新乡医学院第一附属医院1消化内科2口腔科,河南卫辉 453100
3杭州市第六人民医院肝病科,杭州 310014
摘要:目的探讨环氧合酶- 2- 1195G/A(COX- 2- 1195G/A)和锰超氧化物歧化酶9Ala/Val(MnSOD9Ala/Val)基因多态性与高脂饮食的交互作用及其与溃疡性结肠炎(UC)的关系。方法采用病例-对照研究的方法,以750例UC患者及750例健康对照者的外周血白细胞为样本,采用聚合酶链反应(PCR)技术分析COX- 2- 1195G/A和MnSOD9Ala/Val基因多态性。结果UC组和对照组COX- 2- 1195G/A(A/A)基因型的分布频率分别为49.07%和21.20%,MnSOD9Ala/Val(V/V)基因型的分布频率分别为50.13%和22.40%,差异均有统计学意义(P均<0.01)。COX- 2- 1195G/A(A/A)基因型(OR=3.5808,95%CI=1.8062~5.3478)和MnSOD9Ala/Val(V/V)基因型(OR=3.4828,95%CI=1.9137~5.5496)者患UC的风险均显著增加。基因突变的协同分析结果显示,COX- 2- 1195G/A(A/A)/MnSOD9Ala/Val(V/V)基因型者在UC组和对照组中的分布频率分别为40.67%和8.40%,差异有统计学意义(P<0.01),COX- 2- 1195G/A(A/A)/MnSOD9Ala/Val(V/V)基因型者患UC的风险显著增加(OR=7.5655,95%CI=4.1849~11.2037)。UC组高脂饮食率显著高于对照组(49.73%比20.13%,P<0.01),高脂饮食与COX- 2- 1195G/A(A/A)(γ=11.81821)和 MnSOD9Ala/Val(V/V)(γ=9.0107)基因型均有交互作用。结论COX- 2- 1195G/A(A/A)和MnSOD9Ala/Val(V/V)基因型及高脂饮食是UC的易患因素,基因多态性与高脂饮食的交互作用增加了UC的发病风险。
关键词:溃疡性结肠炎;环氧合酶- 2- 1195G/A;锰超氧化物歧化酶9Ala/Val;多态现象;高脂饮食
Interaction between the Polymorphisms of Cyclooxygenase- 2- 1195G/A,MnSOD9Ala/Val Genes and the High-fat Diets and Its Correlation with Ulcerative Colitis
ActaAcadMedSin,2015,37(1):37-43
溃疡性结肠炎(ulcerative colitis,UC)是一类病因不明的胃肠道慢性非特异性炎症,近年来其发病率不断增加,已成为消化系统常见疾病和慢性腹泻的主要病因[1]。UC病因和发病机制尚未完全明确,目前认为肠道黏膜炎症介质,如前列腺素E2(prostaglandin E2,PGE2)、白细胞三烯及组胺等调节紊乱和自由基、脂质过氧化反应在UC发病中发挥重要作用,并与遗传、饮食等因素密切相关[2- 3]。长期高脂饮食不仅可通过提高肠道次级胆汁酸含量,增加环氧合酶- 2(cyclooxygenase- 2,COX- 2)mRNA 稳定性,刺激COX- 2 基因转录,促进PGE2合成,而且还可通过促进自由基、脂质过氧化反应来参与UC的发生、发展[4- 5]。COX- 2为花生四烯酸转化为PGE2代谢过程中的关键酶,能使已存在的炎症放大或持久化,与炎症反应密切相关[6]。锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)主要存在于细胞的线粒体基质内,生物体使用的能源主要在线粒体内产生,在能量合成过程中,氧化呼吸链的电子传递过程是机体内自由基产生的最主要途径,因此存在于线粒体基质内的MnSOD可首先清除这些自由基,以防止自由基的累积和扩散,所以MnSOD对维持体内自由基的平衡起关键作用,通过清除自由基、抑制脂质过氧化反应而成为UC进展的重要控制因素[7]。COX- 2、MnSOD基因均具有单核苷酸多态性位点,即1个单核苷酸多态性位点具有2或多个等位基因,不同等位基因编码的COX- 2或MnSOD活性有差异[8- 9]。COX- 2或MnSOD基因的多态性可使机体对外界环境饮食因素(如高脂饮食)的反应能力有所不同,这是决定机体肿瘤、炎症性疾病易感性的一个重要因素。COX- 2、MnSOD基因多态性与UC易感性的研究日渐增多,但尚未见高脂饮食与上述基因多态性的联合作用对UC易感性影响的报道。本研究探讨了COX- 2- 1195G/A、MnSOD9Ala/Val基因多态性与高脂饮食的交互作用及其与UC的关系。
对象和方法
对象及资料收集2010年7月至2013年6月在新乡医学院第一附属医院收治的UC患者750例,经内镜结合病理学检查均确诊为UC。对照组750例为同期健康体检人群,体检显示无肿瘤、其他自身免疫性及遗传性疾病。收集所有受试者的人口学资料,吸烟、饮酒史、职业史和家族史。并根据饮食状况分为低脂饮食和高脂饮食(饮食中脂肪的产热量占总热量百分比超过25%持续1年以上定义为高脂饮食)。
标本采集所有受试者均抽取静脉血2~3 ml,置乙二胺四乙酸钠抗凝管,分离白细胞层。用QIAampDNA提取试剂盒(德国QIAgen公司)提取白细胞DNA,DNA置-30 ℃低温冰箱保存备用。
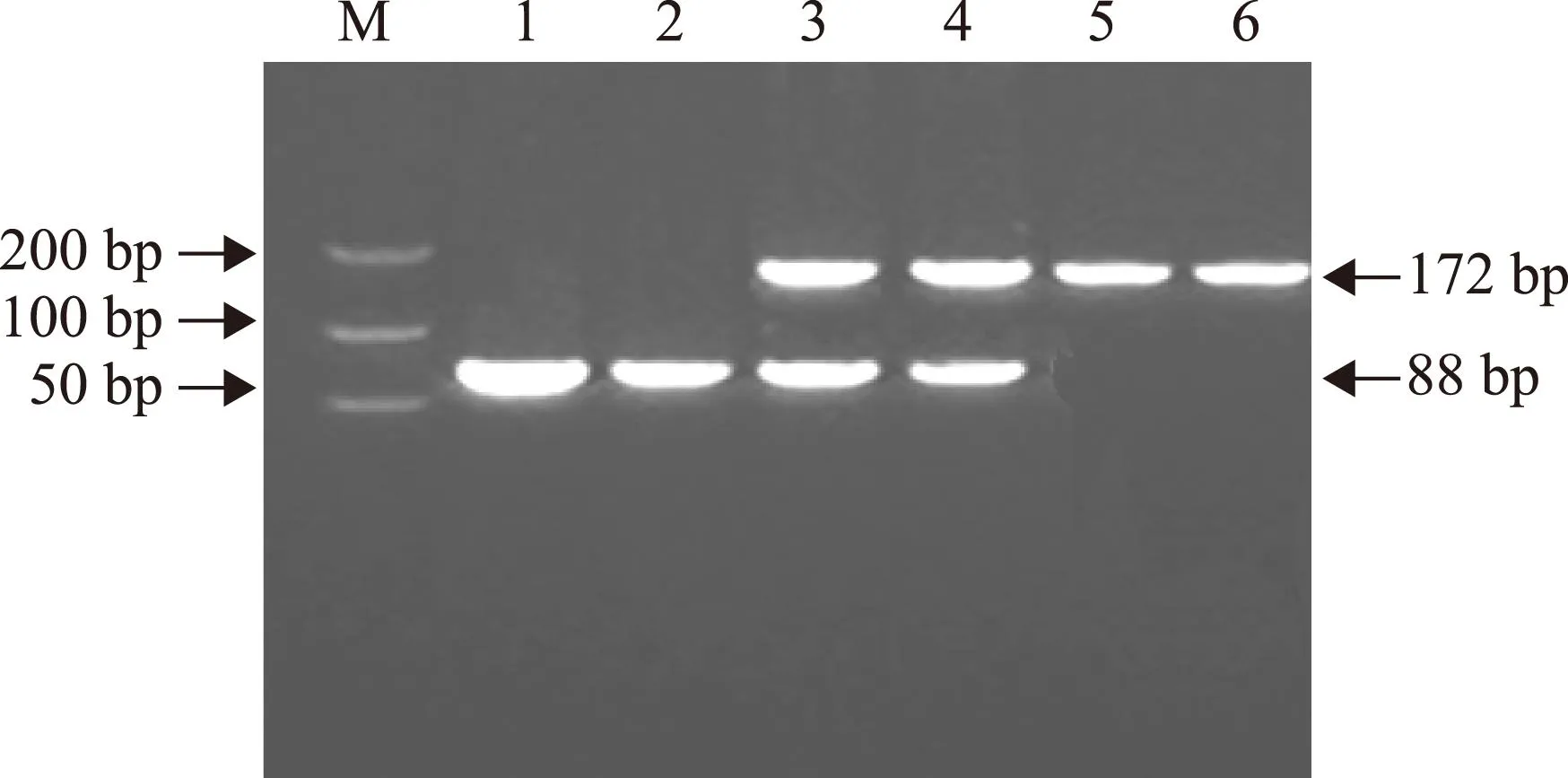
参考文献COX- 2- 1195G/A多态性分析[10],引物序列为:上游引物5’-TATCTCACCCTCACATCTC- 3’,下游引物5’-TCCTTACTAGCCCTTCATAG- 3’,由上海生工生物技术有限公司合成。PCR反应体系包括:基因组DNA 1 μl,上下游引物各0.5 μl,Taq DNA聚合酶Mix液(Takara公司)25 μl。反应条件为:94 ℃预变性5 min;94 ℃变性及55 ℃退火各45 s,72 ℃延伸30 s,40个循环;最后72 ℃延伸7 min。PCR产物长度为304 bp,经Bio-Rad染色琼脂糖凝胶电泳确认扩增结果后,以PvuII(NEB公司)酶切,37 ℃孵育4 h,取酶切产物4 μl经Bio-Rad染色琼脂糖凝胶电泳后,酶切产物放入紫外线凝胶成像仪观测,可见3种带型:AA纯合子为304 bp的1条区带,GG纯合子为230 和74 bp的2条区带,AG杂合子为304、74和230bp的3条区带(图1)。 MnSOD9Ala/Val多态性分析[11],引物序列为:上游引物5’-CAGCCCAGCCTGCGTAGAC G- 3’,下游引物:5’-GCGTTGATGTGAGGTTCCAG- 3’,由上海生工生物技术有限公司合成。应用TaKaRa PCR Am-plification Kit(大连宝生物工程有限公司)PCR 试剂盒在 25 μl PCR 反应体系中进行基因组 DNA 扩增,包括模板 DNA 1 μl(10 mg/L),10×PCR Buffer(含 3 mmol/L MgCl2)2.5 μl,dNTP Mixture 2 μl,TaKaRa Taq DNA 聚合酶0.125 μl(5 U/μl),引物各 1 μl(0.5 μmol/L),灭菌去离子水 17.375 μl。PCR反应条件如下:93 ℃ 预变3 min;93 ℃变性1 min,66 ℃退火1 min,70 ℃延伸1 min,35 个循环;70 ℃延伸10 min。PCR 扩增后的 MnSOD9Ala/Val基因片段为 172 bp,PCR反应完成后,在 10 μl的PCR 反应产物中加入10×Buffer 2 μl、100×牛血清白蛋白(BSA)0.2 μl、BsaW I酶0.5 μl(5 U/μl,美国新英格兰生物公司);灭菌去离子水 7.3 ml,酶切反应总体系为20 μl,酶切反应液放置于60 ℃恒温干浴锅温育16 h进行酶切。酶切产物经3.5%琼脂糖凝胶电泳(含0.5 μg/ml 溴乙啶),电泳缓冲液为0.5×TBE,在80 V电压下电泳 40 min。MnSOD9Ala/Val(AA)纯合子基因型个体显示1条88 bp长的DNA片段,MnSOD9Ala/Val(VV)纯合子基因型个体显示1条172 bp长的DNA片段,而MnSOD9Ala/Val(AV)杂合子基因型个体则显示2条长度分别为88和172 bp的DNA片段(图2)。
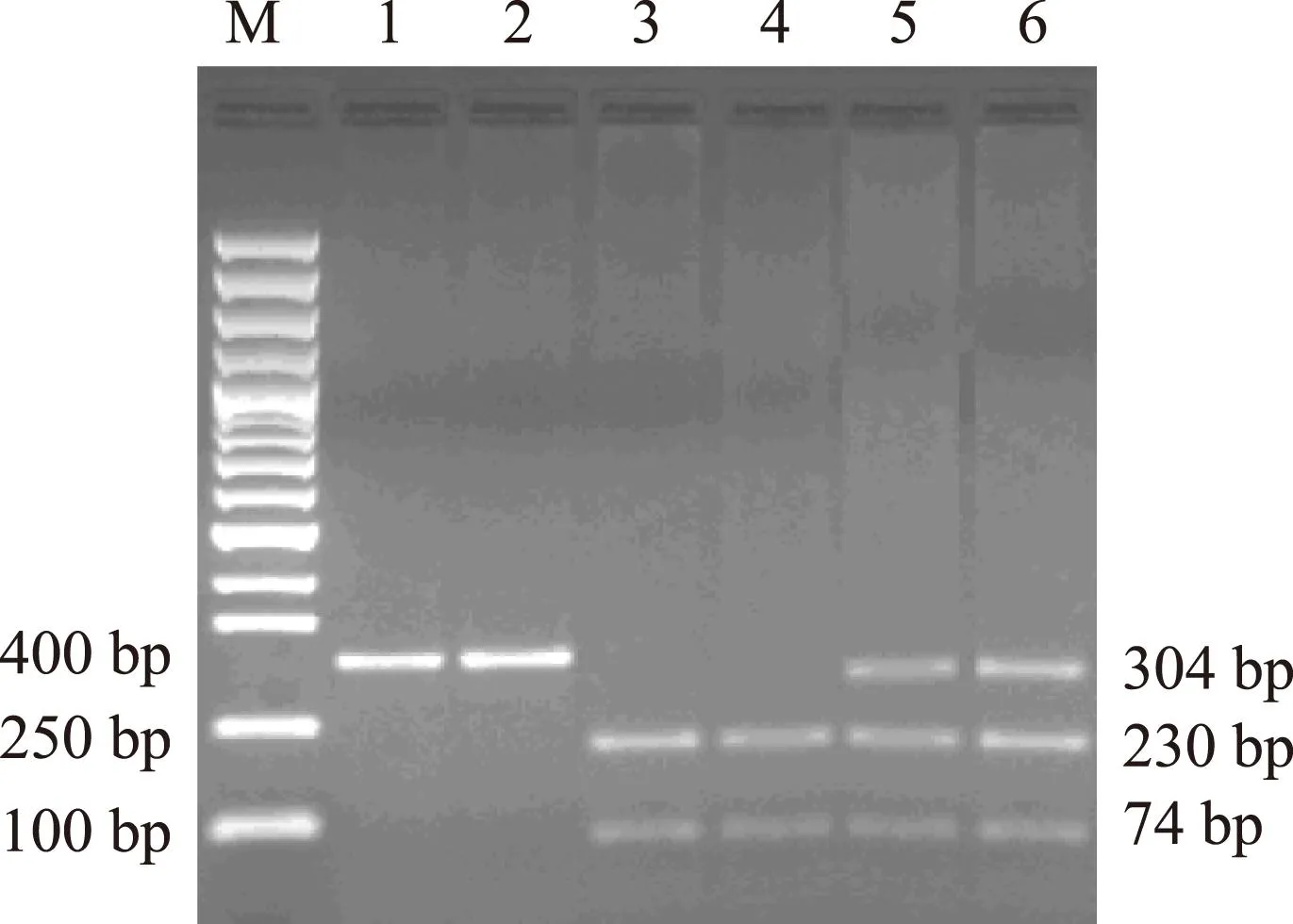
M:Marker;1,2:A/A;3,4:G/G;5,6:A/G
图 1COX- 2- 1195G/A基因PCR 产物检测
Fig 1Electrophoretogram of PCR products of COX- 2- 1195G/A gene
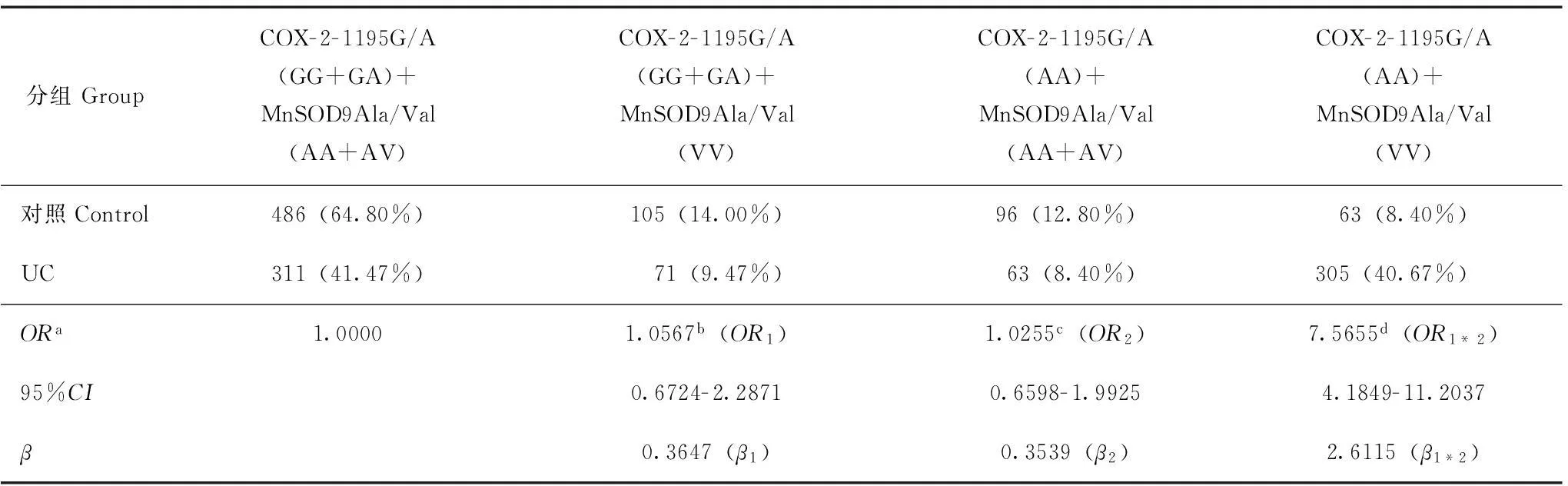
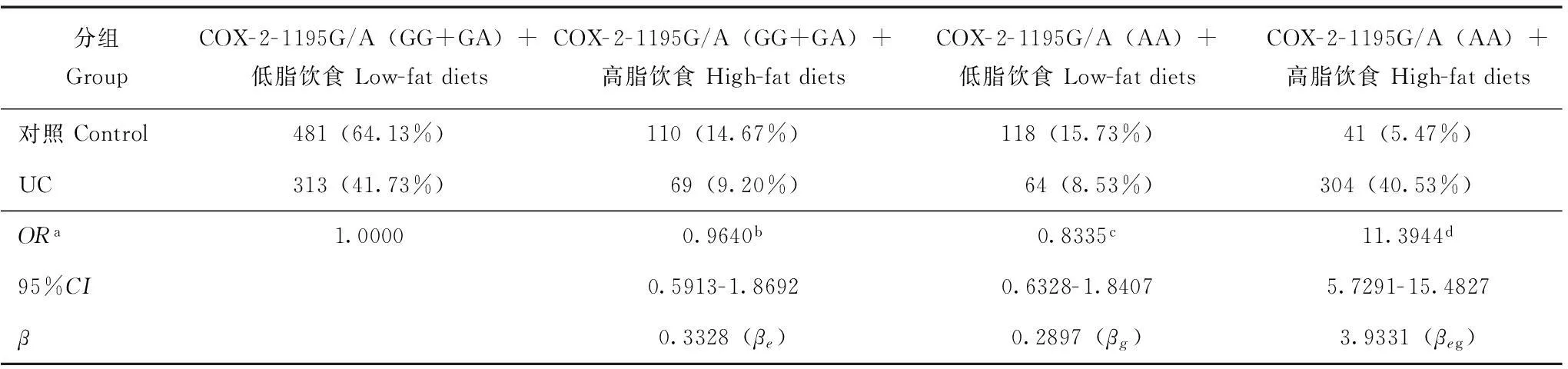
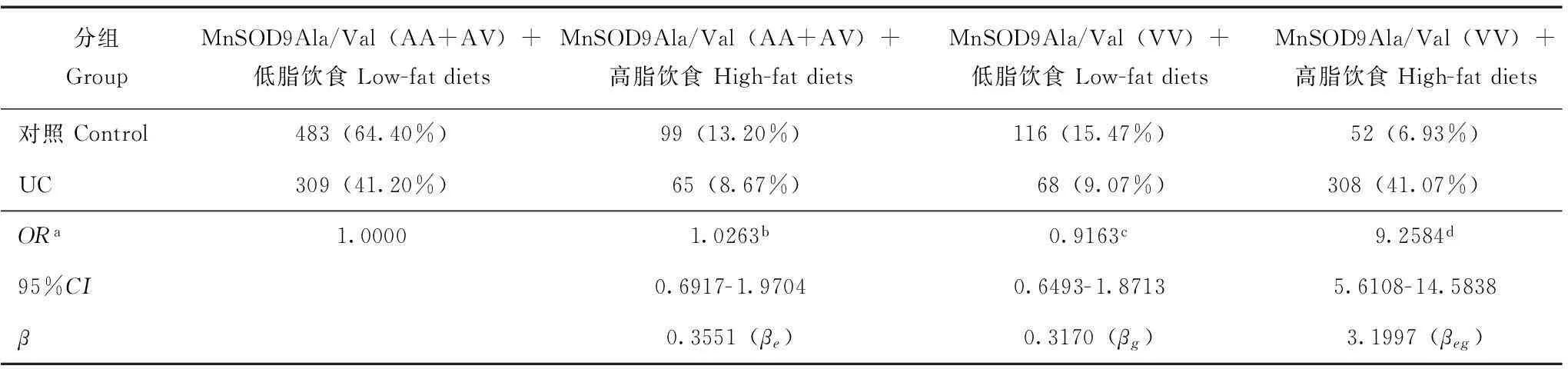
统计学处理采用SPSS 11.0统计软件包,Hardy-Weinberg平衡检验研究样本的群体代表性,以P>0.05为符合 Hardy-Weinberg规律。采用比值比(OR)和95%置信区间(95%CI)评价相对风险,病例组和对照组之间的基因型频率和等位基因频率采用χ2检验,P<0.05为差异有统计学意义。采用条件Logistic回归模型分析交互作用,根据交互作用模型和交互系数(γ=βeg/βe)判断基因- 环境交互作用模型以及交互作用类型。判定依据(1):γ>1,表示基因对环境暴露的效应有放大作用,正向交互作用;γ<1,表示基因对环境暴露的效应有减弱作用,负向交互作用;γ=1,表示基因对环境暴露没有交互作用。在病例对照研究中,γ为两变量lgOR的比值。判定依据(2):OReg=ORe×ORg为相乘模型,OReg>ORe×ORg为超相乘模型,OReg 结果 两组间一般情况的比较UC组750例患者中,男467例,女283例,平均年龄(51.39±7.53)岁;对照组750名受试者中,男469人,女281人,平均年龄(51.37±6.26)岁;两组在年龄、性别方面差异均无统计学意义(P均>0.05)。UC组和对照组高脂饮食率分别为49.73%和20.13%,调整性别、年龄、饮酒和吸烟因素后,两组间差异有统计学意义(P<0.01)。UC组和对照组饮酒率分别为52.13%和23.73%,调整性别、年龄、饮食习惯和吸烟因素后,两组间差异有统计学意义(P<0.01)。UC组和对照组吸烟率分别为48.40%和75.73%,调整性别、年龄、高脂饮食和饮酒因素后,两组间差异有统计学意义(P<0.01)。 M:Marker;1,2:A/A;3,4:A/V;5,6:V/V 图 2MnSOD9Ala/Val 基因PCR 产物检测 Fig 2Electrophoretogram of PCR products of MnSOD9Ala/Val gene COX- 2- 1195G/A基因型、等位基因频率及相关遗传模型关联分析经Hardy-Weinberg平衡检验,COX- 2- 1195G/A各基因型在对照组中的分布均符合Hardy-Weinberg 规律(P>0.05)。COX- 2- 1195G/A(GG+GA)基因型(50.93%比78.80%,P<0.01)和COX- 2- 1195G/A(AA)基因型(49.07%比21.20%,P<0.01)在UC组和对照组的比率差异均有统计学意义。等位基因A在UC组与对照组的比率分别为64.20%和46.73%,差异有统计学意义(P<0.01);经性别、年龄、饮食习惯、饮酒和吸烟状况调整后的OR值为2.0440。显性和隐性两种遗传模型分析结果显示:在隐性模型中,两位点的不同基因型在UC组和对照组间的分布差异均具有统计学意义(P<0.01)。 MnSOD9Ala/Val基因型、等位基因频率及相关遗传模型关联分析经Hardy-Weinberg平衡检验,MnSOD9Ala/Val各基因型在对照组中的分布均符合Hardy-Weinberg 规律(P>0.05)。MnSOD9Ala/Va(AA+AV)基因型(49.87%比77.60%,P<0.01)和MnSOD9Ala/Val(VV)基因型(50.13%比20.40%,P<0.01)在UC组和对照组的比率差异均有统计学意义。等位基因V在UC组与对照组的比率分别为65.07%和47.67%,差异有统计学意义(P<0.01);经性别、年龄、饮食习惯、饮酒和吸烟状况调整后的OR值为2.0450。显性和隐性两种遗传模型分析结果显示:在隐性模型中,两位点的不同基因型在UC组和对照组间的分布差异均具有统计学意义(P<0.01)。 COX- 2- 1195G/A和MnSOD9Ala/Val基因多态性在UC发病中的交互作用COX- 2- 1195G/A(AA)/MnSOD9Ala/Val(VV)在UC组和对照组的分布分别为40.67%和8.40%,COX- 2- 1195G/A(AA)和 MnSOD9Ala/Val(VV)在UC发病中存在正向交互作用,交互系数γ1=β1*2/β2=7.3792,γ2=β1*2/β1=7.1607,均大于1,OR1*2>OR1×OR2为超相乘模型(表1)。 COX- 2- 1195G/A 基因多态性和高脂饮食在UC发病中的交互作用携带COX- 2- 1195G/A(GG+GA)基因高脂饮食者ORe为0.9640(95%CI:0.5913~1.8692),单独携带COX- 2- 1195G/A(AA)型的ORg为0.8335(95%CI:0.6328~1.8407),两者同时存在时,交互作用OReg为11.3944(95%CI:5.7291~15.48277),交互系数γ=βeg/βe=11.8182>1,OReg>ORe×ORg为超相乘模型(表2)。携带MnSOD9Ala/Val(VV)者同时高脂饮食交互作用OReg为9.2584(95%CI:5.6108~14.5838),交互系数γ=βeg/βe=9.0107>1,OReg>ORe×ORg为超相乘模型(表3)。 表 1 COX- 2- 1195G/A和MnSOD9Ala/Val基因多态性在UC发病中的交互作用 UC:溃疡性结肠炎;a:按照性别、年龄、饮食习惯、饮酒和吸烟状况调整;b:单纯MnSOD9Ala/Val纯合突变型暴露的OR值(OR1);c:单纯COX- 2- 1195G/A纯合突变型暴露的OR值(OR2);d:两种基因纯合突变型交互后的OR值(OR1*2) UC:ulcerative colitis;a:adjusted according to gender,age,diet status,drinking status,and smoking status;b:ORvalue by simple MnSOD9Ala/Val homozygous mutants exposure(OR1);c:ORvalue by simple COX- 2- 1195G/A homozygous mutants exposure(OR2);d:ORvalue by two interacting genes in homozygous mutant(OR1*2) 表 2 COX- 2- 1195G/A基因多态性和高脂饮食在UC发病中的交互作用 a:按照性别、年龄、饮酒和吸烟状况调整;b:单纯高脂饮食暴露的OR值(ORe);c:单纯纯合突变型暴露的OR值(ORg);d:高脂饮食与纯合突变型交互后的OR值(OReg) a:adjusted according to gender,age,drinking status,and smoking status;b:ORvalue by simple high-fat diets exposure(ORe);c:ORvalue by simple homozygous mutant type exposure(ORg);d:ORvalue by the interaction between high-fat diets and homozygous mutant(OReg) 表 3 MnSOD9Ala/Val基因多态性和高脂饮食在UC发病中的交互作用 a:按照性别、年龄、饮酒和吸烟状况调整;b:单纯高脂饮食暴露的OR值(ORe);c:单纯纯合突变型暴露的OR值(ORg);d:高脂饮食与纯合突变型交互后的OR值(OReg) a:adjusted according to gender,age,drinking status,and smoking status;b:ORvalue by simple high-fat diet exposure(ORe);c:ORvalue by simple homozygous mutant type exposure(ORg);d:ORvalue by the interaction between high-fat diet and homozygous mutant(OReg) 讨论 COX是合成各种前列素(prostaglandins,PGs)的关键酶。细胞膜中的磷脂在磷脂酶A催化下可释放出花生四烯酸,后者在COX催化下形成前列腺素H2(prostaglandin H2,PGH2)。PGH2又分别在相应PG异构酶作用下合成PGE、前列腺素F(prostaglandin F,PGF)、前列腺素D(prostaglandin D,PGD)、前列腺素I(prostaglandin I,PGI)等。COX有COX- 1和COX- 2两种同工酶,其中,COX- 1为结构型酶,在人体内广泛持续表达,维持细胞的正常生理功能,对胃肠道具有保护作用;COX- 2为诱生型酶,是PGE2合成产生的关键酶,正常情况下不表达或表达很少,当细胞受到刺激时其表达量迅速增加,从而合成多种过量的PGE2等前列腺素类物质,最终导致红、肿、热、痛、充血、水肿、炎细胞浸润等炎症反应,同时也使已存在的炎症反应扩大化和持久化[12]。COX- 2的表达受基因的控制和环境因素的诱导,其表达和诱导表达水平均有显著的个体差异。COX- 2基因位于染色体 lq25.2~q25.3,包括10个内含子和9个外显子,长83 kb。近年研究发现了一些COX- 2基因位点的遗传多态性,包括-765G/C,-1195G/A和8473T/C位点,可能影响基因转录和 mRNA的稳定性,从而影响个体中COX- 2的表达。COX- 2- 1195G/A多态性具有COX- 2- 1195G/A(G/G)、COX- 2- 1195G/A(G/A)和COX- 2- 1195G/A(A/A)3种基因型,国内外已有研究报道认为COX- 2- 1195G/A位点多态性与多种炎症性、自身免疫性、肿瘤性疾病的易感性有关[13- 14]。本研究发现,COX- 2- 1195G/A(A/A)基因型者发生UC的风险显著增加,其OR为3.5808,95%CI为1.8276~5.1835,与上述研究结果一致。COX- 2- 1195G/A(A/A)基因型者易患UC的机制还不清楚,相关研究显示COX- 2基因启动子区包含许多重要的顺式作用元件,包括c-AMP、核转录因子-κB(nuclear transcription factor-kappa B,NF-κB)、白细胞介素- 6(interleukin- 6,IL- 6)和转化生长因子-β(transforming growth factor-β,TGF-β),-1195G/A变异并不影响这些转录因子结合位点,而是创造了1个C-MYB结合位点,这种改变使COX- 2基因的转录活性增加。同时,COX- 2- 1195G/A多态性可影响COX- 2基因的表达,COX- 2- 1195G/A(A/A)基因型携带者COX- 2基因表达增加,可能会诱导炎症出现,增加UC发生的危险性。 超氧化物歧化酶(superoxide dismutase,SOD)是一类广泛存在于生物体内的金属酶,可催化超氧离子歧化为H2O2,而使体内的超氧离子维持在一定水平。根据SOD中心金属原子的不同可将其分为CuZnSOD、MnSOD、FeSOD、NiSOD和FeZnSOD等几种。线粒体内的氧化呼吸链是活性氧簇(reactive oxygen species,ROS)产生的主要场所,MnSOD是线粒体内的主要酶性自由基清除剂,能将超氧阴离子歧化为过氧化氢和氧,对维持胞内氧化还原平衡至关重要。MnSOD基因定位于6号染色体(6q25),目前共发现4个功能多态性位点,研究最多的是位于第2外显子的GCT/GTT点突变。现已证实,MnSOD基因第2外显子GCT/GTT点突变引起MnSOD线粒体靶序列(MTS)第9位氨基酸替换,即丙氨酸(Ala)替换为丝氨酸(Val),此时信号肽构象由α-螺旋结构转变成β-折叠层结构。α-螺旋的亲水结构有利于MnSOD向线粒体的转运及酶的细胞内定位,Val等位基因存在使该信号肽的一段成β-折叠,此构象破坏信号肽的亲水结构从而不利于MnSOD向线粒体转移,因此携带VV基因型的个体MnSOD活力可能比携带其他基因型的个体低[16]。研究证明,MnSOD基因多态性可增加氧化应激相关疾病,如糖尿病视网膜病变、肺癌等的发病率[17- 18]。本研究结果显示,MnSOD9Ala/Val(VV)与UC的发生有关,携带MnSOD9Ala/Val(VV)基因者患UC的风险高于携带MnSOD9Ala/Val(AA+AV)的个体,与相关研究结果一致。 本研究还采用交互作用模型理论,探讨了COX- 2- 1195G/A和MnSOD9Ala/Val基因多态性与高脂饮食的交互作用,及其对UC发生的意义。结果发现,COX- 2- 1195G/A与MnSOD9Ala/Val突变型的交互作用增加了UC的发病风险。COX- 2- 1195G/A(AA)和 MnSOD9Ala/Val(VV)基因型对UC的发生风险有相互放大效应,通过对饮食状况的分析发现,高脂饮食患UC的风险明显高于低脂饮食者,高脂饮食与COX- 2- 1195G/A(AA)和MnSOD9Ala/Val(VV)基因型的交互作用OR值分别为11.3944、9.2584,γ值分别为11.8182、9.0107,均明显大于1,提示COX- 2- 1195G/A(AA)和MnSOD9Ala/Val(VV)基因型与高脂饮食暴露在UC发生中均有正向交互作用,携带COX- 2- 1195G/A(AA)或/和MnSOD9Ala/Val(VV)基因型者高脂饮食的危害效应更大。而两基因型与高脂饮食暴露交互作用OReg均大于ORe×ORg,显示上述两纯合突变基因与高脂饮食交互作用机制在UC发生中可能为超相乘模型。高脂饮食能促进机体胆汁的分泌,胆汁中初级胆汁酸在肠道菌丛的作用下变成脱氧胆酸、石胆酸等次级胆酸,而胆汁酸,尤其是次级胆酸中脱氧胆酸可刺激正常黏膜上皮、炎症细胞、转化细胞COX- 2基因转录及其mRNA稳定性增加,在其作用下,PGE2生成增多[19]。通常情况下,生物体内的活细胞均可产生氧自由基,因存在着包括SOD在内的自由基清除系统,可及时清除体内过剩的自由基,维持自由基的动态平衡,长期高脂饮食的人血脂升高,脂质代谢紊乱,心、肝、肾等实质脏器氧化应激增加[20],氧自由基产生过多,过量氧自由基通过血液进入肠黏膜细胞,使肠黏膜细胞发生脂质过氧化及启动新的自由基反应。这可能是高脂饮食可单独增加及与COX- 2- 1195G/A(AA)、MnSOD9Ala/Val(VV)发生交互作用联合协同增加UC发生风险的重要原因。 综上,UC是涉及环境因子和多种基因相互作用的复杂过程,本研究结果显示,携带COX- 2- 1195G/A和MnSOD9Ala/Val突变基因型的个体属UC高危险人群,在UC防治方案中应加以重视,虽然尚不能通过改变其UC易感的基因型来防治UC,但可以根据其与环境病因相互作用的特点,采取相应的控制环境病因的措施,如低脂饮食或基因调控以达到有效预防UC的目的。 [1]Blonski W,Buchner AM,Lichtenstein GR. Treatment of ulcerative colitis[J]. Curr Opin Gastroenterol,2014,30(1):84- 96. [2]Al-Rejai SS,Abuohashish HM,Al-Enazi MM,et al.Protective effect of naringenin on acetic acid-induced ulcerative colitis in rats[J]. World J Gastroenterol,2013,19(34):5633- 5644. [3]Sakthivel KM,Guruvayoorappan C. Amentoflavone inhibits iNOS,COX- 2 expression and modulates cytokine profile,NF-κB signal transduction pathways in rats with ulcerative colitis[J]. Int Immunopharmacol,2013,17(3):907- 916. [4]Philip B,Roland CL,Daniluk J,et al.A high-fat diet activates oncogenic Kras and COX2 to induce development of pancreatic ductal adenocarcinoma in mice[J]. Gastroenterology,2013,145(6):1449- 1458. [5]Charradi K,Elkahoui S,Limam F,et al. High-fat diet induced an oxidative stress in white adipose tissue and disturbed plasma transition metals in rat:prevention by grape seed and skin extract[J]. J Physiol Sci,2013,63(6):445- 455. [6]Neeb L,Hellen P,Boehnke C,et al.IL- 1β stimulates COX- 2 dependent PGE2synthesis and CGRP release in rat trigeminal ganglia cells[J]. PLoS One,2011,6(3):e17360.doi:10.1371/journal.pone.0017360. [8]Daing A,Singh SV,Saimbi CS,et al. Cyclooxygenase 2 gene polymorphisms and chronic periodontitis in a North Indian population:a pilot study[J]. J Periodontal Implant Sci,2012,42(5):151- 157. [9]Ben-Zaken S,Eliakim A,Nemet D,et al. Increased prevalence of MnSOD genetic polymorphism in endurance and power athletes[J]. Free Radic Res,2013,47(12):1002- 1008. [10]Mittal M,Kapoor V,Mohanti BK,et al. Functional variants of COX- 2 and risk of tobacco-related oral squamous cell carcinoma in high-risk Asian Indians[J]. Oral Oncol,2010,46(8):622- 626. [11]Chen Y,Pei J. Possible risk modifications in the association between MnSOD Ala- 9Val polymorphism and breast cancer risk:subgroup analysis and evidence-based sample size calculation for a future trial[J]. Breast Cancer Res Treat,2011,125(2):495- 504. [12]Hsieh PS,Jin JS,Chiang CF,et al. COX- 2-mediated inflammation in fat is crucial for obesity-linked insulin resistance and fatty liver[J]. Obesity(Silver Spring),2009,17(6):1150- 1157. [13]Talar-Wojnarowska R,Gasiorowska A,Olakowski M,et al. Role of cyclooxygenase- 2 gene polymorphisms in pancreatic carcinogenesis[J]. World J Gastroenterol,2011,17(36):4113- 4117. [14]Li F,Ren GS,Li HY,et al. A novel single nucleotide polymorphism of the cyclooxygenase- 2 gene associated with breast cancer[J]. Clin Oncol(R Coll Radiol),2009,21(4):302- 305. [15]Bi N,Yang M,Zhang L,et al. Cyclooxygenase- 2 genetic variants are associated with survival in unresectable locally advanced non-small cell lung cancer[J]. Clin Cancer Res,2010,16(8):2383- 2390. [16]Tugcu V,Ozbek E,Aras B,et al.Manganese superoxide dismutase(Mn-SOD)gene polymorphisms in urolithiasis[J]. Urol Res,2007,35(5):219- 324. [17]叶林秀,杨茂平,邱红,等.锰超氧化物歧化酶基因Ala9Val多态性与2型糖尿病视网膜病变的相关性[J]. 中华医学遗传学杂志,2008,25(4):452- 454. [18]Zejnilovic J,Akev N,Yilmaz H,et al. Association between manganese superoxide dismutase polymorphism and risk of lung cancer[J]. Cancer Genet Cytogenet,2009,189(1):1- 4. [19]吴学文,王邦茂.胆汁酸与胃肠道肿瘤的关系及作用机制的研究进展[J]. 天津医科大学学报,2004,10(S0):46- 48. [20]Ha AW,Na SJ,Kim WK. Antioxidant effects of fucoxanthin rich powder in rats fed with high fat diet[J]. Nutr Res Pract,2013,7(6):475- 480. ·论著· ZHANG Chao-xian1,GUO Li-ke2,GUO Xiao-feng3 1Department of Gastroenterology,2Department of Stomatology,the First Affiliated Hospital of Xinxiang Medical University,Weihui,Henan 453100,China 3Department of Hepatology,the Sixth people’s Hospital of Hangzhou,Hangzhou 310014,China Corresponding author:ZHANG Chao-xianTel:0373- 4404195,E-mail:nn21882001@aliyun.com ABSTRACT:ObjectiveTo investigate the interaction of the polymorphisms of cyclooxygenase- 2- 1195G/A(COX- 2- 1195G/A)and manganese superoxide dismutase 9Ala/Val(MnSOD9Ala/Val)genes and the high-fat diets and its potential correlation with ulcerative colitis(UC). MethodsThe genetic polymorphisms of COX- 2- 1195G/A and MnSOD9Ala/Val were analyzed by polymorphism-polymerase chain reaction(PCR)in peripheral blood leukocytes obtained from 750 UC patients(UC group)and 750 healthy subjects(control group). ResultsThe frequencies of COX- 2- 1195G/A(A/A)and MnSOD9Ala/Val(V/V)were 49.07% and 50.13% in UC group and 21.20% and 22.40% in control group,respectively(P<0.01). The risk of UC significantly increased in subjects with COX- 2- 1195G/A(A/A)genotype(OR=3.5808,95%CI=1.8062- 5.3478)and in those with MnSOD9Ala/Val(V/V)genotype(OR=3.4828,95%CI=1.9137- 5.5496). Pooled analysis of the polymorphisms showed that distribution frequency of COX- 2- 1195G/A(A/A)/MnSOD9Ala/Val(V/V)was 40.67% in UC group and 8.40% in control group(P<0.01). Subjects with COX- 2- 1195G/A(A/A)/MnSOD9Ala/Val(V/V)had a significantly higher risk of UC(OR=7.5655,95%CI=4.1849- 11.2037). The rate of high-fat diets was significantly higher in the UC group than in the control group(49.73 vs.20.13%,P<0.01),and statistic analysis suggested an interaction between high-fat diet and COX- 2- 1195G/A(A/A)(γ=11.81821)and MnSOD9Ala/Val(V/V)(γ=9.0107),which increase risk of UC. ConclusionsCOX- 2- 1195G/A(A/A),MnSOD9Ala/Val(V/V),and high-fat diet are the risk factors of UC. The interaction between the genetic polymorphisms of COX- 2- 1195G/A and MnSOD9Ala/Val and the high-fat diet increases the risk of UC. Key words:ulcerative colitis;cyclooxygenase- 2- 1195G/A;manganese superoxide dismutase 9Ala/Val;polymorphism;high-fat diet 收稿日期:(2014- 03- 12) DOI:10.3881/j.issn.1000- 503X.2015.01.007 中图分类号:R574.62 文献标志码:A 文章编号:1000- 503X(2015)01- 0037- 07 通信作者:张超贤电话:0373- 4404195,电子邮件:nn21882001@aliyun.com