肾缺血再灌注损伤大鼠模型足细胞损伤及机制研究*
艾娜 谢席胜 王强 龙琼先 王彦江 夏梦迪
(1.川北医学院第二临床医学院·南充市中心医院 肾内科,四川 南充 637000;2.泸州医学院,四川 泸州 646000;3.川北医学院附属医院检验科,四川 南充 637000;4.川北医学院第二临床医学院·南充市中心医院 病理科,四川 南充 637000)
肾缺血再灌注损伤大鼠模型足细胞损伤及机制研究*
艾娜1,2谢席胜1王强3龙琼先4王彦江1夏梦迪1,2
(1.川北医学院第二临床医学院·南充市中心医院 肾内科,四川 南充 637000;2.泸州医学院,四川 泸州 646000;3.川北医学院附属医院检验科,四川 南充 637000;4.川北医学院第二临床医学院·南充市中心医院 病理科,四川 南充 637000)
目的 探讨肾缺血再灌注损伤(renal ischemia reperfusion injury,IRI)大鼠模型足细胞的损伤,并对其损伤机制进行初步研究。方法 雄性SD大鼠42只,随机分为正常组(n=5)、假手术组(n=5)和模型组(n=32),模型组下设IRI后1h、6h、12h、24h 4个时间点,每个时间点8只大鼠。通过阻断大鼠双侧肾脏血流构建肾IRI模型。采用全自动生化分析仪检测各组大鼠的肾功能,流式细胞仪检测血活性氧(reactive oxygen species, ROS)的变化,糖原染色(periodic Acid Schiff, PAS)了解肾脏病理损害,通过透射电镜观察足细胞损伤情况。结果 在IRI大鼠模型中,我们发现了明显的足细胞损伤现象,即足细胞减少,足突消失,基底膜增厚。同时观察到,随着缺血再灌注后时间的延长,大鼠肌酐、尿素氮水平逐渐升高,红细胞中ROS荧光强度阳性率逐渐升高,肾小管出现不同程度的管腔扩张、变性与坏死,间质炎性细胞浸润、充血水肿等。相关性分析发现,红细胞ROS荧光强度阳性率与肾小管损伤评分、肌酐、尿素氮水平成正相关,与足细胞计数呈负相关。结论 肾IRI早期足细胞就可出现明显的损伤,同时伴有血ROS荧光强度阳性率明显上升;血ROS的变化可能参与了肾IRI足细胞损伤及病理损害的过程。
肾缺血再灌注损伤; 活性氧; 足细胞损伤
肾脏缺血再灌注损伤(renal ischemia reperfusion injury,IRI)诱导的急性肾功能衰竭是临床常见疾病,其发病率高,但临床治疗效果差。既往研究多关注肾IRI引起急性肾小管坏死机制,而肾IRI是否引起肾小球病变的研究报道甚少。本实验拟通过构建肾IRI大鼠模型,观察肾IRI大鼠肾小球足细胞的变化,以及通过流式细胞仪检测大鼠血活性氧(reactive oxygen species,ROS)的变化,了解IRI大鼠模型足细胞的损伤情况,并对其损伤机制进行初步探讨。
1 材料与方法
1.1 材料 清洁级雄性SD大鼠42只,6~8周龄,体重(220~250)g,购自川北医学院实验动物中心,生产许可证号为SCXK(川)2008- 1B。尿素(BUN)检测试剂盒、肌酐(Cr)检测试剂盒(上海科华生物公司);活性氧检测试剂盒(碧云天生物研究所)。HITACHI全自动生化分析仪(日立公司);KDC-40低速离心机(科大创新公司);FAsccaliber流式细胞仪(BD公司);日立H-600IV型透射电镜(日立公司)。
1.2 动物分组及造模 雄性SD大鼠42只,随机分为正常组(n=5)、假手术组(n=5)和模型组(n=32),模型组下设IRI后1h、6h、12h、24h,4个时间点(n=8)。实验组:3%戊巴比妥钠(1ml/kg)注射麻醉后[1],沿腹正中线切口,逐层分离暴露双侧肾脏,游离出双侧肾动脉,将消毒的压脉带片段包裹在肾动脉外层,将手术线系在压脉带片段外迅速打结,使肾缺血45min后再灌注。假手术组除不阻断双侧肾脏血流,其余处理与实验组相同。
手术前后情况观察:术中阻断双侧肾动脉后,可见肾脏由鲜红变紫黑色,去结扎线后,恢复血流灌注,可见肾脏迅速由紫黑色变为鲜红;术后1~3h,可见大鼠苏醒,逐渐恢复活动,视为造模成功。肾脏恢复血流后5 min,肾脏未恢复正常颜色;或术中大出血;或术后1~3 h,大鼠未苏醒或死亡,视为造模不成功。
1.3 指标检测
1.3.1 Scr和BUN检测 处死大鼠前心脏采血3ml,按4200 r/min 5min离心后保存于-20℃冰箱,待标本收集完后统一检测。
1.3.2 流式细胞仪检测血ROS的变化 红细胞洗涤:将收集的血液用0.9%的生理盐水反复漂洗,离心(3800r/min 5min),直至离心后漂洗液清亮为止,去除上清液备用。
实验组:取DCFH-DA 1μl,用无血清培养液按照1∶1000稀释DCFH-DA,使终浓度为10μmmol/L。向DCFH-DA稀释液中加入1μl已洗涤好的红细胞,放入流式细胞仪专用暗盒,在37℃细胞培养箱内孵育30min,每3-5min混匀一次,使探针和细胞充分接触。孵育结束后,离心去除上清液,用无血清培养液洗涤细胞三次,充分去除未进入细胞内的DCFH-DA,最后加入3ml无血清培养液,放到流式细胞仪进行检测。对照组:在DCFH-DA稀释液中加入活性氧阳性对照试剂(Rosup 1μl),其余操作同实验组。依据各组大鼠红细胞ROS荧光强度阳性率进行统计。
1.3.3 肾脏PAS染色 将双侧肾脏取下后沿纵轴剖开,用10%中性福尔马林固定,常规切片,PAS染色,光镜下观察。根据肾小管坏死程度,参考文献[2]的半定量病理评估法评分:评分越高说明肾小管坏死越严重(最高4分),0分:正常肾脏;1分:最轻微的(<25%的肾小管受累);2分:轻度坏死(25%~50%的肾小管受累);3分:中度坏死(50%~75%的肾小管受累);4分:重度坏死(>75%的肾小管受累)。选择两个不同的区域,在400倍光镜下分别选择10个不同的视野进行评分。
1.3.4 肾组织超微结构及足细胞的电镜观察:取部分肾组织经3%戊二醛固定,1%四氧化锇再固定,丙酮逐级脱水,Epon812包埋,1μm半薄切片光学定位,超薄切片,醋酸铀及枸橼酸铅双重染色,在透射电镜下观察亚细胞结构的病理改变以及肾微血管超微结构的改变。每只大鼠肾组织在10000×放大倍数下取30个视野,以确保每只大鼠最少观察100个足细胞,应用计算机图像分析软件计数足细胞数目,以及肾小球基底膜的厚度。
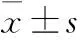
2 结果
2.1 各组大鼠一般情况 正常组大鼠活动自如,饮食饮水正常。手术后各组大鼠的苏醒时间不一,假手术组大约于术后30min苏醒。模型组大鼠多在术后1h苏醒。术后,假手术组大鼠精神尚可,偶有进食饮水,模型组大鼠精神欠佳,活动减少。实验组32只大鼠,造模成功30例,成功率为93.75%。其中12h组1只大鼠于肾动脉结扎后40min死亡;24h组1只大鼠于肾动脉结扎30min后死亡。对其解剖未发现腹腔内出血等明显异常。
2.2 各组尿量记录 正常组大鼠尿量为(10.08±0.97)ml,假手术组大鼠尿量为(1.94±0.63)ml,IRI各组大鼠均无小便,结果见图1。

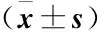
Figure 1 The urine volume of each group
注:与正常对照组相比,*P<0.05
2.3 各组大鼠肾功变化 结果见表1。
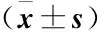
表1 各组大鼠的肾功检测情况
注:肌酐 与正常组相比:①P<0.05;与假手术相比:②P<0.05 尿素氮 与正常组相比:①P<0.05,②P>0.05;与假手术相比:①P<0.05,②P>0.05
2.4 各组大鼠红细胞ROS检测 结果见表2,图2。
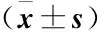
表2 各组大鼠红细胞ROS荧光强度阳性率检测情况
注:与正常组相比:①P<0.05,与假手术相比:②P>0.05。
2.5 各组大鼠病理改变
2.5.1 外观 假手术组为正常肾组织表现;IRI组肉眼可见肾皮质,肾髓质瘀血、色深暗。
2.5.2 PAS染色 IRI组肾小管上皮细胞肿胀,界限不清,出现不同程度的变性与坏死,间质炎性细胞浸润,充血水肿。结果见图3、图4。
2.5.3 电镜检查结果 正常组大鼠肾小球上皮细胞及突足,内皮细胞完好,血管开放良好,系膜基质及系膜细胞结构清晰。IRI组大鼠肾小球出现内皮细胞核染色质聚集,核固缩,坏死。上皮细胞增生微绒毛样变,突足消失,系膜基质增生严重,结果见表3,图5。

图2 缺血再灌注大鼠红细胞活性氧阳性率检测Figure 2 Ischemia-reperfusion in rat erythrocytes reactive oxygen positive rate
①:正常对照组 ②:假手术组 ③:IRI 1h组 ④:IRI 6h组 ⑤:IRI 12h组 ⑥:IRI 24h组

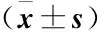
图3 各组大鼠肾小管损伤评分
注:与正常对照组相比,①P<0.05,各IRI组间比较P>0.05
2.6 相关性分析 红细胞ROS荧光强度阳性率与肌酐呈正相关(r=0.706,P<0.01);与尿素氮呈正相关(r=0.648,P<0.01),与肾小管损伤评分呈正相关(r=0.752,P<0.01),与足细胞计数呈负相关(r=-0.875,P<0.01)。足细胞计数与肌酐呈负相关(r=-0.651,P<0.01);足细胞计数与尿素氮呈负相关(r=-0.580,P<0.01);与肾小管损伤评分呈负相关(r=-0.635,P<0.01),结果见图6。

图4 缺血再灌注大鼠肾小管组织学改变(PAS×200)
Figure 4 The renal tubular tissue changes of ischemia-reperfusion rat(PAS×200)
①:正常对照组 ②:假手术组 ③:IRI 1h组 ④:IRI 6h组 ⑤:IRI 12h组 ⑥:IRI 24h组

图5 各组大鼠肾脏电镜图片(×10000)
Figure 5 Electron microscopy images of rats of all groups(×10000)
①:正常对照组 ②:假手术组 ③:IRI 1h组 ④:IRI 6h组 ⑤:IRI 12h组 ⑥:IRI 24h组
3 讨论
本研究通过阻断双侧肾脏血流建立肾IRI动物模型,动态观察了大鼠足细胞损伤变化及肾功能肾脏病理的改变。
研究结果显示在肾IRI术后,大鼠血肌酐、尿素氮水平持续升高,说明肾缺血再灌注对肾脏造成了损伤,表明我们的造模方法成功构建了肾IRI大鼠模型,这与既往关于IRI大鼠模型的研究结果一致[3]。通过PAS染色发现,肾IRI各组大鼠肾小管上皮细胞肿胀,界限不清,出现不同程度的变性与坏死,间质炎性细胞浸润,充血水肿,并且随着缺血后再灌注时间的延长呈逐渐加重趋势,至IRI 24h时出现肾小管大片状坏死,肾小管结构紊乱。说明肾IRI后引起肾小管损伤,出现肾功能的异常,这与既往研究结果一致[4]。
我们之前的研究已经证实在肾IRI早期,血红细胞ROS荧光强度阳性率的升高也能很好的反应肾组织和全身氧化应激的状态[5]。我们的研究发现,与正常组相比,在缺血再灌注损伤早期,血红细胞ROS荧光强度阳性率已明显升高,且随着缺血后再灌注损伤时间的延长呈逐渐升高趋势。通过相关性分析发现,血红细胞ROS荧光强度阳性率与肾小管损伤评分、肌酐、尿素氮均呈正相关。进一步证实ROS的产生增多与IRI的病理损害和肾功能的改变密切相关,这与既往研究一致[6]。
我们的研究不仅发现肾IRI大鼠肾小管上皮细胞的损伤严重,还发现在肾IRI早期,大鼠肾小球足细胞即出现严重的损伤,呈现足细胞突足消失,系膜基质增生严重。而既往关于肾IRI模型肾小球足细胞的变化的研究结果存在较大分歧。李俊[7]等通过切除大鼠右肾,夹闭左肾动脉45分钟构建肾IRI模型,观察再灌注后6小时、12小时、24小时、72小时后,发现肾IRI大鼠肾小球结构变化不明显。Andersson等[8]通

图6 相关性分析结果
Figure 6 The correlation analysis
注:红细胞ROS荧光强度阳性率与①肌酐、②尿素氮、③肾小管损伤评分呈正相关,与④足细胞计数呈负相关;足细胞计数与⑤肌酐、⑥尿素氮、⑦肾小管损伤评分呈负相关。
过阻断肾脏血流15分钟,发现轻度肾IRI后足细胞和基底膜没有重大变化。而王新良[9]等通过离断右侧肾动脉,夹闭左侧肾动脉45分组构建肾IRI模型,再灌注后持续观察5小时,发现肾小球足细胞足突排列紊乱,有明显的融合现象,与我们的研究结果一致。我们推测肾IRI大鼠出现严重的足细胞损伤,可能与肾缺血及再灌注时间的长短,以及与肾IRI模型制作的手术方式等有关。关于肾IRI肾小球足细胞损伤的机制,相关研究报道较少。我们通过相关性分析发现,足细胞计数与血ROS荧光强度阳性率呈负相关,在肾IRI早期血红细胞ROS荧光强度阳性率明显升高,与此同时肾小球足细胞即出现明显的损伤,因此我们推测血红细胞ROS的变化与肾小球足细胞的损伤密切相关,但是血红细胞ROS具体通过何种机制引起足细胞损伤还需进一步研究。
4 结论
本研究结果显示,肾IRI早期足细胞即出现明显的损伤,同时伴有血ROS荧光强度阳性率明显上升;血ROS的变化可能参与了肾IRI足细胞损伤及病理损害的过程。
[1] Zahmatkesh M, Kadkhodaee M, Moosavi SM,etal. Beneficial effects of MnTBAP, a broad-spectrum reactive species scavenger, in rat renal ischemia/reperfusion injury[J]. Clin Exp Nephrol, 2005, 9(3):212-218.
[2] Zaouali MA, Ben Abdennebi H, Padrissa-Altes S,etal. Pharmacolo-Gical strategies against cold ischemia reperfusion injury[J]. Expert Opin Pharmacother, 2010,11(4):537-555.
[3] Sagiroglu T, Sezer A, Torun N,etal. Protective effect of everolimus on renal ischemia reperfusion injury in rats[J]. Saudi J Kidney Dis Transpl, 2014, 25(2):294-302.
[4] Jung HS, Joo JD, Kim DW,etal. Effect of milrinone on the inflammatory response and NF-kB activation in renal ischemia- reperfusion injury in mice[J].Korean J Anesthesiol, 2014, 66(2):136-142.
[5] 艾娜, 谢席胜, 樊均明, 等. 大鼠血红细胞活性氧在肾缺血再灌注损伤中的表达及作用研究[J]. 西部医学,2013,25(2):164-168.
[6] Devarajan P.Update on mechanisms of ischemic acute kidney injury[J].J Am Soc Nephrol, 2006,17(6):1503-1520.
[7] 李俊. TRAIL信号通路在大鼠肾缺血再灌注损伤中介导细胞凋亡及米诺环素干预作用的研究[J].重庆医科大学学报,2007,04(1):1-55.
[8] Andersson M, Nilsson U, Hjalmarsson C,etal. Mild renal ischemia- reperfusion reduces charge and size selectivity of the glomerular barrier[J]. Am J Physiol Renal Physiol, 2007, 292(6):1802-1809.
[9] 王新良, 王新颖, 牟兆新, 等.肾缺血再灌注对大鼠肾小球超微结构及负电荷位点的影响[J]. 河北医科大学学报, 2005,26(5):321-323,358.
Mechanism of podocyte injury of renal ischemia-reperfusion injury in rats
AI Na1,2, XIE Xi-sheng1, WANG Qiang3,etal
(1.DepartmentofNephrology,NanchongCentralHospital,Nanchong637001,Sichuan;2.LuzhouMedicalCollege,Luzhou646000,Sichuan;3.Clinicallaboratory,TheAffiliatedHospitalofNorthSichuanMedicalCollege,Nanchong637001,Sichuan;4.DepartmentofPathology,NanchongCentralHospital,Nanchong637001,Sichuan)
Objective To investigate the changes of podocytes and its mechanism in the rat of renal ischemia-reperfusion injury (IRI).Methods 42 male Sprague-Dawley rats were randomly divided into normal group(n=5), sham group(n=5) and IRI roup(n=32). IRI group is divided into four time points:1 hour, 6 hour, 12 hour and 24 hour. Each time point contained 8 animals. Through blocking bilateral renal blood flow in rats, the IRI model was established. The renal function, the ROS of erythrocyte, the renal pathological damage and podocyte injury were observed. Results We found the obvious podocyte damage phenomenon in the IRI rat model, such as decreased podocyte and foot processes and thick basement. The level of creatinine and blood urea nitrogen (BUN) and the positive rate of ROS fluorescence intensity in erythrocyte were gradually increased with the extension of the time after ischemia-reperfusion injury rats. Tubular could appearing vary degrees of luminal expansion and degeneration and necrosis and interstitial inflammatory cell infiltration and congestion and edema and so on. Correlation analysis found that the positive rate of erythrocyte ROS fluorescence intensity was positively correlated with tubular injury score, creatinine and blood urea nitrogen leve, but negatively correlated with podocyte count. Conclusion The damage of podocytes obvious in the early of IRI, at the same time the blood of ROS is significantly increased. The change of blood ROS may be involved in the process of renal IRI podocyte injury.
Renal ischemia-reperfusion injury; Reactive oxygen species; Podocyte injury
;四川省教育厅科研项目(10ZC027)
谢席胜,E-mail:xishengx@163.com
R 692.3+9
A
10.3969/j.issn.1672-3511.2015.02.004
2014-07-11; 编辑: 张文秀)

