CYP2A6基因多态性与晚期肿瘤患者S-1化疗获益关系的Meta分析
屈 涛, 张弘纲, 崔成旭, 杨 林
(中国医学科学院 肿瘤医院 内科, 北京, 100021)
CYP2A6基因多态性与晚期肿瘤患者S-1化疗获益关系的Meta分析
屈涛, 张弘纲, 崔成旭, 杨林
(中国医学科学院 肿瘤医院 内科, 北京, 100021)
摘要:目的运用系统回顾和Meta分析的方法评价CYP2A6基因多态性与S-1化疗获益的关系。方法检索Pubmed、CNKI、CBM和万方中文数据库,按照纳入和排除标准筛选关于CYP2A6基因与S-1化疗获益相关的病例对照研究或队列研究,检索时限为数据库建库至2014年6月。使用RevMan 5.3和Stata 11.2进行统计分析。结果共纳入7篇文献进入分析,文献质量评价结果显示纳入研究质量良好。一般资料结果显示,在东方人种中,CYP2A6*1/*1(W/W)频率平均为25.6%;CYP2A6*4A,*7,*9,*10存在一种突变(W/V)频率平均为48.8%, CYP2A6*4A,*7,*9,*10存在2种突变(V/V)频率平均为25.6%。Meta分析发现: ① 突变型V/V与野生型W/W及突变型W/V患者的S-1化疗敏感性差异有统计学意义,合并优势比(OR)为0.27 (95%CI: 0.14~0.51); ② 野生型W/W与突变型W/V及V/V生存HR差异有统计学意义,合并HR值为1.71(95% CI: 0.99~2.94)。结论CYP2A6*4A,*7,*9,*10与晚期肿瘤患者S-1化疗获益存在一定关联性。但因为纳入研究的数量有限,需要有大样本、多变量的分析研究来进一步证实和完善本研究结果。 1.3.1文献提取:由2名独立的研究人员根据已经确定的检索流程,对每篇文献的题目和进行审查和评价,对每篇文献的题目和摘要进行审查和评价,确定符合入选标准的文献。最后由第3名独立的研究人员根据纳入及排除标准进行讨论,达成一致后作出最终决定。
关键词:肿瘤; CYP2A6; 单核苷酸多态性; S-1; Meta分析
Correlation between CYP2A6 polymorphisms and
S-1 是由替加氟(FT)、吉美嘧啶(CDHP)及奥替拉西钾(OXO)按1∶0.4∶1(摩尔比值)组成的新一代氟尿嘧啶类口服抗肿瘤药物[1]。作为新型的口服化疗药物,S-1具有药物作用目标明确、不良反应较低、安全性能好、用药方便等优点。其于1999年在日本被批准用来治疗晚期胃癌,在日本有80%以上的晚期胃癌患者使用,有效率可达50%[2]。中国SC-101研究报道了S-1联合顺铂治疗晚期胃癌的中位总生存期为433 d (14.4月),较以前有明显进步[3]。鉴于此,NCCN中国版胃癌指南推荐晚期胃癌一线治疗可采用S1联合顺铂的方案治疗,在辅助治疗方面,增加了单药S-1用于D2术后、Ⅱ期和ⅢA期患者以及年老、体质弱、有较多内科合并症的患者[4]。
S-1主要抗肿瘤成分为替加氟,替加氟进入人体后,主要通过肝脏微粒体的细胞色素P-450酶系的CYP2A6代谢,生成一种不稳定的中间物,5-羟基替加氟。后者进一步转化为氟尿嘧啶(5-Fu),从而发生抗肿瘤活性[5]。近年来,国内外学者针对CYP2A6基因多态性与S-1药物敏感性的关系进行了探索研究。由于该研究往往会受到疾病的异质性、单个研究统计效力的局限性以及不同人群和种族特异性等因素的影响,各研究结果不尽一致。本研究搜集整理有关CYP2A6与S-1治疗有关的文献,进行总结分析,为进一步研究CYP2A6基因多态性与S-1化疗获益的关联提供依据。
1资料与方法
1.1文献检索
以PubMed、CNKI中文数据库、中国生物医学文献数据库(CBM)、万方中文数据库为文献检索的主要来源。英文检索词为:“cancer”“OR”“carcinoma”、“CYP2A6”、“S-1”,检索语种为英文。中文检索词:“肿瘤”或“癌”、“CYP2A6”、“爱斯万”或“替吉奥”。同时人工检索相关文献中参考文献。
1.2选择标准
1.2.1文献纳入标准: ① 原始资料为已经公开发表的文献; ② 研究对象为病理确诊的肿瘤的患者; ③ 研究内容包括CYP2A6基因多态性与S-1化疗敏感性的研究; ④ 疗效的评价标准为RESIST标准,以完全缓解(CR)+部分缓解(PR)为化疗敏感性的评价指标;随访期观察终点为无进展生存期(PFS)或总生存期(OS), 并提供足够的数据以得出风险比(HR)和95%可信区间(CI)。
1.2.2文献排除标准: ① 动物研究或细胞系的研究; ② 非肿瘤患者为对象的研究; ③ 非CYP2A6基因多态性与S-1化疗的研究; ④ 摘要或综述。
1.3文献质量评价
1.3.2文献质量评价:严格按照英国牛津循证医学中心文献评价项目评价纳入病例对照研究的质量。由2位评价员从诊断标准、样本量、分组匹配情况、对照组与病例组间的可比性、基因检测方法、数据完整性6个方面进行评估,如遇分歧通过讨论解决由第三位研究者协助解决。
1.4数据提取
文献录入的主要内容包括: ① 一般资料:包括文献题目、作者、发表时间; ② 研究对象的基本特征,样本量检测方法,临床分期; ③ 提取信息:CYP2A6野生型基因及突变型基因的位点及类型、病例数、各自化疗敏感例数、PFS、HR等。
1.5统计分析
采用合并优势比(OR)和95% CI作为疗效分析的统计量,对异质性检验采用Q检验。若P>0.1、I2<50%,则认为各研究之间具有较好的同质性,采用固定效应模型分析;反之,则应用随机效应模型分析。使用方差倒数法计算合并HR以及95%CI。所有数据均为双侧检验,P<0.05为差异具有统计学意义。运用RevMan 5.3软件和Stata 11.2进行统计学分析。
2结果
2.1文献基本特征
检索到中、英文文献共46篇,按纳入及排除标准进行筛选,共7篇文献[6-12]纳入分析,发表于2008—2012年,具体信息见表1。
2.2文献质量评价
文献质量评价显示,各纳入研究中对肿瘤诊断交代清楚,基因检测方法合理,数据完整,分组匹配良好,组间可比性较好。整体纳入研究的质量良好。

表1 纳入文献基本信息
2.3CYP2A6基因型频率分布
关于CYP2A6基因型频率分析,纳入文献中共有6篇[6-10,12]文献提供充足的基因型统计学信息。文献中报道CYP2A6*4A,*7,*9,*10会导致CY2A6酶活性降低。野生型WW即CYP2A6*1/*1,W/V即CYP2A6*4A,*7,*9,*10存在1种突变;V/V即CYP2A6*4A,*7,*9,*10存在2种突变。表2中,在东方人种中,CYP2A6野生型频率平均为25.6%, 杂合型突变(CYP2A6*4A,*7,*9,*10存在1种突变)频率平均为48.8%,纯合型突变(CYP2A6*4A,*7,*9,*10存在2种突变)频率平均为25.6%。提示CYP2A6效应位点是一个热点突变区域。

表2 基因型频率分布
备注:W/W即CYP2A6*1/*1,W/V即CYP2A6*4A,*7,*9,*10存在1种突变;V/V即CYP2A6*4A,*7,*9,*10存在2种突变
2.4化疗敏感性获益分析
关于CYP2A6突变型与晚期胃肠肿瘤患者S-1化疗敏感性获益的Meta分析,纳入文献中共有3篇文献[8,10,12]提供充分的统计学信息得到OR。对纳入的3篇文献进行异质性检验,结果显示I2值为0%,P值为0.86,结果之间不存在异质性,应用固定效应模型进行合并分析。对于CYP2A6纯和突变型,纯和突变型V/V与杂合突变型W/V及野生型W/W患者的S-1化疗敏感性有显著性差异,合并OR值为0.27(95%CI: 0.14~0.51),见图1。Egger′s检验P=0.444, 提示无显著的发表偏倚存在,表明总体结果可靠。利用漏斗图进行发表偏倚的描述,从图2中可见大样本的研究分布比较集中,呈漏斗型,提示无显著性的发表偏倚存在,表明发表偏倚的可能性较小,纳入总体结果可靠。

图1 纯和突变型V/V与杂合突变型W/V及野生型W/WS-1化疗敏感性分析

图2 敏感性分析漏斗图
2.5化疗生存获益分析
关于CYP2A6突变型与晚期肿瘤患者S-1化疗生存获益的Meta分析,共纳入文献3篇[8,10,12]。对其进行异质性检验,结果显示I2值为61%,P值为0.05,结果之间存在异质性,应用随机效应模型进行合并分析。对于CYP2A6*4A,*7,*9,*10基因多态性,见图3中。野生型W/W与突变型W/V及V/V生存HR有显著性差异,合并HR值为1.71(95%: CI 0.99~2.94)。亚组分析显示野生型W/W与突变型W/V生存HR无显著性差异,合并HR值为1.13(95% CI: 0.74~1.73)。野生型W/W与突变型V/V生存HR有显著性差异,合并HR值为2.77(95% CI: 1.32~5.81)。Egger's检验P=0.350,提示无显著的发表偏倚存在,总体结果可靠。
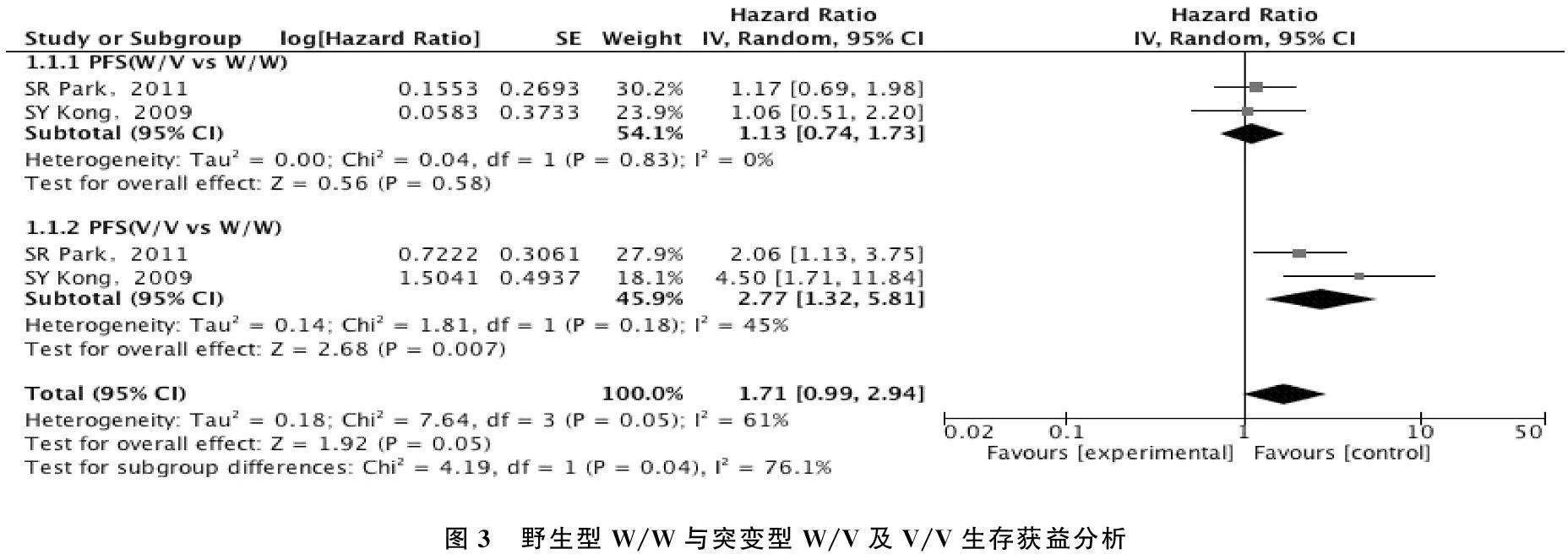
图3 野生型W/W与突变型W/V及V/V生存获益分析
3讨论
随着人们对药物基因组学的深刻了解,临床个体化用药已经成为治疗肿瘤的策略,越来越受到人们的关注。个体与种族之间药物的代谢存在很大差异,这些差异可能引起个体对药物的效应、毒性和耐药程度的不同。合理用药的核心便是根据个体变异与药效差异的关系设计临床个体化用药方案,以充分发挥药物对机体的作用,这样不仅可以增加首剂处方的有效性,还减少了患者的毒副作用。
S-1主要抗肿瘤成分为替加氟,替加氟进入人体后,主要通过肝脏微粒体的细胞色素P-450酶系的CYP2A6代谢,生成一种不稳定的中间物,5-羟基替加氟。后者进一步转化为氟尿嘧啶(5-Fu),从而发生抗肿瘤活性[5]。研究发现,CYP2A6含有多种等位基因突变型,影响CYP2A6酶的表达与活性,是导致个体间替加氟代谢差异的主要原因。CYP2A6是CYP2A亚家族重要成员之一,是主要的药物代谢I相酶,大约代谢3%的临床药物(n>30),约占整个P450酶系统的5%,位于6号常染色体上,长度为1763bp, 具有高度的遗传多态性,目前已经发现了30余种等位基因[13-15]。
Fujita等[6]在54个接受S-1日本患者中研究替加氟与5-Fu的代谢动力学,结果发现携带CYP2A6*4A,*7和*9的患者催化活性丧失或减少。Fang等[7]在中国77个消化道肿瘤患者中研究基因多态性对S-1代谢的影响,研究发现了CYP2A6*1A,CYP2A6*1B和CYP2A6*4C突变体,突变频率分别为62%,42%和13%,含有CYP2A6*4C患者S-1的治疗效果降低。Park等[8]在108个韩国晚期胃癌患者中发现,携带CYP2A6(*4,*7,*9,*10)野生型的患者具有更高的缓解率,并且生存时间延长。由于样本量限制、不同研究采用S-1联合治疗方案的不同,导致上述临床研究,得出与S-1代谢活性相关的结论有所不同。但是可以肯定的是,CYP2A6的基因多态性与替加氟的体内代谢密切相关,研究CYP2A6的基因多态性对替加氟代谢清除率的影响对于替加氟的代谢研究及临床用药至关重要。
本研究共纳入相关文献7篇[6-12],异质性分析提示研究间不存在异质性。结果显示,在东方人种中,CYP2A6野生型W/W频率平均为25.6%, 杂合型突变W/V(CYP2A6*4A,*7,*9,*10存在1种突变)频率平均为48.8%, 纯合型突变V/V(CYP2A6*4A,*7,*9,*10存在2种突变)频率平均为25.6%。提示CYP2A6效应位点是一个热点突变区域。纳入文献中有3篇文献[8,10,12]可纳入缓解率分析和生存获益分析。对于CYP2A6纯和突变型,纯和突变型V/V与杂合突变型W/V及野生型W/W患者的S-1化疗敏感性差异有统计学意义,合并OR值为0.27(95%CI: 0.14~0.51)。生存获益分析显示,野生型W/W与突变型W/V及V/V生存HR有显著性差异,合并HR值为1.71(95%CI: 0.99~2.94)。而亚组分析显示野生型W/W与突变型W/V生存HR无显著性差异,合并HR值为1.13(95%CI: 0.74~1.73)。野生型W/W与突变型V/V生存HR有显著性差异,合并HR值为2.77(95%CI: 1.32~5.81)。
Meta分析能够系统客观地综合评价多个研究结果,提高了检验效能,但本研究仍然存在一些局限性。首先,由于数据不完整或者未能获得完整资料而排除的文献,不能排除发生研究内偏倚的可能。其次,不同癌肿、不同联合方案对S-1化疗获益不同,可能导致选择偏倚的发生。最后,晚期肿瘤患者对S-1化疗反应效果受到诸多因素的影响,其生存结果更是受种族、年龄、性别、环境等潜在因素影响,这些因素的不可控也影响了研究的结果。因此还需要有大样本、多变量的分析研究来进一步证实和完善本研究结果。
参考文献
[1]Fukushima M, Satake H, Uchida J, et al. Preclinical antitumor efficacy of S-1: a new oral formulation of 5-fluorouracil on human tumor xenografts[J].Int J Oncol, 1998, 13(4): 693.
[2]Koizumi W, Kurihara M, Nakano S, et al. Phase II study of S-1, a novel oral derivative of 5-fluorouracil, in advanced gastric cancer[J].Oncology, 2000, 58(3): 191.
[3]Jin M, Lu H, Li J, et al. Randomized 3-armed phase III study of S-1 monotherapy versus S-1/CDDP (SP) versus 5-FU/CDDP (FP) in patients (pts) with advanced gastric cancer (AGC): SC-101 study[J].J Clin Oncol, 2008, 26(Suppl 15): 4533.
[4]National Comprehensive Cancer Network. NCCN 胃癌临床实践指南 (中国版)[E/OL][J]. http://www.nccnchina.org/nccn-guidelines-china.aspx
[5]El Sayed Y M, Sadée W. Metabolic activation of ftorafur [R, S-1-(tetrahydro-2-furanyl)-5-fluorouracil]: the microsomal oxidative pathway[J].Biochemical Pharmacology, 1982, 31(18): 3006.
[6]Fujita K, Yamamoto W, Endo S, et al. CYP2A6 and the plasma level of 5‐chloro‐2, 4‐dihydroxypyridine are determinants of the pharmacokinetic variability of tegafur and 5‐fluorouracil, respectively, in Japanese patients with cancer given S‐1[J].Cancer Sci, 2008, 99(5): 1049.
[7]Fang W J, Mou H B, Jin D Z, et al. Characteristic CYP2A6 genetic polymorphisms detected by TA cloning-based sequencing in Chinese digestive system cancer patients with S-1 based chemotherapy[J].Oncology Reports, 2012, 27(5): 1606.
[8]Park S R, Kong S Y, Nam B H, et al. CYP2A6 and ERCC1 polymorphisms correlate with efficacy of S-1 plus cisplatin in metastatic gastric cancer patients[J].Br J Cancer, 2011, 104(7): 1126.
[9]Hirose T, Fujita K I, Nishimura K, et al. Pharmacokinetics of S-1 and CYP2A6 genotype in Japanese patients with advanced cancer[J].Oncology Reports, 2010, 24(2): 529.
[10]Hong J, Han S W, Ham H S, et al. Phase Ⅱ study of biweekly S-1 and oxaliplatin combination chemotherapy in metastatic colorectal cancer and pharmacogenetic analysis[J]. Cancer Chemother Pharmacol, 2011, 67(6): 1323.
[11]Kim K P, Jang G, Hong Y S, et al. Phase II study of S-1 combined with oxaliplatin as therapy for patients with metastatic biliary tract cancer: influence of the CYP2A6 polymorphism on pharmacokinetics and clinical activity[J].Br J Cancer, 2011, 104(4): 605.
[12]Kong S Y, Lim H S, Nam B H, et al. Association of CYP2A6 polymorphisms with S-1 plus docetaxel therapy outcomes in metastatic gastric cancer[J]. Pharmacogenomics, 2009, 10(7): 1147.
[13]Oscarson M, McLellan R A, Gullstén H, et al. Characterisation and PCR-based detection of a CYP2A6 gene deletion found at a high frequency in a Chinese population [J]. FEBS letters, 1999, 448(1): 105.
[14]Johansson I, Ingelman-Sundberg M. Genetic polymorphism and toxicology-with emphasis on cytochrome p450[J]. Toxicological Sci, 2010, 120(1): 1.
[15]Tiong K H, Yiap B C, Tan E L, et al. Functional characterization of cytochrome P450 2A6 allelic variants CYP2A6*15, CYP2A6*16, CYP2A6*21, and CYP2A6*22[J]. Drug Metab Dispos, 2010, 38(5): 745.
clinical outcome of S-1-based chemotherapy in
patients with advanced cancer: A meta-analysis
QU Tao, ZHANG Honggang, CUI Chengxu, YANG Lin
(DepartmentofInternalMedicine,CancerInstitute&HospitalofChineseAcademyof
MedicalSciences,Beijing, 100021)
ABSTRACT:ObjectiveTo evaluate the correlation between CYP2A6 polymorphisms and the clinical outcome of S-1 based chemotherapy in patients with advanced cancer by meta-analysis and systematic review. MethodsAccording to the inclusion and exclusion criteria, the cases for evaluation of the correlation between CYP2A6 polymorphisms and the clinical outcome of S-1 based chemotherapy were strictly selected, retrieving database dated to June 2014 via searching database including Pubmed, CNKI, CBM and Wanfang Database. RevMan 5.3 and Stata 11.2 softwares were used for statistical analysis. ResultsA total of 7 qualified studies were included for meta-analysis. Patients who carried*1/*7,*1/*9, or*1/*10 were assigned to a wild-type/ variant (W/V) group and those who carried two variant alleles were assigned to a variant/variant (V/V) group, While CYP2A6*4, CYP2A6*7, CYP2A6*9, and CYP2A6*10 were classified as variant alleles. The results showed that the mean frequencies of genotypes in Eastern population were as follows: W/W (25.6%), W/V (48.8%) and V/V (26.6%). The result of meta-analysis indicated that there was a correlation between CYP2A6*4A,*7,*9,*10 and the clinical outcome of S-1 based chemotherapy in patients with advanced cancer, the OR values for the V/V group compared with the W/W and the W/V group was 0.27(95%CI: 0.14~0.51), and the HR of death in the patients was 1.71(95% CI: 0.99~2.94).ConclusionThe result of meta-analysis suggests that there was a correlation between CYP2A6*4A,*7,*9,*10 and the clinical outcome of S-1 based chemotherapy in patients with advanced cancer. Further studies with large sample and multiple variables are needed to validate the conclusion.
KEYWORDS:cancer; CYP2A6; single nucleotide polymorphism; S-1; meta-analysis
通信作者:杨林, E-mail: lyang69@sina.com.cn
基金项目:中国高校医学期刊临床专项资金(11321382)
收稿日期:2014-11-13
中图分类号:R 73
文献标志码:A
文章编号:1672-2353(2015)03-015-05
DOI:10.7619/jcmp.201503004

