ox-LDL检测在糖尿病肾病患者中的价值
许红兰, 万美燕, 夏 平, 邹作君
(山东省青岛市市立医院 肾内科, 山东 青岛, 266000)
ox-LDL检测在糖尿病肾病患者中的价值
许红兰, 万美燕, 夏平, 邹作君
(山东省青岛市市立医院 肾内科, 山东 青岛, 266000)
摘要:目的探讨ox-LDL检测在2型糖尿病肾病患者中的价值。方法将90例糖尿病肾病患者分为正常蛋白尿组、微量蛋白尿组和大量蛋白尿组。另选取20例健康者作为正常对照组。检测血ox-LDL浓度、尿微量白蛋白、尿8-OHdG、N-乙酰-β-氨基葡萄糖苷酶(NAG)等指标。结果糖尿病组血ox-LDL水平显著高于正常对照组(P<0.01); 大量蛋白尿组的血ox-LDL水平明显高于微量蛋白尿组及正常蛋白尿组( P<0.01)。糖尿病肾病患者血ox-LDL水平与总胆固醇、低密度脂蛋白、甘油三酯及脉压差呈正相关,与BMI及HDL-C呈负相关。ox-LDL水平与尿微量白蛋白、尿8-OHdG、NAG、α2-MG、FDP呈显著正相关。结论糖尿病肾病患者随着蛋白尿的增多其脂质的氧化应激水平增强,且脂质氧化应激作为重要因素参与糖尿病肾病的发生与发展。
关键词:糖尿病肾病; 氧化应激; ox-LDL; 尿8-OHdG
糖尿病肾病是终末期肾脏病变的一个重要病因。氧化应激是糖尿病肾病发展的重要病理生理机制之一[1-2], 2型糖尿病患者早期肾脏病变与炎症、氧化应激的关系密切[3]。2型糖尿病患者除血糖代谢异常外,还伴有一系列的脂代谢紊乱。糖尿病时脂蛋白脂肪酶活性低下,以小而密的低密度脂蛋白胆固醇(LDL-C)升高为主,并在高糖的作用下易被糖基化,容易被氧化成为氧化修饰低密度脂蛋白(ox-LDL)。ox-LDL系沉积在血管壁中的LDL-C, 在细胞、金属离子等因子的作用下,发生氧化修饰而形成。其理化性质和生物学特性与正常LDL-C具有很大区别,具有很强的细胞毒性,可作为DN早期较敏感的诊断指标[4]。本研究通过检测糖尿病肾病患者血中ox-LDL, 评价2型糖尿病肾病患者脂质异常与氧化应激的关系,现报告如下。
1资料与方法
1.1一般资料
将2007年6月—2008年6月在青岛市市立医院肾内科就诊的2型糖尿病患者90例设为糖尿病组,均符合1999年WHO诊断与分型标准,空腹血糖≥7.0 mmol/L, 或症状+随机血糖≥11.1 mmol/L, 或口服葡萄糖耐量实验(OGTT)餐后2 h血糖≥11.1 mmol/L的2型糖尿病患者纳入本研究。正常对照组20例来自本院健康体检中心。记录患者的临床情况及实验室检查资料。采集受检者清晨空腹静脉血5 mL, 离心取血浆后-40 ℃贮存备用,并留取尿标本。排除1型糖尿病、糖尿病急性代谢并发症及可影响尿白蛋白排泄的疾病如创伤、发热、重度心功能不全、泌尿道感染或其他原因所致的肾脏疾病者,病情稳定。
1.2实验室检查
按照尿蛋白排泄率(uAER)诊断标准将所有糖尿病患者分为3组: uAER<20 μg/min(或<30 mg/24 h)为正常蛋白尿组; UAER 20~200 μg/min (30~300 mg/24 h)为微量白蛋白尿组; UAER>200 μg/min (>300 mg/24 h)为大量白蛋白尿组。各组一般资料见表1。所有糖尿病患者及健康对照组均检测血总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、血清肌酐(SCr)、血尿素氮(BUN)、血糖等血生化指标,检测尿微量白蛋白(mALB)、N-乙酰-β-氨基葡萄糖苷酶(NAG)、尿α2-巨球蛋白(α2-MG)、2-微球蛋白(2-MG)、纤维蛋白原(FDP)浓度。尿标本置于-40 ℃冰箱中待测8-羟脱氧鸟苷(8-OHdG)。ox-LDL与8-OHdG测定采用酶联免疫吸附测定(ELISA)法。ox-LDL-C与8-OHdG试剂盒购自美国Trevigen公司,按说明书操作。于清晨空腹采集肘静脉血, 1 h内2 400×g离心5 min, 取1 mL血清置于-20 ℃保存用于ox-LDL检测,尿中8-OHdG浓度用尿肌酐来补正。通过以ox-LDL为因变量,以年龄、病程、收缩压、舒张压、脉压差、总胆固醇(T-CHOL)、LDL-C、BMI、肌酐(CREA)、表皮生长因子受体(eGFR)、8-OHdG、mALB、α2-MG、FDP、视黄醇结合蛋白(RBP)、β2-MG、NAG为自变量进行简单线性相关分析,探讨影响糖尿病患者脂质代谢异常与氧化应激的相关性。

表1 各组一般资料比较
与微量蛋白尿组比较, **P<0.01; 与正常蛋白尿组比较, #P<0.05, ##P<0.01。
2结果
糖尿病组的血ox-LDL水平为(14.0±0.6) μg/dL, 高于正常对照组(7.5±0.2) μg/dL, 差异有统计学意义(P<0.01) ; 糖尿病肾病3组间比较,大量蛋白尿组的血ox-LDL水平明显高于微量蛋白尿组及正常蛋白尿组(P<0.05或P<0.01), 微量蛋白尿组与正常蛋白尿组之间的血ox-LDL水平无显著差异(P>0.05)。正常蛋白尿组患者血ox-LDL水平高于健康对照组,差异有统计学意义(P<0.01)。肾小球源性蛋白尿mALB, α2-MG, FDP在微量蛋白尿组和大量蛋白尿组显著高于正常蛋白尿组(P<0.01), 肾小管源性蛋白尿RBP, β2-MG, NAG在大量蛋白尿组显著高于正常蛋白尿组(P<0.01), 见表2。糖尿病肾病患者血ox-LDL水平与总胆固醇(r=0.423,P<0.01)、低密度脂蛋白(r=0.419,P<0.01)、甘油三酯(r=0.288,P<0.01)及脉压差(r=0.287,P<0.05)呈正相关,与BMI(r=-0.252,P<0.05)及HDL-C(r=-0.269,P<0.05)呈负相关。见表3。ox-LDL水平与尿微量白蛋白(r=0.329,P<0.01)、尿8-OHdG(r=0.252,P<0.05)、NAG(r=0.378,P<0.01)、α2-MG(r=0.315,P<0.01)、FDP(r=0.293,P<0.05)呈显著正相关。见表4。

表2 各组8-OHdG与尿蛋白分析指标比较
与微量蛋白尿组,*P<0.05,**P<0.01; 与正常蛋白尿组比较,#P<0.05,##P<0.01。

表3 90例糖尿病肾病患者血ox-LDL水平与
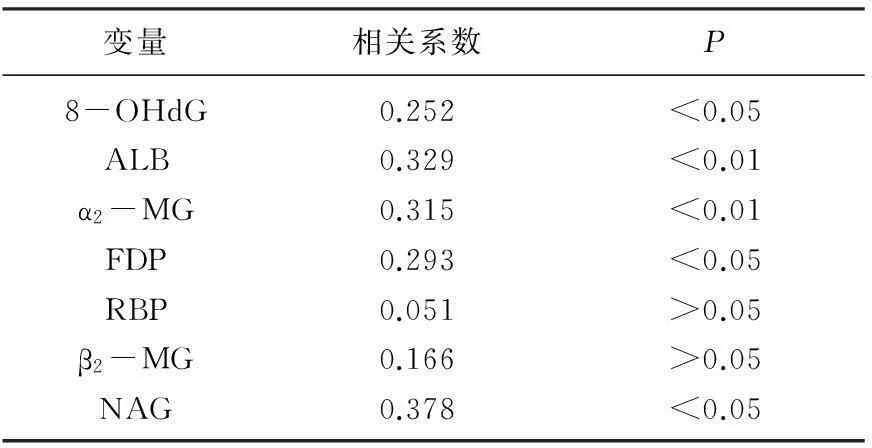
表4 90例糖尿病肾病患者血ox-LDL水平与肾小球源性
3讨论
LDL-C被氧化修饰后,不仅生物活性发生了改变,而且免疫原性也发生了改变,在机体内产生一系列病理、生理反应。它在糖尿病及慢性并发症的发生、发展中扮演了重要角色。本研究发现糖尿病患者血ox-LDL水平显著高于正常对照组,在正常蛋白尿的2型糖尿病患者中,其ox-LDL水平也显著高于非糖尿病的正常对照组。随着蛋白尿的增多,其水平升高,说明ox-LDL贯穿于糖尿病肾病发生、发展的整个过程。因此ox-LDL可作为糖尿病肾病早期的较敏感的诊断指标。糖尿病患者氧化应激水平增高,在应激状态下线粒体产生大量的超氧阴离子,糖基化的LDL-C在超氧阴离子的作用下更容易被氧化修饰成ox-LDL。2型糖尿病患者的ox- LDL水平高于正常对照组,提示糖尿病患者体内LDL-C氧化能力普遍增强,且LDL-C氧化后形成的ox-LDL极易导致微血管病变。
糖尿病肾病患者中ox-LDL升高的原因可能为: ① 糖尿病患者体内代谢紊乱,导致抗氧化物质消耗过多; ② 糖尿病患者血液中活化的单核细胞能增加超氧化物量; ③ 糖基化胶原可促进体内脂质的过氧化。研究中发现,ox-LDL水平与线粒体DNA氧化损伤的主要标记物8-OHdG正相关,且与尿微量白蛋白尿呈正相关,与尿α2-MG、NAG、FDP也呈正相关,与BMI与HDL-C呈负相关。糖尿病肾病患者由于糖的分解受阻,又导致脂肪组织的分解代谢增强,致使血浆内游离脂肪酸水平明显增高,进而刺激肝脏合成大量的LDL-C。糖尿病的高胰岛素血症亦可致脂质代谢障碍,产生高脂血症。游离脂肪酸水平升高可直接导致内皮细胞损伤、功能异常、随着糖尿病病程的延长,微血管循环障碍[5]、缺血缺氧加重,内皮损伤加重,尿蛋白也随之增加。脂质的过氧化反应尤其是ox-LDL是动脉硬化的重要原因之一[6]。通常LDL不会被巨核细胞吞噬,但是氧化LDL却被巨核细胞吞噬后形成动脉粥样斑块构成物泡沫细胞[7],并滞留于血管壁上,促进了早期肾小球损
伤[8]。不仅如此还促进单核、淋巴细胞的游走,分化,促使血管平滑肌细胞的增殖,并作用于内皮细胞,引起内皮功能障碍[9]。本研究结果显示,ox-LDL与8-OHdG存在正相关。有研究[10]表明,脂质异常症患者中血清抗氧化LDL自身抗体水平与LDL-C无相关性,但与8-OHdG相关,说明在脂质异常患者中氧化应激可引起DNA损伤。
参考文献
[1]Elmarakby A A, Sullivan J C. Relationship between oxidative stress and inflammatory cytokines in diabetic nephropathy[J]. CardiovascTher, 2012, 30: 49.
[2]Moresco R N, Sangoi M B, De Carvalho J A, et al. Diabetic nephropathy:Traditional to proteomic markers[J]. Clin Chim Acta, 2013, 31: 23.
[3]Pan H, Zhang L,Guo M, et al. The oxidative stress status in diabetes mellitus and diabetic nephropathy[J]. ActaDiabetol, 2009, 47(Suppl 1): 71.
[4]Lee H S, Song C Y. Oxidized low-density lipoprotein and oxidative stree in the development of glomeruloscherosis[J]. AmNephrol, 2009, 29: 62.
[5]Devaraj S, Jialal I. Low-density lipoprotein postsecretory modification, monocyte function, and circulating adhesion molecules in type 2 diabetic patients with and without macrovascular complications: the effect of alpha-tocopherol supplementation[J]. Circulation, 2000, 102(2): 191.
[6]Steinberg D. Low density lipoprotein oxidation and itspathological significance[J]. J BiolChem, 1997, 272: 20963.
[7]Lee H Y, Oh E, Kim S D, et al. Oxidized low-density lipoprotein-induced foam cell formation is mediated by formyl peptide receptor 2[J]. BiochemBiophys Res Commun, 2014, 443(3): 1003.
[8]Okamura D M, López-Guisa J M, Koelsch K, et al. Atherogenic scavenger receptor modulation in the tubulointerstitium in response to chronic renal injury[J]. Am J Physiol Renal Physiol, 2007, 293(2): F575.
[9]Quinn M T, Parthasarathy S, Fong L G, et al. Oxidativelymodified low density lipoproteins: a potential rolein recruitment and retention of monocyte/macrophages duringatherosclerosis[J]. ProcNatlAcadSci, 1987, 84: 2995.
[10]Inoue T, Inoue K, Maeda H, et al. Immunological response to oxidized LDL occurs in association with oxidative DNA damage independently of serum LDL concentrations in dyslipidemic patients[J]. Clin Chim Acta, 2001, 305: 115.
Clinical value of serum ox-LDL detection in
patients with diabetic nephropathy
XU Honglan, WAN Meiyan, XIA Ping, ZOU Zuojun
(DepartmentofNephrology,QingdaoMunicipalHospital,Qingdao,Shandong, 266000)
ABSTRACT:ObjectiveTo investigate the value of serum ox-LDL detection in patients with diabetic nephropathy (DN). MethodsA total of 90 DN patients were divided into normal proteinuria group, micro proteinuria group and large amount proteinuria group. Twenty healthy people were selected as control group. The indicators of serum ox-LDL concentration, microalbuminuria, urinary 8-OHdG and NAG were measured. ResultsThe level of serum ox-LDL in DN patients were significantly higher than that of the control group (P<0.01). The level of ox-LDL in the large amount proteinuria group was significantly higher than that of normal proteinuria group and micro proteinuria group (P<0.01). The level of serum ox-LDL was positively correlated with total cho1esterol, triglyceride and low-density 1ipoprotein as well as pulse pressure, but was negatively correlated with BMI and HDL-C. The level of serum ox-LDL was positively correlated with the urinary albumin and urine 8-OHdG, NAG, α2-MG and FDP. ConclusionThe lipid oxidative stress increases significantly with the enhancement of proteinuria in DN patients, and it is correlated with the development and progression of DN.
KEYWORDS:diabetic nephropathy; oxidative stress; ox-LDL; 8-OHdG
通信作者:万美燕
收稿日期:2014-11-20
中图分类号:R 587.2
文献标志码:A
文章编号:1672-2353(2015)03-047-03
DOI:10.7619/jcmp.201503013

