CMIA、FPIA、MEIA与EMIT测定血药浓度的比较分析*
朱婷婷,储小曼,赵宇蕾,芮建中,周国华
南京军区南京总医院药理科,南京 210002
CMIA、FPIA、MEIA与EMIT测定血药浓度的比较分析*
朱婷婷,储小曼,赵宇蕾,芮建中**,周国华
南京军区南京总医院药理科,南京 210002
目的:分析比较化学发光微粒子免疫分析法 (CMIA)、荧光偏振免疫分析法(FPIA)、微粒子捕捉免疫分析法(MEIA)和酶扩大免疫分析法(EMIT)测定血清丙戊酸(VPA)、全血环孢霉素A(CsA)、血清卡马西平(CBZ)和血清地高辛(DIG)浓度的一致性。方法:通过测定高、中、低浓度质控样品,评价各方法的准确度及精密度,并对临床患者的VPA、CsA、CBZ和DIG样本进行测定,比较4种方法测定结果的相关性。结果:CMIA与EMIT(测定值为函数Y)比较,测定VPA的结果具有良好的相关性和差异性,YEMIT=1.172XCMIA+0.227(r=0.97),EMIT的测定结果比CMIA平均高17.49%。FPIA与EMIT比较,测定结果具有良好的相关性:VPA,YEMIT= 1.259XFPIA-4.671(r=0.97);CsA,YEMIT=0.832XFPIA+17.63(r=0.97);CBZ,YEMIT=1.156XFPIA-2.657(r= 0.98);MEIA与EMIT比较,测定结果有相关性:DIG,YEMIT=0.634XMEIA+0.018(r=0.91);其中CsA的EMIT测定结果比FPIA平均低2.08%,DIG的EMIT测定结果比MEIA平均低35.91%,而VPA的EMIT测定结果比FPIA平均高16.83%、CBZ的EMIT测定结果比FPIA平均高3.07%。结论:CMIA测定VPA血药浓度、FPIA测定VPA、CsA、CBZ及MEIA测定DIG血药浓度与EMIT的测定结果,存在差异性(P<0.05),临床应用中应予以关注并作相应调整。
化学发光微粒子免疫分析法;荧光偏振免疫分析法;微粒子捕捉免疫分析法;酶扩大免疫分析法;治疗药物监测
环孢霉素A(cyclosporine A,CsA)是临床常用的免疫抑制剂,广泛用于器官移植中的抗排斥反应,具有免疫抑制和抗真菌活性,用于人体器官移植手术和自身免疫疾病的治疗[1];丙戊酸(valproate,VPA)是一种广谱抗癫痫药物,是儿童多种癫痫发作类型的首选药物,对各型小发作、肌阵挛性发作、局限性发作、大发作和混合型癫痫均有效[2];卡马西平(carbamazepine,CBZ)又称酰胺咪嗪,属三环类抗惊厥药,作为一线抗癫痫药,首选用于治疗继发性癫痫,包括部分性和全身性发作[3];地高辛(digoxin,DIG)为中效强心苷类药,在治疗伴室上性快速心律失常的中、重度心力衰竭方面常为首选,临床上主要用于治疗充血性心力衰竭、心律失常等慢性心功能不全患者[4]。这4种药物治疗作用与毒性和血药浓度密切相关,由于生物利用度和药代动力学的个体差异大,因此,需要对上述药物进行常规血药浓度监测,以提高临床疗效和减少不良反应[5]。
治疗药物监测 (Therapeutic Drug Monitoring,TDM)常用的检测方法包括色谱法、质谱法和免疫学方法,其中临床上使用较多的是高效液相色谱法(HPLC)、化学发光微粒子免疫分析法(CMIA)[6]、荧光偏振免疫分析法(FPIA)、微粒子捕捉免疫分析法(MEIA)、酶扩大免疫分析法(EMIT)。受不同测定原理的影响,同一份样品采用不同的方法检测,其测定结果会有较大差异。本研究分别用i1000SR、AxSYM、VIVA-E等血药浓度分析仪测定 VPA、CsA、CBZ、DIG的血药浓度,并对测定结果间的差异和相关性进行评价,以利临床正确解读检测数据,从而合理调整患者用药剂量,制定个体化给药方案[7]。
1 仪器与材料
1.1 仪器
雅培Architect系统i1000SR型、AxSYM型血药浓度分析仪 (美国Abbott公司);VIVA-E血药浓度分析仪(西门子Dade Berhring公司);微型涡旋混合仪(上海沪西仪器分析厂);Eppendorf Centrifugal 5810低速离心机;Sigma高速离心机。
1.2 试剂
美国Abbott公司i1000SR VPA试剂盒 (批号为31081LP18),定标品(批号为35085LP20),血清复合质控品(批号为40811、40812、40813);美国Abbott公司AxSYM型CsA、VPA、CBZ、DIG试剂盒(批号分别为36192UI00、17325M500、32277UI00、16256M500),定标品(批号分别为28159UI01、8381M500、22627M500、15474M500),质控品 (批号分别为18272JN00、18437M500、13355M500、18467M500);西门子Dade Berhring公司VIVA-E的CsA、VPA、CBZ、DIG试剂盒(批号分别为6R079UL-F1、4G019UL-F3、4F019UL-E3、4H019UL-E1),定标品(批号分别为6R119UL-E3、4G109UL-F2、4F109UL-E2、4H209UL-E4);血清复合质控品(批号为57311、57312、57313);全血复合质控品(批号为12841、12842、12843)。
1.3 病例
患者样本来自我院血液科、儿科及肾脏科服用CsA患者的常规监测全血样本50例;神经内科、神经外科服用VPA患者的血清样本45例、服用CBZ患者的血清样本48例;呼吸内科、心血管内科服用DIG患者的血清样本20例。
1.4 标本采集
早晨服药前采血1~2 mL,CsA全血样本置于EDTA-K2抗凝管中;VPA、CBZ、DIG样本置于普通管中静置,取血清备检。
2 方法与结果
2.1 测试原理
2.1.1 CMIA (A)抗原/抗体包被的微粒子:采用类磁颗粒,增加了反应的表面积,提高了反应的灵敏度,缩短了反应的时间,应用磁力吸附分离,彻底冲洗干净,提高了反应的特异性。(B)标记抗体:采用专利技术的吖啶类(N-磺酰基)羧基氨基化合物作为标记物,由于其分子结构特性和增加的光子量,使得其在非竞争免疫分析模式中有极好的测试灵敏度和极宽的线性范围;更主要的是,此复合物所结合的特色硫磺丙烷基,提供了极佳的水溶性,使得背景噪音极大降低,从而检测灵敏度值大大提高。(C)基质液:采用H2O2作为预激发液,将吖啶酯从反应复合物中脱离下来,采用NaOH作为激发液,吖啶酯在过氧化物和碱性溶液中发生氧化反应,引起化学发光反应的发生。N-甲基吖啶酮形成并释放能量(光发射),并返回到基态。
2.1.2 FPIA 以抗原抗体竞争结合反应为原理,通过测定荧光偏振度的变化来确定药物浓度。在分析系统内,除待测药物外,还加入带有荧光标记的药物(小分子)与相应的抗体(大分子)进行竞争结合。通过竞争反应,大部分药物与抗体结合,带荧光素标记的药物多呈游离的小分子状态,所测试的荧光偏振程度较低;相反,待测药物浓度低时,大部分带荧光标记的药物与抗体形成抗原-抗体分子复合物,使所检测的荧光偏振程度高。
2.1.3 MEIA 一般在反应的第一阶段,标本与微粒子以一定比例混合,标本中被检物质与微粒子上包被的抗体进行一定时间的反应。第一反应阶段终了后,反应液的一部分被移到玻璃纤维上,洗去未反应的被检物质与其它的杂质成份;反应的第二阶段终了后,为了将未反应的第二抗体除去,再一次进行冲洗;反应的第三阶段,加入基质液(MUP),基质液被碱性磷酸酶所分解生成甲基伞形酮。当该生成物受荧光照射后就产生了荧光。
2.1.4 EMIT 药物与经葡萄糖-6-磷酸脱氢酶(G6PDH)酶标的该药物竞争抗体结合位点,与抗体结合后,酶活性降低,可根据酶的活性来确定样本中的药物的浓度。有活性的酶可以将氧化型烟酰胺腺嘌呤二核苷酸(NAD)转化成还原型烟酰胺腺嘌呤二核苷酸,从而造成了吸光度的改变,用分光光度法进行检测。
2.2 样本处理
2.2.1 CMIA 血清样本 (VPA):4000 r·min-1离心10 min,离心后上机待测。
2.2.2 EMIT 全血CsA样本:精密吸取混匀血样100 μL至1.5 mL具塞离心管中,加入300 μL样本预处理液;涡旋振荡10 s,13000 r·min-1离心5 min,取上清液至样品管,上机待测。血清样本(VPA、CBZ和DIG):4000 r·min-1离心10 min,离心取血清200 μL上机测定。
2.2.3 FPIA 全血CsA样本:精密吸取混匀血样150 μL至1.5 mL具塞离心管中,依次加入50 μL细胞溶解剂、300 μL蛋白沉淀剂,涡旋振荡10 s,13000 r·min-1离心5 min,取上清液至样品杯,上机待测。血清样本(VPA和CBZ):4000 r·min-1离心10 min,离心后取血清200 μL上机测定。
2.2.4 MEIA 血清样本 (DIG):4000 r·min-1离心10 min,离心后取血清200 μL上机测定。
2.3 标准曲线及质控结果
2.3.1 CMIA 血清样本(VPA):取6份血清定标样品(线性范围:20~150 μg·mL-1),3水平值血清质控样品,按“2.2.1”项下处理后上机测定,自动生成标准曲线,样本测定时随行质控,质控测定结果的RSD符合方法学测定要求,结果见表1。
2.3.2 EMIT 血清样本(VPA、CBZ和DIG):取6份血清定标样品 (VPA、CBZ和DIG线性范围分别为:0~150 μg·mL-1、2~20 μg·mL-1、0.2~5 ng·mL-1),3水平值血清质控样品。按“2.2.2”项下处理后上机测定,自动生成标准曲线,样本测定时随行质控,质控测定结果的RSD符合方法学测定要求,结果见表1、表2、表3。

表1 血清VPA样本CMIA、FPIA与EMIT测定的随行质控结果(n=10)
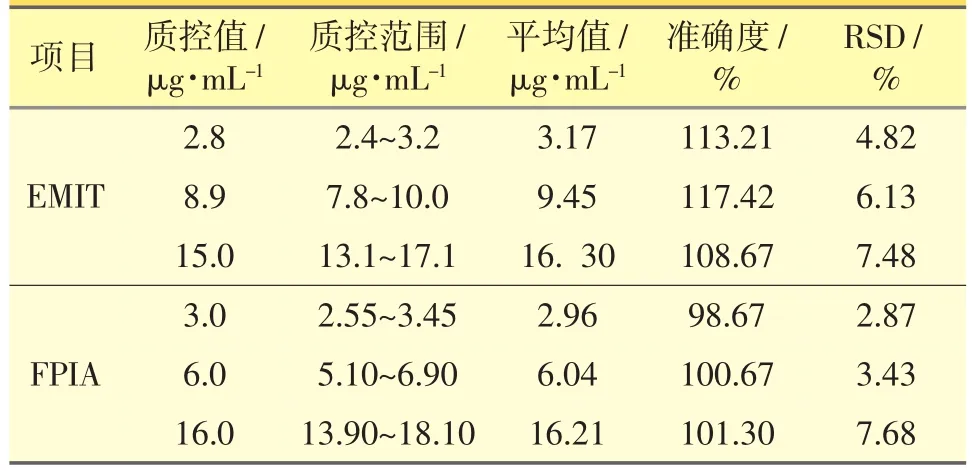
表2 血清CBZ样本FPIA与EMIT测定的随行质控结果(n=10)

表3 血清DIG样本MEIA与EMIT测定的随行质控结果(n=10)
全血CsA样本:取6份全血定标样品(线性范围:40~500 ng·mL-1),3水平值全血质控样品,按“2.2.2”项下处理后上机测定,自动生成标准曲线,样本测定时随行质控,质控测定结果的RSD符合方法学测定要求,结果见表4。
2.3.3 FPIA 全血CsA样本:取6份全血定标样品(线性范围:25~800 ng·mL-1),3份质控全血。按“2.2.3”项下方法处理后上机测定,自动生成标准曲线,每批次样本随行质控,质控测定结果的RSD符合方法学测定要求,结果见表4。
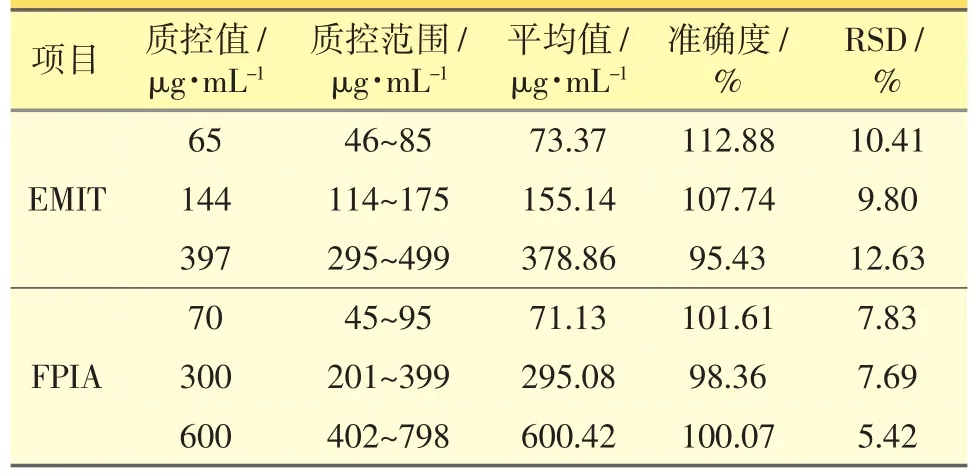
表4 全血CsA样本FPIA与EMIT测定的随行质控结果(n=10)
血清样本(VPA和CBZ):取6份血清定标样品(VPA和CBZ线性范围分别为:0.7~150 μg·mL-1、0.5~20 μg·mL-1),3水平值血清质控样品,按“2.2.3”项下处理后上机测定,自动生成标准曲线,样本测定时随行质控,质控测定结果的RSD符合方法学测定要求,结果见表1、表2。
2.3.4 MEIA 血清样本(DIG):取6份血清定标样品(DIG线性范围:0.3~4 ng·mL-1),3水平值血清质控样品,按“2.2.4”项下处理后上机测定,自动生成标准曲线,样本测定时随行质控,质控测定结果的RSD符合方法学测定要求,结果见表3。
2.4 样本测定的相关性分析
采用CMIA与EMIT检测来自我院30例患者血清样本中的VPA浓度。分别用EMIT与FPIA检测来自我院50例患者的EDTA-K2抗凝全血样本中的CsA浓度,15例患者血清样本中的VPA浓度、48例患者血清样本中的CBZ浓度。采用EMIT与MEIA检测来自我院20例患者血清样本中的DIG浓度。所有样本均按“2.2”项下方法处理并上机测定。以FPIA(CMIA、MEIA)测定结果为X,EMIT法测定结果为Y,进行线性回归。
采用SPSS19.0统计软件对方法间结果进行线性回归分析,结果采用Bland-Altman偏差图法比较。两种仪器的测定结果采用配对t检验,以P<0.05为差异有统计学意义。
2种方法测定结果的相关性比较见图1、图3、图5;2种方法测定结果的偏差比较见图2、图4、图6。
图1、图2结果显示,VPA样本两方法间相关性良好(r=0.97),相关性直线方程为:YEMIT=1.172XCMIA+ 0.227。对方法间结果进行显著性分析,显示2种方法测定结果具有显著性差异 (P<0.001),EMIT方法的检测结果总体大于CMIA法。患者4种血样(VPA、CsA、CBZ、DIG)采用两种方法对比的血药浓度平均比值和标准偏差见表5。

图1 CMIA与EMIT法测定VPA血药浓度结果的相关性

图2 CMIA与EMIT法测定VPA血药浓度结果的偏差比较
图3、图4结果显示,CsA样本两方法间相关性良好(r=0.97),相关性直线方程为:YEMIT=0.832XFPIA+ 17.63,对方法间结果进行显著性分析,显示2种方法测定结果具有显著性差异(P<0.05),EMIT方法的检测结果总体小于FPIA法。若CsA样本测得结果分为X≤150 ng·mL-1和X>150 ng·mL-12个层次,分别进行线性回归,得到方程分别为:YEMIT=0.739XF-PIA+25.94 (r=0.85,n=33,P>0.05);YEMIT=0.794XFPIA+ 30.21(r=0.95,n=17,P<0.05)。
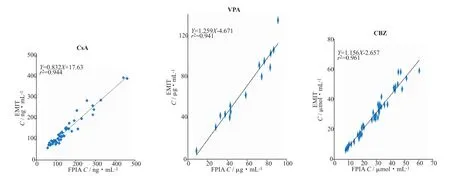
图3 EMIT与FPIA法测定CsA、VPA和CBZ血药浓度结果的相关性

图4 EMIT与FPIA法测定CsA、VPA和CBZ血药浓度结果的偏差比较
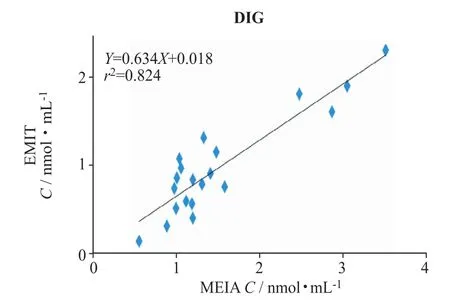
图5 EMIT与MEIA法测定DIG血药浓度结果的相关性
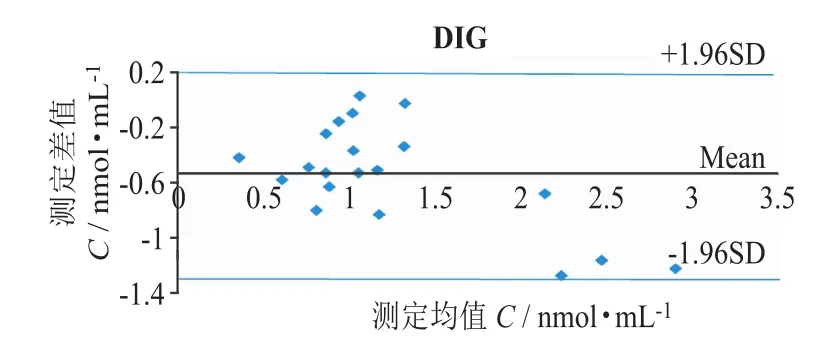
图6 EMIT与MEIA法测定DIG血药浓度结果的偏差比较
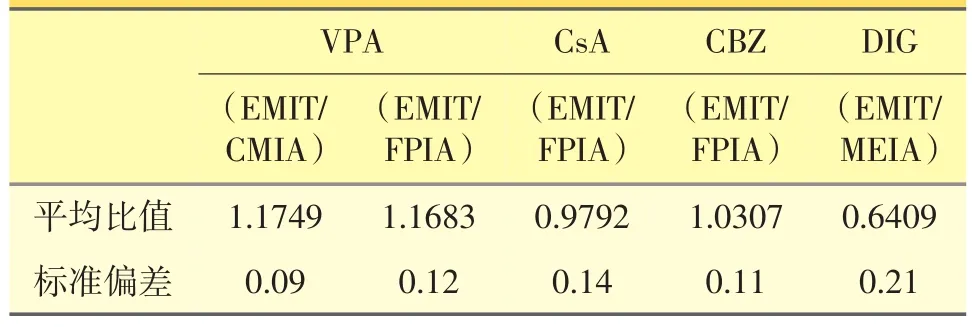
表5 患者4种血样(VPA、CsA、CBZ、DIG)采用两种方法对比的血药浓度平均比值和标准偏差
VPA样本两方法间相关性良好(r=0.97),相关性直线方程为:YEMIT=1.259XFPIA-4.671,对方法间结果进行显著性分析,显示2种方法测定结果具有显著性差异(P<0.01),EMIT方法的检测结果总体大于FPIA法。CBZ样本两方法间相关性良好 (r=0.98),相关性直线方程为:YEMIT=1.156XFPIA-2.657,对方法间结果进行显著性分析,显示2种方法测定结果具有显著性差异(P<0.01),EMIT方法的检测结果总体大于FPIA法。
图5、图6结果显示,DIG样本两方法间有相关性 (r=0.91),相关性直线方程为:YEMIT=0.634XMEIA+ 0.018,对方法间结果进行显著性分析,显示2种方法测定结果具有显著性差异 (P<0.001),EMIT方法的检测结果总体小于MEIA法。
3 讨 论
本研究应用不同方法同时测定同份临床样品,结果具有较好的相关性,但方法间差异存在统计学显著意义。这种差异产生的原因,可能是不同方法的原理和所使用试剂各不相同造成的。个体之间因药物代谢酶基因多态性使得药物在体内代谢产物的种类和浓度不同,由于不同方法对于不同药物代谢产物的交叉反应的活性不同,从而导致个体间不同方法测定结果的差异。
CsA血药浓度相关性良好,病人都监测谷浓度(C0),少数病人同时监测峰浓度(C2),肾移植后长期用环孢素的病人 (移植超过半年)C0一般≤150 ng· mL-1,所以尝试把CsA结果分为2个层次,在X≤150 ng·mL-1时(r=0.85)没有X>150 ng·mL-1时(r= 0.95)相关性好,可能是在CsA低浓度时代谢物AM1(M17)和AM9(M1)对检测结果干扰大引起的[8],并且CsA的EMIT测定结果低于FPIA测定结果,与文献报道一致[9]。VPA的EMIT测定结果高于FPIA测定结果,可能由于EMIT是利用抗原抗体相互识别并结合来产生检测信号,因而那些化学结构相近于母体的代谢产物以及样本中的内源性物质有可能产生交叉反应,使得测定结果偏高。另外温度等因素也可影响抗原和抗体的结合。CBZ的活性代谢产物卡马西平10,11-环氧化物(CBZE)对CBZ的测定有干扰,发生交叉反应,使结果有偏差,而CBZE亦有药理活性,会产生与CBZ相同的治疗作用和毒性反应,本试验CBZ的EMIT测定结果高于FPIA测定结果。
DIG的对比结果差异大,有一半的结果显示两台仪器间比值小于0.6,平均比值达到0.64,DIG的EMIT法的测定结果明显低于MEIA法。研究表明,VIVA-E与AxSYM两台仪器不可互相替代,测定结果存在显著性差异,相关性(r=0.91)没有其他药物好,可能是标本中内源性的地高辛样免疫反应因子(DLIF)对DIG浓度的测定产生干扰,而使DIG浓度假性升高。由于VIVA-E在低浓度(0.60 ng·mL-1)时质控RSD值为15.83%,明显较大。AxSYM线性范围为0.3~4.0 ng·mL-1,而VIVA-E线性范围为0.2~5.0 ng·mL-1,范围较宽。AxSYM用的是微粒子捕捉免疫法,而VIVA-E是酶扩大免疫法,对环境和温度的要求更高,稳定性不如前者。
因此,在更换仪器时,一定要做好2种仪器方法的全面对比测定工作,同时在利用监测结果制定给药方案时要充分考虑年龄、性别、疾病、遗传、血容量及血浆/红细胞比例、肝功能、胆汁排泄等代谢因素和合并用药等各种影响因素对血药浓度的影响。不同药物有各自的临床应用的注意事项,CsA血药浓度监测时间可于术后1周开始,3个月内每周监测1~2次,3个月后每月一次,肾功能或临床表现异常时随时监测,长期存活的患者监测频率可以更低。血药浓度低于有效血浓度范围易致排斥或诱发自身免疫性疾病,高则易引起感染或肝、肾及中枢神经系统损害[10]。VPA不良反应较少,其最低有效血药浓度为40~50 mg·mL-1,超过100 mg·mL-1后,再增加药量,对疗效几无影响,且浓度超过120 mg· mL-1后,毒副反应发生率增高。CBZ的有效血药浓度为17~51 mmol·L-1,相对比较安全。DIG的有效血药浓度是0.8~2.0 ng·mL-1,治疗浓度与中毒浓度有时会存在交叠,这就使中毒浓度的确定较难掌握。
综上所述,不同药物拥有不同的特点,本研究分别用i1000SR、AxSYM、VIVA-E测定VPA、CsA、CBZ和DIG的血药浓度,并对测定结果间的差异和相关性进行评价,CMIA测定VPA血药浓度与EMIT的结果、FPIA测定VPA、CsA、CBZ及MEIA测定DIG血药浓度与EMIT的结果,均存在显著性差异(P<0.05),临床应用中应予以关注并正确解读检测数据,从而合理调整患者用药剂量,制定个体化的给药方案。
[1]伍三兰,马 林,陈东生,等.酶扩大免疫测定技术与荧光偏振免疫法测定全血环孢素浓度的比较[J].中国医院药学杂志,2012,32(4):295-8.
[2]Yoon HW,Giraldo EA,Wijdicks EF.Valproic acid and warfarin:an underrecognized drug interaction[J]. Neurocritical Care,2011,15(1):182-5.
[3]汪 洋,宋新文,梅 艳.癫痫患儿卡马西平血药浓度监测结果分析[J].中国药房,2010,21(30):2846-8.
[4]黄一玲,田 蕾,蒋娟娟,等.2种方法检测环孢霉素和地高辛血药浓度的比较[J].临床检验杂志,2009,27(4):301.
[5]齐谢敏,虞留明,李 东,等.一种基于常规生化仪的低成本治疗药物监测新技术[J].医学研究生学报,2014,27(11):1197-201.
[6]朱婷婷,芮建中,周国华.治疗药物监测技术质量保证的发展状况[J].药学与临床研究,2014,2(5):427-32.
[7]刘思婷,张 永,仇锦春,等.EMIT和FPIA测定丙戊酸、甲氨喋呤和环孢霉素A血药浓度的比较研究[J].中国现代应用药学,2012,29(8):740-4.
[8]王学彬,段慧钧,黄 瑾,等.AxSYM替代TDXFLX应用于环孢素血药浓度检测的可行性研究[J].药学服务与研究,2011,11(4):272-5.
[9]顾志东,陈 皓,周佩军,等.基质效应对荧光偏振免疫测定技术和酶放大免疫测定方法检测环孢素A结果的影响[J].中华检验医学杂志,2009,32(2):222-6.
[10]Meng XG,Guo CF,Feng GQ,et al.Association of CYP3A polymorphisms with the pharmacokinetics of cyclosporine A in early post-renal transplant recipients in China[J].Acta Pharmacol Sin,2012,33(12):1563-70.
Comparison of CMIA,FPIA,MEIA with EMIT in Determination of Blood Drug Concentrations*
ZHU Ting-ting,CHU Xiao-man,ZHAO Yu-lei,RUI Jian-zhong**,ZHOU Guo-hua
Department of Pharmacology,General Hospital of Nanjing Military Command,Nanjing 210002
Objective:To compare the consistency of Chemiluminesent Microparticle Immunoassay(CMI-A),Fluorescence Polarization Immunoassay(FPIA),Microparticle Enzyme Immunoassay(MEIA)with Enzyme Multiplied Immunoassay Technique (EMIT)in the determination of Cyclosporine A (CsA)in whole blood, and Valproic Acid(VPA),Carbamazepine(CBZ)and Digoxin(DIG)in serum.Methods:The accuracy and precision of each method were evaluated by assaying the high,medium and low concentration samples of quality control respectively.The correlations between CMIA,FPIA,MEIA with EMIT were determined by assaying the concentrations of CsA,VPA,CBZ and DIG in patient blood samples.Results:The VPA con-centrations assayed by EMIT were well linearly correlated with those by CMIA,YEMIT=1.172XCMIA+0.227 (r= 0.97),and the concentrations determined by EMIT were 17.49%higher on average.FPIA compared with EMIT,the results showed good correlation:VPA,YEMIT=1.259XFPIA-4.671 (r=0.97);CsA,YEMIT=0.832XFPIA+ 17.63(r=0.97);CBZ,YEMIT=1.156XFPIA-2.657(r=0.98).MEIA compared with EMIT,the results showed corre-lation:DIG,YEMIT=0.634XMEIA+0.018 (r=0.91).For the concentrations determined by EMIT,CsA were aver-agely 2.08%lower than those by FPIA;DIG were significantly lower by 35.91%in average than by EMIT; but VPA were averagely 17%higher than those by CMIA or FPIA;CBZ were averagely 3.07%higher than those by FPIA.Conclusion:There were significant differences(P<0.05)between EMIT and CMIA,FPIA or MEIA in assaying VPA,CsA,CBZ or DIG concentrations,which suggest that we should pay attention to the discrepancy in clinical application.
Chemiluminesent microparticle immunoassay;Fluorescence polarization immunoassay;Mi-croparticle enzyme immunoassay;Enzyme multiplied immunoassay technique;Therapeutic drug monitoring
R969.1
A
1673-7806(2015)05-437-06
江苏省第七批“六大人才高峰”资助项目(2010WSN-204)
朱婷婷,女,药师 E-mail:zhutingting00790@126.com
* *通讯作者芮建中,男,副主任药师,研究方向:治疗药物监测,群体药代动力学 E-mail:ruijianzhong@126.com
2015-03-18
2015-04-02

