球形红细菌降解RDX的动力学及其机理研究
白红娟,王 珊,柴春镜,牛伟平
(1. 中北大学化工与环境学院,山西太原030051;2. 北京航天计量测试技术研究所,北京100076;
3. 中北大学朔州校区化工与环境学院,山西朔州036000;4. 山西省农药检定所,山西太原030001)
球形红细菌降解RDX的动力学及其机理研究
白红娟1,王珊2,柴春镜3,牛伟平4
(1. 中北大学化工与环境学院,山西太原030051;2. 北京航天计量测试技术研究所,北京100076;
3. 中北大学朔州校区化工与环境学院,山西朔州036000;4. 山西省农药检定所,山西太原030001)
摘要:为了探索球形红细菌对黑索今(RDX)的降解动力学及机理,研究了该菌株生长与降解RDX的关系,并对降解的动力学方程进行了拟合分析。采用气相色谱-质谱联用仪(GC-MS)分析了该菌株降解RDX的中间代谢产物,并推测了其可能的降解途径。结果表明,RDX质量浓度为2.5~30mg/L时,该菌株对RDX的降解符合一级动力学方程。培养4d时,用GC-MS检测到两种中间产物:六氢-1-亚硝基-3,5-二硝基-1,3,5-三嗪(MNX)和次甲基二硝胺(MEDINA),其母离子的质荷比(m/z)分别为207和135,其可能的降解途径为:RDX首先还原为MNX,再进行一系列还原反应生成产物MEDINA,最终降解为小分子物质,并认为硝基还原酶为该降解过程中的重要酶。
关键词:球形红细菌;光合细菌;黑索今;RDX;降解动力学;降解机理;MNX;MEDINA
引言
黑索今(RDX)广泛应用于工业生产,因其具有显著的生物毒性,美国环境保护署已将其列入优先控制污染物名单[1]。国内外处理RDX毒性的常用方法有光催化、吸附、超临界水氧化以及微生物处理等[2-4]。物理化学方法一般仅适于浓度较高的有机废水处理,对浓度较低的有机废水处理效果差且成本高。生物降解具有成本低廉、无二次污染等优点,已经被广泛应用。尽管许多研究[5-10]表明RDX能被微生物降解,但其代谢途径却各不相同。Eaton H L等[6]用LC-MS/MS(APCI-)检测到RDX的代谢产物六氢-1,3-二亚硝基-5-硝基-1,3,5三嗪(DNX)和六氢-1,3,5-三亚硝基-1,3,5三嗪(TNX),但未检测到次甲基二硝胺。Chen Yong等[9]用LC-MS/MS(APCI-)检测到RDX的代谢产物MNX、二羟胺-硝基-1,3,5-三嗪和羟胺-二硝基-1,3,5-三嗪,但未检测到DNX和TNX。Zhao J S等[10]用HPLC/UV分析了双酶杆菌HAW-1代谢RDX的中间产物MNX、DNX和TNX。
光合细菌能在厌氧光照条件下进行不放氧光合作用,特别是紫色非硫细菌不仅能在厌氧光照的条件下进行光能异养生长,而且能在好氧黑暗条件下进行好气异养生长。光合细菌这种随着生存环境而灵活改变代谢类型的特性,较其他微生物材料具有优越性[11]。本研究采用球形红细菌降解RDX,探讨了RDX的厌氧降解动力学和降解途径,为该菌株在杂氮化合物废水污染治理中的应用提供参考。
1实验
1.1材料和仪器
菌种:球形红细菌(Rhodobacter sphaeroides) H菌株系紫色非硫菌群红细菌属光合细菌, 由山西大学光合细菌研究室分离、鉴定并保存[11];基础培养基(酵母膏 1.0g、MgSO40.2g、CaCl20.07g、(NH4)2SO41.25g、苹果酸 2.5g、KH2PO40.6g、K2HPO40.9g、蒸馏水1000mL, pH值7.0);驯化培养基(基础培养基加适量RDX)。
日本日立公司CXTH-3000型高效液相色谱仪,分离柱为 HYPERHILBDH C18柱 (4.6mm×250mm, 5μm),紫外检测器检测波长235nm,流动相为甲醇/水(体积比为50∶50),流速 1.0mL/min, 进样量10μL;美国Agilent公司HP5973型气相色谱-质谱联用仪(GC-MS),柱温为80℃,以10℃/min升温至280℃,恒温2min,进样口温度为250℃,色谱-质谱接口温度为280℃,电子能量70eV,扫描范围50~500m/z,选择离子全扫描法,载气为高纯氦气(99.999%),流速为1.0mL/min。
1.2实验方法
1.2.1菌种的驯化
将体积分数10%的原始菌液接入RDX质量浓度为20mg/L的驯化培养基, 在30℃、2500 Lux光照度的培养箱中厌氧驯化培养4d作为驯化菌种。
1.2.2RDX降解培养基
将2g/L的RDX丙酮溶液过0.45μm滤膜除菌,取一定量置于灭菌的血清瓶中,待丙酮挥发完全后加入灭菌的基础培养基,使RDX的最终质量浓度达到实验设计值。
1.2.3菌株生长与RDX降解动力学实验
在无菌条件下, 将一定量驯化后的菌悬液在10000r/min下离心10min, 弃上清液,菌体用磷酸缓冲液洗涤2次后,用培养基制备成菌悬液备用。在RDX 质量浓度分别为2.5、5、10、20、30 和40mg/L的降解培养基中,接种一定量的菌悬液(OD值为0.123),分别调节pH值至6.5~ 7.0,在温度30℃、厌氧光照条件(血清瓶装满培养物, 盖橡皮塞;光照度为2500 Lux, 静置)培养0、1、2、3、4、5、6、7d后以10000r/min离心菌体10min,测定上清液中剩余RDX的质量浓度,考察菌种对不同质量浓度RDX的降解动力学。用等量蒸馏水制备的菌悬液,于波长680nm处测定OD值,以测定其生物量。同时,用不加菌体和接种灭活的死菌体的样品作对照,每个条件做2个平行样本,重复实验3次。
1.2.4降解RDX菌株粗酶液的制备
参考文献[13]制备粗酶液。将已培养好的菌液以10000r/min离心10min,弃上清液,菌体用0.1mol/L、pH值7.5的磷酸缓冲溶液洗涤2次,悬浮于1mL的磷酸缓冲溶液中,然后样品在冰浴中用频率50Hz超声波破碎10次(每次间隔30s超声10s),细胞破碎液于4℃再以12000r/min离心10min,弃沉淀,上清液即为粗酶液。
1.3测试方法
用紫外可见分光光度计在最大吸收波长680nm 处测定菌液浓度。
用高效液相色谱法测定RDX的质量浓度。20mg/L的RDX经球形红细菌降解4d后取样,经过高速离心(10000r/min,10min)后收集上清液,经0.2μm 微孔滤膜过滤除菌后,用30mL乙酸乙酯萃取3次,合并有机相,用2g无水Na2SO4干燥,在35℃下用旋转蒸发仪浓缩后,甲醇定容至2mL细胞瓶,用GC-MS进样分析。
用考马斯亮蓝比色法测定粗酶液中总蛋白质含量[14]。硝基还原酶活性的测定参考文献[15],反应混合物包括:6.5~8.5mg 蛋白/mL,20mmol/L 磷酸缓冲溶液(pH值7.4),0.09mmol/L RDX (二甲基甲酰胺溶剂,体积分数2%),0.5mmol/L NADPH。混合物在37℃下反应4h, 然后放置于冰浴,并加入1mL ZnSO4(质量分数15%)终止反应。反应后的混合物中加入1.0g NaCl和4.0mL乙酸乙酯萃取残留的RDX,浓缩有机层,用0.5mL甲醇定容。以每分钟消耗1μmol RDX所需的酶量定义为一个酶活单位(U)。
2结果与讨论
2.1H菌株生长与降解RDX的关系
球形红细菌H菌株在RDX(初始质量浓度为20mg/L)培养基中的生长情况及其与RDX降解的关系见图1。
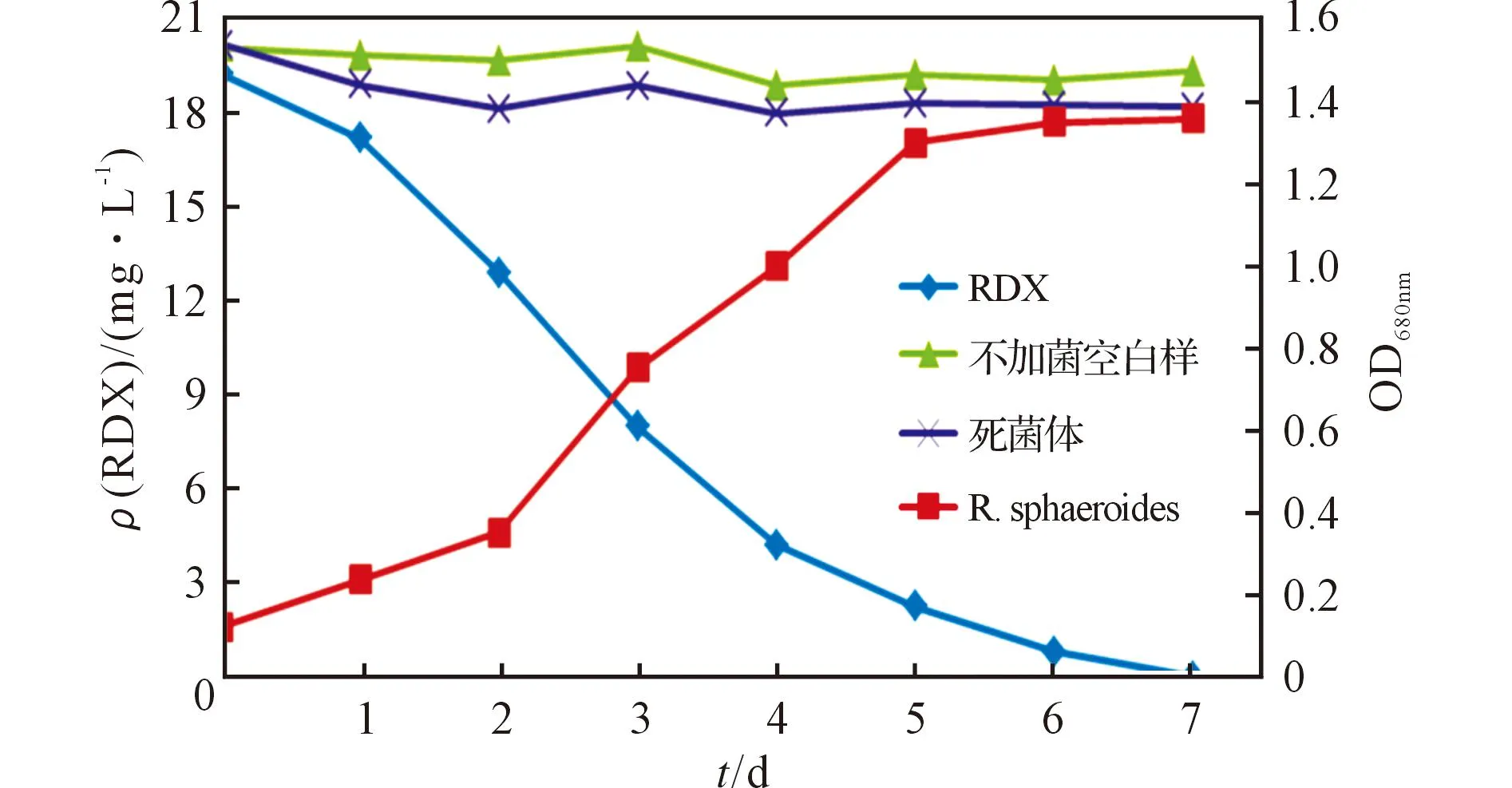
图1 降解时间与细菌生长量及RDX质量浓度的关系曲线Fig.1 The relation curves between the growth ofRhodobacter sphaeroides, the mass concentration of RDXand RDX degradation time
从图1可以看出,当降解2d时,RDX质量浓度为12.9mg/L,RDX的去除率为32.8%;当降解4d 时,RDX质量浓度迅速降低为4.2mg/L,去除率达到78.0%;当降解5d 时,RDX质量浓度明显降低为2.2mg/L,去除率达到88.6%。可见菌株的生长曲线与RDX的降解曲线具有一定的一致性,随着菌株进入对数生长期(3~5d) ,RDX的降解效率显著升高;之后随着时间的增加,由于营养成分的缺失和代谢物的增加,菌株生长逐渐至衰退期,对RDX的降解能力也随之下降,降解曲线趋于平缓。当降解7d时,用降解菌降解RDX(初始质量浓度为20mg/L)培养液,未检测到RDX;而不加菌的空白对照液中,RDX的7d自然降解率仅为3.1%,接种死菌体对照液中,RDX的7d吸附率仅为2.3%,表明RDX的降解过程是生物酶的作用过程。因此,菌体降解RDX与菌体的生长指数期有关。
2.2H菌株对不同质量浓度RDX的降解动力学
将降解试验数据进行一级动力学和二级动力学模拟,见式(1)和式(2):
C=C0e-k1t
(1)
1/C=1/C0+k2t
(2)
式中:k1为一级反应速率常数,d-1;k2为二级反应速率常数,L/(mg·d);t为反应时间,h;C、C0分别为t时间和初始时的底物浓度,mg/L。
H菌株对不同质量浓度RDX降解的动力学参数如表1所示。由表1可看出本试验条件下的模拟结果,降解动力学在一定程度上较符合一级动力学特征;RDX质量浓度为2.5~30.0mg/L时,k1较大,半衰期t1/2较短,均小于2.5d;RDX质量浓度为5.0mg/L时,k1最大,t1/2仅为1.3d;RDX质量浓度为30.0mg/L时,k1降低,t1/2增至2.2d;RDX质量浓度为40.0mg/L时,降解效果出现明显下降,k1迅速降至0.092d-1。结果也表明,在RDX的生物降解过程中,RDX既是反应的基质,同时也是抑制剂。
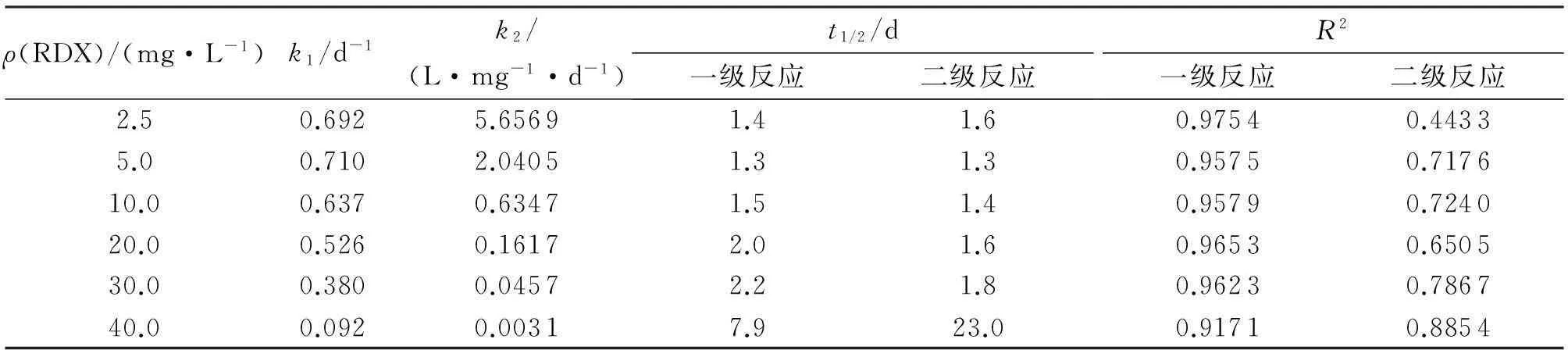
表1 H菌株对不同质量浓度RDX降解的动力学参数
注:ρ(RDX)为RDX的初始质量浓度;k1为一级反应速率常数;k2为二级反应速率常数;t1/2为半衰期;R2为相关系数。
2.3H菌株降解RDX的中间产物及途径分析
2.3.1中间产物的GC-MS分析
为探讨H菌株对RDX的降解动态过程及其降解产物,在降解反应完成后,将其体系中各组分用GC-MS进行检测分析,结果见图2。研究结果表明, 随着降解的进行,各种物质呈现动态变化,底物及各种不同中间产物均表现出有序的产生和消失规律。从图2可以看出,物质A的出峰时间为16.1min,当其被H菌株降解3d后, 其峰高比未降解处理的峰高降低了大约60%,同时出现了1个较大的峰(出峰时间13.2min)和1个小峰(出峰时间4.3min),形成的主要中间产物B和C;当降解4d时,物质A的峰高比未降解处理时明显降低了78%,中间产物B和C的峰高比降解3d分别降低了40%和24%;当降解7d时, 物质A、中间产物B和C的峰均已消失,表明物质A及其中间产物已经降解完全。
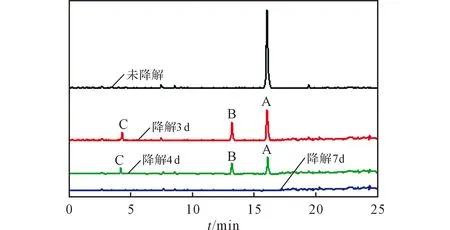
图2 不同降解时间下球形红细菌降解RDX代谢产物的GC-MS图谱Fig.2 GC-MS spectra of metabolites during RDX degradationby Rhodobacter sphaeroides with different degradation times
通过与数据库谱图的比对分析物质A、中间代谢产物B和C的质谱图,其对应母离子、离子碎片及其质核比(m/z)见表2。3种主要物质分别为RDX、六氢-1-亚硝基-3,5-二硝基-1,3,5三嗪 (MNX)和次甲基二硝胺(MEDINA)。保留时间为16.1min,母离子的m/z为223,物质A为RDX;保留时间为13.2min,母离子的m/z为207,中间代谢产物B为MNX;保留时间为4.3min,母离子[MEDINA-H]+的m/z为135,中间代谢产物C为MEDINA。本实验检测到RDX的2种代谢中间产物与文献[8]报道的一致。
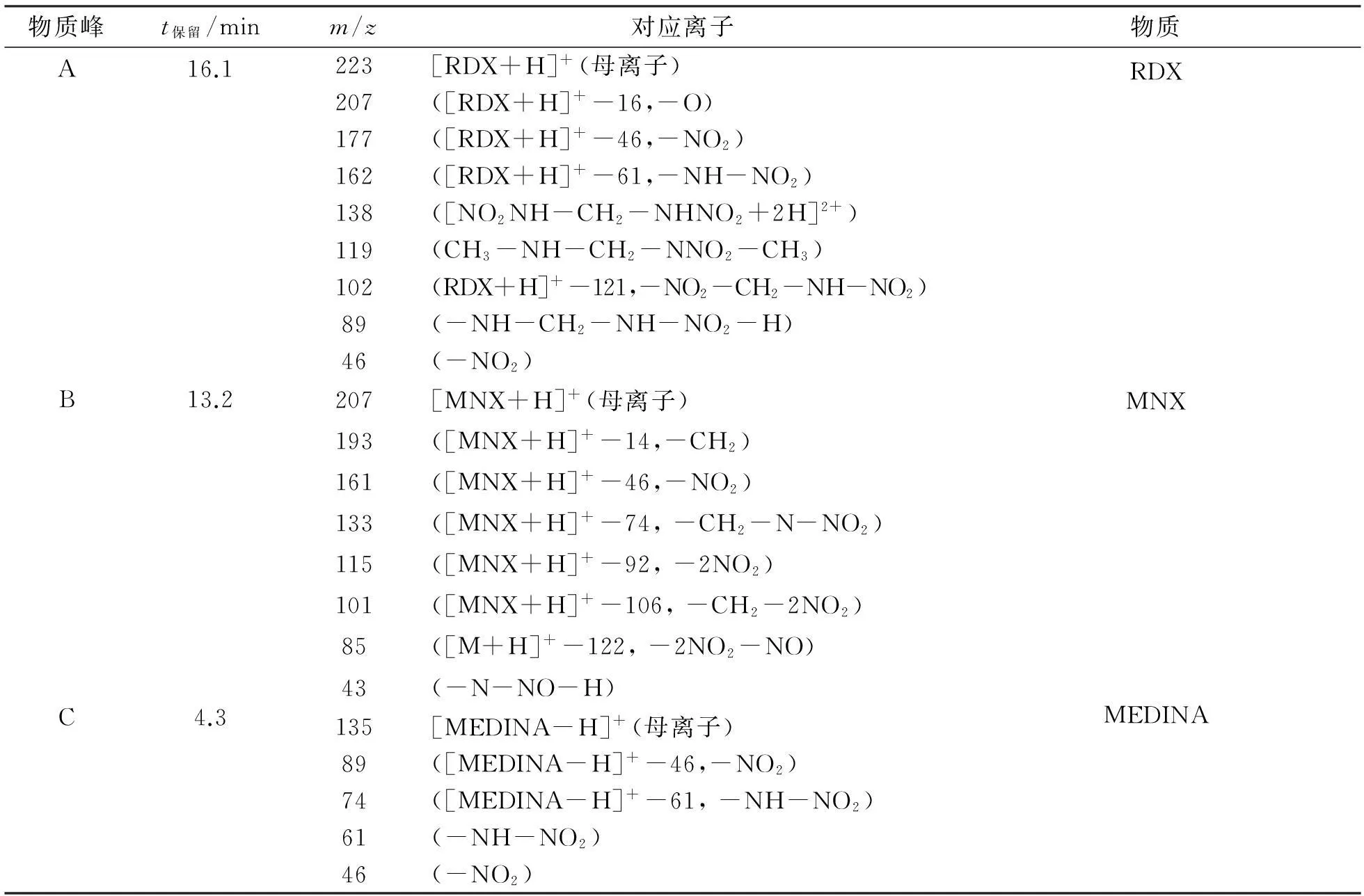
表2 球形红细菌降解RDX代谢过程中代谢产物的GC-MS分析结果
2.3.2H菌株降解RDX的机理分析
为探讨H菌株降解RDX的机理,通过测定微生物代谢产物分析其降解代谢途径,见图3。
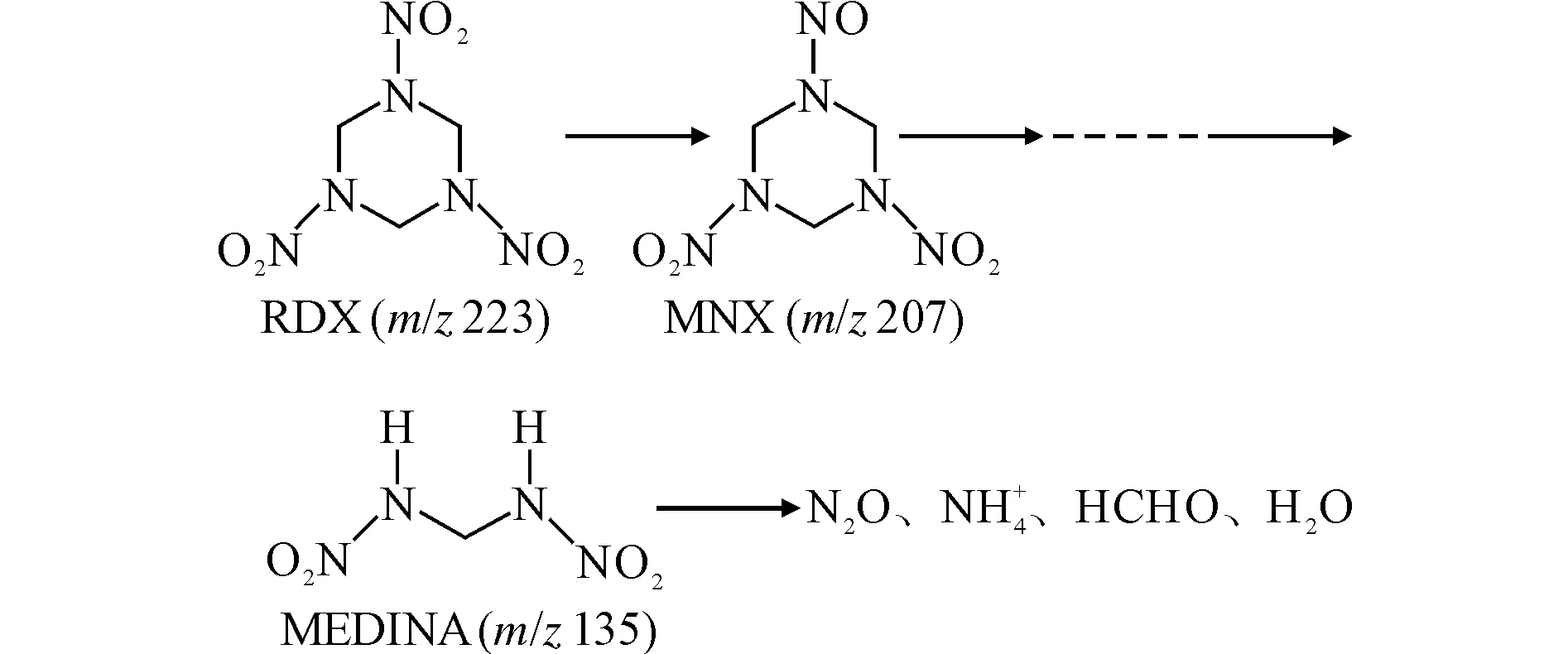
图3 球形红细菌对RDX降解的厌氧生物转化途径Fig.3 The anaerobic biotransformation pathway of RDXdegradation by Rhodobacter sphaeroides
2.4RDX质量浓度对菌体细胞中硝基还原酶活力的影响
不同质量浓度RDX对H菌株产生硝基还原酶活力的影响如表3所示。由表3可见,在低质量浓度RDX的培养液中,H菌株产生的硝基还原酶比活力与对照组相比有一定程度升高;在RDX(质量浓度分别为2.5、5.0、10.0、20.0mg/L)作用下,其比活力较对照组分别增加了21.4%、41.4%、27.3%、6.5%。而随着培养液中RDX质量浓度的提高,其比活力受到抑制;当培养液中RDX降解质量浓度达到30.0mg/L时,相比对照组,其比活力下降了17.9 %。
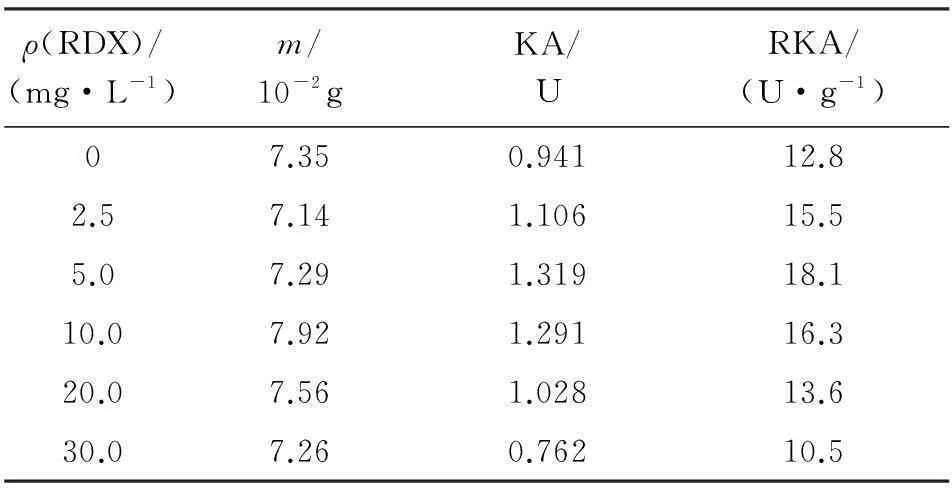
表3 RDX质量浓度对H菌株产生硝基还原酶的影响
注:ρ(RDX)为RDX初始质量浓度;m为总蛋白质量;KA为总酶活;RKA为比活力。
3结论
(1)球形红细菌降解RDX与菌体的生长指数期有关;RDX质量浓度为2.5~30.0mg/L时,降解动力学较符合一级动力学特征,半衰期均小于2.5d。
(2)在球形红细菌降解RDX的过程中,出现了两种中间产物MNX和MEDINA,推测其可能的降解途径为RDX首先还原为MNX,再进行一系列还原反应生成产物MEDINA,最终矿化为小分子。
(3)硝基还原酶为该降解过程中的重要酶,RDX质量浓度分别为2.5、5.0、10.0、20.0mg/L时,其比活力比对照组分别增加了21.4%、41.4%、27.3%、6.5%;而随着培养液中RDX质量浓度提高到30.0mg/L,其比活力受到抑制。
[1]McLellan W L, Hartley W R, Brower M E. Health advisory for octahydro-1,3,5,7-tetranitro-1,3,5,7-tetrazocine and health advisory for hexahydro-1,3,5-tetranitro-1,3,5-triazine[R]. Washington DC: US Environmental Protection Agency, 1988.
[2]尚海茹, 刘霞,冯长根. TNT、RDX及HMX炸药废水处理技术综述[J]. 安全与环境学报, 2013, 13(6): 9-14.
SHANG Hai-ru , LIU Xia, FENG Chang-gen. Research review on treating technologies for TNT , RDX and HMX explosive sewage [J]. Journal of Safety and Environment, 2013, 13(6): 9-14.
[3]Khue D N, Lam T D, Chat N V, et al. Simultaneous degradation of 2,4,6-trinitrophenyl-N-methylnitramine (tetryl) and hexahydro-1,3,5-trinitro-1,3,5 triazine (RDX) in polluted wastewater using some advanced oxidation processes [J]. Journal of Industrial and Engineering Chemistry, 2014, 20: 1468-1475.
[4]焦纬洲,郭亮,刘文丽, 等. Fenton氧化法降解HMX废水中有机物的氧化反应动力学[J]. 火炸药学报, 2014,37(2): 53-56.
JIAO Wei-zhou ,GUO Liang, LIU Wen-li, et al. Oxidation reaction kinetics of degrading organic matter in HMX wastewater by Fenton oxidation method[J]. Chinese Journal of Explosives and Propellants, 2014,37(2):53-56.
[5]Elizabeth L R, Astrid L, Neil C B. Biodegradation and biotransformation of explosives [J]. Current Opinion in Biotechnology, 2011, 22:434-440.
[6]Eaton H L, Duringer J M, Murty L D, et al. Anaerobic bioremediation of RDX by ovine whole rumen fluid and pure culture isolates [J]. Applied Microbiology and Biotechnology, 2013, 97: 3699-3710.
[7]Giarrizzo J G, Murty L, Tanaree D, et al. Validation of a novel extraction method for studying hexahydro-1,3,5-trinitro-1,3,5 triazine (RDX) biodegradation by ruminal microbiota [J]. Journal of Chromatography B, 2013, 925:70-75.
[8]Bharat B, Annamaria H, Jim S, et al. Biotransformation of hexahydro-1,3,5-trinitro-1,3,5-triazine catalyzed by a NAD(P)H: nitrate oxidoreductase from aspergillus niger [J]. Environmental Science and Technology, 2002, 36: 3104-3108.
[9]Chen Y, Hong L, Han W Q, et al. Treatment of high explosive production wastewater containing RDX by combined electrocatalytic reaction and anoxic-oxic biodegradation [J]. Chemical Engineering Journal, 2011, 168: 1256-1262.
[10]Zhao J S, Paquet L, Halasz A, et al. Metabolism of hexahydro-1,3,5-trinitro-1,3,5-triazine through initial reduction to hexahydro-1-nitroso-3,5-dinitro-1,3,5-triazine followed by denitration in Clostridium bifermentans HAW-1 [J]. Applied Microbiology and Biotechnology, 2003, 63:187-193.
LONG Si-si, XIE Shu-tao, DUAN Shun-shan, et al. Photosynthetic bacteria and their applied actualities [J].Ecological Science, 2002, 21(1):91-94.
[12]姚竹云,张肇铭. 几株光合细菌的表型特征及其DNA-DNA同源性分析[J]. 应用与环境生物学报, 1996, 2(1):84-89
YAO Zhu-yun, ZHANG Zhao-ming. Phenotypic features and DNA-DNA homology analyses of some photosynthetic bacteria [J].Chinese Journal Applied Environmental Biology , 1996, 2(1):84-89.
[13]白红娟, 张肇铭, 杨官娥, 等. 球形红细菌转化去除重金属镉及其机理研究[J]. 环境科学学报, 2006, 26(11): 1809-1814.
BAI Hong-juan, ZHANG Zhao-ming, YANG Guan-e, et al. Study on transformation and removal of the heavy metal cadmium by Rhodobacter sphaeroides [J]. Acta Scientiae Circumstantiae, 2006, 26(11): 1809-1814.
[14]陈钧辉,陶力,李俊,等. 生物化学实验[M]. 第六版. 北京:科学出版社, 2006: 63-68.
CHEN Jun-hui, TAO Li, LI Jun, et al. Biochemistry Laboratory[M]. 6th Edition. Beijing: Science Press, 2006: 63-64.
[15]Carmen R C, Mar′a M M, Silvia L F, et al. Benznidazole-induced ultrastructural and biochemical alterations in rat esophagus [J]. Toxicology, 2003, 191: 189-198.
Study on Degradation Kinetics and Mechanism of Explosive
Hexahydro-1,3,5-trinitro-1,3,5-triazine (RDX) by Rhodobacter Sphaeroides
BAI Hong-juan1, WANG Shan2, CHAI Chun-jing3, NIU Wei-ping4
(1. School of Chemical Engineering and Environment, North University of China, Taiyuan 030051, China;
2. Beijing Aerospace Institute for Metrology and Measurement Technology, Beijing 100076, China;
3. School of Chemical Engineering and Environment, North University of China, Shuozhou Shanxi 036000, China;
4. Institute for the Control of Agrochemicals Shanxi, Taiyuan 030001, China)
Abstract:To explore the degradation kinetics and mechanism of explosive hexahydro-1, 3, 5-trinitro-1, 3, 5-triazine (RDX) by Rhodobacter sphaeroides, the relationship between the growth of Rhodobacter sphaeroides and RDX degradation was studied, and the fitting analysis of the degradation kinetic equation of RDX was performed. The intermediates of RDX metabolized by the strain were analyzed by gas chromatograph-mass spectrometer(GC-MS), and the possible pathway of RDX degradation was deduced. The results show that the RDX degradation by the strain is in accordance with the first-order kinetic model for RDX with initial mass concentration of 2.5-30mg/L. Cultivating for 4d, two intermediates hexahydro-1-nitroso-3,5-dinitro-1,3,5-triazine (MNX) and methylenedinitramine(MEDINA) were detected by GC-MS, and the ratios of mass to charge(m/z)of its parention were 207 and 135, respectively. The possible degradation pathway is that RDX is first reduced to MNX and the latter undergoes further reduction to finally produce MEDINA, which was finally degraded to smaller molecular compounds, considering that nitro reductase is an important enzyme in the degradation process.
Keywords:Rhodobacter sphaeroides; photosynthetic bacteria; hexahydro-1,3,5-trinitro-1,3,5-triazine; RDX; degradation kinetics; degradation mechanism; MNX; MEDINA
作者简介:白红娟(1969-),女,教授,从事环境微生物技术研究。
基金项目:山西省科技攻关资助项目(20080311027-1);中北大学自然科学基金项目资助
收稿日期:2015-08-04;修回日期:2015-10-13
中图分类号:TJ55; X93
文献标志码:A
文章编号:1007-7812(2015)06-0051-05
DOI:10.14077/j.issn.1007-7812.2015.06.010

