海藻胶低聚寡糖的酶法制备纯化技术及保水理化性质分析*
黄 菊 丁 晨 谢 超① 裘晓华 俞群娣 李桂芬
(1. 浙江省海产品健康危害因素关键技术研究重点实验室 浙江海洋学院食品与医药学院 舟山 316022;2. 浙江国际海运学院 舟山 316002)
当前世界经济已经进入资源环境瓶颈期, 陆域资源、能源和空间的压力与日俱增。开发海洋资源、发展蓝色经济相继成为世界各国实现可持续发展的战略选择。我国海洋资源丰富, 海藻加工及其高值化利用成为我国海洋资源综合利用的重要领域。其中,海洋生物功能资源的开发利用正迅速成为新的支柱产业不断发展。尤其以海藻多糖及其降解产物——特异性海藻低聚糖为原料的海洋药源和食药同用的保健食品原料的开发和功能研究近年来受到广泛关注,而利用海洋微生物代谢酶降解海藻生产海藻低聚糖已成为继化学降解后更为有效的研究手段。海藻胶是一种源自海藻类植物细胞壁的水溶性酸性多糖, 其降解产物——海藻低聚糖因其特殊的化学特性和生物活性, 其功能评价和开发研究得到不断深入, 活性及药用价值研究已经成为新的热点(纪明侯, 1997)。海藻胶寡糖、低聚糖具有多种生物功能, 在药物、能源、食品等各个方面都用途广泛, 且与褐藻胶相比,具有易溶于水、无抗原性, 以及在宿主体内具有较弱的积累效应等优点(纪明侯等, 1962; 张晨, 1992)。但目前寡糖、低聚糖的价格十分昂贵, 在规模化应用上受到很大的限制, 主要原因是对寡糖、低聚糖的制备技术和作用机制的研究尚不够深入, 因此研制或改进新的生产技术, 生产工艺, 降低成本, 提高产率是扩大其应用范围的关键问题(赵齐川等, 1991)。经过对前人的研究总结和文献查新, 在酶解法制备方面,作者选择了海藻胶裂解酶做探索性研究, 该酶对海藻胶裂解速度快, 产率高、产物质量均一, 且操作安全无公害, 到目前为止, 国内外虽对酶降解制备低聚糖的研究已有报道, 但对酶裂解反应过程中的工艺条件及参数没有明确的定义和确定最优值; 而在膜分离提取方面, 国内外对海藻胶寡糖的分离、分析方法的研究文献报道尚未多见(李金宝等, 2003)。因此,对海藻胶低聚糖的分离、分析检测方法的研究能够有助于进一步理解海藻胶的结构, 并制定海藻胶低聚糖的分离制备标准。本研究将通过一系列正交实验对海藻胶寡糖进行酶降解, 和采用层析柱分离膜对1000—8000Da聚合度的海藻寡糖进行分离提取, 确定最佳工艺条件。进而为提高海藻胶寡糖及低聚糖的制备条件和生产工艺起到一定的指导作用, 以期为海藻胶寡糖和低聚糖的利用开发提供理论依据(陈正霖等, 1989)。
1 材料与方法
1.1 材料与仪器
仪器和设备: TZL-98型恒温振荡器(浙江省宁波市医疗器械厂); Milli-Q 超纯水系统(Millipore,Milford), AXIMACFR型基质辅助激光解析电离质谱仪(MALDI-TOF-MS, 岛津); 旋转蒸发仪 RE64-B(上海荣威); Heto公司L-000型真空冷冻干燥; 集热式恒温磁力搅拌器(北京长城科技); LTQ-XL型质谱仪(ThermoFisher)。
材料和试剂: 海藻酸钠、褐藻胶裂解酶(青岛百成海洋生物资源有限公司)、酒石酸钾钠、苯酚、亚硫酸、磷酸氢二钾、硫酸镁等(国药化学试剂有限公司)。层析柱硅胶(粒度: 200-300目)青岛海洋化工厂; 强阴离子交换柱(Dowex, 1×4400目); 凝胶柱(SephadexG-25); 正丁醇、醋酸、甲酸为分析纯; 甲醇为fisher色谱纯。
1.2 实验内容及方法
1.2.1 温度对褐藻胶裂解酶降解效果的影响 取pH 7.0、1% (W/V)的海藻胶溶液 10mL, 加入粗酶液2mL, 反应体积为 12mL。混合液分别于 20°C、25°C、30°C、35°C、40°C、45°C、50°C、55°C、60°C、60°C水浴保温5h后, 立即在沸水浴处理15min灭活, 用灭活的粗酶液作为对照, 保温处理10min后在265nm处测定吸光度, 做三次平行试验(张书利等, 2006)。
1.2.2 pH对褐藻胶裂解酶降解效果的影响 取1%(W/V)的海藻胶溶液, 调节 pH 分别为 4.5、5.0、5.5、6.0、6.6、7.0、7.5、8.0、8.5。取不同 pH 的海藻胶溶液 10mL, 加入粗酶液 2mL, 反应体积为 12mL。混合液在最适温度下, 保温水解 5h 后, 用灭活的粗酶液作为对照, 在 265nm 处测定降解液的吸光度。
1.2.3 酶解时间对褐藻胶裂解酶降解效果的影响取1% (W/V)的海藻胶溶液, 调节pH为最适反应pH,取海藻胶溶液 10mL, 加入粗酶液 2mL, 反应体积为12mL。混合液在最适pH条件下, 分别保温水解 1、3、5、7、9h 后, 用灭活的粗酶液作为对照, 在265nm处测定吸光度(Davidson et al, 1976)。
1.2.4 加酶量对褐藻胶裂解酶降解效果的影响取1%(W/V)的海藻胶溶液, 加入裂解酶分别占总体积比为 5%、15%、25%、35%、45%、反应体积为20mL,调节最适 pH, 用灭活的粗酶液作为对照, 其余操作相同, 在265nm处测定吸光度(Sawbe et al, 1992)。
1.2.5 底物浓度对褐藻胶裂解酶降解效果的影响取浓度(W/V)分别为0.2%、0.4%、0.6%、0.8%、1.0%的海藻胶溶液 10mL, 加入粗酶液 2mL, 再分别加入占总体积比为 10%、15%、20%、25%、30%、35%、40%、50%的裂解酶溶液, 反应体积为20mL, 调节最适 pH, 用灭活的粗酶液作为对照, 在 265nm处测定海藻胶降解液的吸光度(王斌等, 2007)。
1.2.6 强阴离子交换柱分离 将海藻胶低聚糖样品溶于水, 调节最适 pH, 过强阴离子交换层析柱(Dorex, 2×4400 目), 依次用蒸馏水, 0.5、0.7、1.0、2.0、3.0mol/L的NH4Ac洗脱, 分别隔管吸取收集液200μL于试管中。然后加入100μL 50%苯酚与2mL浓硫酸,摇匀, 室温静置 30min, 测定 368nm处吸光值, 对吸光值做分离曲线, 得到两个组分, 然后用TLC分析各组分含量(Kitamikado et al, 1990)。
1.2.7 硅胶柱分离 将 200mg海藻胶低聚糖溶于10mL蒸馏水中, 加入5g硅胶, 搅匀, 于烘箱中35°C烘干, 自然洗脱, 每约 10mL收集一管, 至洗脱液中无糖检出为止。按照TLC的检测结果合并相应组分,浓缩蒸发, 上样。然后将各组分溶于水, 进行Malde-Tof-Ms分析。重复过柱, 富集各组分后, 用上述方法将各组分进行二次分离, 进行 TLC分析和质谱分析(冯蕾等, 2006)。
2 结果与讨论
2.1 酶解法对海藻胶低聚寡糖制备的优化研究
2.1.1 温度对褐藻胶裂解酶降解效果的影响 温度对海藻胶裂解酶降解效果的影响结果如图1所示。随着水解温度的升高, 酶解液在 265nm处的吸光度逐渐增大, 在45°C时, 达到最大值。之后再随着温度的升高, 吸光度开始逐渐下降。这是因为, 温度会影响酶的活性, 在一定范围内酶的活性会随着温度的升高而增强, 但过了最适温度后, 酶的活性会随着温度的升高而降低甚至失活不再改变, 使催化活性降低。结果表明45°C是海藻胶酶解的最适温度。
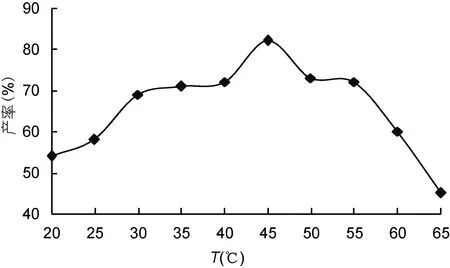
图1 温度对海藻胶酶解产率的影响Fig.1 Temperature effect on enzymatic hydrolysis yield from alginate gel
2.1.2 pH对海藻胶裂解酶水解效果的影响 pH对海藻胶裂解酶水解效果的影响的结果如图 2所示,随着pH的增加, 在pH小于7.0时, OD265缓慢增加,在 pH 7.0处达到最大值, 当 pH超过7.0时, OD265开始迅速下降。因为pH的大小改变了溶液中氢离子的浓度, 影响了酶作用的环境, 从而对酶活性产生了影响, 结果表明海藻胶酶解的最佳pH为7.0。
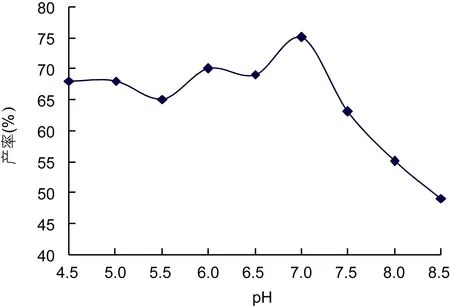
图2 pH对海藻胶水解效果的影响Fig.2 Effects of pH on hydrolysis of alginate gel
2.1.3 时间对海藻胶裂解酶降解效果的影响 由图 3中可以看出, 在降解过程中, 随着降解时间的增加, OD265也随之增加, 当降解 6h 后, 吸光度开始缓慢下降。因为随着反应时间的增加, 底物的转化率在不断增加, 使得产物浓度越来越大, 阻碍了反应的进行(万小飞等, 2008)。研究表明海藻胶酶解的最佳时间为6h 。
2.1.4 加酶量对海藻胶裂解酶降解效果的影响从图4中可以看出, 在海藻胶裂解酶降解海藻胶的过程中, 随着酶含量的提高, OD265也逐渐增大。在酶用量达45%时, 降解产物在 265nm 处的吸光度达到最大值。之后, 随着海藻胶裂解酶含量的继续增加,OD265保持不变甚至有所下降, 研究表明海藻胶酶解的最适酶添加量为45%。
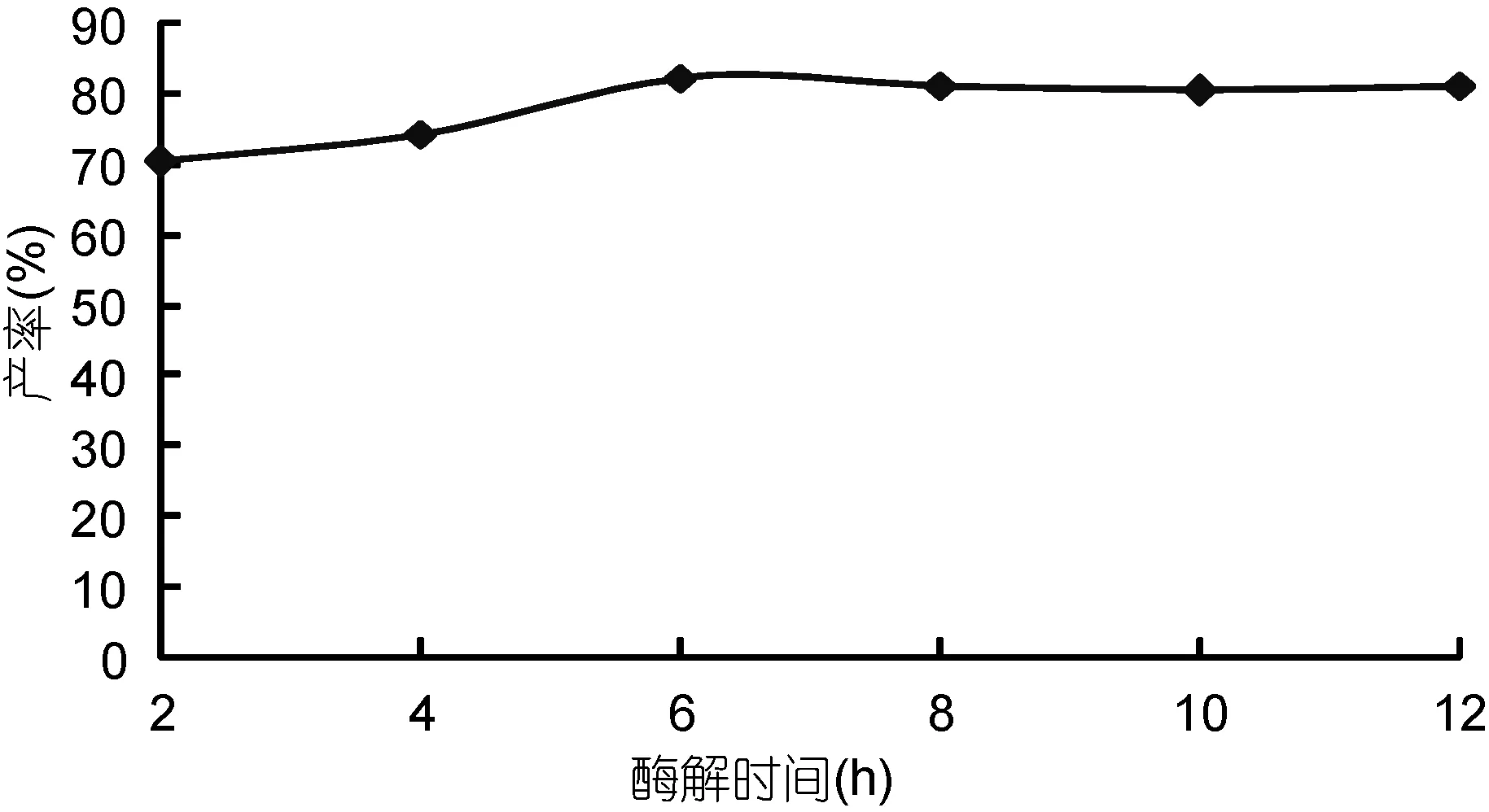
图3 时间对海藻胶水解效果的影响Fig.3 Temporal effect on alginate gel hydrolysis
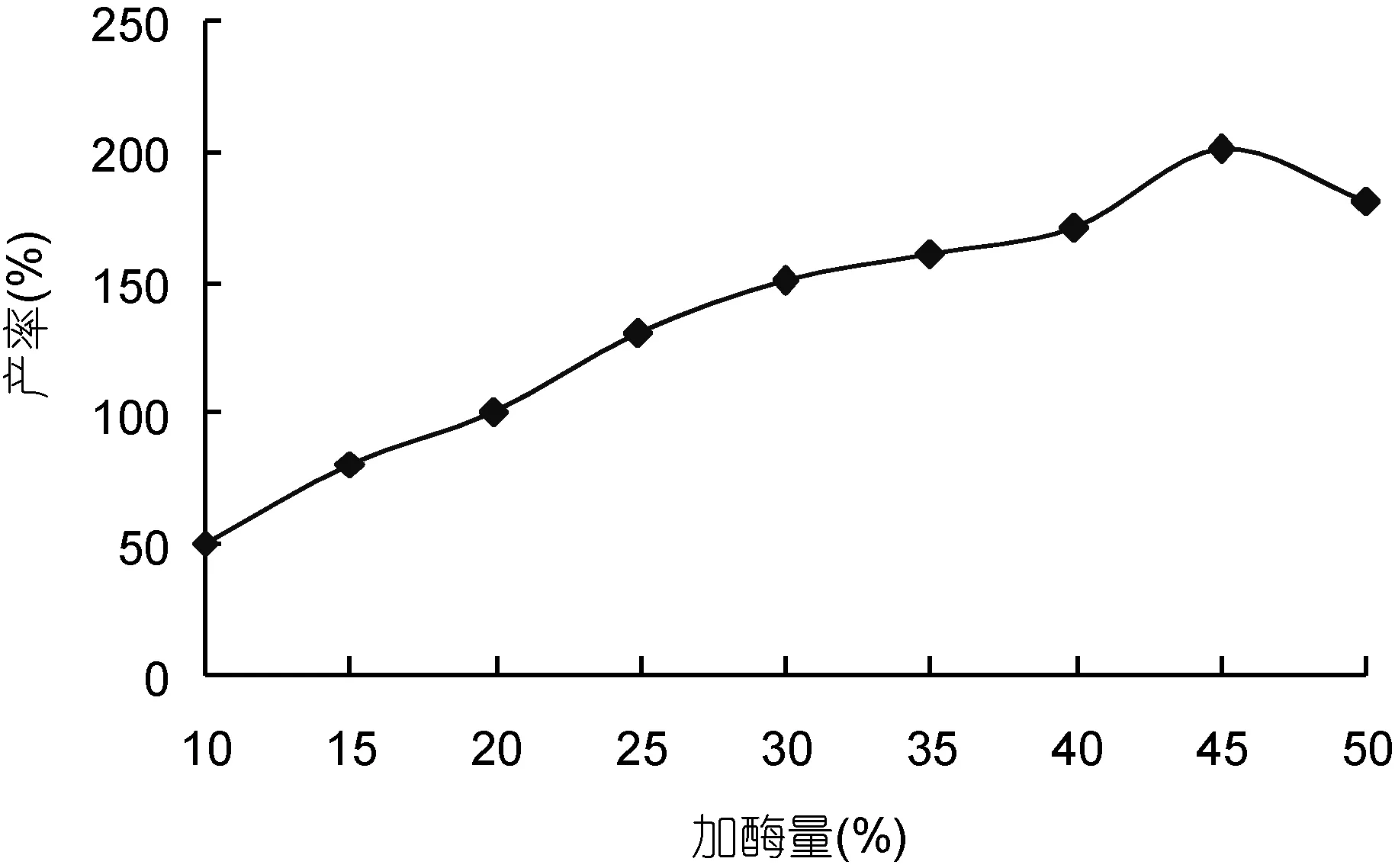
图4 加酶量对海藻胶水解效果的影响Fig.4 Effect of enzyme addition on alginate gel hydrolysis

图5 底物浓度对海藻胶水解效果的影响Fig.5 Effect of substrate concentration on alginate gel hydrolysis
2.1.5 底物浓度对海藻胶裂解酶降解效果的影响由图 5中可以看出, 当海藻胶浓度在一定范围内增加时, 酶解产物OD265也逐渐增加。当海藻胶质量分数达到 0.8%(W/V)时, 海藻胶酶解产物在 265nm 处的吸光度达到最大, 之后随着底物浓度的增加, 酶解效果开始逐渐下降。因为, 当底物质量分数较低时,反应速度与底物质量分数呈正比, 随着底物浓度的再增加, 底物逐渐被酶饱和, 反应速率不再上升, 反而有所下降。研究表明: 海藻胶酶解的最适底物浓度为 0.8%(W/V)。

图6 强阴离子交换柱分离后两个组分对应的MALDI-TOF-MS图谱Fig.6 MALDI-TOF-MS analysis of two fractions

图7 海藻胶低聚糖经硅胶柱的分离图Fig.7 Separation of alginate oligosaccharides by silica gel column
2.2 海藻胶低聚寡糖的提取分级优化研究
2.2.1 膜类型对海藻胶低聚糖超滤截留液 DE值的影响
(一) 强阴离子交换层析柱分离 通过图 6可以看出, 用强阴离子交换层析柱(Dorex, 2X4400)对样品进行分离所得的四个组分都为混合物。因此, 用强阴离子交换柱层析分离, 样品中各聚合度低聚寡糖均未得到分离。
(二) 硅胶柱分离 一次分离: 将样品按照TLC的检测结果共分为四个组分, 再将这四个组分取等体积做Malde-Tof-Ms分析, 结果如下图所示。从图7结果显示, 各组分并未得到完全分离, 但是各组分样品以一个聚合度为主。为了进一步验证分离的情况, 取四个组分样品各 200mL, 稀释 100倍, 进行Malde-Tof-Ms分析。从Malde-Tof-Ms图谱(图8)可以看出, 在硅胶柱层析分离所得的四个组分中, 组分一是以分子量为1000—2000Da海藻胶低聚寡糖为主的组分, 含有少量的 2000—4000Da的低聚寡糖; 组分二是以分子量为2000—4000Da海藻胶低聚寡糖为主的组分, 含有少量的 4000—6000Da低聚寡糖; 组分三是以分子量为4000—6000Da海藻胶低聚寡糖为主的组分, 也含有2000—4000Da和6000—8000Da的低聚寡糖; 组分四是以分子量为 6000—8000Da海藻胶低聚寡糖为主的组分, 同时也含有少量4000—6000Da的低聚寡糖。因此样品中的低聚部分已被分为两种寡糖或三种寡糖的混合物。
二次分离: 为了进一步得到纯品, 将第一次分离的各个组分用硅胶柱进行第二次分离。Malde-Tof-Ms分析结果如下图所示(李悦明等, 2010)。
结果显示, 二次分离各聚合度寡糖基本得到分离(如图 9所示)。为了进一步验证分离的情况, 取四个组分样品各 2 0 0 m L, 稀释 1 0 0倍, 进行Malde-Tof-Ms分析, 从 Malde-Tof-Ms图谱(图 10)可以看出, 在硅胶柱二次分离所得的四个组分中, 组分一以 1000—2000Da海藻胶低聚寡糖为主, 含有极少量的 2000—4000Da的低聚寡糖; 组分二为2000—4000Da的海藻胶低聚寡糖, 几乎不含其它聚合度的寡糖; 组分三以分子量为 4000—6000Da海藻胶低聚寡糖为主, 几乎不含其它聚合度的寡糖; 组分四以分子量为6000—8000Da的海藻胶低聚寡糖为主,几乎不含其它聚合度的寡糖。因此1000—8000Da分子量的海藻胶低聚寡糖基本得到分离, 其中4000—6000Da、6000—8000Da的低聚寡糖纯度相对比较大, 所以采用硅胶柱层析分离海藻胶低聚寡糖。
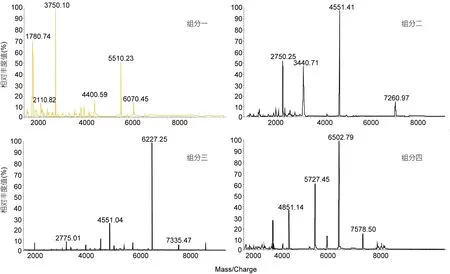
图8 硅胶柱一次分离后各组分对应的MALDI-TOF-MS图谱Fig.8 MALDI-TOF-MS spectra of all components after first separation by silica column

图9 海藻胶低聚糖经硅胶柱二次分离的TLC图Fig.9 TLC (Thin Layer Chromatography) diagram of secondary separation of alginate oligosaccharides by silica gel column
2.2.2 四种海藻胶低聚糖超滤截留液DE值随时间的变化 在膜分离过程中, 于不同时间段取截留液进行DE值的测定, 随着分离的进行, 四种截留液 DE 值随时间的变化如图11所示。由图11可知, 随着超滤膜分离的不断进行, 截留液的 DE 值均呈下降趋势。DE值越低代表产品分离程度越高。四组超滤截留液的DE值还可下降到比较低的程度, 均可获得 DE 值在 20以下的产品。 当在起始的 2h分离时间内, 4000—6000Da和 6000—8000Da的两种海藻胶低聚糖在超滤过程中, DE值要明显好于其它两组, 且下降趋势较平缓, 当到达过滤的最终时间段时, 6000—8000Da和4000—6000Da的DE值相近且都略低于另外两组。且在超滤膜过滤 4h后, 6000—8000Da和 4000—6000Da两组截留液海藻胶低聚寡糖的 DE值下降都不再明显,说明此时过滤已基本终止, 所以, 超滤膜分离的最适时间应为4h。且这一过程, 操作可控, 安全无杂, 可根据实际所需自主调控, 直到产品达到所需的要求(康平等,2007)。由此可见, 通过对酶法制备的海藻胶低聚寡糖的超滤分离, 可以得到精确控制DE值的产品。
2.2.3 不同分子量海藻胶低聚糖超滤截留液DE值随温度的变化 如图 12所示, 随着超滤膜分离温度的不断升高, 截留液 DE值均呈上升趋势, 说明还原糖没有被过滤出去, 渗透通量呈不断下降趋势。运行初期, 渗透通量下降较慢, 但随着运行温度的增长,超滤膜发生变性, 粘度增加, 流动性能变差, 膜表面开始产生浓差极化, 此时膜通量的衰减加快。当温度达到 30°C时, 膜表面会因截留的大分子多糖不断积累而形成凝胶层, 膜通量开始迅速衰减, 如果持续运行将会引起膜的严重污染和损坏(蔡俊鹏等, 2006)。由图 12可见, 在MWCO 8000Da超滤分离运行的温度应控制在27°C左右为最宜, 方能得到较适DE值的海藻胶低聚寡糖产品。

图10 硅胶柱二次分离后各组分对应的MALDI-TOF-MS图谱Fig.10 MALDI-TOF-MS spectra of all components after secondary separation by silica gel column
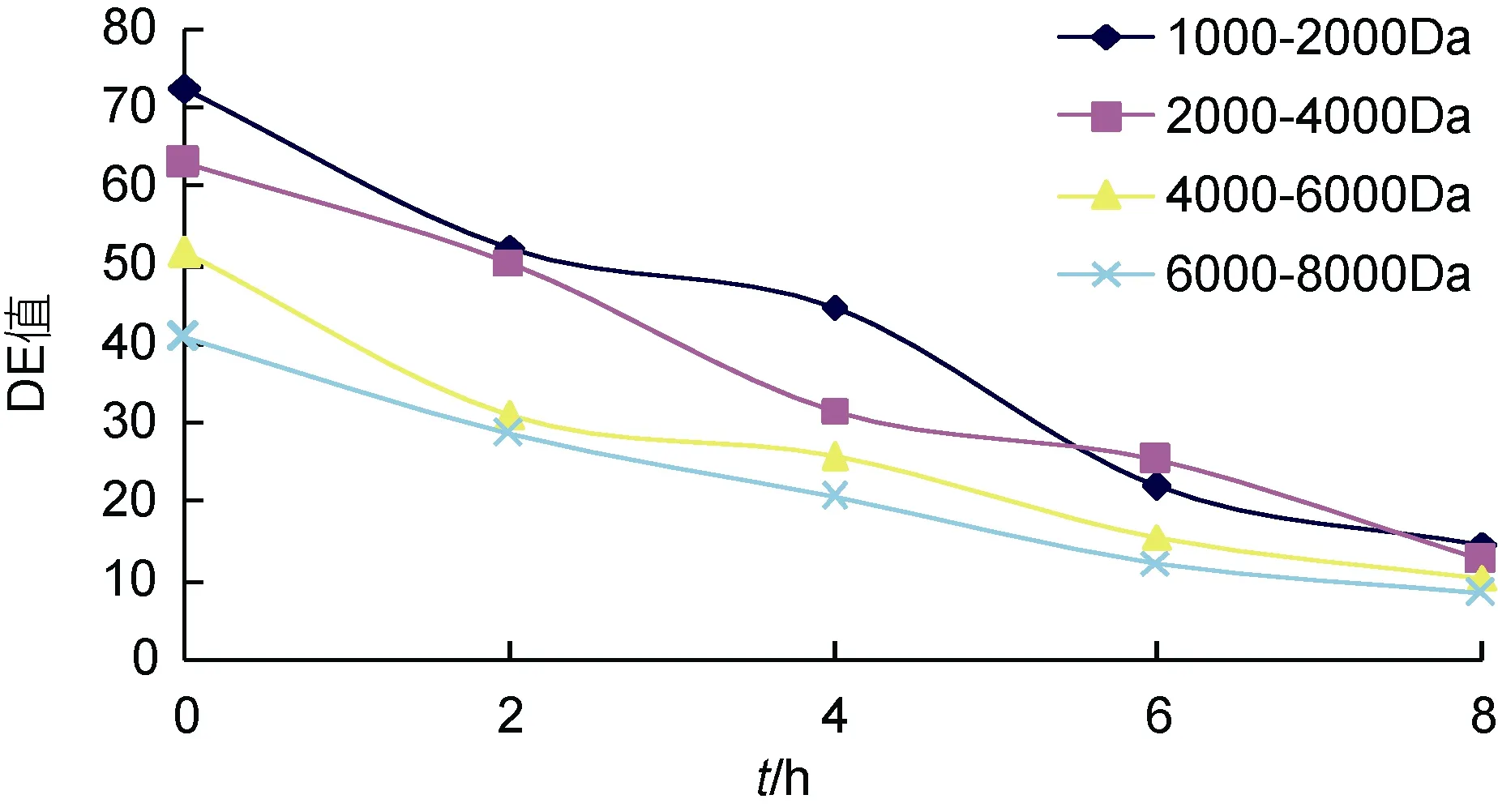
图11 四种海藻胶低聚糖超滤截留液DE值随时间的变化Fig.11 Temporal changes in DE (dextrose equivalent) value for four liquid alginate oligosaccharides in the rejected liquid after ultrafiltration
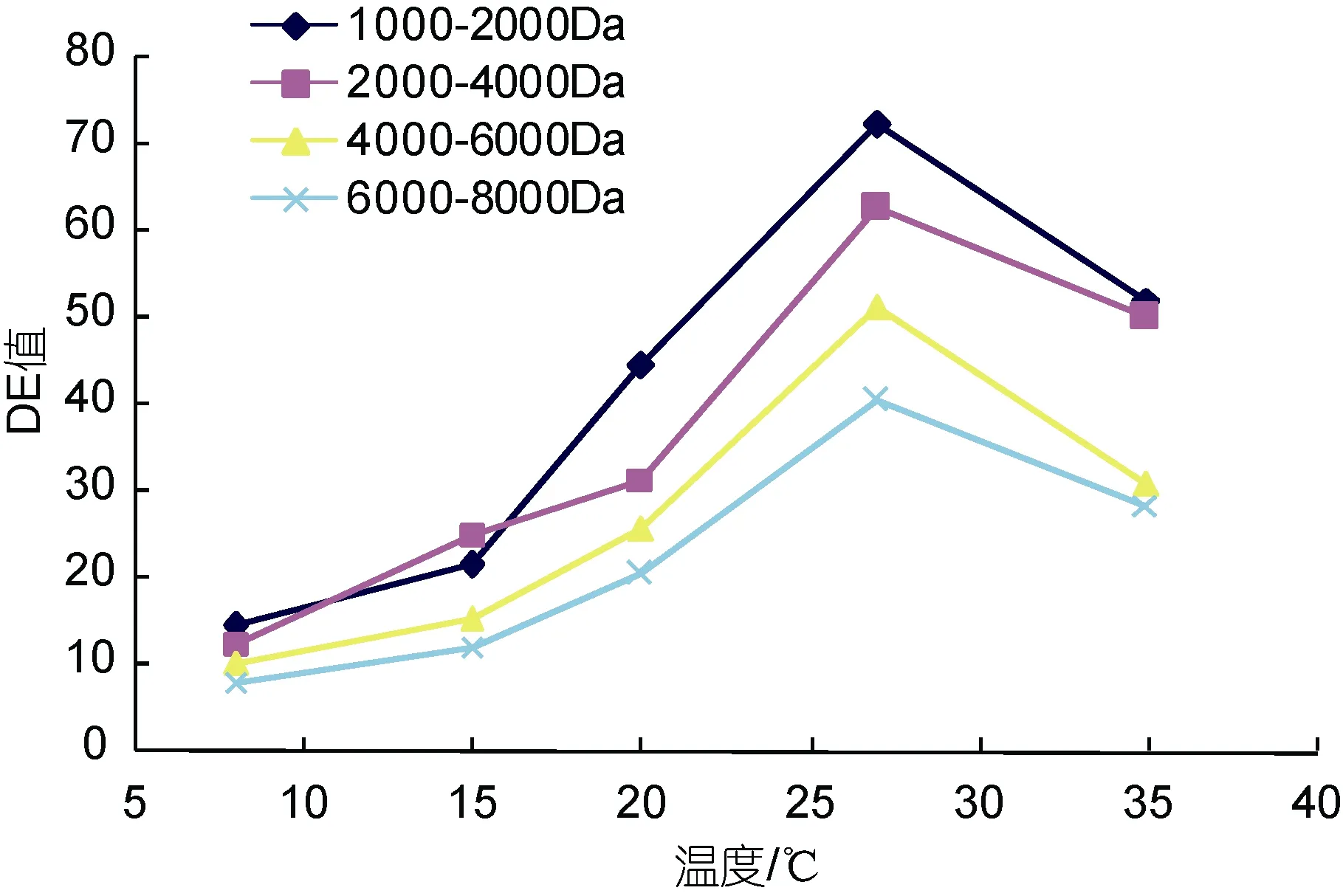
图12 四种海藻胶低聚糖超滤截留液DE值随温度的变化Fig.12 Changes with temperature in DE value for four liquid alginate oligosaccharides in the rejected liquid after ultrafiltration
2.3 不同分子量海藻胶低聚寡糖的溶解、吸水、稳定性比较
2.3.1 溶解性分析比较 不同分子量海藻胶低聚寡糖的水溶性测定结果如表 1所示, 分级前后海藻胶低聚寡糖的水溶性存在较大的差异。在25°C冷水中, 分子量 6000—8000Da的低聚寡糖水溶性最高,达到 93.01%, 而 1000—2000Da的最差, 而在 75°C热水中, 各海藻胶低聚寡糖的水溶性都比较高, 尤其是分子量为6000—8000Da的, 水溶性达到了99.66%。因为升温能破坏晶形, 因此其它海藻胶低聚糖在冷、热水中的水溶性差异较大, 水溶性随温度的升高而大大提高(包华芳等, 2010), 其中, 1000—2000Da的低聚寡糖水溶性增幅最大, 但在热水中的溶解性却依然最小, 可能是与其分子间聚合度较低有关。
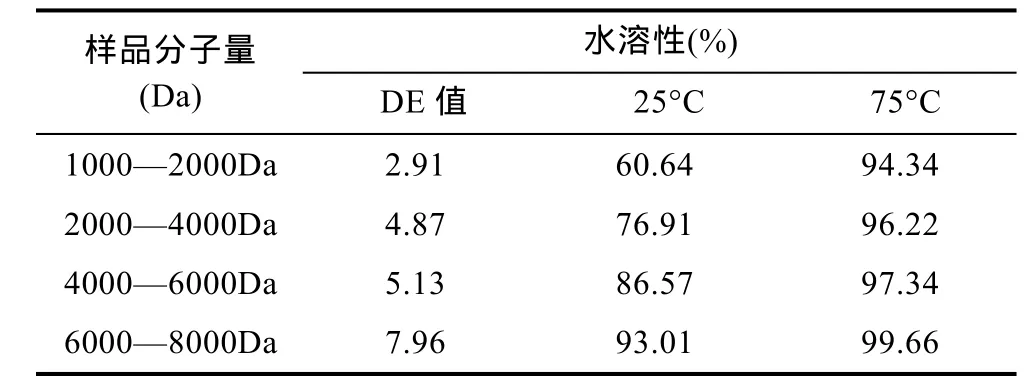
表1 不同分子量海藻胶低聚糖的水溶性Tab.1 Water solubility of alginate oligosaccharides in different molecular weights
2.3.2 吸水性分析比较 不同相对湿度条件下不同分子量海藻胶低聚寡糖样品的吸水性如图 13 所示。由图13可以看出, 随着环境湿度的增加, 海藻胶低聚寡糖的吸水性都呈现增加的趋势。相对湿度在85%以下时, 随着相对湿度的增加, 海藻胶低聚寡糖的吸水性缓慢上升, 分级前后海藻胶低聚寡糖的吸水性差异较小。随着相对湿度的继续增加, 不同分子量海藻胶低聚寡糖的吸水性大幅度上升, 当相对湿度为 98%时, 各分子量海藻胶低聚寡糖的吸水强弱顺序为: 6000—8000Da>4000—6000Da>2000—4000Da>1000—2000Da, 其水分含量分别为46.36%、41.83%、40.32%、32.39%。可以看出, 各种海藻胶低聚寡糖在吸水性上的差异, 在高湿度条件下才体现出来(刘岩等, 2001), 经过分级后, 1000—2000Da的吸水性最弱,6000—8000Da分子量的海藻胶低聚寡糖最强。
2.3.3 冻融稳定性分析比较 不同分子量海藻胶低聚寡糖的冻融稳定性测定结果如表 2 所示。冻融稳定性代表了物质的持水能力, 用析水率表示。由表2 可以看到, 冻融 4 次, 1000—2000Da、2000—4000Da和 4000—6000Da都有水析出, 析水率随冻融次数的增加呈上升趋势, 且 1000—2000Da的最大。6000—8000Da的没有水析出, 冻融稳定性最好, 因为形成坚硬的冻胶, 解冻后基本无水析出(Higgins et al, 1996)。可见, 分子量为 6000—8000Da 的海藻胶低聚寡糖的冻融稳定性最好。

图13 不同分子量海藻胶低聚寡糖的吸水性Fig.13 Water absorption by alginate oligosaccharides in different molecular weights

表2 不同分子量海藻胶低聚糖的析水率Tab.2 Syneresis rate (in %) of alginate oligosaccharides in different molecular weights
在对海藻胶低聚寡糖的溶解性、吸水性、稳定性上述3种保水指标的测量中发现, 四种不同分子量海藻胶低聚寡糖中, 6000—8000Da的低聚寡糖无论是在溶解性、吸水性还是在稳定性方面均最好。可能是因为: 分子量越大, 分子间聚合程度越高, 结晶性越强, 相互作用性也越强, 且含有更多的水溶性大分子物质造成的(Jeanmougin et al, 1998)。可见, 随着分子量增大, 海藻胶低聚寡糖的持水性, 冻融稳定性都显著提高, 而 6000—8000Da分子量的海藻胶低聚糖因其更加稳定且致密的网状聚合结构, 以及更多的亲水基团, 大大增强了其吸附和持水能力, 因而使其吸水性、稳定性更好。大分子海藻胶低聚寡糖的制备与分级筛选, 为后期其对鱿鱼、虾及肉制品的抗冻保水应用提供了理论基础和原料保障。
3 结论
在利用酶解法制备海藻胶低聚糖时, 当温度45°C, pH 7.0, 时间 6h, 酶添加量 45%, 底物浓度0.8%时, 海藻胶降解成低聚糖的产率最高, 达到75%左右; 采用硅胶柱超滤膜分离提取不同分子量海藻胶低聚糖时, 温度控制在 27°C, 时间在 4h以内时,分离提取率最高, 达到70%左右。且海藻胶低聚糖分子量多为6000—8000 Da范围内。该方法成本低, 工艺简单, 产品较均一, 无污染, 是工业制备海藻胶低聚糖发展方向之一。
万小飞, 伦 璇, 程 路等, 2008. 副溶血弧菌C20海藻胶裂解酶的纯化及酶学特性研究. 现代食品科技, 24(5):415—419
王 斌, 甘纯玑, 管华诗等, 2007. 九孔鲍海藻酸酶降解褐藻胶的反应条件与酶解产物的分析. 中国水产科学, 14(4):659—666
包华芳, 刘 磷, 丁玉庭, 2010. 酶解制备褐藻胶寡糖及其抗氧化活性研究. 中国酿造, (4): 82—84
冯 蕾, 唐学玺, 王艳玲等, 2006. 海藻酸降解酶特性的初步研究. 海洋科学, 30(2): 30—33
刘 岩, 江晓路, 管华诗, 2001. 褐藻胶裂解酶研究进展. 中国水产科学, 7(4): 99—104
纪明侯, 1997. 海藻化学. 北京: 科学出版社, 231—244
纪明侯, 张燕霞, 1962. 我国经济褐藻的化学成分研究Ⅰ. 各种经济海藻的主要化学成分. 海洋与湖沼, 4(3—4):161—168
李金宝, 于文功, 韩 峰等, 2003. 从海洋中分离的弧菌QY102褐藻胶裂解酶的纯化和性质研究. 微生物学报,43(6): 753—757
李悦明, 韩建友, 徐建春等, 2010. 利用芽孢杆菌发酵生产褐藻胶裂解酶的研究. 中国酿造, (4): 79—81
张 晨, 1992. 藻酸双酯钠对血清高密度脂蛋白亚组分含量影响的观察. 中国海洋药物, (1): 23—25
张书利, 管 斌, 邱向锋等, 2006. 褐藻胶裂解酶产生菌的筛选、鉴定及其产酶条件研究. 现代食品科技, 22(3): 24—127
陈正霖, 高金城, 1989. 海藻胶. 青岛: 青岛海洋大学出版社,235—241
赵齐川, 张万群, 1991. 褐藻胶的性质、用途及在人体中的作用. 四川工业科技, 10(1): 52—56
康 平, 汪秋宽, 宋琳琳等, 2007. 皱纹盘鲍内脏酶的酶学性质及海藻胶裂解酶的分离纯化. 水产学报, 31(1): 15—22
蔡俊鹏, 程 璐, 2006. 褐藻胶裂解酶及其裂解产物的研究进展. 食品研究与开发, 27(11): 219—221
Davidson I W, Sutherland I W, Lawson C J, 1976. Purification and properties of an alginate lyase from a marine bacterium.Biochemical Journal, 159(3): 707—713
Higgins D G, Thompson J D, Gibson T J, 1996. Using CLUSTAL for multiple sequence alignments. Methods in Enzymology,266: 383—402
Jeanmougin F, Thompson J D, Gouy M et al, 1998. Multiple sequence alignment with Clustal X. Trends Biochemical Sciences, 23(3): 403—405
Kitamikado M, Yamaguchi K, Tseng C-H et al, 1990. Method designed to detect alginate-degrading bacteria. Applied and Environmental Microbiology, 56(9): 2939—2940
Sawbe T, Ezura Y, Kimura T, 1992. Purification and characterization of an alginate lyase from marine Alteromonas sp. Nippon Suisan Gakkaishi, 58(3): 521—527 Schaeffer D J, Krylov V S, 2000. Anti-HIV activity of extracts and compounds form algae and cyanobacteria.Ecotoxicology and Environmental Safety, 45(3): 208—227

