长牡蛎(Crassostrea gigas)三个选育群体完全双列杂交后代生长性状分析*
王卫军 李 琪 杨建敏① 李 彬 张荣良
(1. 中国海洋大学 海水养殖教育部重点实验室 青岛 266003;
2. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 烟台 264006)
长牡蛎(Crassostrea gigas)又称太平洋牡蛎, 自然分布于西太平洋海域, 是一种广温、广盐性贝类, 具有环境适应强、生长快、风味鲜美、营养丰富等优点, 是世界上养殖范围最广、产量最高的经济贝类。长牡蛎在我国沿海均有分布, 但以辽宁、山东、江苏较多, 年产量达到数百万吨, 2013年我国牡蛎产量421.9万吨, 占海水养殖总产量的24.26%(农业部渔业渔政管理局, 2014)。
近几年, 随着长牡蛎养殖规模的扩大, 产量大幅度提高, 但其品质却在下降, 种质也出现退化。表现为出肉率低、形状不规则、肉质差的特点, 养殖单位和广大消费者迫切需要产量高、品质好的长牡蛎新品种。因此, 应用传统的定向选育和杂交育种方法, 进行长牡蛎遗传改良、培育名优新品种, 是推动我国长牡蛎养殖品种的良种化, 使我国由牡蛎养殖大国向牡蛎养殖强国转变的重要技术手段。我国的牡蛎良种选育工作开展较晚, 但发展迅速。目前, 利用群体继代选育方法, 已经在我国培育出了第一个长牡蛎快速生长新品种“海大 1号”。在国外, 美国农业部的WRAC(Western Regional Aquaculture Center)主要研究杂交育种是否具有提高牡蛎产量的潜力。研究表明,通过建立配套系或者近交系, 进行杂交育种是提高长牡蛎生长和存活性状的重要途径(Britten, 1996;Hedgecock et al, 2007)。
有关牡蛎杂交的研究在 20世纪 80年代即有报道。Mallet等(1983)对未经选育的美洲牡蛎进行了群体间杂交, 发现杂交子代在总重和存活率方面存在杂种优势。Hedgecock等(1995)验证了长牡蛎近交系间杂交获得的子代的杂合度与生长和存活成正相关。Hedgecock等(2007)利用近交系进行完全双列杂交,通过分析配合力和回交效应, 筛选出了最佳的杂交组合。宋盛亮等(2011)利用中国、日本和韩国三个地理群体的长牡蛎F2代选育系进行了杂交子代的早期生长发育研究, 部分杂交组合在生长和存活方面表现出杂种优势。目前, 有关牡蛎杂交育种方面的研究主要集中在利用牡蛎种间杂交评估生长优势(张跃环等, 2012, 2014; 郑怀平等, 2012; Huo et al, 2013)和对不同长牡蛎选育群体进行种内杂交, 分析幼虫阶段生长性状和存活性状的杂种优势(宋盛亮等, 2011; 孔令锋等, 2013)等方面, 未见关于利用多代选育系进行种内杂交分析成体阶段生长性状的报道。
作者于2007年从日本宫城、韩国釜山引进野生群体以及采用中国乳山养殖群体, 建立快速生长定向选育系, 至 2010年这三个选育系已选育至第四(F4)代。群体选育的代数越高, 群体间的遗传分化越大,产生杂种优势的可能性就越大(Sheridan, 1997)。本实验以中国、日本和韩国长牡蛎F4代选育群体为材料,采用完全双列杂交, 通过构建家系的方式, 建立选育系间杂交和自交群体, 分析各个交配组合的生长性能, 剖分生长性状的加性(一般配合力)和非加性(特殊配合力)遗传组分, 为运用杂交育种, 培育长牡蛎优良新品种, 提高长牡蛎生长性状指标提供技术参数。
1 材料与方法
1.1 实验材料
2007—2010年期间, 在山东省文登市水产综合育苗试验基地对2007年采集的中国(C)、日本(J)和韩国(K)群体进行了四代定向选育。本实验用长牡蛎亲贝分别取自2010年构建的中国、日本和韩国选育群体。二龄贝时, 在每个选育群体中选取壳形规则, 湿重较大的个体作为亲贝。壳高48.96—105.92 mm, 湿重21.10—73.80 g。实验于2012年6月在山东省蓬莱海益苗业有限公司莱州分公司进行。
1.2 实验设计
采用3×3完全双列杂交的方式, 构建选育组合共9组, 其中自交组合3个: 中♂×中♀(C♂C♀), 日♂×日♀(J♂J♀), 韩♂×韩♀(K♂K♀); 正反交组合 6 个:C♂J♀, C♂K♀, J♂C♀, J♂K♀, K♂C♀, K♂J♀。实验采用家系构建的方式, 每个交配组合构建 3-5个家系,共计33个家系(表1)。
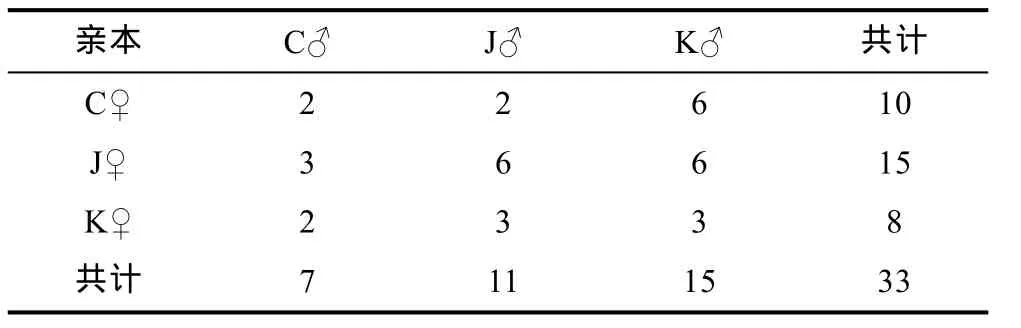
表1 交配表及每个交配组合中的家系数量Tab.1 Mating schedule and number of families of each group
1.3 实验方法
1.3.1 人工授精孵化与幼虫培育 从 C、J、K选育群体中分别挑选性腺发育良好的雌、雄个体, 要求亲本壳形规则、贝壳完整。实验采用人工解剖受精的方式, 将每个雌性个体的卵子解剖后放置于 10 L小桶中, 在22°C海水的小桶中促熟30 min。等卵子熟化后解剖雄性个体, 将精卵混合, 采用单对单受精模式建立家系。孵化密度控制在30—50个/ml, 温度控制在22—23°C, 受精后约22 h, 发育到D形幼虫。
为保证每个交配组合中各家系幼虫的数量一致,将每个交配组合家系的幼虫分别选优至100 L聚乙烯桶中培育, 初始D形幼虫密度10个/mL。每个家系取相同数量的 D形幼虫, 按照正反交和自交组合的交配设计将相应的家系进行混合。混合过程中, 保证各个实验组的养殖密度一致, 最终密度控制在5个/mL,在200L的聚乙烯桶中进行培育。
当幼虫平均壳高在 200μm 左右时, 将密度调整至 1—2个/mL。水温控制在 22—23°C, 持续充气。幼虫培育早期, 每天换水一次, 换水量 1/3—1/2; 幼虫培育后期, 每天换水两次, 换水量 1, 每周清底一次, 所用海水经过砂滤处理。饵料以等边金藻(Isochrysis galbana)和小球藻(Cholorella pyrenoidosa)为主, 后期辅助投喂扁藻(Platymonas helgolandica),投饵量根据幼虫的消化腺颜色情况和水中残饵情况确定。各实验组投饵、换水、充气等操作一致。所用试验器具都在淡水中浸泡10min以上, 然后晒干, 杀死残留幼虫, 避免各试验组之间相互污染。
1.3.2 稚贝及成体培育 当 20%左右的幼虫出现眼点, 投放栉孔扇贝壳附着基, 保证每片附着基上附着5—10个稚贝。稚贝继续在室内培养10天后暂养于沉淀池, 确认自然海区无野生长牡蛎浮游幼虫污染后, 于2012年9月, 将各实验组放置于烟台崆峒岛(KTD)进行笼式浮筏悬挂养成。
1.3.3 数据测量 由于长牡蛎是一种固着型贝类,壳高小于4cm时, 仅测量壳高和壳长数据; 当壳高大于 4cm时, 将固着在扇贝壳附着基上的稚贝撬为单体牡蛎, 测量壳高、壳长、壳宽和湿重等生长性状指标。2012年12月(180日龄)、2013年5月(330日龄)和2013年9月(450日龄)测量长牡蛎成体的生长数据,测量时清除长牡蛎表面的附着物及野生小牡蛎, 每个交配组合测量100个左右个体。
1.4 统计分析
1.4.1 生长性状数据分析 利用SPSS16.0软件进行多组数据的单向方差分析(One-way ANOVA), 获得各个交配组合在各阶段各生长指标的平均值、标准差和标准误, 以 P<0.05作为差异显著水平, 对其平均值进行LSD, Turkey多重比较; 利用SPSS16.0软件中的相关性分析模块, 对不同生长阶段生长指标进行皮尔逊相关性分析(丁国盛等, 2006)。
1.4.2 配合力计算 利用ASReml-R软件, 采用混合线性模型和约束极大似然法估算生长性状的配合力, 其线性混合模型(亲本模型)为:

式中, yij系第i个父本群体与第j个母本群体杂交的生长性状观测值, μ为生长性状的总体均数, Mi为母本效应, Dj为父本效应, MDij为杂交组合效应, eij为随机误差效应。其中μ作为固定效应, 其它因子作为随机效应(林元震等, 2014)。
1.4.3 杂种优势效能
式中, CV指的是杂交组合表型值(Cross value), MPV指中亲值(Mid-parent value), L指的是两亲本自交系表型性状平均值的绝对值(Griffing, 1990; Hedgecock et al, 2007)。效能值大于1.0作为具有杂种优势的标准(Griffing, 1990)。
2 结果
2.1 各个交配组合在不同生长阶段生长性状的统计性描述
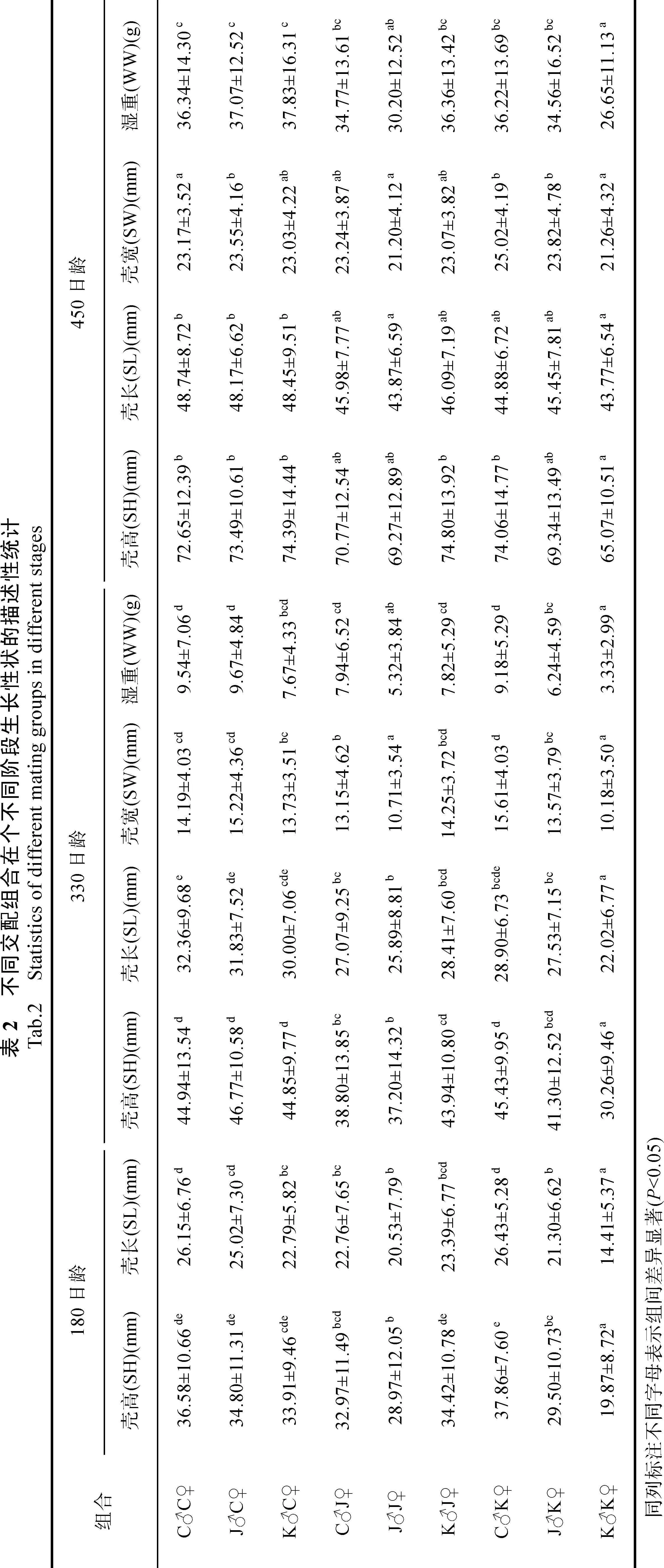
以交配组合为单位, 分别统计长牡蛎各组合在不同生长阶段壳高、壳长、壳宽和湿重各生长指标的平均值, 并进行显著性检验, 统计结果见表2和图1、图2。
180日龄, 各交配组合平均壳高范围为 19.87—37.86 mm, 平均壳长为14.41—26.43 mm。杂交组合C♂K♀的平均壳高值最大, 是自交组合K♂K♀的1.91倍, 两组间差异显著(P<0.05)。330日龄, 各交配组合平均壳高、壳长、壳宽和湿重的变化范围依次是为:30.26—46.77 mm, 22.02—32.36 mm, 10.18—15.61 mm和 3.33—9.18 g。杂交组合 J♂C♀各生长指标值均为最大(壳长除外, 为第二高值), 其生长优势明显, 自交组合K♂K♀生长最慢。杂交组合J♂C♀的平均湿重是自交组合K♂K♀的2.76倍, 且差异显著(P<0.05)。450日龄, 壳高、壳长、壳宽和湿重等生长指标最大值的组合各不相同。其中, K♂J♀壳高平均值最大,C♂C♀壳长平均值最大, C♂K♀壳宽平均值最大,K♂C♀湿重平均值最大。但是这四个组合在平均壳高、壳长和湿重方面差异性不显著(P>0.05)。以产量(湿重)为主要指标, 杂交组合 K♂C♀生长优势明显,自交组合K♂K♀生长最慢。
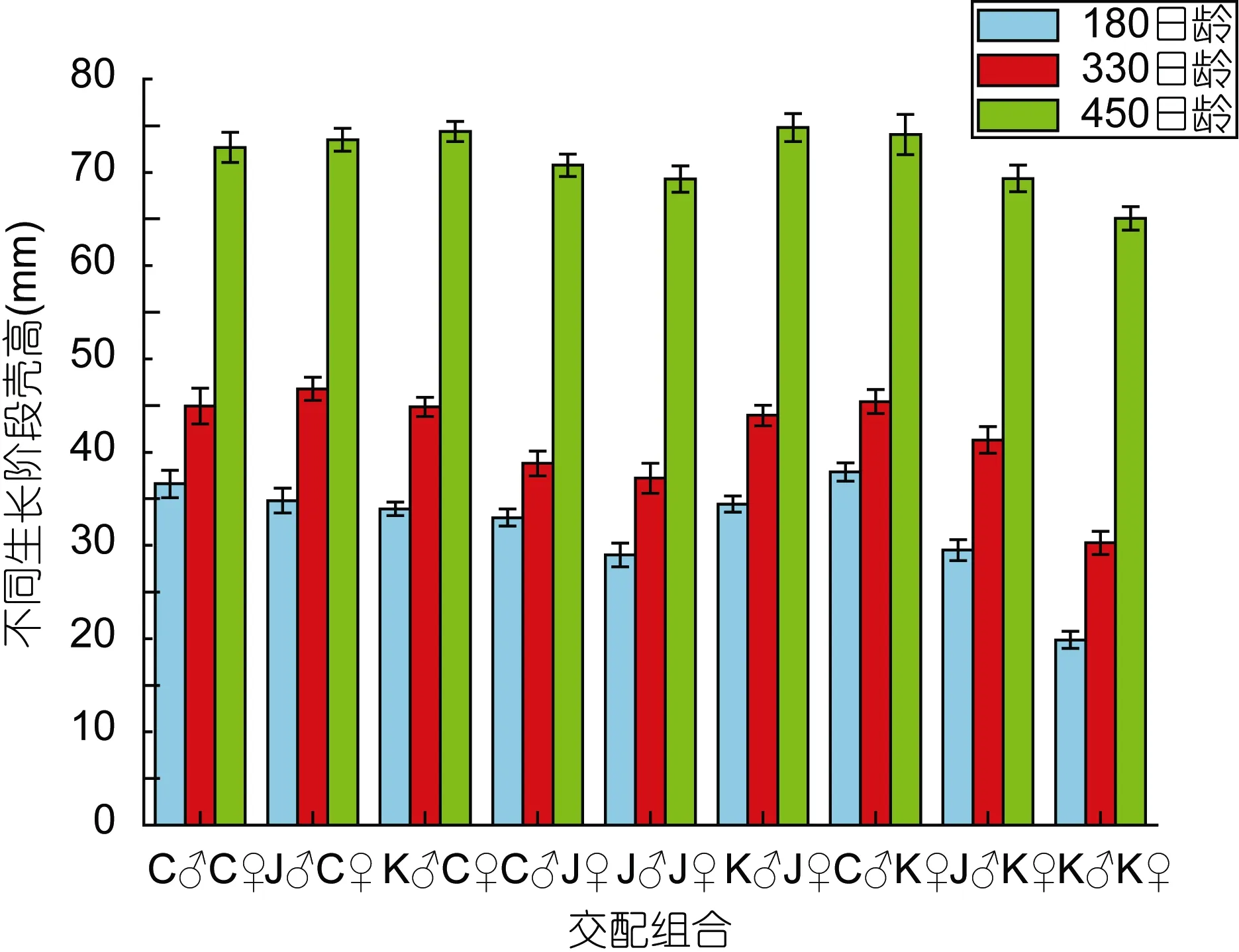
图1 不同生长阶段各交配组合壳高的比较Fig.1 Comparison in shell height at different growth stages of each group

图2 不同生长阶段各交配组合湿重的比较Fig.2 Comparison in wet weight at different growth stages of each group
2.2 配合力分析
?
鉴于在长牡蛎商业化生产过程中主要关注个体大小(壳高)和产量高低(湿重), 故配合力分析时只对长牡蛎的壳高和湿重这两个生长性状指标进行分析。本实验设计采用刘来福等(1979)第一种方法, 即可以同时产生包括亲本自交子代和正、反交子代材料, 共有(n2, n=3)9个组合。因此, 通过本实验可以同时估算父本和母本一般配合力(加性遗传)效应和子代特殊配合力(非加性遗传)效应。
中国F4代选育群体的父母本在三个生长阶段多数具有较高的一般配合力效应值, 而韩国 F4代选育群体父母本一般配合力效应值较低, 均具为非正值(表 3)。不同交配组合在不同生长阶段表现出不同的特殊配合力效应值(表4)。180日龄, 壳高平均值最大的杂交组合为C♂K♀, 是最大GCA效应值(gC♂=2.21,gK♀=0.00)和最大 SCA 效应值(sC♂K♀=4.95)的组合。与之不同的是, 在330日龄, 壳高和湿重平均值最大的杂交组合均为 J♂C♀, 但是其父本 GCA效应值并不是最大值。在450日龄时, 壳高平均值最大的杂交组合为 K♂J♀, 其父母本的 GCA 效应值(gK♂=0.00,gJ♀=0.06)均不是最大值, 但是其 SCA 效应值(sK♂J♀=3.33)最大; 湿重平均值最大的杂交组合为K♂C♀, 其父母本的 GCA 效应值(gK♂=0.00, gC♀=0.39)均是最大值, 其 SCA 效应值(sK♂C♀=2.87)接近于最大值 2.99。可见, 一般配合力(加性效应)和特殊配合力(非加性效应)在不同生长阶段发挥着不同的作用。
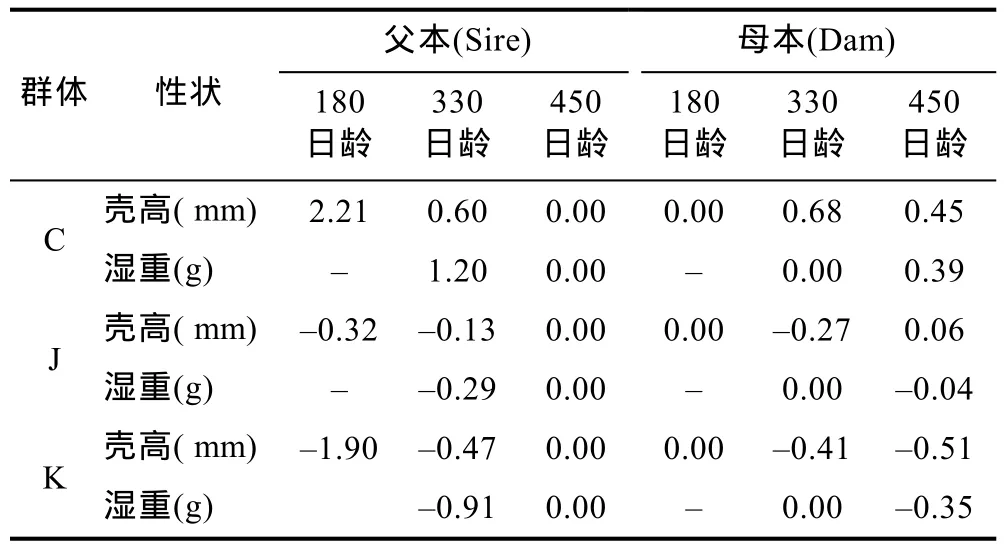
表3 不同群体主要生长性状的父母本一般配合力效应值Tab.3 General combing ability in main growth traits of sire and dam in different groups
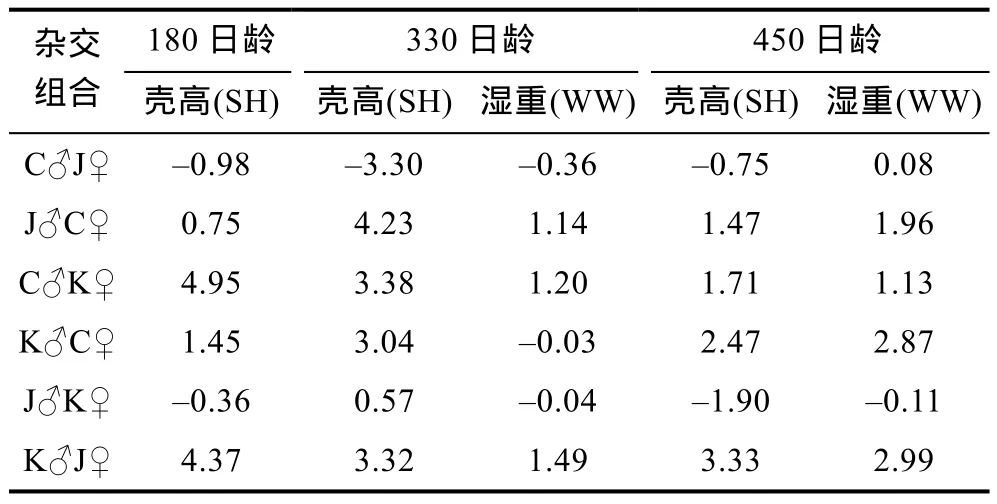
表4 不同交配组合主要生长性状的特殊配合力效应值Tab.4 Specific combing ability in main growth traits of different mating groups
2.3 杂种优势效能
在不同生长阶段, 多数(19/30)杂交组合的壳高和湿重指标表现出杂种优势(表 5), 符合 Griffing(1956)数量遗传学意义上的杂种优势(hp>1.0)。杂交组合C♂J♀在330日龄和450日龄的壳高指标表现出杂种劣势(hp<0), 但是其反交组合 J♂C♀的壳高和湿重指标表现出杂种优势(180日龄除外)。330日龄时,C♂J♀的壳高比中亲值41.07 mm小2.13 mm。而J♂C♀壳高比中亲值大5.70 mm。日本F4代选育群体和韩国F4代选育群体不论是正交(J♂K♀)还是反交(K♂J♀)组合的效能值均大于 1.0, 均表现出不同程度的杂种优势。450日龄时, K♂J♀的壳高效能值是J♂K♀的3.52倍。实验结果表明, 正反交组合存在明显的正反交效应。

表5 各杂交组合主要生长性状参数的杂种优势效能值Tab.5 Heterosis potence of main growth traits in hybridized groups
2.4 不同生长阶段的相关性分析
假如能从长牡蛎早期生长阶段预测商品规格收获时期的生长情况, 就可以节省大量养殖试验成本和加快杂交育种的进程。对180日龄、330日龄和450日龄长牡蛎的壳高和湿重进行了两两相关性分析, 并进行了显著性检验(P=0.01), 结果发现, 180日龄、330日龄和450日龄壳高的相关性均高于0.92(表6), 且达到显著性水平(P<0.01)。330日龄和 450日龄湿重也成正相关,相关系数为0.895, 且达到显著水平(P=0.001)。

表6 不同生长阶段的相关性分析结果Tab.6 Results of correlation analysis on traits of different growth stages
3 讨论
3.1 自交组合与杂交组合生长性状的差异
在本实验中大多数杂交组合表现出生长优势,但在不同生长阶段个别自交组合也表现出好的生长性能(如: 180日龄和330日龄自交组合C♂C♀), 然而自交组合 K♂K♀在不同生长阶段生长性能表现均为最差。杂种优势的利用一般是在亲本种群纯合子基因型频率尽可能增加, 个体间差异尽可能减小的基础上进行(Sheridan, 1997)。在本实验中, 杂交子代的表型值并不都比最优亲本的表型值高, 主要有两个方面的原因: 一是在对亲本群体进行继代选育过程中,为了有效防止近交衰退的发生, 在获得高的遗传进展的同时, 通过增加有效繁殖亲本的数量和平衡有效亲本精卵的贡献率, 最大程度的避免了三个继代选育群体的遗传多样性丢失(王庆志, 2011); 二是虽然本实验用材料已经进行了四代继代选育, 但是从表型值的变异系数看, 各个自交系的变异系数仍较大。结合各自交系的生长性能, 实验结果说明中国F4代群体还有较大的选育空间。
3.2 配合力与杂种优势效能值
不同品系/种群间杂交能否获得好的效果, 其遗传基础是基因的加性效应。遗传力主要是由加性效应决定, 一般配合力也是由基因的加性效应控制(盛志廉等, 1999)。有学者对长牡蛎生长性状遗传参数估计,结果显示幼体阶段壳高和壳长为中高遗传力(王庆志等, 2009), 成体阶段壳高和湿重的遗传力分别为0.35和0.27(王庆志等, 2012)。中国F4代选育群体壳高和湿重的父母本一般配合力(加性效应值)大多为正值,而韩国F4代选育群体壳高和湿重父母本一般配合力均为负值, 说明中国 F4代选育群体作为亲本时可将性状优势稳定传递给杂交子代。
杂交子代的表型值会随着一般配合力的增加而增大(Langdon et al, 2003), 但非加性因素有时却是影响产量的最大因素, 即表型值高的杂交子代常会具有高的特殊配合力效应值和较低的一般配合力效应值(Hedgecock et al, 2007)。在水产动物中, 皱纹盘鲍(Haliotis discus hannai)、海湾扇贝(Argopectens irradias)的生长性状和凡纳滨对虾(Litopenaeus vannamei)的存活性状均存在较高的非加性效应(Zheng et al, 2006; Deng et al, 2010; 王浩等, 2013),因此, 可以通过特殊配合力分析指导杂交育种(邓岳文, 2005)。
在本试验数据分析过程中, 杂种优势效能值计算方法不同于传统动物学家的定义, 我们所采用的公式更能体现杂种子代是否超过了最优的亲本值(Hedgecock et al, 2007)。与SGA相似, 杂交优势的遗传学基础也主要是非加性效应(显性效应和上位效应)。邓岳文(2005)认为遗传力低、近交时衰退严重的性状, 在进行杂交育种时, 杂种优势(非加性效应)较大。
在杂交育种过程中, 是应该主要参考 GCA效应值、SCA效应值还是杂交效能值?Hedgecock等(2007)认为, 选择近交亲本系和进行一般配合力与特殊配合力效应值评估应同时进行。杂交育种的目的是获得具有优良生长性能的杂交子代, 并对其进行商业推广。但是在大规模商业化推广之前, 首先要测试杂交子代的生长性能, 在此过程中通过对数据的分析, 获得亲本的GCA效应值、杂交子代的SCA效应值和杂种优势效能值。由于GCA效应值属于加性遗传范畴,可以保证亲本的优良性状稳定地遗传给杂交子代,故 GCA效应值可以指导亲本的选择。杂交子代的SCA效应值和杂种优势效能值都属于非加性效应范畴, 故可以在试验范围内筛选 SCA效应值和杂种优势效能值高的杂交组合进行大规模商业化推广。
3.3 不同生长阶段的相关性分析
通过相关性分析, 结果表明不同发育阶段存在正相关, 而且相关系数均大于0.89。按照传统的杂交育种进程, 在长牡蛎杂交育种过程中, 需要对多个品系或者种群进行杂交测试, 这需要大量的养殖空间,加之养到商品规格需要的时间长, 这在时间和空间上制约了杂交育种的开展。但是本实验发现不同生长阶段的相关系数高, 可以大幅缩短育种过程中的测试时间和养殖成本, 可加速优良杂交组合的商业化推广进程。
4 结论
综上所述, 杂交组合 C♂K♀、J♂C♀和 K♂J♀分别在180日龄、360日龄和450日龄表现出较大的生长优势, 而自交组合 K♂K♀在各个生长阶段均表现出生长劣势。中国F4代选育群体的GCA效应值高,适合作为杂交候选父母本; K♂J♀、K♂C♀、J♂C♀的SCA效应值和杂种优势效能均较高, 可进行商业化推广。不同生长阶段相关系数大于0.89, 可实现早期生长对商品期长牡蛎最佳杂交组合的预测, 这将大幅缩短育种过程中的测试时间和养殖成本, 可加速优良杂交组合的商业化推广进程。
丁国盛, 李 涛, 2006. SPSS统计教程: 从研究设计到数据分析. 北京: 机械工业出版社
王 浩, 罗 坤, 栾 生等, 2013. 凡纳滨对虾多个引进群体的杂交配合力分析. 水产学报, 37(4): 489—495
王庆志, 2011. 长牡蛎品种选育与生长性状的遗传参数估计.青岛: 中国海洋大学博士学位论文
王庆志, 李 琪, 刘士凯等, 2009. 长牡蛎幼体生长性状的遗传力及其相关性分析. 中国水产科学, 16(5): 736—743
王庆志, 李 琪, 刘士凯等, 2012. 长牡蛎成体生长性状的遗传参数估计. 中国水产科学, 19(4): 700—706
孔令锋, 滕爽爽, 李 琪, 2013. 长牡蛎中国群体与日本群体杂交子一代的生长和存活比较. 海洋科学, 37(8): 78—84
邓岳文, 2005. 皱纹盘鲍数量遗传与育种研究. 青岛: 中国科学院海洋研究所博士学位论文
刘来福, 黄远樟, 1979. 作物数量遗传学基础四、配合力: 完全双列杂交(上). 遗传, 1(6): 45—47
农业部渔业渔政管理局, 2014. 中国渔业统计年鉴. 北京: 中国农业出版社
宋盛亮, 李 琪, 孔令锋, 2011. 不同地理群体长牡蛎杂交子代的早期生长发育. 中国海洋大学学报, 41(12): 30—35
张跃环, 王昭萍, 闫喜武等, 2012. 太平洋牡蛎与近江牡蛎的种间杂交. 水产学报, 36(8): 1215—1224
张跃环, 王昭萍, 喻子牛等, 2014. 北方沿海香港牡蛎(♀)×长牡蛎(♂)杂种中期优势评估. 水产学报, 38(9): 1310—1317
林元震, 陈晓阳, 2014. R与 ASReml-R统计分析教程. 北京:中国林业出版社
郑怀平, 王迪文, 林 清等, 2012. 太平洋牡蛎与葡萄牙牡蛎两近缘种间杂交及其早期阶段生长与存活的杂种优势.水产学报, 36(2): 210—215
盛志廉, 陈瑶生, 1999. 数量遗传学. 北京: 科学出版社
Britten H, 1996. Meta-analysis of the association between multilocus heterozygosity and fitness. Evolution, 50(6):2158—2164
Deng Y W, Liu X, Zhang G F et al, 2010. Heterosis and combining ability: a diallel cross of three geographically isolated populations of Pacific abalone Haliotis discus hannai Ino. Chinese Journal of Oceanology and Limnology,28(6): 1195—1199
Griffing B, 1956. Concept of general and specific combining ability in relation to diallel crossing systems. Australian Journal of Biological Sciences, (9): 463—493
Griffing B, 1990. Use of a controlled-nutrient experiment to test heterosis hypotheses. Genetics, 126: 753—767
Hedgecock D, Davis J P, 2007. Heterosis for yield and crossbreeding of the Pacific oyster Crassostrea gigas.Aquaculture, 272(S1): S17—S29
Hedgecock D, McGoldrick D J, Bayne B L, 1995. Hybrid vigor in Pacific oysters: an experimental approach using crosses among inbred lines. Aquaculture, 137(1—4): 285—298
Huo Z M, Wang Z P, Yan X W et al, 2013. Fertilization, Survival,and Growth of Crassostrea hongkongensis ♀ × Crassostrea ariakensis ♂ Hybrids in Northern China. Journal of Shellfish Research, 32(2): 377—385
Langdon C, Evans F, Jacobson D et al, 2003. Yields of cultured Pacific oysters Crassostrea gigas Thunberg improved after one generation of selection. Aquaculture, 220(1—4):227—244
Mallet A L, Haley L E, 1984. General and specific combining abilities of larval and juvenile growth and viability estimated from natural oyster populations. Marine Biology,81(1): 53—59
Sheridan A K, 1997. Genetic improvement of oyster production——a critique. Aquaculture, 153(3—4): 165 —179
Zheng H P, Zhang G F, Guo X M et al, 2006. Heterosis between two stocks of the bay scallop, Argopecten irradians Lamarck(1819). Journal of Shellfish Research, 25(3): 807—812

