长牡蛎(Crassostrea gigas)两个Dmrt家族基因的时空表达*
张 娜 黄 雯 许 飞 李 莉 张国范 郭希明
(1. 海洋生态养殖技术国家地方联合工程实验室 中国科学院海洋研究所 青岛 266071; 2. 中国科学院大学 北京 100049;3. Haskin Shellfish Research Laboratory, Institute of Marine and Coastal Sciences, Rutgers University, Port Norris, New Jersey USA 08349)
Dmrt (Doublesex and mab-3 related transcription factor)是近年来比较受关注的一个基因家族, 因为这个家族中的一些基因在无脊椎和脊椎动物中都与性别决定和两性分化相关。DM 结构域最先在果蝇(Drosophila melanogaster)的性别调控基因Doublesex中发现的(Burtis et al, 1989), 随后又在很多物种, 如鱼类(Guan et al, 2000; Marchand et al, 2000; Kondo et al, 2002; Nanda et al, 2002; Koopman et al, 2003;Ohmuro-Matsuyama et al, 2003)、鸟类(Raymond et al,1999; Smith et al, 1999; Ren et al, 2001)、爬行类(Raymond et al, 1999; Smith et al, 1999; Kettlewell et al, 2000)和哺乳类(Raymond et al, 1998; Raymond et al, 1999; Smith et al, 1999; De Grandi et al, 2000;Moniot et al, 2000; Kim et al, 2003)的同源基因中都发现了它的存在, 说明该家族的基因在无脊椎和脊椎动物中都是高度保守的。长牡蛎(Crassostrea gigas)中共编码 3个含有 DM 结构域的基因, 分别是Cg-DM1(CGI_10015952), CgDsx(CGI_10019568)以及CgDmrtA2 (CGI_10001830) (Zhang et al, 2014)。编号为CGI_10015952的基因最初被Naimi等(2009)认定为 Cg-DMl, 并认为该基因具有与性腺发育相关的作用。CGI_10019568基因含有典型的 DM 结构域, 而且与果蝇的Doublesex (Dsx)基因同源关系很近, 因此被命名为CgDsx (Zhang et al, 2014)。果蝇的Dsx基因与线虫的Mab-3以及脊椎动物的Dmrt1基因都对雄性的性别决定起着关键的作用。果蝇的Dsx基因可通过可变剪切在卵巢和精巢中分别产生雌性和雄性两种剪切形式(Burtis et al, 1989)。线虫的Mab-3与脊椎动物的 Dmrt1基因都在雄性性腺中特异表达并促进雄性特征的发育(Smith et al, 2009; Kopp, 2012)。
CGI_10001830除了含有Dmrt家族共有的DM保守结构域外, 还含有 Dmrt家族的亚族(subfamily)DmrtA的DMA结构域, 而且其与 DmrtA2(Dmrt5)同源性很高, 因此将其命名为 CgDmrtA2 (Zhang et al,2014)。DmrtA家族成员包括Dmrta1(Dmrt4), Dmrta2(Dmrt5), Dmrta3(Dmrt3) (Volffet al, 2003)。在小鼠中,Dmrt4在各组织中都有表达(Balciunieneet al, 2006)。牙鲆(Paralichthys olivaceus)的 Dmrt4在精巢中表达量很高, 在卵巢中几乎没有表达, 另外在脑部和鳃中的表达量也远远高于其它组织, 因而牙鲆的Dmrt4在性腺, 神经以及感觉器官的发育过程中可能起到重要作用(Wen et al, 2009)。而该基因在青鳉中的表达模式却很特殊, 只在耳板和苦胆中表达(Winkler et al,2004)。在斑马鱼胚胎发育时期, Dmrt5在原肠胚后期表达量很高, 并主要表达于胚胎时期的中枢神经系统, 特别是中脑及中后脑的神经系统, 而且其在斑马鱼的雌雄性腺的生殖细胞中均有表达(Guoet al,2004)。在斑马鱼体节发生过程中, Dmrt5只在端脑,中脑和嗅板中表达, 其对后部-背部端脑细胞的分化起着重要的作用(Yoshizawa et al, 2011)。Dmrt5在非洲爪蟾蜍胚胎发育过程中, 对于神经系统的发生具有重要的调节作用(Parlier et al, 2013)。另外, Dmrt5对小鼠胚胎早期大脑的皮层及腹侧中脑神经系统的发育都是不可或缺的(Kim et al, 2003; Gennet et al,2011; Konno et al, 2012; Saulnier et al, 2013)。在斑马鱼中, Dmrta3即Dmrt3对于嗅板、神经管和生殖细胞的发育都具有潜在的影响(Li et al, 2008)。在小鼠和鸡中, Dmrt3只在胚胎中表达, 其中在小鼠胚胎的前脑,神经管和鼻腔结构中表达, 在鸡胚胎早期形成的体节,体节前中胚层以及勒氏管中表达(Smith et al, 2002)。
Cg-DM1(CGI_10015952)基因已被详细报道过(Naimiet al, 2009)。Zhang等(2014)通过对基因组和转录组的分析发现CgDmrtA2可能和性别决定无关, 而CgDsx可能和性别决定有关。鉴于Zhang等的结果是基于有限的转录组数据, 因此作者进一步通过实时荧光定量PCR分析对Zhang等的转录组结果加以印证, 对长牡蛎的CgDsx以及CgDmrtA两个基因进一步分析, 研究这两个基因在长牡蛎的雌雄个体、组织间的表达特征以及在幼虫各发育时期的时空表达模式, 以确定这两者在长牡蛎性别决定中可能发挥的作用。
1 材料与方法
1.1 实验材料
实验所用成体长牡蛎于2013年5月取自青岛市崂东养殖场, 为处于成熟期的二龄牡蛎, 用显微镜检验雌雄后分别取三只雌性和三只雄性的外套膜、鳃、闭壳肌和性腺组织样品用于RNA提取。幼虫样品也取自青岛崂东海珍品良种培育有限公司, 发育时期通过显微镜观察确定后, 在适当的时间点取样。样品取出后立刻用液氮冷冻, 随后转移到–80°C冰箱保存。
1.2 总RNA的提取及cDNA模板的合成
将取得的样品用液氮充分研磨之后取 100mg左右的干粉将之加入Trizol Reagent (Invitrogen)中并按照说明书进行总 RAN的提取。提取到的总 RNA用1%的琼脂糖凝胶电泳检测 RNA的完整性, 用NanoDrop 2000 (Thermo Scientific)检测纯度与浓度。cDNA的合成使用PrimeScript® RT reagent Kit With gDNA Eraser (TaKaRa)试剂盒, 根据使用说明, 每20μL反应体系加入1μg的总RNA进行反转录, 得到的cDNA用于下一步的荧光定量PCR反应。
1.3 引物设计
本实验所涉及的引物序列详见表 1。引物使用Primer Premier 5.0软件进行设计, 送上海生工(Sangon)生物技术有限公司合成。引物稀释成10μmol/mL的浓度备用。

表1 实验涉及引物名称、序列及产物长度Tab.1 Primer name, sequence, and product length used in this study
1.4 序列比对
CgDsx以及 CgDmrtA2的蛋白序列可从 http://oysterdb.cn/上获得, 并在NCBI上搜索相关的同源蛋白序列, 用于蛋白序列比对分析。
1.5 实时荧光定量PCR检测
根据已知的CgDsx以及CgDmrtA2序列进行引物设计, 幼虫时期的内参基因使用 Ribosomal protein S18 (RS18), 成体时期的内参基因使用(Eukaryotic translation elongation factor 2 (EF2))。采用相对定量的方法对长牡蛎这两个 DM 家族基因在成体各组织及幼虫各时期的表达进行测定。实验采用ABI7500 Fast荧光定量PCR仪, SYBR Green I 荧光染料。反应体系如下:

反应条件: 95°C 30s, 一个循环; 95°C 5s, 60°C 30s, 40个循环。每个样品做3个重复, 另外再做3个无模板的阴性对照。通过ABI 7500 V2.0.2软件输出反应的Ct值, 采用2–ΔΔCt法对这两个基因在不同组织和不同幼虫时期的表达差异进行相对定量研究。
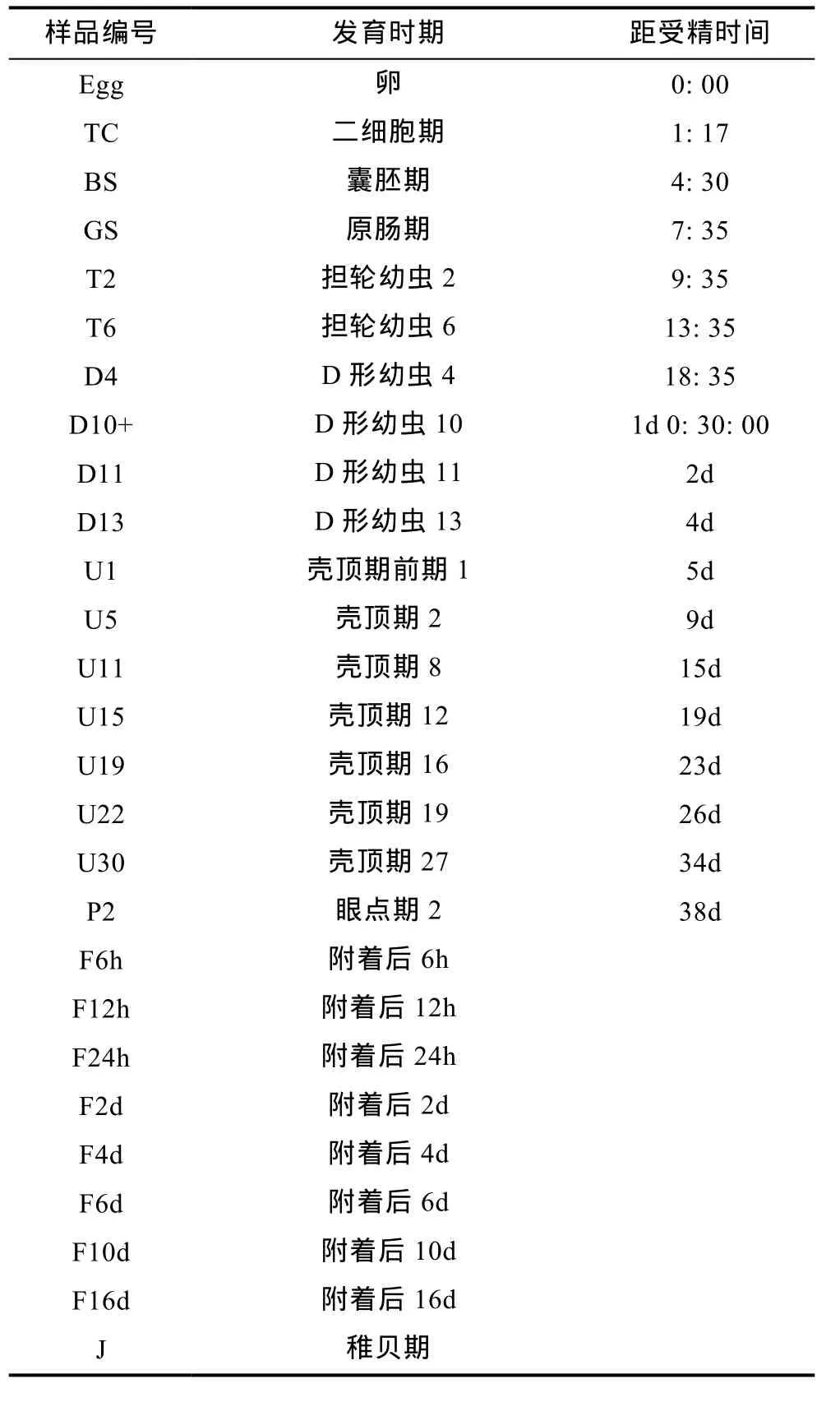
表2 幼虫分期明细Tab.2 Details of larval stages
2 结果
2.1 长牡蛎CgDsx与CgDmrtA2基因的同源比较与进化分析
2.1.1 CgDsx的同源比较与进化分析 CgDsx的序列分析及同源关系比对已经在Zhang等(2014)的文章中详细阐述过, 这里仅展示其与其它物种同源基因的蛋白序列比对结果(图1)。从图1中可以看出, 长牡蛎的 CgDsx氨基酸序列与其它物种的同源性不高,DM家族的成员之间除了共有的一个DM结构域之外,其它序列的保守性很低(Kopp, 2012)。
2.1.2 CgDmrtA2的同源比较与进化分析 长牡蛎的CgDmrtA2的ORF长1173bp, 编码390个氨基酸,含有2个外显子。该基因除了含有典型的DM结构域外, 还含有一个DmrtA家族特有的DMA结构域。而且该基因与 Dmrta2/Dmrt5亲缘关系较近, 因此被命名为DmrtA2 (Zhang et al, 2014)。CgDmrtA2与小鼠的Dmrta2(Dmrt5)同源性达到79% (e-value 5e-31), 与人类的同源性为77% (e-value 2e-31), 与斑马鱼的同源性为36% (e-value 2e-46), 与东方红鳍豚的同源性为37% (e-value 3e-44)。目前没有软体动物 Dmrta2/Dmrt5方面的报道, 也没有相关的数据可供比对, 目前数据显示, 牡蛎 CgDmrtA2与哺乳动物的 Dmrta2(Dmrt5)同源性更高。
2.2 长牡蛎CgDsx和CgDmrtA2基因的时空表达分析
2.2.1 长牡蛎CgDsx和CgDmrtA2基因在幼虫时期的表达分析 实验测定了包括卵子在内, 直至稚贝的27个时期(见表2)的表达模式。CgDsx在卵子到D型幼虫中后期的表达量较高, D型幼虫后期到稚贝期表达量开始降低, 卵子到 D型幼虫中后期的表达量平均值是其后表达量平均值的4.15倍。CgDmrtA2在卵子和二细胞期的表达量都很低, 到桑椹期开始增高, 到D4期的时候达到最高, 随之稍有下降, 到U11期又达到一个较高的水平, 到U30期降到低点, 之后未有明显升高。
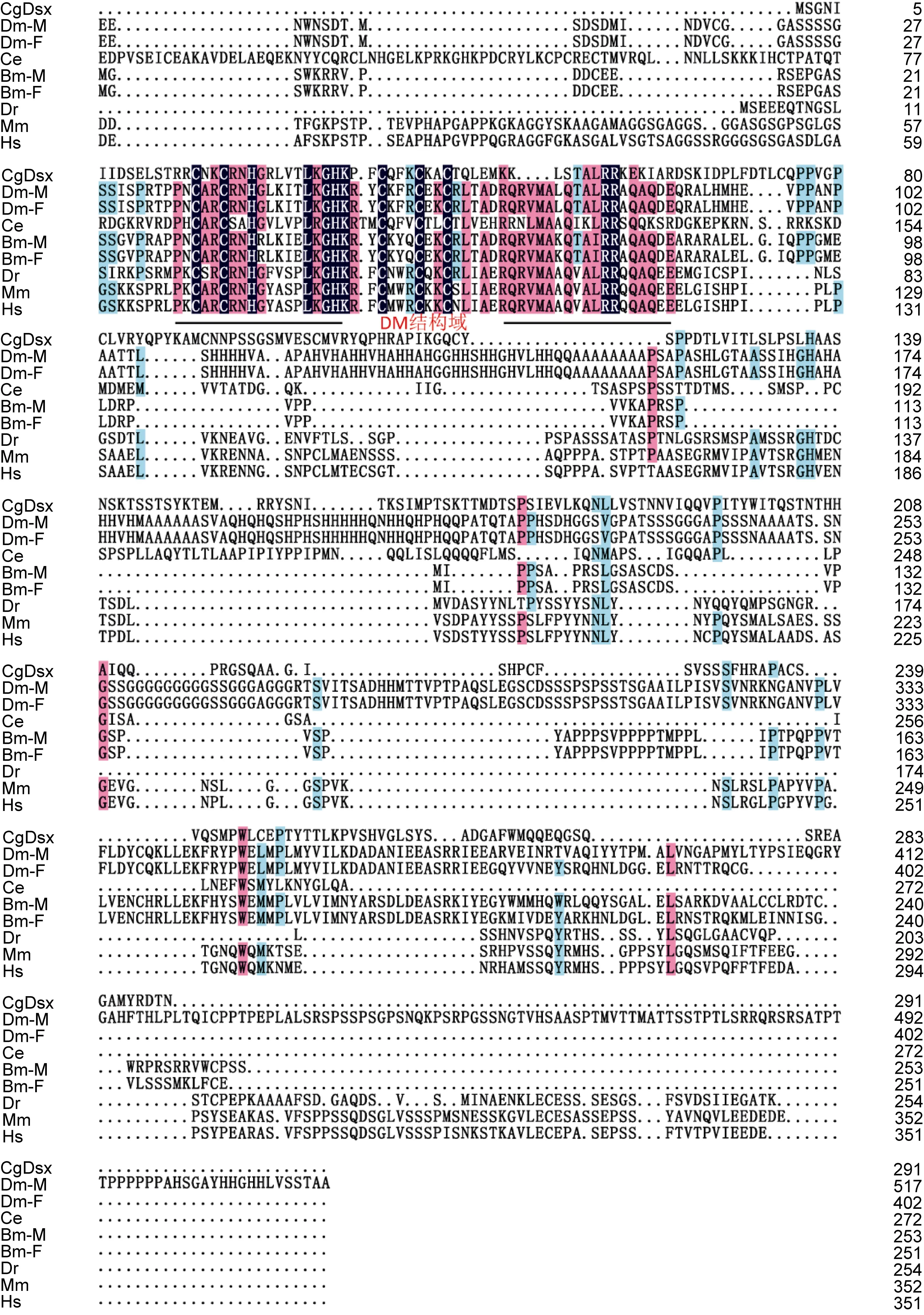
图1 长牡蛎和其它物种Doublesex同源基因的氨基酸序列比对Fig.1 Alignment of Doublesex homolog amino acid sequences of C. gigas and other species
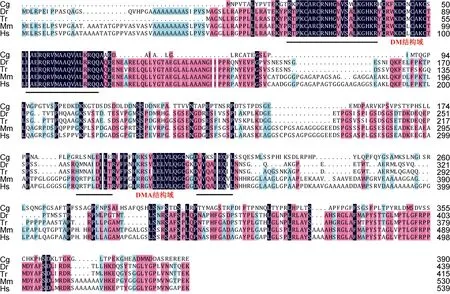
图2 长牡蛎和其它物种Dmrta2/Dmrt5基因的氨基酸序列比对Fig.2 Alignment of Dmrta2/Dmrt5 homolog amino acids sequences of C. gigas and other species
2.2.2 长牡蛎CgDsx和CgDmrtA2基因在不同组织中的表达分析 实验所用成体牡蛎均为二龄成熟期个体, 实验结果显示, CgDsx基因在雄性性腺中的表达量显著(P<0.01)高于其它组织, 雄性性腺的表达量是雌性性腺的8.9倍。在除性腺之外的体细胞组织中,CgDsx表达量低, 彼此间无太大差异。CgDmrtA2基因在各组织中均有表达, 在雄性性腺中表达量最低,在雌性性腺中最高, 雌性性腺的表达量是雄性性腺的5倍, 在另外3个组织中差异也不明显。
3 讨论
Dmrt家族基因的共有特征就是一个含有锌指结构可与特异DNA序列结合的保守结构域-DM结构域(Dmrt8除外(Veith et al, 2006))。该家族基因在许多种类, 包括节肢动物, 线虫类以及脊椎动物中都参与调控性别的分化与发育, 因而该基因家族可能是首例广泛分布的性别调控基因。在线虫C. elegans中, 含有DM结构域的Mab-3基对于雄性的发育是必需的,它与果蝇中的 Doublesex基因发挥类似的作用(Shen et al, 1988; Yi et al, 1999)。在脊椎动物中, Dmrt1基因展示出在早期的雄性性腺中特异表达的模式(Zarkower, 2001, 2002)。含有Dmrt1基因的区域被报道与人类男性的性逆转相关(Bennett et al, 1993;Crocker et al, 1988; Flejter et al, 1998; Guioli et al,1998; Veitia et al, 1997, 1998), 而且Dmrt1基因还是小鼠出生后精巢发育所必需的(Raymond et al, 2000)。珊瑚虫中也发现一种含有DM结构域的基因, 它同样表现出具有与性别决定和分化相关的功能(Miller et al, 2003)。
长牡蛎基因组中共发现 3个含有 DM结构域的Dmrt家族基因, 分别是 Cg-DM1 (CGI_10015952),CgDsx (CGI_10019568)以及CgDmrtA2 (CGI_10001830)(Naimi et al, 2009; Zhang et al, 2014)。而在线虫、果蝇和人类中的该家族基因的数目分别是 11个、4个和7个(Matson et al, 2012)。Cg-DM1(CGI_10015952)曾被报道过(Naimi et al, 2009)。CgDsx (CGI_10019568)与果蝇的 doublesex、线虫的Mab-3以及脊椎动物的Dmrt1是同源基因。CgDsx虽然含有3个外显子, 但没有表现出雌雄相关的可变剪切(Zhang et al, 2014)。定量 PCR结果表明它在雄性性腺中表达量最高,这和转录组结果一致, 它很可能在长牡蛎的性别决定中起关键作用或促进雄性发育。其在雌性性腺中也稍有表达, 雄性性腺的表达量是雌性性腺的 8.9倍,这或许意味着雌性性腺中存在着休眠的精子, 随时为性别转变做着准备。牡蛎的性腺中同时存在着两种生殖细胞, 这或许是性别转变的先决条件(Cole, 1941;Guo et al, 1998; Zhang et al, 2014)。
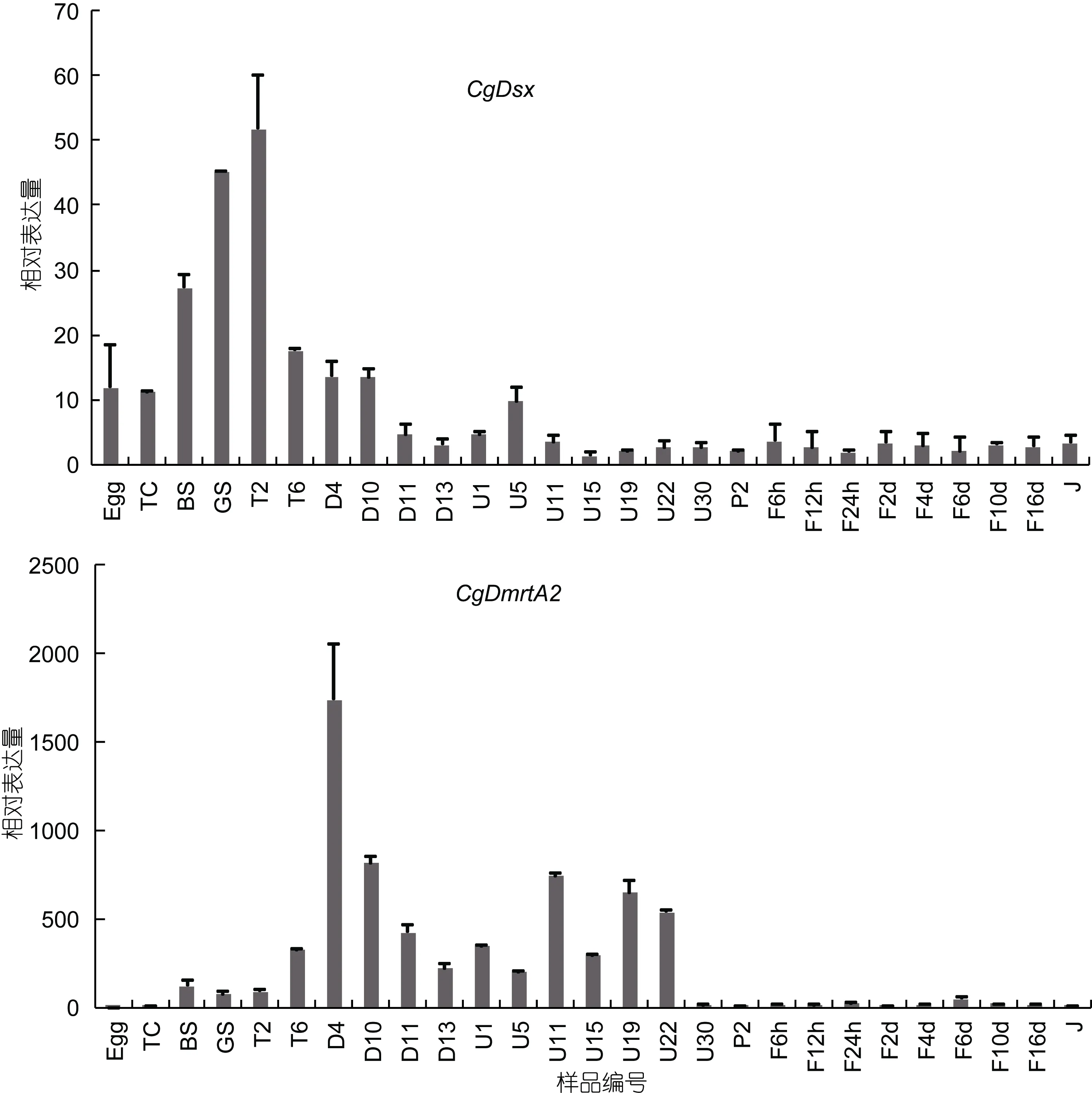
图3 Real-time qPCR检测CgDsx和CgDmrtA2在幼虫时期的表达模式Fig.3 Expression profiles of CgDsx and CgDmrtA2 in larval stages幼虫分期详见表2
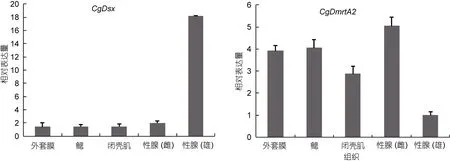
图4 CgDsx和CgDmrtA2在不同成体组织中的表达模式Fig.4 Expression profiles of CgDsx and CgDmrtA2 in different adult tissues
通过 DM 结构域的同源比对及进化分析发现,CgDsx与果蝇的doublesex聚到一起。CgDsx与无脊椎动物的同源基因进化距离较近, 与脊椎动物的Dmrt1进化距离较远(Zhang et al, 2014)。CgDsx在囊胚期到担轮幼虫初期表达量较高, 说明在该段时期的发育需要CgDsx的参与。
Cg01830(CGI_10001830)是 Dmrt家族的亚族DmrtA中的一员。通过同源比对及进化分析发现,Cg01830与Dmrta2/Dmrt5同源关系较近(Zhang et al,2014)。据报道, Dmrt5对大脑以及神经系统的发育具有重要的作用(Kim et al, 2003; Guo et al, 2004;Gennetet al, 2011; Yoshizawa et al, 2011; Konno et al,2012; Parlier et al, 2013; Saulnier et al, 2013)。在长牡蛎中, 该基因在卵子和二细胞期的表达量很低, 到桑椹期开始增高, 到 U22期一直保持较高的表达量,U30期降到低点, 之后未有明显升高。这说明,CgDmrtA2主要在长牡蛎的D形到U22期幼虫阶段合成, 在这期间发挥的作用可能也与其在斑马鱼及小鼠的胚胎中行使的功能类似, 与神经系统的形成相关。在成体中, 该基因在所有组织中均有表达, 雌性性腺中表达量最高, 其次是鳃和外套膜, 在雄性性腺中表达量最低, 但各组织间表达差异都不显著。因此该基因应不参与长牡蛎的性别决定和分化等功能,其具体功能还需要进一步探索与研究。
Balciuniene J, Bardwell V J, Zarkower D, 2006. Mice mutant in the DM domain gene Dmrt4 are viable and fertile but have polyovular follicles. Mol Cell Biol, 26(23): 8984—8991
Bennett C P, Docherty Z, Robb S A et al, 1993. Deletion 9p and sex reversal. J Med Genet, 30(6): 518—520
Burtis K C, Baker B S, 1989. Drosophila doublesex gene controls somatic sexual differentiation by producing alternatively spliced mRNAs encoding related sex-specific polypeptides.Cell, 56(6): 997—1010
Cole H A, 1941. Sex-Ratio in Urosalpinx cinerea, the American Oyster Drill. Nature, 147: 116—117
Crocker M, Coghill S B, Cortinho R, 1988. An unbalanced autosomal translocation (7;9) associated with feminization.Clin Genet, 34(1): 70—73
De Grandi A, Calvari V, Bertini V et al, 2000. The expression pattern of a mouse doublesex-related gene is consistent with a role in gonadal differentiation. Mech Dev, 90(2): 323—326 Flejter W L, Fergestad J, Gorski J et al, 1998. A gene involved in XY sex reversal is located on chromosome 9, distal to marker D9S1779. Am J Hum Genet, 63(3): 794—802
Gennet N, Gale E, Nan X S et al, 2011. Doublesex and mab-3-related transcription factor 5 promotes midbrain dopaminergic identity in pluripotent stem cells by enforcing a ventral-medial progenitor fate. P Natl Acad Sci USA,108(22): 9131—9136
Guan G J, Kobayashi T, Nagahama Y, 2000. Sexually dimorphic expression of two types of DM (Doublesex/Mab-3)-domain genes in a teleost fish, the Tilapia (Oreochromis niloticus).Biochem Bioph Res Co, 272(3): 662—666
Guioli S, Schmitt K, Critcher R et al, 1998. Molecular analysis of 9p deletions associated with XY sex reversal: Refining the localization of a sex-determining gene to the tip of the chromosome. Am J Hum Genet, 63(3): 905—908
Guo X M, Hedgecock D, Hershberger W K et al, 1998. Genetic determinants of protandric sex in the Pacific oyster,Crassostrea gigas Thunberg. Evolution, 52(2): 394—402
GuoY Q, Li Q, Gao Set al, 2004. Molecular cloning,characterization, and expression in brain and gonad of Dmrt5 of zebrafish. Biochem Bioph Res Co, 324(2):569—575
Kettlewell J R, Raymond C S, Zarkower D, 2000. Temperaturedependent expression of turtle Dmrt1 prior to sexual differentiation. Genesis, 26(3): 174—178
Kim S, Kettlewell J R, Anderson R C et al, 2003. Sexually dimorphic expression of multiple doublesex-related genes in the embryonic mouse gonad. Gene Expr Patterns, 3(1):77—82
Kondo M, Froschauer A, Kitano A et al, 2002. Molecular cloning and characterization of DMRT genes from the medaka Oryzias latipes and the platyfish Xiphophorus maculatus.Gene, 295(2): 213—222
Konno D, Iwashita M, Satoh Y et al, 2012. The mammalian DM domain transcription factor dmrta2 is required for early embryonic development of the cerebral cortex. PLoS One,7(10): e46577
Koopman P, Loffler K A, 2003. Sex determination: The fishy tale of Dmrt1. Curr Biol, 13(5): R177—R179
Kopp A, 2012. Dmrt genes in the development and evolution of sexual dimorphism. Trends Genet, 28(4): 175—184
Li Q, Zhou X, Guo Y Q et al, 2008. Nuclear localization, DNA binding and restricted expression in neural and germ cells of zebrafish Dmrt3. Biol Cell, 100(8): 453—463
Marchand O, GovorounM, D'Cotta H et al, 2000. DMRT1 expression during gonadal differentiation and spermatogenesis in the rainbow trout, Oncorhynchus mykiss.BBA-Gene Struct Expr, 1493(1—2): 180—187
Matson C K, Zarkower D, 2012. Sex and the singular DM domain: insights into sexual regulation, evolution and plasticity. Nat Rev Genet, 13(3): 163—174
Miller S W, Hayward D C, Bunch T A et al, 2003. A DM domain protein from a coral, Acropora millepora, homologous to proteins important for sex determination. Evol Dev, 5(3):251—258
Moniot B, Berta P, Scherer G et al, 2000. Male specific expression suggests role of DMRT1 in human sex determination. Mech Develop, 91(1—2): 323—325
Naimi A, Martinez A S, Specq M L et al, 2009. Identification and expression of a factor of the DM family in the oyster Crassostrea gigas. Comp Biochem Phys A Mol Inteqr Physiol, 152(2): 189—196
Nanda I, Kondo M, Hornung U et al, 2002. A duplicated copy of DMRT1 in the sex-determining region of the Y chromosome of the medaka, Oryzias latipes. P Natl Acad Sci USA, 99(18):11778—11783
Ohmuro-Matsuyama Y, Matsuda M, Kobayashi T et al, 2003.Expression of DMY and DMRT1 in the various tissues of the medaka, Oryzias latipes. Fish PhysiolBiochem, 28(1—4): 171
Parlier D, Moers V, Van Campenhout C et al, 2013. The Xenopus doublesex-related gene Dmrt5 is required for olfactory placode neurogenesis. Dev Biol, 373(1): 39—52
Raymond C S, Kettlewell J R, Hirsch B et al, 1999. Expression of Dmrt1 in the genital ridge of mouse and chicken embryos suggests a role in vertebrate sexual development. Dev Biol,215(2): 208—220
Raymond C S, Murphy M W, O'Sullivan M G et al, 2000. Dmrt1,a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation. Gene Dev, 14(20):2587—2595
Raymond C S, Shamu C E, Shen M M et al, 1998. Evidence for evolutionary conservation of sex-determining genes. Nature,391(6668): 691—695
Ren L L, Cheng H H, Guo Y Q et al, 2001. Evolutionary conservation of Dmrt gene family in amphibians, reptiles and birds. Chin Sci Bull, 46(23): 1992—1994
Saulnier A, Keruzore M, De Clercq S et al, 2013. The doublesex homolog Dmrt5 is required for the development of the caudomedial cerebral cortex in mammals. Cereb Cortex,23(11): 2552—2567
Shen M M, Hodgkin J, 1988. Mab-3, a gene required for sex-specific yolk protein expression and a male-specific lineage in C. elegans. Cell, 54(7): 1019—1031
Smith C A, Hurley T M, McClive P J et al, 2002. Restricted expression of DMRT3 in chicken and mouse embryos. Mech Develop, 119(Suppl): S73—S76
Smith C A, McClive P J, Western P S et al, 1999. Evolution-Conservation of a sex-determining gene. Nature, 402(6762):601—602
Smith C A, Roeszler K N, Ohnesorg T et al, 2009. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken. Nature, 461(7261): 267—271 Veith A M, Klattig J, Dettai A et al, 2006. Male-biased expression of X-chromosomal DM domain-less Dmrt8 genes in the mouse. Genomics, 88(2): 185—195
Veitia R A, Nunes M, Quintana-Murci L et al, 1998. Swyer syndrome and 46, XY partial gonadal dysgenesis associated with 9p deletions in the absence of monosomy-9p syndrome.Am J Hum Genet, 63(3): 901—905
Veitia R, Nunes M, Brauner R et al, 1997. Deletions of distal 9p associated with 46, XY male to female sex reversal:definition of the breakpoints at 9p23.3-p24.1. Genomics,41(2): 271—274
Volff J N, Zarkower D, Bardwell V J et al, 2003. Evolutionary dynamics of the DM domain gene family in metazoans. J Mol Evol, 57(Suppl 1): S241—S249
Wen A Y, You F, Tan X G et al, 2009. Expression pattern of dmrt4 from olive flounder (Paralichthys olivaceus) in adult gonads and during embryogenesis. Fish Physiol Biochem,35(3): 421—433
Winkler C, Hornung U, Kondo M et al, 2004. Developmentally regulated and non-sex-specific expression of autosomal dmrt genes in embryos of the Medaka fish (Oryzias latipes).Mech Develop, 121(7—8): 997—1005
Yi W, Zarkower D, 1999. Similarity of DNA binding and transcriptional regulation by Caenorhabditis elegans MAB-3 and Drosophila melanogaster DSX suggests conservation of sex determining mechanisms. Development, 126(5): 873—881 Yoshizawa A, Nakahara Y, Izawa T et al, 2011. Zebrafish Dmrta2 regulates neurogenesis in the telencephalon. Genes Cells,16(11): 1097—1109
Zarkower D, 2001. Establishing sexual dimorphism: Conservation amidst diversity? Nat Rev Genet, 2(3): 175—185
Zarkower D, 2002. Invertebrates may not be so different after all.Novart Found Symp, 244: 115—126
Zhang N, Xu F, Guo X M, 2014. Genomic analysis of the Pacific oyster (Crassostrea gigas) reveals possible conservation of vertebrate sex determination in a mollusc. Genes Genomes Genetics, 4(11): 2207—2217

