首款3D打印抗癫痫药物
——Spritam
刘 珍,孙明杰
(1.菏泽市牡丹区食品药品监督管理局食品药品稽查大队,山东菏泽274000;2.山东电力建设第一工程公司职工医院,山东济南250100)
·药物信息·
首款3D打印抗癫痫药物
——Spritam
刘 珍1,孙明杰2
(1.菏泽市牡丹区食品药品监督管理局食品药品稽查大队,山东菏泽274000;2.山东电力建设第一工程公司职工医院,山东济南250100)
2015年7月31日,美国食品药品监督管理局批准了Aprecia制药公司的首款采用3D打印技术制备的Spritam(左乙拉西坦,levetiracetam)速溶片上市,用于和其它抗癫痫药物联合治疗成人或儿童患者的局灶性发作、肌阵挛发作、以及原发性全身癫痫发作。Spritam采用Aprecia公司自主知识产权的ZipDose 3D打印技术生产,这种以3D打印技术制备的新型制剂内部成多空状,因为内表面积高能在短时间内被很少量的水融化。Spritam是美国FDA批准的首款采用3D打印技术制备的药物。
商品名:Spritam
通用名:左乙拉西坦,levetiracetam
化学名:(-)-(S)-α-乙基-2-氧合-1-乙酰胺吡咯烷
结构式:

1 作用机制
左乙拉西坦是一种吡咯烷酮衍生物,其化学结构与现有的抗癫痫药物无相关性。左乙拉西坦抗癫痫作用的确切机制尚不清楚。对毛果芸香碱和红藻氨酸诱导的癫痫局灶性发作继发的全身性发作的实验中观察到左乙拉西坦的保护作用。左乙拉西坦对复杂局灶性发作的大鼠点燃模型的点燃过程和点燃状态均具有抑制作用,但这些动物模型对人体特定类型癫痫的预测价值尚不明确。体外、体内试验显示,左乙拉西坦抑制海马癫痫样突发放电,而对正常神经元兴奋性无影响,提示左乙拉西坦可能选择性地抑制癫痫样突发放电的超同步性和癫痫发作的传播。左乙拉西坦在浓度高至10μmol·L-1时,对多种已知受体无亲和力,如苯二氮类、GABA、甘氨酸、NMDA、再摄取位点和第二信使系统。体外试验显示左乙拉西坦对神经元电压门控的钠离子通道或T-型钙电流无影响。左乙拉西坦并不直接易化GABA能神经传递,但研究显示对培养的神经元GABA和甘氨酸门控电流负调节子活性有对抗作用。
有研究表明,在大鼠脑组织中发现了左乙拉西坦的可饱和的和立体选择性的神经元结合位点,实验数据证实这个结合位点是突出小泡蛋白SV2A,认为涉及到小泡的胞吐作用的调整。虽然左乙拉西坦结合SV2A的意义还不清楚,但是左乙拉西坦和相关类似物表明SV2亲和力的等级次序与它们在有听原性癫痫发作倾向的小鼠中抗发作活性的能力有关。这些结果表明,左乙拉西坦与SV2A蛋白的相互作用可能有助于药物作用的抗癫痫机制。
2 药效动力学
左乙拉西坦在QTc间期延长部分的作用通过一项由52位健康受试者参与的随机、双盲、阳性对照(莫西沙星400 mg)和安慰剂对照的左乙拉西坦(1 000 mg或5 000 mg)交叉研究进行评价。最大安慰剂校正的90%置信区间的上限、基线校正的QTc间期在10 ms以下。因此,在该研究中,没有证据证实显著的QTc间期延长部分。
3 药代动力学
3.1 吸收与分布 左乙拉西坦的血药浓度峰值发生在受试者口服1 h左右。在健康志愿受试者的交叉研究中,用一口水冲服给予Spritam,结果显示,相对于禁食条件下用一杯水口服左乙拉西坦立即释放片剂,其具有当量率和吸收程度。高脂肪用餐不影响Spritam的吸收程度,但是其使Cmax降低了36%,使tmax延迟了3.4 h。
左乙拉西坦片的口服生物利用度是100%,片剂和口服溶液剂在吸收率和吸收程度上是生物等价的。食物不影响左乙拉西坦的吸收程度,但是它使Cmax降低20%,使tmax延迟1.5 h。超出剂量范围500~5 000 mg时,左乙拉西坦的药代动力学是线性的。多个每天2次给药后2 d即可达到稳定状态。左乙拉西坦及其主要代谢物少于10%结合于血浆蛋白质类,所以临床上与其它药物竞争蛋白结合位点而发生显著干扰是不太可能的。
3.2 代谢 左乙拉西坦在人体中不是广泛代谢的,其主要代谢途径是乙酰胺类的酶法水解,产生代谢产物羧酸、ucb L057(剂量的24%),并且不依赖任何肝脏细胞色素P450同工酶类。主要代谢产物在癫痫发作动物模型中是无活性的。两种较少的代谢产物经鉴定为羟基化产物2-氧基-吡咯环烷(剂量的2%)和在位置5上开放的2-氧基-吡咯环烷(剂量的1%)。这里没有左乙拉西坦或其主要代谢产物的对映体互变。
3.3 消除 在成人中左乙拉西坦血浆半衰期为(7±1)h,不受单次给药或是重复给药的影响。左乙拉西坦以未变化药物的形式(占给药剂量的66%)通过肾脏排泄从体循环中消除。机体总清除率为0.96 mL·(min·kg)-1,肾脏清除率为0.6 mL·(min·kg)-1。排泄机制是肾小球滤过以及随后部分的肾小管重吸收作用。代谢产物ucb L057是通过肾小球滤过和活跃的肾小管分泌排泄的,肾清除率为4 mL·(min·kg)-1。左乙拉西坦的消除是与肌酸酐清除率相关联的。在肾脏病损的患者中,左乙拉西坦的清除率是降低的。
4 临床研究
对难治性癫痫局灶性发作患者(伴或不伴有继发性全身发作)进行的3个多中心、随机、双盲和安慰剂对照的临床研究,建立了成年人左乙拉西坦作为加用治疗(其他抗癫痫药物的辅助治疗)的有效性数据。所有这些研究都涉及到了该片剂的成分。这些研究中,904名患者随机接受安慰剂、1 000 mg·d-1、2 000 mg·d-1或3 000 mg·d-1的治疗。进入研究1或研究2的患者患有至少2年的难治性癫痫局灶性发作,并服用两种以上传统抗癫痫药。进入研究3的患者患有至少1年的难治性癫痫局灶性发作,并服用1种传统抗癫痫药。在试验时,患者正服用至少1个最多2个抗癫痫药的稳定的给药方案。在基线阶段,每个4周的阶段患者必须至少发生2次局灶性发作。
4.1 临床研究1 研究1是在美国41个研究地点进行的双盲、安慰剂对照的平行试验,在一个12周基线阶段后,患者随机分配入左乙拉西坦剂量1 000mg·d-1(n=97)、左乙拉西坦3 000 mg·d-1(n=101)和安慰剂(n=95)组每日分2次给药。进行18周的治疗周期内(6周的逐量加药期+12周的评价期)的疗效评估,试验期间可同服抗癫痫药治疗方案保持不变。主要的疗效指标是在整个随机治疗阶段(逐量加药阶段+评价阶段)相对于安慰剂组每周局灶性发作频度下降百分比的组间比较。次要的疗效指标包括有效应答率(局灶性发作频度下降≥50%的患者发生率)。临床研究1的分析结果见表1。

表1 临床研究1中相对于安慰剂局灶性发作频度降低结果
在3个治疗组(X轴)的整个随机治疗期(加药期+评价期)内,局灶性癫痫发作频度从基线减低达到≥50%的患者比例(Y轴)见图1。
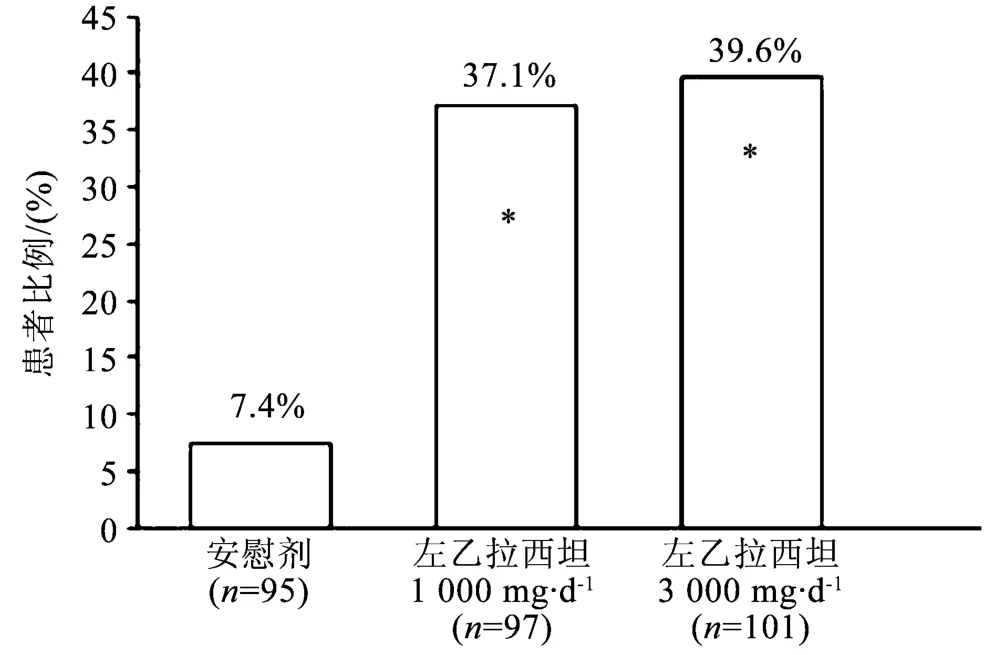
图1 临床研究1的应答率(从基线降低≥50%)注:*与安慰剂比较,在统计学上有显著性差异
4.2 临床研究2 研究2是在欧洲62个研究中心进行的双盲、安慰剂对照的交叉试验,用于比较左乙拉西坦1 000 mg·d-1(n=106)、左乙拉西坦2 000 mg·d-1(n=105)和安慰剂(n=106),每天分2次给药。
设计试验的第1阶段(阶段A)作为平行组试验来分析,在12周的基线阶段后,患者随机分至以上3组中,进行了16周的治疗周期(含4周的逐量加药期和12周的稳定剂量评价阶段)的疗效评估,在试验期间同服抗癫痫药的治疗方案保持不变。主要的疗效指标在整个随机治疗阶段(逐量加药期+评价阶段)相对于安慰剂组每周局灶性发作频度下降百分比的组间比较。两次结果的变量包括应答率(患者局灶性癫痫发作频度的发病率从基线降低≥50%)。阶段A的分析结果见表2。

表2 临床研究2阶段A中相对于安慰剂的局灶性发作频度降低结果
在3个治疗组(X轴)的整个随机治疗期(加药期+评价期)内,局灶性癫痫发作频度从基线减低达到≥50%的患者比例(Y轴)见图2。
与左乙拉西坦1 000 mg·d-1天比较,左乙拉西坦2 000 mg·d-1的应答率在统计学上有显著性差异(P=0.02)。该试验作为一个交叉分析得出了类似的结果。
4.3 临床研究3 研究3是在欧洲47个研究中心进行的双盲、安慰剂对照的平行组试验,分为左乙拉西坦3 000 mg·d-1组(n=180)和安慰剂组(n=104)。该研究比较了对伴有或不伴有继发性全身发作的难治性癫痫局灶性发作患者,仅同服一种抗癫痫药治疗,12周的基线阶段后,患者随机分配入的上述2个治疗组中的一个。16周的治疗周期由一个4周的逐量加药阶段,在12周的稳定剂量阶段进行了疗效的评估。主要的疗效指标在整个治疗阶段(逐量加药期+评价阶段)相对于安慰剂组每周局灶性发作频度下降百分比的组间比较,二次结果的变量包括应答率(患者局灶性癫痫发作频度的发病率从基线降低≥50%)。临床研究3的分析结果见表3。
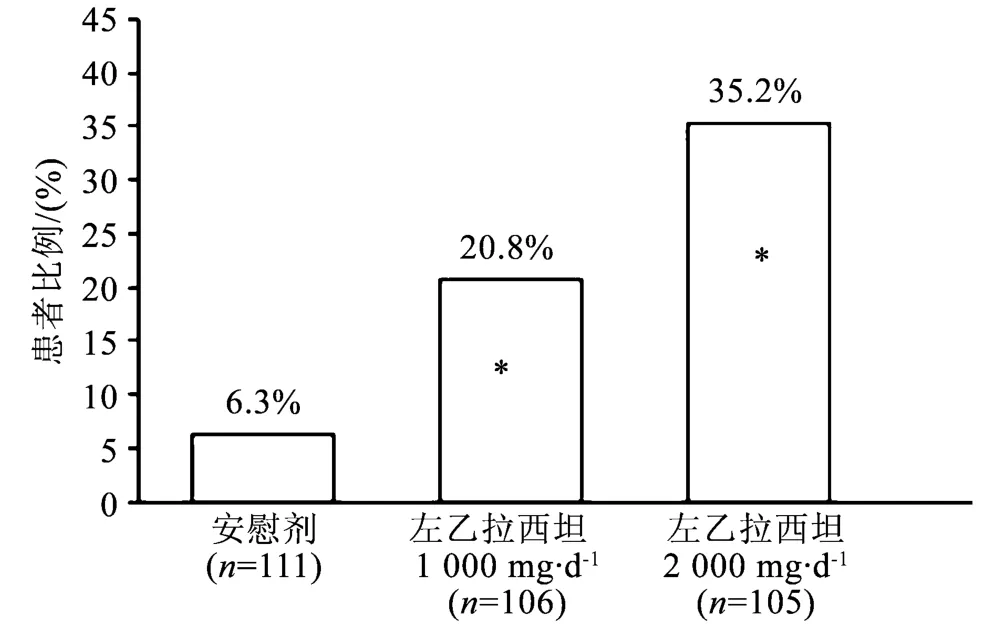
图2 临床研究2阶段A的应答率(从基线降低≥50%)注:*与安慰剂比较,在统计学上有显著性差异
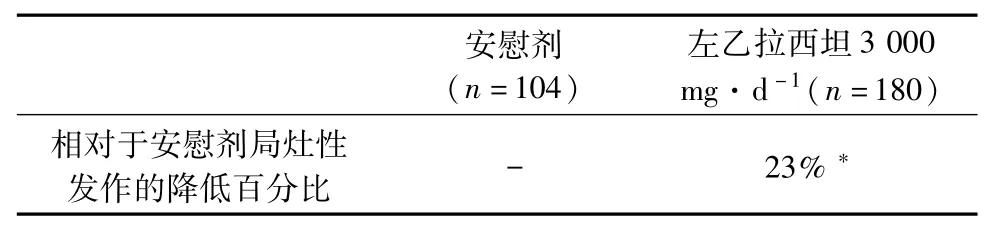
表3 临床研究3中相对于安慰剂的局灶性发作频度降低结果
在3个治疗组(X轴)的整个随机治疗期(加药期+评价期)内,局灶性癫痫发作频度从基线减低达到≥50%的患者比例(Y轴)见图3。
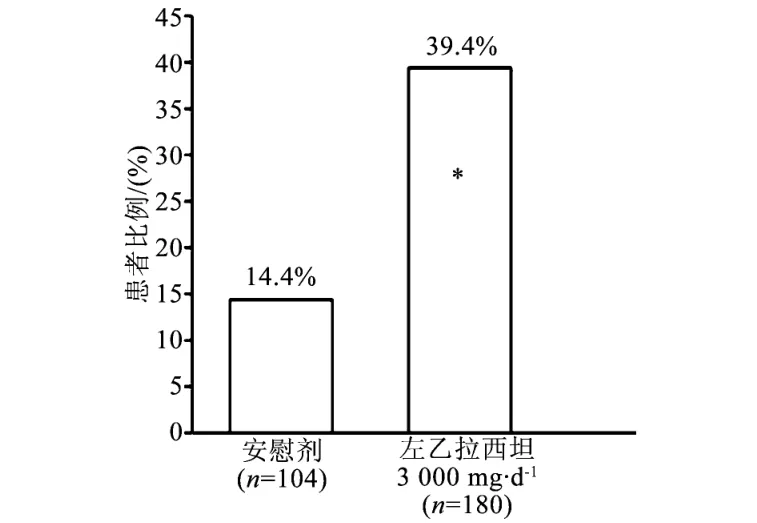
图3 临床研究3的应答率(从基线降低≥50%)注:*与安慰剂比较,在统计学上有显著性差异
5 规格与剂量
片剂,规格有250、500、750、1 000 mg;成人(>18岁)和青少年(12~17岁)(体重≥50 kg者):起始治疗剂量为每次500 mg,每日2次。根据临床效果及耐受性,每日剂量可增加至每次1 500 mg,每日2次。剂量的变化应每2~4周增加或减少每次500 mg,每日2次
6 适应证
Spritam用于和其他抗癫痫药物联合治疗成人或儿童患者的局灶性发作、肌阵挛发作、以及原发性全身癫痫发作。
7 不良反应
Spritam最常见的不良反应(比安慰剂的发生率高≥5%)有①成人:嗜睡、无力、感染和眩晕等;②青少年:疲劳、侵害、鼻充血、食欲减退和过敏等。
R971+.6
A
2095-5375(2015)09-0556-003
刘珍,女,研究方向:药品监管,E-mail:717055193@qq.com
——入侵植物响应人为扰动的适应性进化方向探究
- 药学研究的其它文章
- 伊曲茶碱合成工艺改进

