新型N-杂环取代查尔酮衍生物的合成*
毛泽伟,姜 圆,饶高雄
(云南中医学院药学院,云南 昆明 650500)
查尔酮及其衍生物是芳香醛酮发生交叉羟醛缩合后生成的一类以1,3-二苯基丙烯酮为基本骨架的化合物。查尔酮类化合物在植物中分布广泛,如甘草、红花等[1],具有抗肿瘤、消炎、抗 HIV、抗真菌和抗氧化等活性[2-6]。查尔酮含有独特的柔性分子结构和多个反应活性中心,是一类重要的有机合成及药物合成中间体[7-9]。含氮杂环化合物由于其类似生物体内生物碱结构,均表现出广泛的生物活性。研究发现,含咪唑取代的查尔酮衍生物具有良好的抗菌活性[10]。
鉴于此,本文通过优势结构重组,将具有生理活性N-杂环片段引入到查尔酮分子结构中,设计合成了一系列新型N-杂环取代查尔酮衍生物,以期获得具有更优药理活性的化合物。以4-二甲氨基苯甲醛与4'-氟苯乙酮为原料,经羟醛缩合反应制得4-二甲氨基-4'-氟查尔酮(1);1分别与咪唑(2a),2-甲基咪唑(2b),苯并咪唑(2c),六水合哌嗪(2d),N-甲基哌嗪(2e)和3-羟基-1-氮杂环丁烷盐酸盐(2f)经取代反应,合成了6个新型的N-杂环取代查尔酮衍生物(3a~3f,Scheme 1),其结构经1H NMR,13C NMR和IR表征。
1 实验部分
1.1 仪器与试剂
YANACO型显微熔点仪(温度未校正);Bruker AM-300型核磁共振仪(CDCl3为溶剂,TMS为内标);Bio-Rad FTS-135型红外光谱仪(KBr压片)。
薄层色谱显色剂,10%硫酸乙醇溶液和改良碘化铋钾溶液;柱色谱用硅胶及薄层色谱硅胶板,青岛海洋化工厂;其余所用试剂均为分析纯。
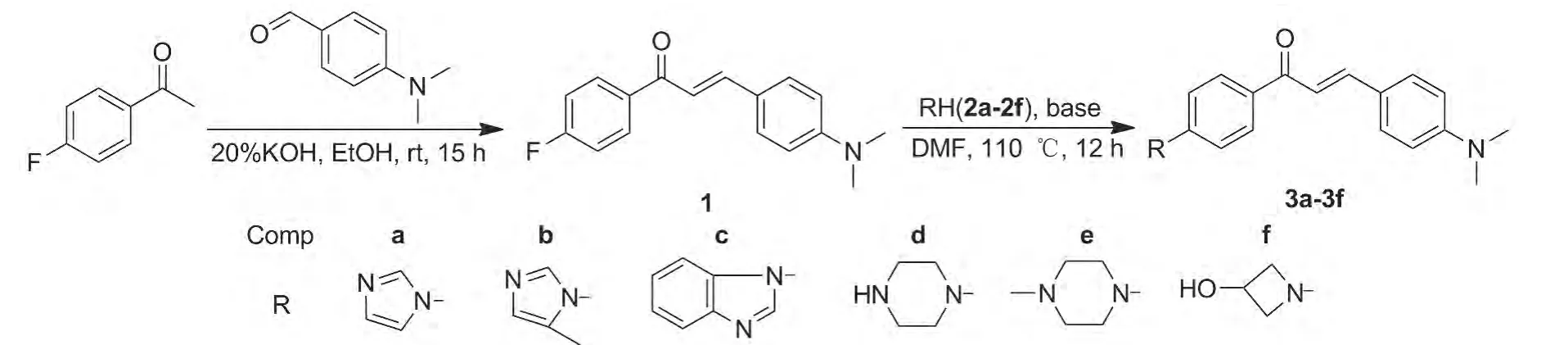
Scheme 1
1.2 合成
(1)1的合成
在反应瓶中依次加入4-氟苯乙酮1.38 g(10 mmol),4-二甲氨基苯甲醛1.49 g(10 mmol)和乙醇15 mL,搅拌下缓慢滴加20%KOH溶液15 mL,滴毕,于室温反应15 h(TLC检测)。倒入50 mL水中,真空抽滤,滤饼用水(3×20 mL)洗涤,干燥得橙黄色固体 1 2.34 g,收率 87%,m.p.139.2℃ ~141.4 ℃;1H NMR δ:8.01 ~8.05(m,2H),7.81(d,J=15.3 Hz,1H),7.55(d,J=8.7 Hz,2H),7.32(d,J=15.2 Hz,1H),7.12 ~ 7.17(m,2H),3.03(s,6H);13C NMR δ:188.92,166.92,163.57,152.13,146.03,135.41,130.85,130.73,130.46,122.53,116.35,115.61,115.33,111.83,40.09;IR ν:3 021,2 090,1 692,1 645,1 622,1 563,1 466,1 438,1 418,1 278,1 235,923,792 cm-1。
(2)3的合成(以3a为例)
在反应瓶中依次加入1 269 mg(1 mmol),碳酸铯652 mg(2 mmol),2a 136 mg(2 mmol)和DMF 5 mL,搅拌下于110℃反应12 h(TLC检测)。倒入20 mL冷水中,搅拌(析出固体),真空抽滤,滤饼用水(3×10 mL)洗涤,干燥得3a。
分别用2b~2f(2d 5 mmol)代替2a,用类似方法合成3b~3f(3c~3f,用K2CO3代替Cs2CO3)。
4-二甲氨基-4'-(1-咪唑基)查尔酮(3a):淡褐色固体,收率91%,m.p.174.7 ℃ ~176.5 ℃;1H NMR δ:8.14(d,J=8.7 Hz,2H),7.95(s,1H),7.85(d,J=15.3 Hz,1H),7.48 ~ 7.57(m,4H),7.36(d,J=4.5 Hz,1H),7.24(s,1H),6.71(d,J=8.7 Hz,2H),3.04(s,6H);13C NMR δ:188.84,152.25,146.52,139.98,137.88,135.43,130.97,130.59,130.22,122.41,120.72,117.82,116.10,111.83,40.08;IR ν:3 020,2 092,1 691,1 656,1 624,1 520,1 464,1 441,1 420,1 277,793 cm-1。
4-二甲氨基-4'-[1-(2-甲基咪唑基)]查尔酮(3b):褐色固体,收率82%,m.p.175.3 ℃ ~177.7℃;1H NMR δ:8.12(d,J=9.0 Hz,2H),7.86(d,J=15.3 Hz,1H),7.55(d,J=8.7 Hz,2H),7.37 ~7.45(m,3H),7.25(s,1H),6.73(d,J=8.7 Hz,2H),3.02(s,6H),2.46(s,3H);13C NMR δ:188.90,152.31,145.99,139.63,137.80,134.72,131.01,130.77,130.23,122.42,120.77,117.86,115.98,111.34,40.09,14.11;IR ν:3 020,2 089,1 692,1 657,1 623,1 522,1 474,1 444,1 418,1 264,1 228,795 cm-1。
4-二甲氨基-4'-(1-苯并咪唑基)查尔酮(3c):淡黄色固体,收率 72%,m.p.198.4 ℃ ~200.8℃;1H NMR δ:8.13 ~ 8.15(m,3H),7.95(s,2H),7.85(s,1H),7.50 ~7.60(m,5H),7.26 ~7.34(m,2H),6.66(d,J=8.7 Hz,2H),3.01(s,6H);13C NMR δ:188.89,162.47,152.25,146.61,144.25,141.95,130.62,130.23,124.03,123.31,120.74,111.80,110.54,40.05;IR ν:3 021,1 689,1 662,1 641,1 524,1 476,1 441,1 415,1 265,794 cm-1。
4-二甲氨基-4'-(1-哌嗪基)查尔酮(3d):黄色固体,收率 78%,m.p.171.4 ℃ ~174.1 ℃;1H NMR δ:8.01(d,J=8.7 Hz,2H),7.79(d,J=15.3 Hz,1H),7.53(d,J=9.0 Hz,2H),7.40(d,J=15.3 Hz,1H),6.93(d,J=8.7 Hz,2H),6.71(d,J=8.7 Hz,2H),3.30(t,J=4.8 Hz,4H),2.99(s,6H),2.53(t,J=5.1 Hz,4H),1.76(s,1H);13C NMR δ:188.42,153.41,151.75,144.12,130.42,130.18,128.88,123.16,117.02,113.52,110.92,53.08,45.71,40.08;IR ν:3 482,3 022,1 692,1 662,1 641,1 524,1 474,1 442,1 415,1 262,1 227,850,752 cm-1。
4-二甲氨基-4'-(N-甲基-1-哌嗪基)查尔酮(3e):黄色固体,收率 85%,m.p.172.8 ℃ ~174.7 ℃;1H NMR δ:8.00(d,J=9.0 Hz,2H),7.80(d,J=15.3 Hz,1H),7.55(d,J=8.7 Hz,2H),7.39(d,J=15.3 Hz,1H),6.92(d,J=8.7 Hz,2H),6.70(d,J=9.0 Hz,2H),3.38(t,J=5.1 Hz,4H),3.01(s,6H),2.57(t,J=6.0 Hz,4H),2.34(s,3H);13C NMR δ:188.33,153.77,151.78,144.09,130.35,130.10,129.16,123.15,116.93,113.64,111.87,54.78,47.63,46.13,40.14;IR ν:3 023,1 690,1 662,1 642,1 623,1 475,1 446,1 416,1 264,798,749 cm-1。
4-二甲氨基-4'-(3-羟基-1-氮杂环丁基)查尔酮(3f):黄褐色固体,收率 62%,m.p.188.9 ℃ ~191.3 ℃;1H NMR δ:7.95(d,J=8.7 Hz,2H),7.78(d,J=15.3 Hz,1H),7.55(d,J=8.7 Hz,2H),7.38(d,J=15.3 Hz,1H),6.70(d,J=8.7 Hz,2H),6.40(d,J=8.7 Hz,2H),4.77 ~4.81(m,1H),4.27(t,J=8.1 Hz,2H),3.79 ~3.83(dd,J=4.5 Hz,4.5 Hz,2H),3.03(s,6H),2.86(br s,1H);13C NMR δ:188.89,153.20,146.11,134.92,130.68,130.46,130.24,122.48,116.19,115.72,115.40,111.58,65.26,55.32,40.07;IR ν:3 632,3 020,1 692,1 663,1 641,1 526,1 474,1 441,1 266,796 cm-1。
2 结果与讨论
2.1 合成
咪唑类化合物与氟苯的取代反应已有文献[11-12]报道,大多以碳酸钾作碱。本文在采用该方法合成3a和3b时发现反应收率较低。改用碳酸铯作碱时,反应收率明显提高(表1)。可能是由于碳酸铯的碱性强于碳酸钾,导致咪唑的亲核反应活性增强。另外,当咪唑环上有甲基取代时,使碱性增强,不利于反应进行。因此,合成咪唑环取代查尔酮衍生物时以碳酸铯为碱较为适宜。
哌嗪类化合物与氟苯的取代反应相对较容易[13-14],但在合成该类目标化合物(3d 和 3e)时发现哌嗪用量对反应收率影响很大。由于哌嗪(2d)和N-甲基哌嗪(2e)在加热时易挥发,从而使能参与反应的量减少,导致产物收率偏低。由表3可以看出,2d用量>5 eq.时,反应效果较好。另外,当氮原子有甲基取代时,哌嗪环参与反应的选择性增强,有利于反应进行。

表1 碱对反应收率的影响Table 1 Effect of the base on the yield

表2 碱对反应收率的影响Table 2 Effect of the base on the yield
3 结论
以4-二甲氨基苯甲醛与4'-氟苯乙酮为原料,经羟醛缩合和取代反应合成了6个新型N-杂环取代查尔酮衍生物。为合成该类化合物提供了方法学参考和借鉴,更多衍生物的合成及活性研究正在进行中。
[1]Wu J H,Wang X H,Yi Y H,et al.A potent anti-HIV chalcone and flavonoids from genus Desmos[J].Bioorg Med Chem Lett,2003,13(10):1813 -1815.
[2]De Carvalho T L,Johann S,De Almeida A T,et al.Quinolinyl and quinolinylN-oxide chalcones:Synthesis,antifungal and cytotoxic activities[J].Eur J Med Chem,2011,46(9):4448 -4456.
[3]廖头根,汪秋安,方伟琴,等.新型查尔酮类化合物的合成及其生物活性研究[J].有机化学,2006,26(5):685-689.
[4]赵乐晶,石玉,刘巍,等.新型查尔酮类化合物的合成及其抗肿瘤活性[J].中国药物化学杂志,2010,20(3):161-165.
[5]Mukherjee S,Kumar V,Prasad A K,et al.Synthetic and biological activity evaluation studies on novel 1,3-diarylpropenones[J].Bioorg Med Chem,2001,9(2):337-345.
[6]Deng J X,Sanchez T,Al-Mawsawi L Q,et al.Discovery of structurally diverse HIV-1 integrase inhibitors based on a chalcone pharmacophore[J].Bioorg Med Chem,2007,15(14):4985 -5002.
[7]Mishra N,Arora P,Kumar B,et al.Synthesis of novel substituted 1,3-diaryl propenone derivatives and their antimalarial activity in vitro[J].Eur J Med Chem,2008,43(7):1530 -1535.
[8]Gloria H T,Bin T,Carlos F B.Organocatalysis as a safe practical method for the stereospecific dibromination of unsaturated compounds[J].Org Lett,2012,14(7):1858-1861.
[9]Zheng X X,Zhang L,Li J Y,et al.Magnetic nanoparticle supported polyoxometalates(POMs)via non-covalent interaction:Reusable acid catalysts and catalyst supports for chiral amines[J].Chem Commu,2011,47(45):12325-12327.
[10]Vijay K M,Vinita C,Shubhra S,et al.Novel aryloxy azolyl chalcones with potent activity against Mycobacterium tuberculosis H37Rv[J].Eur J Med Chem,2011,46(9):4302 -4310.
[11]Lakshmi K M,Jagjit Y,Soumi L,et al.N-arylation of heterocycles with activated chloro-and fluoroarenes using nanocrystalline copper(Ⅱ)oxide[J].Adv Synth Cata,2007,349(11 -12):1938 -1942.
[12]Maria Me,Janka P,Stefan T.Study of SNAr reactions of halobenzenes with imidazole under ultrasonic and microwave irradiation[J].Monatsh Chem,2004,135(4):419-423.
[13]Arya A,Vandana S,Shubhra S,et al.Synthesis and bio-evaluation of alkylaminoaryl phenyl cyclopropyl methanones as antitubercular and antimalarial agents[J].Bioorg Med Chem,2010,18(23):8289 -8301.
[14]Meng X G,Cai Z Y,Xiao S,et al.Microwave-assisted amination from fluorobenzenes without catalyst and strong base[J].J Fluorine Chem,2013,146:70 -75.
- 合成化学的其它文章
- 普利地诺甲磺酸盐的合成*
- 告作者

