离子液体中酶催化天然产物结构修饰研究进展
肖咏梅,陈奎君,袁金伟,杨亮茹,毛 璞,屈凌波
(河南工业大学 化学化工学院,河南 郑州 450001)
0 引言
近几年来,天然产物因其天然、低毒、具有生理活性等特点,作为抗氧化剂、食品添加剂应用于食品行业,但大多数天然产物由于结构特性导致其脂溶性或水溶性较差,并不能满足生理药理的需求,因此对其进行结构修饰成为当前研究的热点[1].天然产物结构修饰可通过化学催化或酶催化完成.其中,酶作为催化剂,由于其区域选择性、立体选择性较高,相对于化学催化,可得到选择性较高的产物[2].
离子液体是一种环境友好的绿色溶剂,同有机溶剂相比,具有低蒸气压、广泛的液态范围、高离子电导性、高热稳定性和可溶解大多数化合物等良好的性质,被广泛应用于有机合成、分离和电化学等领域.以离子液体作为反应介质,用于酶催化反应,可通过调整离子液体中阴阳离子的组合以影响酶的活性、稳定性和选择性[3].此外,离子液体还具有可设计性,对其结构进行设计,可构建出适合酶促反应的离子液体[4].笔者就离子液体中酶催化天然产物结构修饰进行如下综述.
1 离子液体中酶催化黄酮类化合物的生物转化
黄酮是一种多酚类化合物,广泛存在于水果、茶叶、蔬菜和红酒等饮食中,黄酮类化合物具有抗氧化、抗增殖、抗癌、抗炎等多种生物活性[5].但由于其刚性平面结构,分子间排列紧密,使大多数黄酮类天然产物水溶性或脂溶性较差,导致其生理活性利用率不高,限制了黄酮类天然产物的开发和应用[6].因此,以黄酮类天然产物为先导化合物,对其进行结构修饰和改性引起了人们极大的兴趣.目前,通过脂肪酶催化酯化/酯交换反应对黄酮类化合物进行修饰一般在有机溶剂中进行.Ma,Salem,Bhullar 等[7-9]在丙酮和叔戊醇中,以Novozym 435 催化异槲皮苷与脂肪酸的酯化反应,选择性合成了异槲皮苷-6″-O-酯基衍生物.酯化产物脂溶性、抗氧化性、抗增殖活性都有了很大提高.课题组以吡啶为溶剂,酶催化曲克芦丁与不同链长的二酸二乙烯酯反应,合成了一系列曲克芦丁乙烯酯[10],并在此基础上,酶催化曲克芦丁乙烯酯与胺进行酰化反应,选择性地合成了曲克芦丁含氮衍生物[11-12].黄酮酯的生物合成中,黄酮的溶解性是影响反应的主要因素,在这些反应中使用离子液体作为反应介质,可很大地提高黄酮的溶解度和反应速率.
Katsoura 等[13]研究了离子液体中酶催化芦丁和柚皮苷酰化反应(图1、图2),研究结果表明,离子液体的使用,可大大提高反应转化率和酶的区域选择性.在离子液体[BMIM][BF4]中,酰化反应速率是有机溶剂中的4 倍,单酰化柚皮苷产率是叔丁醇中的1.5 倍;其生成的芦丁-4″′-O-油酸酯的抗氧化性有了很大提高.
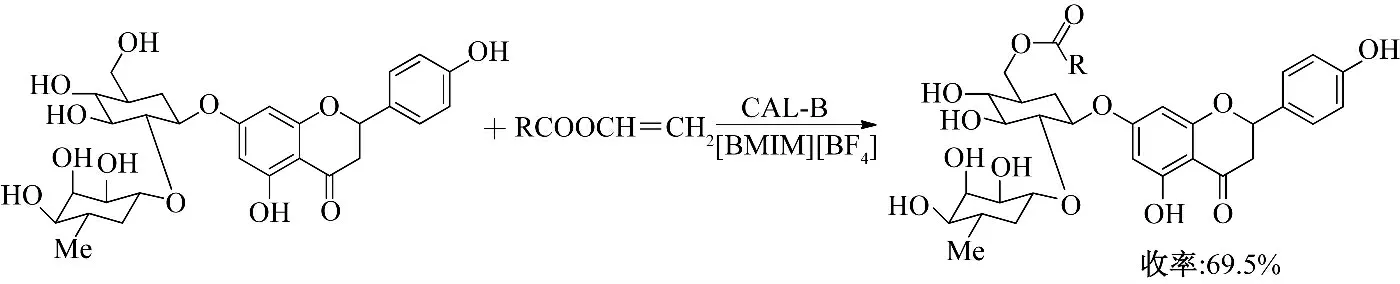
图1 离子液体中酶催化柚皮苷酰化反应Fig.1 Enzymatic acylation of naringin in ionic liquids
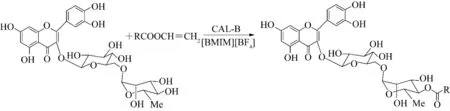
图2 离子液体中酶催化芦丁酰化反应Fig.2 Enzymatic acylation of rutin in ionic liquids
2007 年Katsoura 等[14]在以 [BMIM][BF4]、[BMIM][PF6]为溶剂,CAL-B 催化酚糖甙和黄酮糖甙(水杨苷、水杨醛葡糖苷、马栗树皮甙和柚皮苷)反应,选择性地合成了水杨苷-6″-O-丁酸酯、水杨醛葡糖苷-6″-O-丁酸酯、马栗树皮甙-6″-O-丁酸酯和柚皮苷-6″-O-丁酸酯(图3).研究发现,对所有糖甙溶解性最好的[BMIM][BF4]为溶剂时,反应转化率最高.同有机溶剂中反应相比,离子液体中单酰化衍生物产率有了很大提高.
Theodosion 等[15]分别在有机溶剂和离子液体体系中以CAL-B 为催化剂,催化水飞蓟宾与脂肪酸酯的酰化反应(图4),酰化反应选择性发生在伯羟基位置.以离子液体为溶剂时,阴离子为BF4-时转化率高于阴离子为PF6-的反应体系.在阴离子为BF4-的反应体系中,阳离子烷基链越长反应产率越高,以[OMIM][BF4]为反应介质产率最高可达到75.8%.合成的水飞蓟宾衍生物抗增殖活性均高于水飞蓟宾,但酰基链长对其抗增殖活性影响不大.
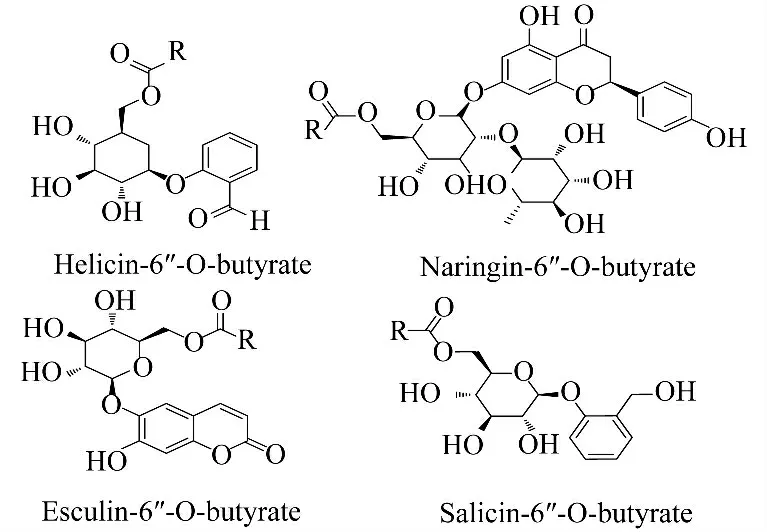
图3 离子液体中酶催化酚糖甙和黄酮糖甙的酰化反应Fig.3 Enzymatic acylation of phenolic and flavonoid glucosides in ionic liquids
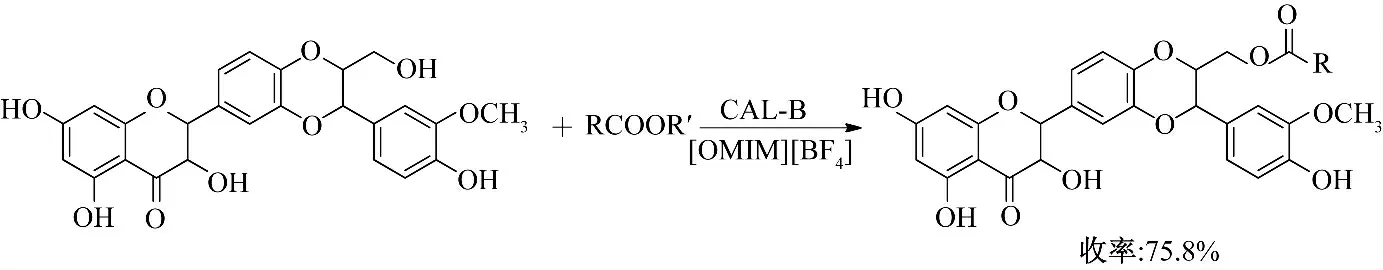
图4 离子液体中酶催化水飞蓟宾的酰化反应Fig.4 Enzymatic acylation of silibinin in ionic liquids
Lue 等[16]以14 种室温离子液体为溶剂、芦丁和马栗树皮甙与脂肪酸为原料、在Novozym 435 的催化作用下,选择性合成了芦丁-4″-O-酯基和马栗树皮甙-6″-O-酯基衍生物(图5、图6),并利用高效液相色谱法对其进行定量分析[17].在酶催化马栗树皮甙的酰化反应中,以阴离子为BF4-、PF6-、Tf2N-的离子液体作为反应溶剂,均可发生反应;而当离子液体的阴离子为Cl-、TFA-、(CN)2N-时不发生反应,这可能是由于离子液体与蛋白质相互作用影响了酶活性[18-21].以[TOMA][Tf2N]为溶剂,反应144 h,马栗树皮甙-6″-O-棕榈酸酯产率可达到98%.而芦丁由于只含有仲羟基,反应活性比马栗树皮甙低,以[OMIM][BF4]为溶剂,反应156 h,芦丁-4″-O-棕榈酸酯产率仅为42.8%.
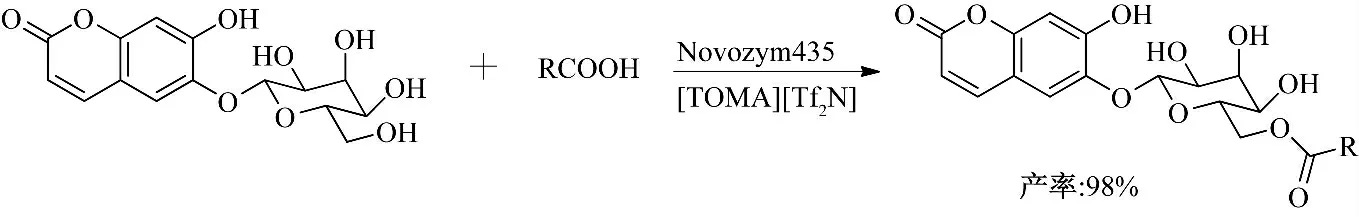
图5 离子液体中酶催化马栗树皮甙与脂肪酸的酯化反应Fig.5 Enzymatic esterification of esculin with fatty acid in ionic liquids
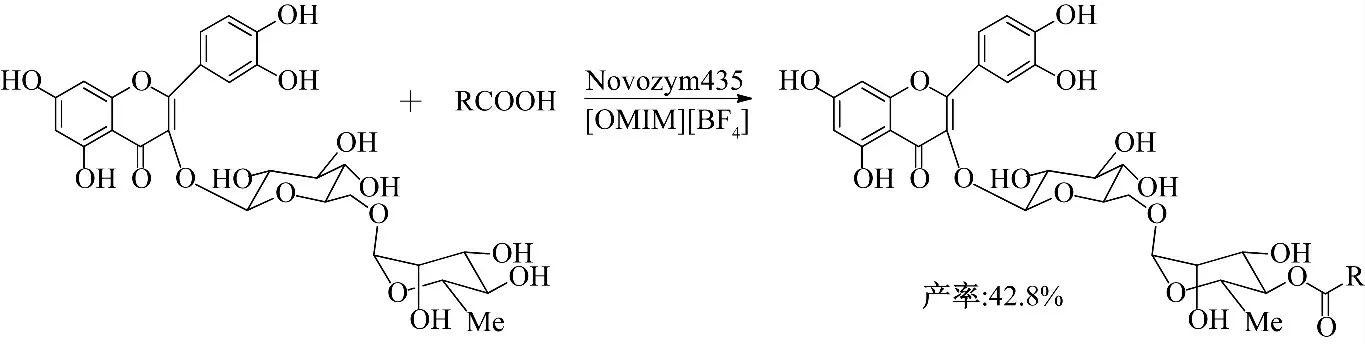
图6 离子液体中酶催化芦丁与脂肪酸的酯化反应Fig.6 Enzymatic esterification of rutin with fatty acid in ionic liquids
许多天然产物在离子液体中的溶解度比在有机溶剂中大得多,但是一些离子液体的阴离子部分会对酶的活性造成一定影响,致使酶催化反应的选择性或转化率降低.因此,一些研究小组使用ILs/有机溶剂反应体系进行酶催化黄酮类化合物的生物转化,期望能够保持酶活性和提高反应选择性和产率.Hu 等[22]研究了离子液体/丙酮作为混合溶剂,Novozym 435 催化马栗树皮甙与软脂酸的酯化反应(图7).同在单一离子液体中的反应相比,以[TOMA][Tf2N]/丙酮作为混合溶剂,马栗树皮甙的溶解度、酶活性和反应速率都有了很大提高,以[TOMA][Tf2N]/丙酮(25/75,V/V)作溶剂时,马栗树皮甙的转化率可达到78.02%.
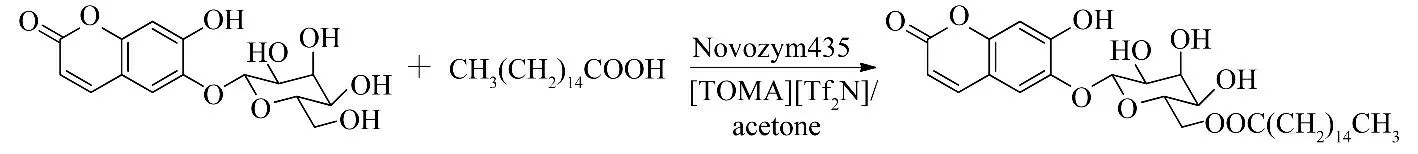
图7 离子液体/丙酮中酶催化马栗树皮甙与软脂酸的酯化反应Fig.7 Enzymatic esterification of esculin with palmitic acid in ionic liquids/acetone media
Araújo 等[23]以CAL-B 为催化剂,在[BMIM][BF4]/丙酮(8/2,V/V)中酶催化橙皮苷与癸酸进行酯化反应(图8),在脂肪酶CAL-B 的催化作用下反应选择性发生在糖苷的C-6″′羟基位.反应体系中水含量的增加导致反应产率的降低,水含量由小于200×10-6增加到500×10-6时,反应产率由39.7%降低到14%.
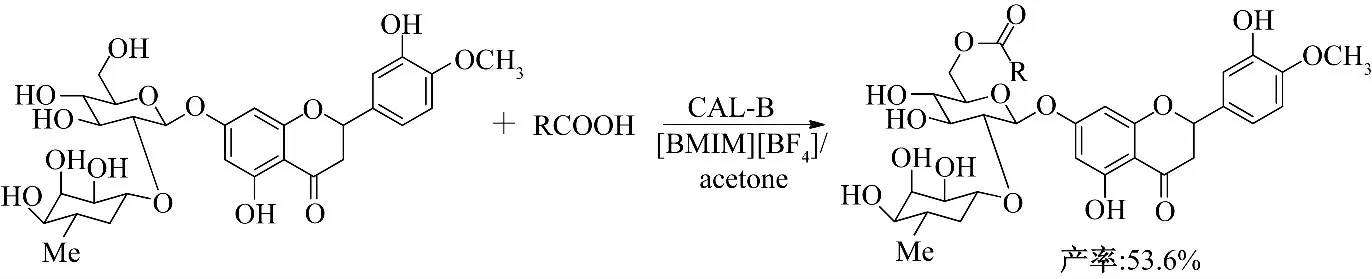
图8 离子液体/丙酮中酶催化橙皮苷与脂肪酸的酯化反应Fig.8 Enzymatic esterification of hesperidin with fatty acid in ionic liquids/acetone media
Wang 等[24-25]研究了 [BMIM][BF4]/甘氨酸-NaOH 缓冲液中酶催化芦丁向异槲皮苷的转化(图9).在[BMIM][BF4]∶甘氨酸-NaOH 缓冲液(pH=9)为9∶1 的反应体系中,反应3 h 后,芦丁转化率和异槲皮苷产率可分别达到99.5%和93.9%.同在有机溶剂中相比反应时间缩短了0.33 倍,而芦丁的转化率和异槲皮苷的产率分别提高了1.67 倍和2.33 倍.
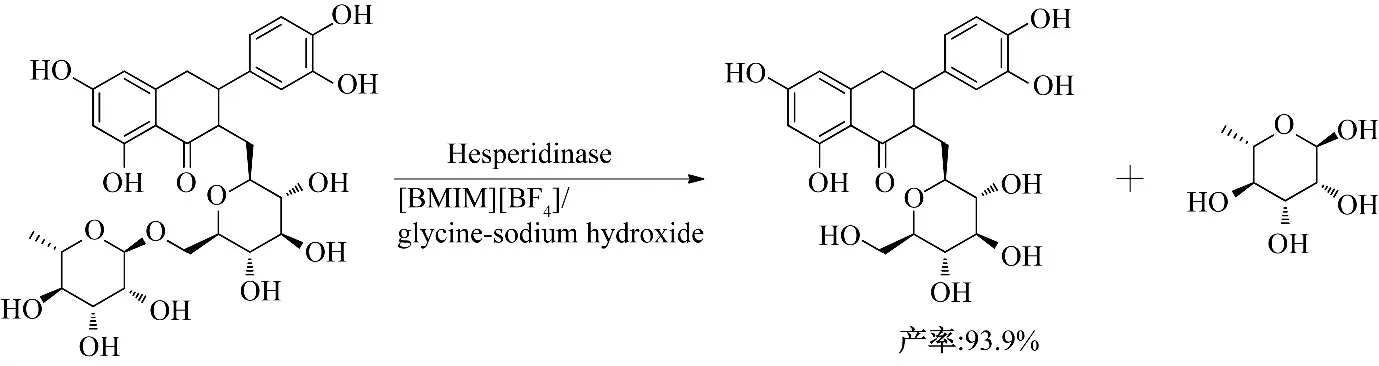
图9 含离子液体的两相体系中酶催化芦丁水解合成异槲皮苷Fig.9 Enzymatic hydrolysis rutin to isoquercitrin in bi-phase system containing ionic liquid
2 离子液体中酶催化有机酸类化合物的生物转化
2.1 咖啡酸
咖啡酸是一种在植物界中天然存在的酚酸,具有抗菌、抗癌、抗氧化等多种生物活性.咖啡酸的脂溶性对其穿过细胞膜到达靶体起着至关重要的作用,但咖啡酸的脂溶性较差,因此近年来合成了很多具有良好脂溶性的咖啡酸酯[26].Kishimoto等[27]在水/乙醇体系中,以绿原酸水解酶催化5-绿原酸与2-苯乙醇的酯交换反应,合成咖啡酸苯乙酯类似物,最大产率仅为50%.Pang 等[28]以Novozym 435 催化咖啡酸与1-丙醇的酯化反应,咖啡酸丙酯的最大产率仅为41%.在常规溶剂中,酶催化合成咖啡酸酯产率通常很低.为了提高咖啡酸酯产率,Ha 等[29]研究了离子液体对酶催化咖啡酸苯乙酯合成的影响,研究表明,在疏水性离子液体中的反应产率明显高于在亲水性离子液体中的产率.在所使用的9 种离子液体中,[EMIM][Tf2N]的反应转化率最高,可达到92%.Wang 等[30]在酶催化咖啡酸苯乙酯的合成反应中(图10),研究了16 种离子液体对咖啡酸转化率、咖啡酸苯乙酯产率和反应选择性的影响,选择合适的阴离子、阳离子和烷基链长的离子液体作溶剂,可很大提高咖啡酸苯乙酯的产率,最终确定[EMIM][Tf2N]为最佳反应溶剂,咖啡酸转化率和咖啡酸苯乙酯产率可分别达到98.76%,63.75%.
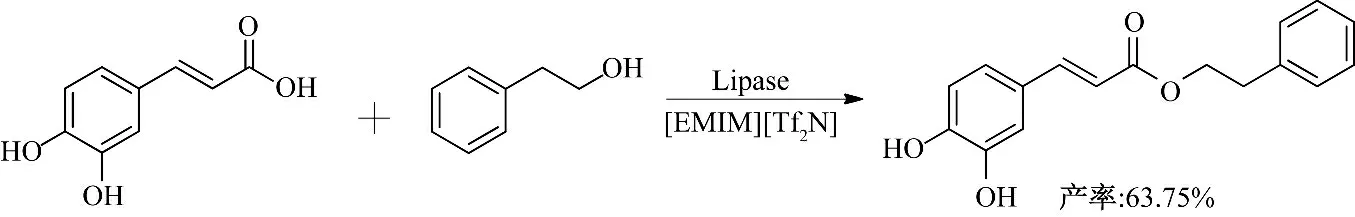
图10 离子液体酶催化咖啡酸苯乙酯的合成Fig.10 Enzymatic synthesis of caffeic acid phenethyl ester in ionic liquids
Kurata 等[31]以8 种离子液体为溶剂、酶催化咖啡酸甲酯进行酯交换反应,合成咖啡酸苯乙酯类似物(图11).以[BMIM][Tf2N]为溶剂时反应产率最高,可达到97.6%.对合成的咖啡酸苯乙酯类似物进行抗增殖活性测定发现,2-环己基乙基咖啡酸酯和3-环己基丙基咖啡酸酯的抗增殖活性与5-氟尿嘧啶相当.
Pang 等[32]以Novozym 435 为催化剂在离子液体中合成咖啡酸丙酯(图12).同在其他离子液体中的反应相比,以[BMIM][CF3SO3]、[BMIM][Tf2N]和[BMIM][PF6]作为反应介质,咖啡酸丙酯的产率有了很大的提高,最高产率可达到98.5%.
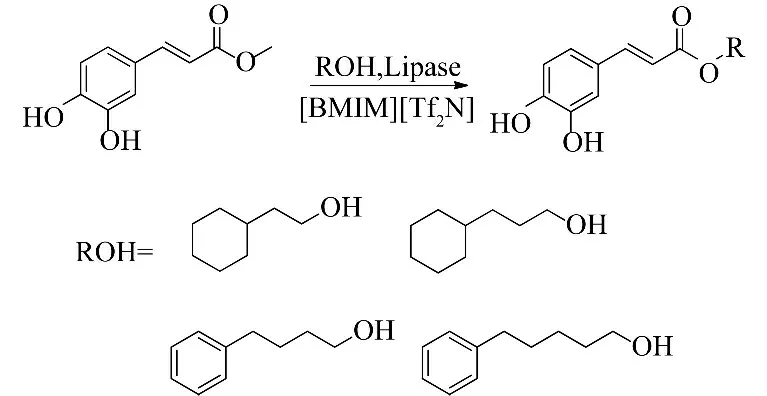
图11 离子液体酶催化咖啡酸苯乙酯类似物的合成Fig.11 Enzymatic synthesis of caffeic acid phenethyl ester analogues in ionic liquids
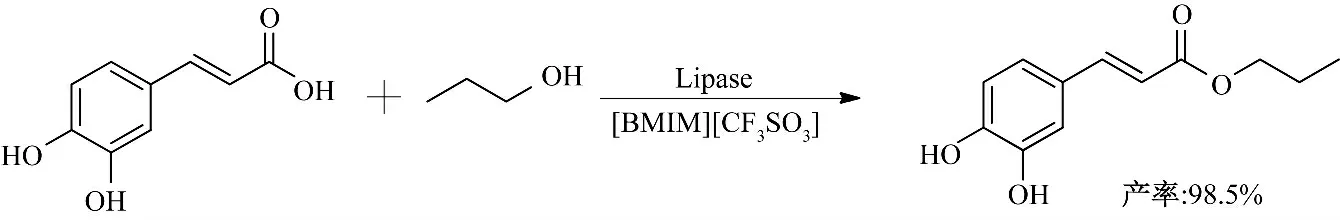
图12 离子液体中酶催化咖啡酸丙酯的合成Fig.12 Enzymatic synthesis of propyl caffeate in ionic liquids
Kurata 等[33]在离子液体中以咖啡酰奎宁酸为原料、在酶催化作用下合成3-环己基丙基咖啡酸酯(图13),考察了 [BMIM][Tf2N]、[BMIM][BF4]、[BMIM][CF3SO3]、[MPPro][Tf2N]、[MPPip][Tf2N]5 种离子液体对绿原酸水解酶催化5-咖啡酰奎宁酸与甲醇醇解反应的影响.在亲水性离子液体[BMIM][BF4]、[BMIM][CF3SO3]中几乎不发生反应,在疏水性离子液体[BMIM][Tf2N]、[MPPro][Tf2N]、[MPPip][Tf2N]中均检测到反应的发生,其中[BMIM][Tf2N]中反应产率最高,可达到85.3%.
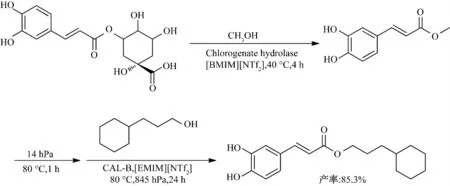
图13 离子液体中酶催化3-环己基丙基咖啡酸酯的合成Fig.13 Enzymatic synthesis of 3-cyclohexylpropyl caffeate in ionic liquids
为了提高合成咖啡酸酯过程中底物在离子液体中的溶解度和减少反应时间,Gu 等[34]以DMSO为助溶剂,在离子液体[BMIM][Tf2N]中,酶催化合成咖啡酸苯乙酯.同单一的[BMIM][Tf2N]做溶剂中相比,以2%的DMSO 为助溶剂时,底物溶解度提高了6 倍,反应时间缩短了一半.在80 ℃下反应36 h,咖啡酸转化率和咖啡酸苯乙酯产率可分别达到96.23%和79.53%.
在酶催化咖啡酸酯的研究中,以[BMIM][Tf2N]离子液体作为反应介质,均得到较高的反应产率,此离子液体有望替代有机溶剂应用于酶催化咖啡酸酯的合成中.
2.2 阿魏酸
阿魏酸是一种低毒的酚酸,可以很容易被人体吸收,阿魏酸作为一种抗氧化剂被广泛应用于食品和化妆品行业.据报道阿魏酸具有抗氧化、抗菌、抗增殖、抗血栓生成、抗癌等生理活性.在阿魏酸中引入疏水基团可有效提高其脂溶性[35].
阿魏酸甘油酯和二阿魏酸甘油酯是亲脂性的阿魏酸衍生物.根据文献报道有两种合成路线,一种是通过阿魏酸和乙醇的酯化反应合成阿魏酸乙酯,然后再与植物油进行酯交换反应得到[36-37];另一种是通过阿魏酸和植物油直接进行酯交换反应得到[38-39].但是这两种合成路线都存在反应产率低、耗时长、需要特殊溶剂等缺点.Sun 等[40]以阴离子为BF4-、PF6-、Tf2N-的咪唑类离子液体为反应介质,Novozym 435 催化阿魏酸乙酯与甘油的酯交换反应(图14).以[EMIM][PF6]为溶剂,反应10 h 后,阿魏酸的转化率可达到100%,阿魏酸甘油酯和二阿魏酸甘油酯的产率分别为55%和45%.离子液体中阳离子链长对反应转化率影响不大,而阴离子对反应转化率有着至关重要的作用,阴离子为PF6-和Tf2N-的疏水性离子液体中,反应转化率明显优于极性较大的BF4-类亲水性离子液体.在PF6-和Tf2N-类离子液体中,反应主要产物为阿魏酸甘油酯和二阿魏酸甘油酯,而在有机溶剂中主要产物为阿魏酸甘油酯.
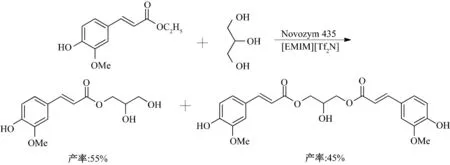
图14 离子液体中酶催化阿魏酸乙酯与甘油的酯交换反应Fig.14 Enzymatic transesterification of ethyl ferulate and glycerol in ionic liquids
目前酶催化修饰阿魏酸多通过在有机溶剂中阿魏酸与短链或中链的脂肪醇的酯化反应.Chen等[35]研究了离子液体-异辛烷共溶剂体系中Novozym 435 催化阿魏酸同长链脂肪醇(油醇)的酯化反应,考察了阴离子为BF4-、PF6-、Tf2N-的咪唑类离子液体对反应的影响,试验结果显示在PF6-、Tf2N-类疏水性离子液体中反应产率最高.
3 离子液体中酶催化糖类化合物的生物转化
糖类衍生物在医药、化妆品、洗涤剂、食品行业具有广泛的应用,这些化合物通常由化学方法合成.过去20 年许多研究表明,酶作为一种更绿色的催化剂在糖类化合物合成中得到广泛的应用.离子液体作为一种绿色溶剂,近年来人们对离子液体中酶催化糖类化合物的生物转化进行了大量的研究.
3.1 单糖
2001 年Park 等[41]首次报道了将离子液体成功应用于酶催化糖类化合物的合成.在Novozym 435催化D-葡萄糖的乙酰化反应中(图15),以纯离子液体作溶剂,所有使用的离子液体的反应速率和选择性同在丙酮或四氢呋喃中相比,均有所提高或与之相当,在[MOEMIM][BF4]中D-葡萄糖的转换率与在四氢呋喃中相当,可达到98%,单酰化产物产率可达到93%,但是在四氢呋喃中的单酰化产率仅为53%.
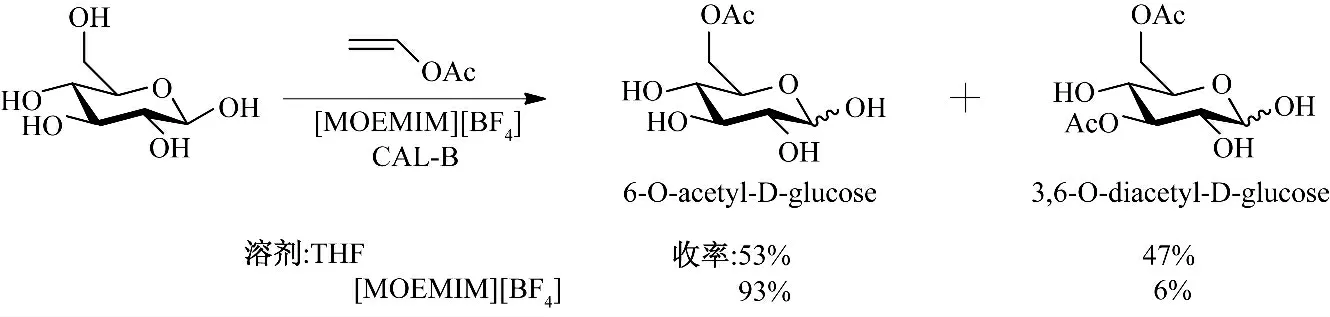
图15 酶催化区域选择性酰化β-D-葡萄糖Fig.15 Regioselective enzymatic acylation of β-D-glucose
Ganske 等[42]以PEG 修饰脂肪酶CAL-B 以提高酶在离子液体中催化合成葡萄糖酯的催化活性.若在离子液体中加入适量的叔丁醇,酶促反应速率明显提高,且酰化反应几乎都发生在C6-OH 位置.Abdulmalek 等[43]以[BMIM][BF4]为溶剂,Lipozyme RM IM 催化半乳糖油酸酯的合成,以少量DMSO为助溶剂,反应2 h 后转换率可达到87%.
迄今为止,疏水性离子液体和亲水性离子液体作为混合溶剂只在脂肪酶催化合成糖酯类化合物中有所应用.糖类化合物在亲水离子液体中具有较高的溶解性,但酶在疏水性离子液体中更稳定.Lee 和Ha 等[44-46]以不同配比的亲水性离子液体[BMIM][TFO]和疏水性离子液体[BMIM][Tf2N]、[OMIM][Tf2N]或[BMIM][PF6]作为反应溶剂,Novozym 435 催化过饱和的葡萄糖和油酸反应合成6-O-油酸-D-葡萄糖,期望能够在提高糖类化合物的溶剂性的同时保持酶的稳定性.在此酶催化反应中,亲水性离子液体 [BMIM][TFO]中反应产率最高(86%),但酶稳定性较差,Novozym 435 重复使用5次后仅保持36%的初始活性;疏水性离子液体[BMIM][Tf2N]中酶稳定性最高,但反应转化率低(19%);使用混合离子液体[BMIM][TFO]/[OMIM][Tf2N]作为反应介质,可同时保持较高的转化率和酶稳定性.混合离子液体 [BMIM][TFO]/[OMIM][Tf2N](1/1,V/V)中反应转化率可达69%,且Novozym 435 重复使用5 次后还可保持85%的初始活性.
3.2 二糖
蔗糖脂肪酸酯由于其无毒和可被生物降解的性质,被广泛应用于药物、食品、化妆品等领域.蔗糖脂肪酸酯可通过化学催化和酶催化的方法合成.化学催化的方法反应特异性较低,容易产生有害物质,而酶催化的方法因条件温和,可减少副反应的发生.常用于酶催化蔗糖脂肪酸酯合成的有机溶剂有DMSO、DMF、吡啶和叔戊醇等.Ashrafuzzaman 等[47]在DMF 中,固定化酶催化合成6-O-酰基蔗糖,50 ℃反应96 h 后,蔗糖脂肪酸单酯产率可达到90%以上.Zhong 等[48]以DMSO 为溶剂、固定化酶催化蔗糖与乙酸乙烯酯进行酯交换反应,60℃反应16 h 后,蔗糖-6-O-乙酸酯产率可达到78.68%.离子液体作为一种绿色溶剂被用于蔗糖酯的合成中,例如Liu 等[49]设计合成了十几种离子液体(图16),并测定了蔗糖在这些离子液体中的溶解度,发现糖类化合物在阴离子为(CN)2N-的离子液体中的溶解度最高.60 ℃时,在[BMIM][(CN)2N]中,脂肪酶Novozym 435 可以直接催化蔗糖和十二酸酯化合成蔗糖十二酸酯.
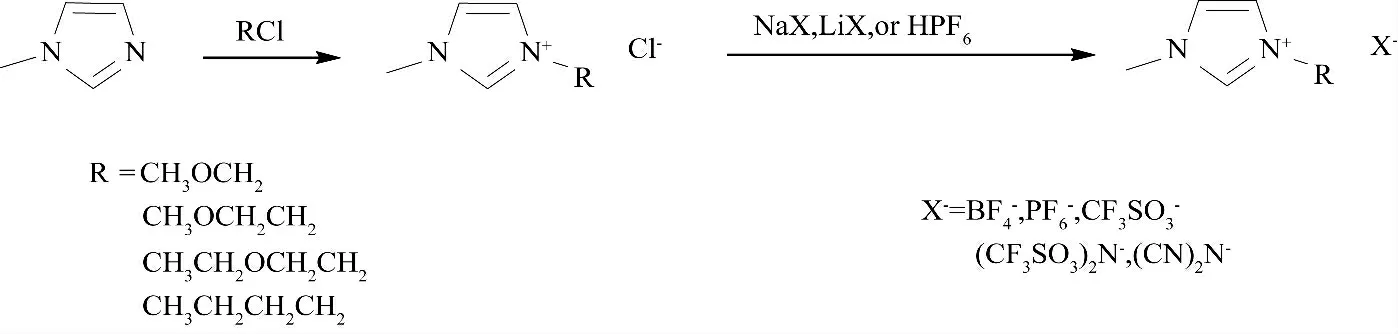
图16 10 种离子液体的合成路线Fig.16 Synthetic routes of ten ionic liquids
3.3 多糖
目前,以离子液体作为反应介质酶促合成糖酯类化合物主要集中在单糖的酰化上,二糖和多糖作为酰基受体的研究报道较少,这可能的原因是二糖和多糖在常规的ILs 中溶解性并不理想.Zhao 等[50]向分子结构中引入乙二醇支链,设计合成了多种ILs(图17),并对其生物相容性和糖类溶解性进行测试,发现这类离子液体对纤维素和D-葡萄糖具有很好的溶解性,并且不会使脂肪酶CAL-B 失活.在这些ILs 中,脂肪酶CAL-B 催化D-葡萄糖和纤维素与甲基丙烯酸甲酯的酯交换反应,D-葡萄糖的转化率可达到80%,纤维素的转化率和产率可达到89%,66%.
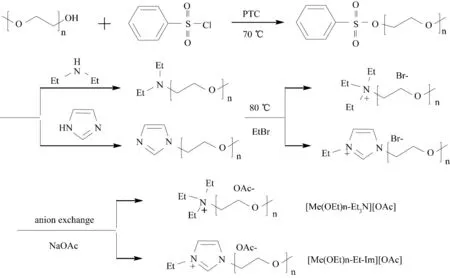
图17 含乙二醇链离子液体[Me(OEt)n-Et3N][OAc]与[Me(OEt)n-Et-Im][OAc]的合成Fig.17 Synthesis of ILs containing alkyloxyalkyl-chain [Me(OEt)n-Et3N][OAc]and [Me(OEt)n-Et-Im][OAc]
Chen 等[51]研究了在IL 和IL/t-BuOH 体系中脂肪酶催化魔芋葡甘聚糖与醋酸乙烯酯的酰化反应,与t-BuOH 中得到的结果相比,在离子液体[CnMIM][BF4](n=2,4,8)和[C4MIM][PF6]中,酰化反应表现出更高的取代度和热稳定性,使用t-BuOH作为助溶剂,取代度可进一步提高.在所有的溶剂体系(IL,t-BuOH 和IL/t-BuOH)中,酰化反应只发生在糖单元的C6-OH 位.在文献报道的4 种离子液体中,对Novozym 435 处理6 h 后,酶可保持80%、82%、86%和79%的初始活性,而在纯粹的t-BuOH 中仅保持15%的初始活性.
2010 年Chen 等[52]在有机溶剂、离子液体和离子液体/有机溶剂混合体系中,固定化脂肪酶PSLC 催化百合多糖与乙酸乙烯酯的酰化反应,在所用有机溶剂中2-甲基四氢呋喃是最佳的反应溶剂.离子液体[C4MIM][BF4]作反应溶剂时酶活性得到进一步提高.以20%(V/V)2-甲基四氢呋喃/[C4MIM][BF4]作反应溶剂时取代度最高(0.67),这可能是由于2-甲基四氢呋喃的加入,降低了反应体系的黏度,使底物和产物可以更容易与酶的活性位点结合,从而加强了酰化反应活性.IL 中脂肪酶PSL-C催化百合多糖的酰化反应,表现出很强的区域选择性,酰化反应仅发生在C6-OH 位.
4 离子液体中酶催化L-抗坏血酸的生物转化
L-抗坏血酸(维生素C)是一种天然抗氧化剂,其较高的极性限制了它在化妆品和油脂行业的应用.L-抗坏血酸脂肪酸酯是一种两亲性化合物,也是一种抗诱变剂和抗肿瘤促进剂,可以和一些抗氧化物质包覆在油脂表层而防止油脂氧化.许多研究小组报道了有机溶剂中酶催化抗坏血酸脂肪酸酯的合成.如Yang 等[53]以叔丁醇为溶剂、Novozym 435 催化L-抗坏血酸与不同肉桂酸酯的酯交换反应,合成了6-O-L-抗坏血酸肉桂酸酯.Lerin 等[54]在不同有机溶剂中,以CAL-B 催化合成了L-抗坏血酸棕榈酸酯.以叔丁醇为溶剂时,70 ℃反应17 h,L-抗坏血酸棕榈酸酯产率可达到67%.
Park 等[55]使用ILs 代替常规有机溶剂、优化了脂肪酶CAL-B 催化合成L-抗坏血酸脂肪酸酯(图18),不仅提高了酶的活性和反应产率,而且可以避免过量添加酰基供体.在离子液体[sBMIM][BF4]中,使用等量或过量20%的脂肪酸作为酰基供体时,6-O-L-抗坏血酸油酸酯产率为61%,而在有机溶剂中,使用5~9 倍当量的脂肪酸时,6-O-L-抗坏血酸油酸酯反应产率仅为40%~47%.
离子液体中的水对酶的结构和蛋白质的功能也起到至关重要的作用,水的存在直接影响酶的活性和稳定性.Adamczak 等[56]利用不同的水和盐(MgCl、CuSO4、NaI 和Na4P2O7水合物)控制ILs 的水活度,以脂肪酶CAL-B 催化合成抗坏血酸油酸酯.在空气中放置达到饱和的 [BMIM][BF4](aw=0.11)中,抗坏血酸油酸酯产率为61%;而使用NaI·2H2O/NaI 控制离子液体[BMIM][BF4]的水活度为0.3 时,抗坏血酸油酸酯的产率可达到72%.
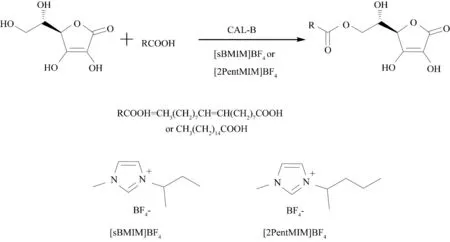
图18 离子液体中酶催化L-抗坏血酸与油酸或棕榈酸的酯化反应Fig.18 Enzymatic esterification of L-ascorbic acid with palmitic acid or oleic acid in ionic liquids
5 离子液体中酶催化植物甾醇的生物转化
植物甾醇酯具有良好的酯溶性和降低胆固醇的特性,通过化学方法合成时,存在能耗高、容易形成副产物3,5-二烯甾体衍生物和产物着色等缺点.因此,一些研究小组通过酶催化植物甾醇与脂肪酸的酯化反应合成植物甾醇酯[57].Pan 等[58]以固定化脂肪酶催化油酸与植物甾醇的酯化反应.45℃反应24 h,植物甾醇的转化率可达到93.4%.酶重复使用13 次后转化率还可保持86.6%.Zheng等[59]在超声条件下,脂肪酶催化合成植物甾醇酯.超声有效减少了反应时间,在35 kHz,200 W 超声条件下反应8 h,植物甾醇转化率可达到85.7%,而振荡条件下反应16 h,转化率仅为76.1%.为寻找可替代有机溶剂的绿色反应体系,Zeng 等[60]以[BMIM][PF6]/H2O 微乳液为反应介质,脂肪酶CRL催化植物甾醇与脂肪酸的酯化反应,反应48 h 后,植物甾醇的转化率可达到95.1%.用正己烷对产物植物甾醇油酸酯进行提取后,[BMIM][PF6]/H2O微乳液和酶可重复使用,使用7 次之后,植物甾醇的转化率还可达到82.5%.
6 结论与展望
离子液体作为反应介质,为酶催化天然产物改性提供了一种新的途径,特别是近年来功能化离子液体的合成和应用研究不断深入,为解决酶促反应的一些不足(酶易失活、反应周期长)提供了重要的参考.尽管如此,离子液体中酶催化天然产物结构修饰仍存在一些问题有待解决.首先,现阶段离子液体中的酶促反应,主要通过经验选择几种离子液体进行尝试,缺乏系统的筛选和设计合成;对离子液体与酶的相互作用机理也需深入研究.其次,离子液体被称为绿色溶剂,主要是因为其蒸气压低,不会通过挥发释放到大气中.但一些离子液体的降解周期较长,容易在土壤和水中累积.因此,新型低毒、可生物降解的离子液体的合成及应用于天然产物的改性也是进一步研究的方向.
[1]郭宗儒.天然产物的结构改造[J].药学学报,2012,47(2):144-157.
[2]Lambusta D,Nicolosi G,Patti A,et al.Application of lipase catalysis in organic solvents for selective protection-deprotection of bioactive compounds[J].Journal of Molecular Catalysis B:Enzymatic,2003,22(5):271-277.
[3]Pereira S C,Bussamara R,Marin G,et al.Enzymatic synthesis of amoxicillin by penicillin G acylase in the presence of ionic liquids[J].Green Chemistry,2012,14(11):3146-3156.
[4]Bi Y H,Duan Z Q,Li X Q,et al.Introducing bio -based ionic liquids as the non -aqueous media for enzymatic synthesis of phosphatidylserine [J].Journal of Agricultural and Food Chemistry,2015,63(5):1558-1561.
[5]Chen A Y,Chen Y C.A review of the dietary flavonoid,kaempferol on human health and cancer chemoprevention[J].Food Chemistry,2013,138(4):2099-2107.
[6]延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(9):1534-1544.
[7]Ma X,Yan R,Yu S,et al.Enzymatic acylation of isoorientin and isovitexin from bamboo-leaf extracts with fatty acids and antiradical activity of the acylated derivatives [J].Journal of Agricultural and Food Chemistry,2012,60(43):10844-10849.
[8]Salem J H,Humeau C,Chevalot I,et al.Effect of acyl donor chain length on isoquercitrin acylation and biological activities of corresponding esters[J].Process Biochemistry,2010,45(3):382-389.
[9]Bhullar K S,Warnakulasuriya S N,Rupasinghe H V.Biocatalytic synthesis,structural elucidation,antioxidant capacity and tyrosinase inhibition activity of long chain fatty acid acylated derivatives of phloridzin and isoquercitrin[J].Bioorganic and Medicinal Chemistry,2013,21(3):684-692.
[10]肖咏梅,栗俊田,毛璞,等.非水介质中曲克芦丁乙烯酯的酶促合成[J].有机化学,2010,30(4):551-557.
[11]王宏雁,杨亮茹,肖咏梅,等.有机介质中脂肪酶催化N-丙基曲克芦丁酰胺类似物的合成研究[J].有机化学,2014,34(2):355-361.
[12]Xiao Y,Zhu X,Yang L,et al.Enzymatic synthesis of novel N -heterocycle -containing troxerutin derivatives[J].Journal of Molecular Catalysis B:Enzymatic,2013,97:297-302.
[13]Katsoura M H,Polydera A C,Tsironis L,et al.Use of ionic liquids as media for the biocatalytic preparation of flavonoid derivatives with antioxidant potency [J].Journal of Biotechnology,2006,123(4):491-503.
[14]Katsoura M H,Polydera A C,Katapodis P,et al.Effect of different reaction parameters on the lipase-catalyzed selective acylation of polyhydroxylated natural compounds in ionic liquids[J].Process Biochemistry,2007,42(9):1326-1334.
[15]Theodosiou E,Katsoura M H,Loutrari H,et al.Enzymatic preparation of acylated derivatives of silybin in organic and ionic liquid media and evaluation of their antitumor proliferative activity[J].Biocatalysis and Biotransformation,2009,27(3):161-169.
[16]Lue B M,Guo Z,Xu X.Effect of room temperature ionic liquid structure on the enzymatic acylation of flavonoids[J].Process Biochemistry,2010,45(8):1375-1382.
[17]Lue B,Guo Z,Xu X.High-performance liquid chromatography analysis methods developed for quantifying enzymatic esterification of flavonoids in ionic liquids[J].Journal of Chromatography A,2008,1198-1199:107-114.
[18]Yang Z,Pan W.Ionic liquids:green solvents for nonaqueous biocatalysis [J].Enzyme and Microbial Technology,2005,37:19-28.
[19]Sheldon R A,Lau R M,Sorgedrager M J,et al.Biocatalysis in ionic liquids [J].Green Chemistry,2002,4:147-151.
[20]Vidya P,Chadha A.The role of different anions in ionic liquids on Pseudomonas cepacia lipase catalyzed transesterification and hydrolysis[J].Journal of Molecular Catalysis B:Enzymatic,2009,57:145-148.
[21]Lau R M,Sorgedrager M J,Carrea G,et al.Dissolution of Candida antarctica lipase B in ionic liquids:effects on structure and activity[J].Green Chemistry,2004,6:483-487.
[22]Hu Y,Guo Z,Lue B M,et al.Enzymatic synthesis of esculin ester in ionic liquids buffered with organic solvents[J].Journal of Agricultural and Food Chemistry,2009,57(9):3845-3852.
[23]Araújo M E M B,Contesini F J,Franco Y E M,et al.Optimized enzymatic synthesis of hesperidin fatty acid esters in a two -phase system containing ionic liquid[J].Molecules,2011,16(8):7171-7182.
[24]Wang J,Sun G,Yu L,et al.Enhancement of the selective enzymatic biotransformation of rutin to isoquercitrin using an ionic liquid as a co-solvent[J].Bioresource Technology 2013,128:156-163.
[25]Wang J,Gong A,Yang C F,et al.An effective biphase system accelerates hesperidinasecatalyzed conversion of rutin to isoquercitrin[J].Scientific Reports,2015,5:8682-8689.
[26]Wang J,Gu S S,Cui H S,et al.Rapid synthesis of propyl caffeate in ionic liquid using a packed bed enzyme microreactor under continuous -flow conditions [J].Bioresource Technology,2013,149:367-374.
[27]Kishimoto N,Kakino Y,Iwai K,et al.Chlorogenate hydrolase-catalyzed synthesis of hydroxycinnamic acid ester derivatives by transesterification,substitution of bromine,and condensation reactions [J].Applied Microbiology and Biotechnology,2005,68(2):198-202.
[28]Pang N,Wang F Q,Cui H S,et al.Lipasecatalyzed synthesis of caffeic acid propyl ester in ionic liquid [J].Advanced Materials Research,2013,634:555-558.
[29]Ha S H,van Anh T,Lee S H,et al.Effect of ionic liquids on enzymatic synthesis of caffeic acid phenethyl ester [J].Bioprocess and Biosystems Engineering,2012,35(1-2):235-240.
[30]Wang J,Li J,Zhang L,et al.Lipase-catalyzed synthesis of caffeic acid phenethyl ester in ionic liquids:effect of specific ions and reaction parameters [J].Chinese Journal of Chemical Engineering,2013,21(12):1376-1385.
[31]Kurata A,Kitamura Y,Irie S,et al.Enzymatic synthesis of caffeic acid phenethyl ester analogues in ionic liquid [J].Journal of Biotechnology,2010,148(2):133-138.
[32]Pang N,Gu S S,Wang J,et al.A novel chemoenzymatic synthesis of propyl caffeate using lipase -catalyzed transesterification in ionic liquid [J].Bioresource Technology,2013,139:337-342.
[33]Kurata A,Takemoto S,Fujita T,et al.Synthesis of 3-cyclohexylpropyl caffeate from 5-caffeoylquinic acid with consecutive enzymatic conversions in ionic liquid [J].Journal of Molecular Catalysis B:Enzymatic,2011,69(3):161-167.
[34]Gu S,Wang J,Wei X,et al.Enhancement of lipase -catalyzed synthesis of caffeic acid phenethyl ester in ionic liquid with DMSO cosolvent [J].Chinese Journal of Chemical Engineering,2014,22(11):1314-1321.
[35]Chen B,Liu H,Guo Z,et al.Lipase-catalyzed esterification of ferulic acid with oleyl alcohol in ionic liquid/isooctane binary systems[J].Journal of Agricultural and Food Chemistry,2011,59:1256-1263.
[36]Xin J,Zhang L,Chen L,et al.Lipase-catalyzed synthesis of ferulyl oleins in solvent-free medium[J].Food Chemistry,2009,112(3):640-645.
[37]Zheng Y,Quan J,Zhu L M,et al.Optimization of selective lipase-catalyzed feruloylated monoacylglycerols by response surface methodology[J].Journal of the American Oil Chemists'Society,2008,85(7):635-639.
[38]Karboune S,Safari M,Lue B M,et al.Lipasecatalyzed biosynthesis of cinnamoylated lipids in a selected organic solvent medium[J].Journal of Biotechnology,2005,119(3):281-290.
[39]Sabally K,Karboune S,St -Louis R,et al.Lipase-catalyzed transesterification of trilinolein or trilinolenin with selected phenolic acids[J].Journal of the American Oil Chemists' Society,2006,83(2):101-107.
[40]Sun S,Qin F,Bi Y,et al.Enhanced transesterification of ethyl ferulate with glycerol for preparing glyceryl diferulate using a lipase in ionic liquids as reaction medium [J].Biotechnology Letters,2013,35(9):1449-1454.
[41]Park S,Kazlauskas R J.Improved preparation and use of room-temperature ionic liquids in lipase-catalyzed enantio-and regioselective acylations[J].The Journal of Organic Chemistry,2001,66(25):8395-8401.
[42]Ganske F,Bornscheuer U T.Lipase-catalyzed glucose fatty acid ester synthesis in ionic liquids [J].Organic Letters,2005,7(14):3097-3098.
[43]Abdulmalek E,Saupi H S M,Tejo B A,et al.Improved enzymatic galactose oleate ester synthesis in ionic liquids[J].Journal of Molecular Catalysis B:Enzymatic,2012,76:37-43.
[44]Ha S H,Hiep N M,Koo Y M.Enhanced production of fructose palmitate by lipase -catalyzed esterification in ionic liquids[J].Biotechnology and Bioprocess Engineering,2010,15(1):126-130.
[45]Lee S H,Ha S H,Hiep N M,et al.Lipasecatalyzed synthesis of glucose fatty acid ester using ionic liquids mixtures [J].Journal of Biotechnology,2008,133(4):486-489.
[46]Ha S H,Hiep N M,Lee S H,et al.Optimization of lipase -catalyzed glucose ester synthesis in ionic liquids[J].Bioprocess and Biosystems Engineering,2010,33(1):63-70.
[47]Ashrafuzzaman M,Pyo J I,Cheong C S.Sucrose derivatives preparation using Thermomyces lanuginosus lipase and their application[J].Bulletin of The Korean Chemical Society,2014,35(2):477.
[48]Zhong X,Qian J,Guo H,et al.Biosynthesis of sucrose -6 -acetate catalyzed by surfactant -coated Candida rugosa lipase immobilized on sol-gel supports[J].Bioprocess and Biosystems Engineering,2014,37(5):813-818.
[49]Liu Q,Janssen M H A,van Rantwijk F,et al.Room -temperature ionic liquids that dissolve carbohydrates in high concentrations[J].Green Chemistry,2005,7(1):39-42.
[50]Zhao H,Baker G A,Song Z,et al.Designing enzyme -compatible ionic liquids that can dissolve carbohydrates [J].Green Chemistry,2008,10(6):696-705.
[51]Chen Z G,Zong M H,Li G J.Lipase-catalyzed acylation of konjac glucomannan in ionic liquids [J].Journal of Chemical Technology and Biotechnology,2006,81(7):1225-1231.
[52]Chen Z G,Zhang D N,Han Y B.Lipase-catalyzed acylation of lily polysaccharide in ionic liquid-containing systems[J].Process Biochemistry,2013,48(4):620-624.
[53]Yang Y H,Raku T,Song E,et al.Lipase catalyzed reaction of L -ascorbic acid with cinnamic acid esters and substituted cinnamic acids [J].Biotechnology and Bioprocess Engineering,2012,17(1):50-54.
[54]Lerin L A,Richetti A,Dallago R,et al.Enzymatic synthesis of ascorbyl palmitate in organic solvents:Process optimization and kinetic evaluation [J].Food and Bioprocess Technology,2012,5(3):1068-1076.
[55]Park S,Viklund F,Hult K,et al.Vacuumdriven lipase -catalysed direct condensation of L -ascorbic acid and fatty acids in ionic liquids:synthesis of a natural surface active antioxidant [J].Green Chemistry,2003,5(6):715-719.
[56]Adamczak M,Bornscheuer U T.Improving ascorbyl oleate synthesis catalyzed by Candida antarctica lipase B in ionic liquids and water activity control by salt hydrates [J].Process Biochemistry,2009,44(3):257-261.
[57]Sengupta A,Pal M,SilRoy S,et al.Comparative study of sterol ester synthesis using Thermomyces lanuginosus lipase in stirred tank and packed-bed bioreactors[J].Journal of the American Oil Chemists' Society,2010,87(9):1019-1025.
[58]Pan X,Chen B,Wang J,et al.Enzymatic synthesizing of phytosterol oleic esters[J].Applied Biochemistry and Biotechnology,2012,168(1):68-77.
[59]Zheng M M,Wang L,Huang F H,et al.Ultrasonic pretreatment for lipase-catalyzed synthesis of phytosterol esters with different acyl donors[J].Ultrasonics Sonochemistry,2012,19(5):1015-1020.
[60]Zeng C,Qi S,Li Z,et al.Enzymatic synthesis of phytosterol esters catalyzed by Candida rugosa lipase in water-in-[Bmim]PF6 microemulsion [J].Bioprocess and Biosystems Engineering,2015,38(5):939-946.

