苦参碱磺胺类拼合物的合成*
王立升,杨龙力,刘 旭,杨 华,梁鹏云,孙云龙,陈淋敏,葛 燕
(1.广西大学化学化工学院,广西南宁 530004;2.广西中医药大学药学院,广西南宁 530001)
苦参碱(1)是豆科植物苦参、苦豆子、广豆根等中草药中的主要成分之一,具有良好的抗炎、抗菌、抗肿瘤等药理活性[1]。由于1存在生物利用度较低、对中枢神经系统有毒副作用等缺点,从而限制了其临床应用[2-9]。
磺胺类药物为人工合成的抗菌药,用于临床已近50年,具有抗菌谱较广、性质稳定等优点,成为大多数人们生活中用于抗菌的首选药物。
本文结合药物拼合原理,利用1-溴-2-氯乙烷(2a)或1-溴-3-氯丙烷(2e)作为连接链,将1和磺胺类化合物连接起来,设计并合成了一系列新型苦参碱磺胺类拼合物,期望通过协同作用增强抗菌活性,使其在医药领域得到广泛应用。以1为原料,分别与2a和2e经取代反应制得苦参碱衍生物(3a和3e);3a和3e分别与磺胺类衍生物(4a~4d)经亲核加成反应合成了8个新型的苦参碱磺胺类拼合物(5a~5h,Scheme 1),其结构经1H NMR,IR和MS表征。
1 实验部分
1.1 仪器与试剂
Bruker 600 MHz型超导核磁共振仪(CDCl3为溶剂,TMS为内标);GC-MS/QP 5050A型气质联用仪;FTIR-8400S型红外光谱仪(KBr压片)。
所用试剂均为分析纯。
1.2 合成
(1)3的合成(以3a为例)
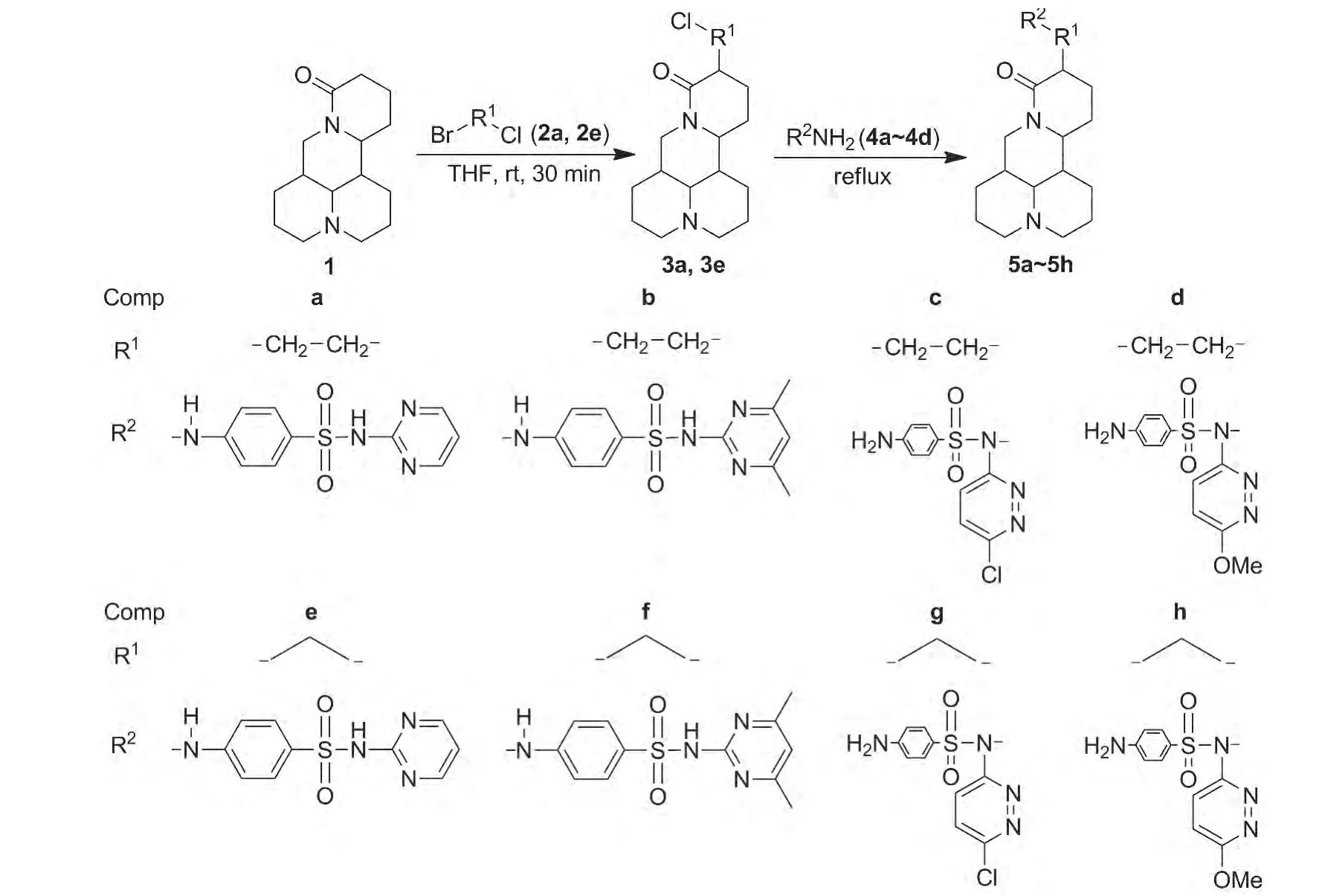
Scheme 1
氮气保护下,在反应瓶中依次加入1 1.24 g(5 mmol)和THF 20 mL,冰浴冷却,搅拌下加入二异丙基氨基锂3 mL,于室温反应30 min;冰浴冷却下加入2a 1.48 g(10 mmol),于室温反应5 h。加入氯化铵淬灭反应,加入5 mL水稀释,用3 mol·L-1盐酸调至 pH 2,用乙酸乙酯萃取(弃去),水相用饱和碳酸氢钠溶液调pH至7~8,用乙酸乙酯萃取,合并有机相,用无水硫酸钠干燥,减压蒸馏得黄色油状液体0.75 g,收率60.5%。
以2e代替2a,用类似方法合成黄色油状液体 3e,收率 55.6%。
(2)5a~5h的合成(以5a为例)
在反应瓶中依次加入丙酮50 mL,3a 1.2 g(2 mmol),搅拌使其溶解;加入磺胺嘧啶(4a)1.3 g(5 mmol)和碳酸钾2.1 g,回流(60℃)反应12 h。抽滤,滤液减压蒸馏得黄色油状液体,经硅胶柱层析[洗脱剂:A=V(甲醇)∶V(乙酸乙酯)=1 ∶10]纯化得 5a 0.82 g。
分别用4b~4d代替4a,用类似方法合成黄色或淡黄色油状液体5b~5d。
用3e代替3a,用类似方法合成黄色或淡黄色油状液体5e~5h[DMF(40 mL)为溶剂,回流(100℃)反应24 h。抽滤,滤液用水5 mL稀释,充分摇匀,用乙酸乙酯萃取,合并有机相,用无水硫酸钠干燥,减压蒸除溶剂得淡黄色油状物,经硅胶柱层析纯化]。
5a:收率 69.2%;1H NMR δ:8.42(dd,J=7.8 Hz,3.8 Hz,2H),7.86(dd,J=7.8 Hz,3.8 Hz,2H),6.81(t,J=4.8 Hz,1H),6.61(dd,J=4.8 Hz,1.8 Hz,2H),4.13(s,1H),3.14(m,1H),2.72 ~2.88(m,2H),2.69 ~2.75(m,1H),2.48(m,1H),2.23(s,1H),1.79 ~1.91(m,4H),1.59 ~ 1.66(m,4H),1.43 ~1.53(m,2H),1.35 ~ 1.44(m,4H),1.24 ~1.29(m,2H);IR ν:2 920(CH2),1 627(C=O),840(ArH)cm-1;MS m/z:524[M+],249,247,177,170,150,96,79,41,28。
5b:收率 65.7%;1H NMR δ:7.78(dd,J=7.2 Hz,3.2 Hz,2H),6.52(dd,J=7.2 Hz,3.2 Hz,2H),6.47(s,1H),4.23(s,1H),3.55(m,1H),2.86(m,3H),2.35(s,1H),2.30(s,2H),2.14 ~2.25(m,2H),1.53 ~1.56(m,4H),1.70 ~ 1.72(m,2H),1.48(s,6H),1.27 ~1.29(m,2H);IR ν:2 955(CH3),2 920(CH2),1 627(C=O),840(ArH)cm-1;MS m/z:552[M+],277,247,177,170,150,107,96,41,28。
5c:收率 59.3%;1H NMR δ:8.14(dd,J=10.2 Hz,5.6 Hz,2H),7.64(dd,J=8.4 Hz,3.8 Hz,2H),7.19(d,J=10.2 Hz,H),6.59(dd,J=8.4 Hz,3.8 Hz,2H),4.42(s,1H),3.15(m,1H),2.84(m,3H),2.45(s,1H),2.04 ~2.18(m,2H),1.88(m,2H),1.75(m,1H),1.64 ~ 1.69(m,4H),1.51(m,2H),1.33 ~1.41(m,4H),1.21 ~1.28(m,2H);IR ν:2 923(CH2),1 628(C=O),840(ArH)cm-1;MS m/z:558.5[M+],283.5,247,177,170,150,113.5,96,41,28。
5d:收率 61.4%;1H NMR δ:8.16(d,J=9.6 Hz,1H),7.72(dd,J=3.0 Hz,1.8 Hz,2H),6.95(d,J=9.6 Hz,1H),6.64(dd,J=3.0 Hz,1.8 Hz,2H),4.32(s,1H),3.99(s,3H),3.25(m,1H),2.82 ~ 2.90(m,2H),2.72 ~2.79(m,1H),2.53(m,1H),2.29(s,1H),1.82 ~ 1.98(m,4H),1.63 ~ 1.72(m,4H),1.49 ~ 1.58(m,2H),1.41 ~ 1.45(m,4H),1.27 ~1.33(m,2H);IR ν:2 920(CH2),1 629(C=O),1 110(C -O),841(ArH)cm-1;MS m/z:554[M+],279,247,177,150,107,96,41,28。
5e:收率 43.6%;1H NMR δ:8.40(dd,J=4.2 Hz,2.2 Hz,2H),7.82(dd,J=4.2 Hz,2.2 Hz,2H),6.80(t,J=4.8 Hz,1H),6.64(dd,J=4.8 Hz,2.4 Hz,2H),4.17(s,1H),3.16(m,1H),2.76 ~2.93(m,2H),2.64 ~2.74(m,1H),2.45(m,1H),2.27(s,1H),1.81 ~1.96(m,4H),1.63 ~ 1.68(m,6H),1.45 ~1.54(m,2H),1.29 ~ 1.43(m,4H),1.19 ~1.25(m,2H);IR ν:1 645(C=O),2 925(CH2),844(ArH)cm-1;MS m/z:538[M+],249,247,177,170,150,96,79,42,41。
5f:收率 48.4%;1H NMR δ:7.83(dd,J=6.0 Hz,3.6 Hz,2H),6.59(dd,J=6.0 Hz,3.6 Hz,2H),6.51(s,1H),4.27(s,1H),3.59(m,1H),2.90(m,3H),2.36(s,1H),2.37(s,2H),2.19 ~ 2.30(m,2H),1.59 ~ 1.63(m,6H),1.74 ~ 1.79(m,2H),1.53(s,6H),1.30 ~1.32(m,2H);IR ν:2 959(CH3),2 925(CH2),1 645(C=O),844(ArH)cm-1;MS m/z:566[M+],277,247,177,170,150,107,96,42,41。
5g:收率 44.5%;1H NMR δ:8.17(dd,J=8.4 Hz,6.2 Hz,2H),7.66(dd,J=5.4 Hz,2.8 Hz,2H),6.93(d,J=8.4 Hz,1H),6.67(dd,J=5.4 Hz,2.8 Hz,2H),4.45(s,1H),3.19(m,1H),2.89(m,3H),2.48(s,1H),2.08 ~2.21(m,2H),1.90(m,2H),1.79(m,1H),1.69 ~1.75(m,4H),1.54(m,2H),1.37 ~1.42(m,6H),1.25 ~ 1.29(m,2H);IR ν:2 924(CH2),1 645(C=O),843(ArH)cm-1;MS m/z:573[M+],284,247,177,170,150,114,96,42,41。
5h:收率 42.1%;1H NMR δ:8.22(d,J=3.6 Hz,1H),7.75(dd,J=4.2 Hz,2.2 Hz,2H),6.99(d,J=3.6 Hz,1H),6.70(dd,J=4.2 Hz,2.2 Hz,2H),4.45(s,1H),4.07(s,3H),3.35(m,1H),2.88 ~ 2.97(m,2H),2.75 ~2.81(m,1H),2.55(m,1H),2.33(s,1H),1.85 ~2.01(m,4H),1.69 ~1.74(m,6H),1.53 ~1.61(m,2H),1.44 ~1.49(m,4H),1.31 ~1.38(m,2H);IR ν:2 923(CH2),1 645(C=O),1 117(C -O),842(ArH)cm-1;MS m/z:568[M+],279,247,177,150,107,96,42,41。
2 结果与讨论
2.1 合成
(1)3[10]的合成
1及其衍生物具有在酸水中易溶而在碱水中难溶的特性,因此,在3的合成 后处理中,先调pH至2,用乙酸乙酯萃取,可以除去未反应完全的2。3a和3e溶于水相中,这时再把水相pH调至7~8,用乙酸乙酯萃取出3a和3b。1溶于水中时,需要调至 pH 9~10才能从水层中萃取出来;3a和3e为1衍生物,连接了短碳链,亲脂性增强,pH调至7~8就能被萃取出来。该法后处理简便、安全,无需进一步纯化。
(2)5的合成
在5a的合成中,3a溶于丙酮,用碳酸钾作缚酸剂,回流(60℃)反应12 h,由于1的15-位羰基具有吸电子效应,对反应有促进作用,收率提高。
在5e~5h的合成中,先采用与5a~5d相同的合成方法时,5e~5h收率相对较低,副产物较多,反应难以进行。后改为将3e溶于DMF中,回流(100℃)反应,反应时间相对延长。3e的反应效率较3a低,由于碳链增长,使苦参碱15-位的羰基吸电子效应对反应有抑制作用,3e自身消去生成Ⅰ;在高温长时间的反应中,3b上的γ-碳与苦参碱15-位羰基上的氧相连,形成一个六元环得Ⅱ(Scheme 2),增强结构稳定性。

Scheme 2
3 结论
利用1-氯-2-溴乙烷和1-氯-3-溴丙烷提供一个短的碳链,将苦参碱和磺胺类衍生物基团连接起来,经2步反应合成了8个新的苦参碱磺胺类拼合物,有望作为抗菌类药物在医药领域得到广泛应用。
该方法具有合成路线简单、收率高等优点,对该类化合物的合成提供了参考。
[1]中华人民共和国国家药典委员会.中国药典(Ⅰ部)[M].北京:化学工业出版社,2000.
[2]袁静,张宗俭.苦参碱的生物活胜及其研究进展[J].农药,2003,42(7):1 -4.
[3]张丽华,陈邦恩,潘明佳.苦参碱药理作用研究进展[J].中草药,2009,40(6):1000 -1003.
[4]王磊,李庆林.苦参碱抗肿瘤作用机制研究进展[J].安徽医药,2009,13(4):360 -362.
[5]黄彩云,谢世荣,黄胜英,等.苦参碱抗心律失常作用的实验研究[J].大连医科大学学报,2002,24(3):176-179.
[6] 冯瑛.苦参碱的药用价值[J].青海大学学报:自然科学版,2005,23(6):50 -51.
[7]黄彩云,谢世荣,黄胜英,等.苦参碱抗心律失常作用的实验研究[J].大连医科大学学报,2002,24(3):176-179.
[8]李静雨,唐安洲,王立升,等.苦参碱改构体X抑制鼻咽癌细胞CNE2增殖作用的实验研究[J].中国医药导报,2011,17(8):13 -15.
[9]万丽艳,张保红.苦参碱在慢性肝病治疗中的作用[J].山西中医,2009,1(25):44 -45.
[10]付海根,唐胜,李迎红,等.新型12-N-取代苦参酸衍生物的合成及其抗结核活性[J].合成化学,2014,22(6):739-743.

