降纤酶胶囊制备工艺研究
段丽萍
(云南省药物研究所、云南白药集团创新研发中心、云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
降纤酶胶囊制备工艺研究
段丽萍
(云南省药物研究所、云南白药集团创新研发中心、云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
目的:通过降纤酶胶囊制备工艺的研究,确定其最佳工艺条件。方法:测定降纤酶原料药粉末的堆密度、吸湿性和流动性,检测分析辅料的性质,优选适宜辅料条件,确定制剂处方和制剂成型工艺。结果:该降纤酶制备工艺条件稳定,方法科学。结论:该方法可作为降纤酶的制备工艺,为生产实践提供理论依据。
降纤酶胶囊;制备工艺;工艺研究
降纤酶(Defibrase)是从尖吻蝮蛇(Agkistrodon acutus)和长白山白眉蝮蛇(Agkistrodon halys ussuriensis)蛇毒中提取分离得到的一种类凝血酶,具有显著的去纤、降黏、溶栓等作用,可广泛用于临床治疗和预防心脑血管血栓性疾病。
1 材料与仪器
1.1 仪器
电子天平(Mettler Toledo),4号空心胶囊(浙江绿健胶囊有限公司,12022503),胶囊充填机(IMA ZANASI40F),热风循环烘箱(H-RXH-A)。
1.2 材料
降纤酶(中鑫东泰纳米基因生物技术有限公司)、二氧化硅(湖南尔康制药有限公司,20100101)、淀粉(辽宁东源药业有限公司,12010601)、糊精、预胶化淀粉、水溶性淀粉、微晶纤维素。
2 方法与结果
2.1 处方前研究
研究原料降纤酶粉末的理化性质,有利于在制剂研究过程中有目的地选择适宜辅料、确定制剂处方和制剂成型工艺。降纤酶粉末的理化性质主要包括堆密度、流动性、吸湿性,分述如下。
2.1.1 堆密度的测定 降纤酶粉末的堆密度与胶囊剂装量具有一定关系,了解其粉末的堆密度有利于选择合适型号的空心胶囊。本实验粉末堆密度采用量筒法测定,结果见表1。
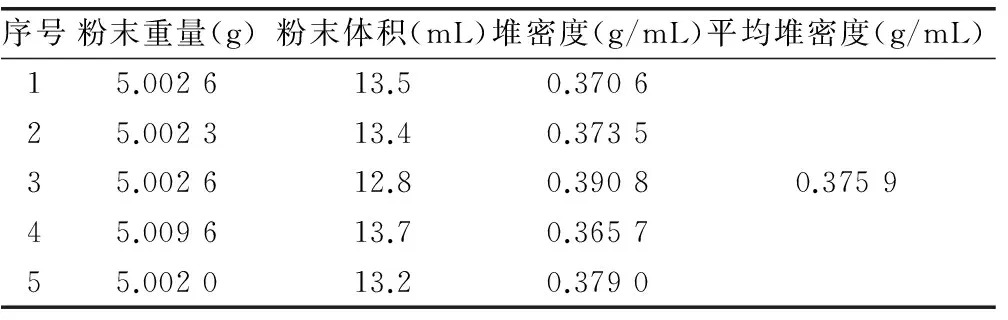
表1 降纤酶粉末堆密度测定结果 (n=5)
实验结果表明,本品粉末的堆密度为0.38g/mL。
2.1.2 吸湿性测定 本实验采用过饱和溶液法测定,结果表示,降纤酶原料粉末吸湿率较高。见表2。
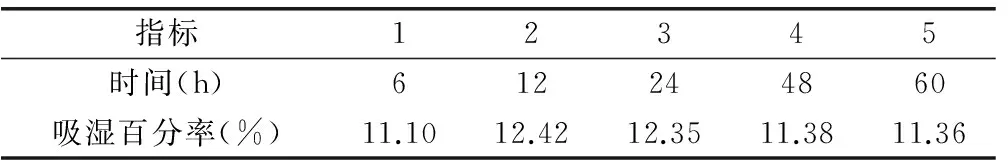
表2 不同相对湿度降纤酶中干燥粉末吸湿率 (25℃)
2.1.3 流动性测定 降纤酶粉末流动性可根据休止角、流出速度和内摩擦系数测定,本研究采用固定漏斗法测定。实验结果表明,降纤酶粉末流动性较差(α>40°)。见表3。
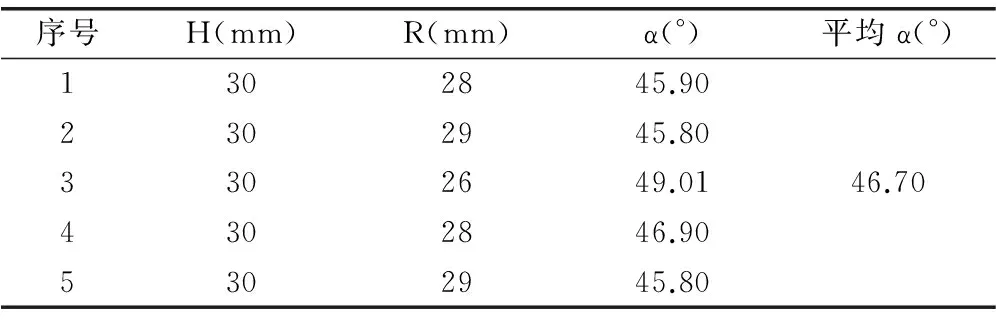
表3 降纤酶干燥粉末休止角测定
综上所述,原药料粉末堆密度为0.38g/mL,休止角(α°)大于40°,吸湿强,流动性较差不宜直接填充胶囊,应考虑加入适当辅料或制成颗粒后再填充。
2.2 处方研究
2.2.1 辅料选择 根据降纤酶粉末物理性质研究结果可知,该粉末吸湿性强、流动性较差,考虑生产成本和辅料性能,拟用辅料为:淀粉、糊精、微晶纤维素(MCC)、二氧化硅,改善粉末的流动性和降低吸湿性。上述辅料的堆密度见表4。

表4 不同辅料堆密度 (g/mL)
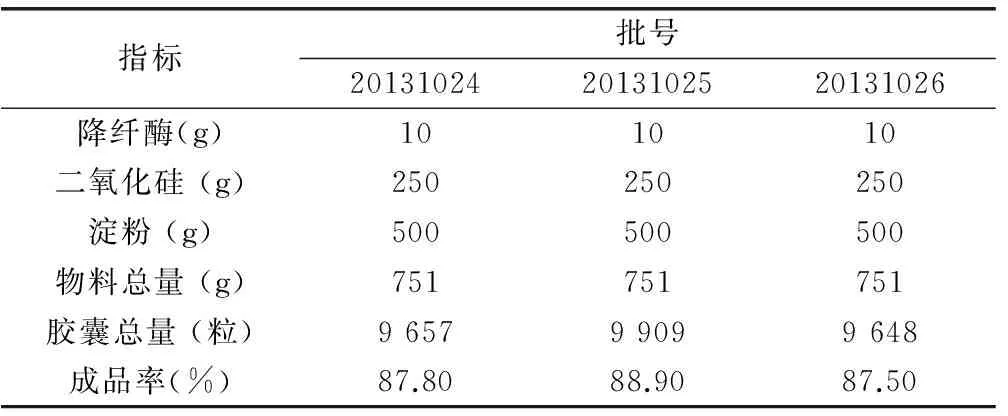
2.2.2 胶囊型号及辅料加入量的确定 根据药效实验和堆密度测试结果,考虑选用4号常用胶囊。按该设想拟定辅料处方组成,分别为FA(淀粉+糊精=1+1)、FB(淀粉+微晶纤维素=1+1)、FC(淀粉+二氧化硅=2+1)进行装置实验,确定原料药与药用辅料用量比。结果见表5。
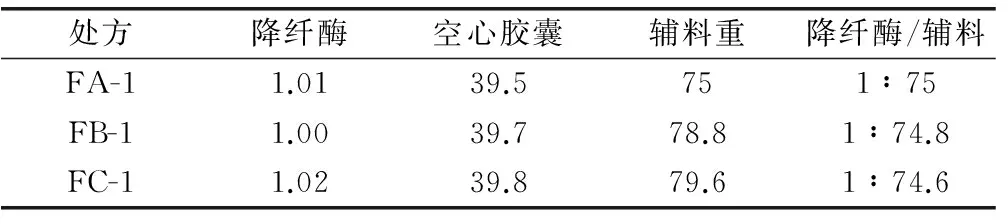
表5 试装量试验结果 (mg)
根据表5结果可知,4号胶囊原料药降纤酶粉末与辅料比例约为1∶79,由此确定填装体积约为0.21mL的4号胶囊所需加入辅料用量,结果见表6。
2.2.3 内容物性质研究 按表6中3个处方组成比例称取辅料,充分混匀加入原料药粉末,混匀,分别考察其吸湿性、流动性,并进行填充试验考察其装量差异、崩解时限等指标。

表6 拟定处方组成
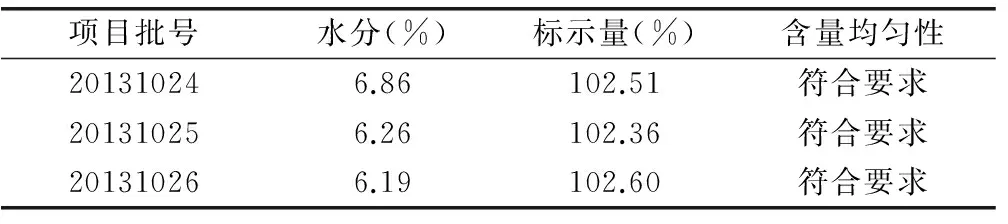
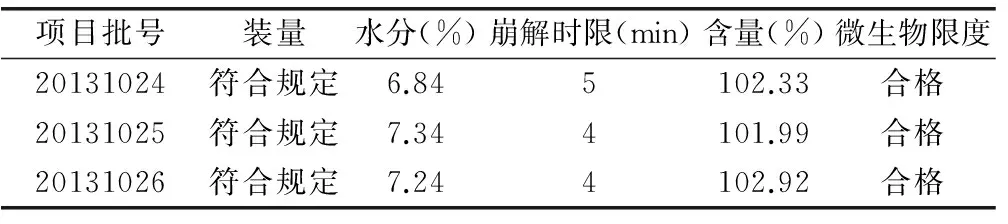
(1)内容物吸湿性研究。在温度为25℃、相对湿度为75%的条件下,各处方60h内吸湿程度为 FC 表7 五种处方内容物吸湿率情况比较 (%,n=2) (2)内容物流动性研究。结果显示, FC处方内容物的休止角均小于35°。见表8。 表8 不同处方内容物休止角情况比较 (n=2) (3)填充试验。结果显示,制备的胶囊FC、FB,其装量差异均符合规定,各处方装量差异变化较小,表明填充较均匀,分剂量较准确。见表9。 表9 不同处方组成的填充试验结果 (n=10) (4)胶囊剂崩解时限的测定。试验结果表明,上述各处方的胶囊崩解时限均符合规定,且无明显差异。见表10。 表10 不同处方胶囊崩解时限检查结果比较 (min) 综上所述,根据上述试验结果,结合生产成本因素考虑,选定处方FC作为该胶囊的制备方法。 3.1 处方组成 处方由降纤酶1g、淀粉50g、二氧化硅25g制成1 000粒胶囊。 3.2 工艺条件 按处方组成称取降纤酶、淀粉、二氧化硅,充分混匀,填充胶囊。按《中国药典》(一部)装量差异项下规定检查相关指标,同样操作三批。结果表明,通过考察三批试验的最佳条件,经检测各项指标均符合《中国药典》(2010版)胶囊剂标准。见表11。 表11 最佳工艺条件重复性考察结果 在确定以上工艺路线及参数后,在昆明国家生物产业基地生物医药中试生产中心进行中试规模生产研究。 4.1 处方组成 处方由降纤酶10g、淀粉500g、二氧化硅250g制成1 000粒胶囊。按处方组成称取降纤酶、淀粉、二氧化硅,处方混匀,装入2号胶囊,即得。 4.2 生产工艺 工艺流程见图1。 图1 生产工艺流程 中试生产设备见表12。 表12 中试生产设备及参数 表13 降纤酶胶囊中试三批试制情况 4.3 中试生产情况 中试结果表明,该工艺可适应现有设备的生产要求,三批中试产品成品率稳定,质量均符合胶囊剂标准及质量标准草案要求,生产工艺可行、稳定。该方法可作为降纤酶的制备工艺,为生产提供理论依据。 表14 降纤酶胶囊中试三批中间品质量检查情况 表15 降纤酶胶囊中试三批质量检查情况 [1] 安慧艳,岳梅林,赵小龙.降纤酶的药理作用及其研究进展[J].中国药房,2005,16(19):1504-1506. [2] 董方言.现代实用中药新制剂新技术[M].北京:人民卫生出版社,2001. [3] 吕红,陈立明,吴保明,等.便通胶囊中浸膏颗粒薄膜包衣的防吸湿研究[J].中成药,2002,24(2):90-92. [4] 国家药典委员会.《中国药典》[M].一部.北京:中国医药科技出版社,2010. (责任编辑:李岚春) Capsule Preparation Technology Research of Defibrase Duan Liping (Yunnan Institute of Materia Medica, Yunnan baiyao group innovation research and development center, key laboratory of drug discovery enterprise of Chinese medicine and national medicine of Yunnan,Kunming 650111,China) Objective:Through the capsule preparation technology research of Defibrase,determine the optimum process conditiongs.Methods:Through the determination of API powder bulk density、hygroscopicity and liquidity,analysis on the nature of the material for testing at the same time,selection of appropriate materials、determine the formulation and preparation for molding process.Results:Appropriate preparation process of the study on defibrase capsule preparation.Conclusion:The conditions and method of Defibrase preparation process are stable and scientific,to provide a theoretical basis for the production. Defibrase Capsule;Preparation Process;Research 2015-03-19 段丽萍(1980-),女,云南省药物研究所、云南白药集团创新研发中心、云南省中药和民族药新药创制企业重点实验室化学制药研究室工程师,研究方向为药物制剂。 R282;TQ461 A 1673-2197(2015)14-0020-03 10.11954/ytctyy.201514009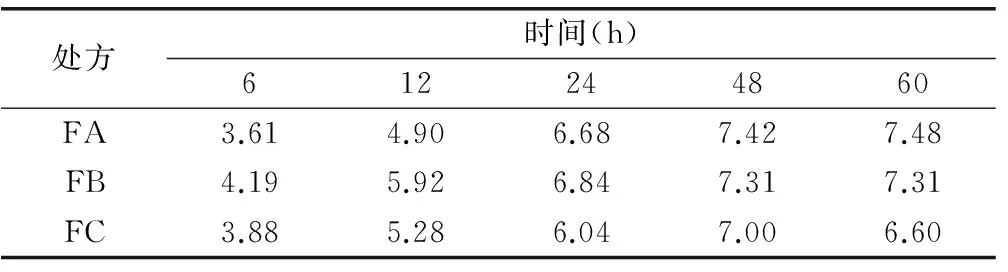



3 最佳工艺条件重复性考察

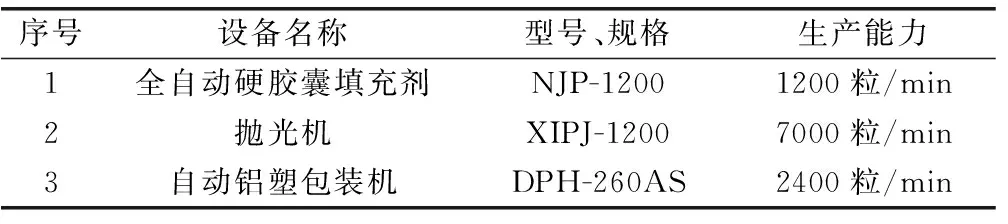
4 中试研究