PtRhSn/GN的制备及其对甲醇电催化氧化性能研究
朱复春,游乐星,瞿希铭,张斌伟,张宗成,姜艳霞,孙世刚
(厦门大学 化学化工学院,固体表面物理化学国家重点实验室,福建厦门361005)

PtRhSn/GN的制备及其对甲醇电催化氧化性能研究
朱复春,游乐星,瞿希铭,张斌伟,张宗成,姜艳霞*,孙世刚
(厦门大学 化学化工学院,固体表面物理化学国家重点实验室,福建厦门361005)
本研究通过多元醇还原法制备了石墨烯(graphene,GN)负载的Pt及Pt基多元催化剂:Pt/GN、PtRh/GN、PtSn/GN、PtRhSn/GN.X射线粉末衍射(XRD)和透射电镜(TEM)结果表明,所制备的催化剂分布均匀,Pt/GN和PtRh/GN具有立方体形状,PtSn/GN呈现三维网络形貌,PtRhSn/GN则为立方体延伸的三维网络.循环伏安研究表明,Rh的加入提升了甲醇电催化氧化的活性,而Sn的加入明显降低了甲醇在Pt上的起始氧化电位,负移达到106 mV.电化学原位红外光谱研究进一步证明,Rh和Sn的加入使得Pt基催化剂对甲醇氧化的起始氧化电位负移;Rh的加入使得CO谱峰强度增大,而Sn的加入明显降低了CO谱峰强度.三元催化剂PtRhSn/GN很好地综合了Rh和Sn的电子效应及协同效应特点,相比于Pt/GN催化剂,起始氧化电位负移60 mV,且催化活性达到其1.57倍,表明该三元催化剂在直接甲醇燃料电池中将会有较好的应用前景.
PtRhSn/GN;石墨烯;甲醇;循环伏安法;电化学原位红外光谱
直接甲醇燃料电池(DMFC)因其质量轻、体积小、结构简单、能量效率高而具有广阔的应用前景[1-2].目前,制约DMFC商业化的主要问题之一是Pt阳极催化剂对甲醇的电催化活性较低,且甲醇电氧化过程中产生的CO中间产物容易使Pt催化剂中毒.因此,如何提高DMFC阳极催化剂对甲醇氧化的电催化活性是一个很重要的研究课题.一般主要从两个方面来提高催化剂的活性:一是改变催化剂的表面结构[3-5];二是改变催化剂的电子结构[6-8].通过改进催化剂的制备方法,能获得粒径小、分布均匀且具有特定表面结构和电子结构的催化剂,有效提升贵金属元素的活性表面积和催化活性.对于电子结构调控,合金化是一种很好的方法,不仅可以通过第二元素的添加改变贵金属表面电子结构,使得其对有机小分子吸附方式发生改变,还可以通过添加特殊性能的元素协同贵金属进行催化氧化反应.大量科研实验表明,第二甚至第三元素的添加,能够使得贵金属元素Pt不仅拥有更高的催化活性,而且稳定性也有所提升[9-13].与此同时,催化剂中贵金属Pt的负载量降低,使得催化剂成本降低,从而促进了低温燃料电池商业化发展.有文献报道,Rh与Pt的协同效应使得PtRh催化剂对于甲醇电氧化所需能量降低[14],因此Rh掺杂的Pt基催化剂对甲醇电催化氧化表现出更高的活性,且有效降低起始氧化电位;Sn能与Pt产生很好的双功能效应,能在低电位下提供更多的羟基从而提升Pt对有机小分子电氧化的催化活性,有效地消除了催化剂的自毒化现象[15].虽然关于PtSn和PtRh催化剂的研究已有过报道,但是当两种添加元素共同作用于Pt时,各元素在甲醇电催化氧化时的作用机理仍然值得研究.石墨烯(graphene,GN)材料比表面积大、导电性好,可以用作载体制备出粒径小且分布均匀的贵金属催化剂[16].
本工作中,以不同金属的盐为前躯体,通过多元醇共还原法,以GN为载体、四甲基溴化铵为结构导向剂,制备出粒子尺度小、分布均匀的Pt/GN、PtRh/GN、PtSn/GN、PtRhSn/GN电催化剂.并通过X射线粉末衍射(XRD)、透射电镜(TEM)、能谱仪(EDS)、循环伏安、傅里叶变换红外光谱(FT-IR)等方法,对所合成的电催化剂进行结构和形貌及其对甲醇氧化的电催化性能的研究,分析了添加元素Rh和Sn的作用机理,并得到了催化性能更佳的三元催化剂PtRhSn/GN.
1 实 验
1.1 试剂和仪器
氯铂酸(H2PtCl6·6H2O,AR级)、二水合氯化亚锡(SnCl2·2H2O,AR级)、氯化铑(RhCl3,AR级)、硫酸(GR级)、无水甲醇(AR级)、乙二醇(AR级)均购于国药集团化学试剂有限公司;GN购于南京先丰纳米材料科技有限公司;5%(质量分数)Nafion溶液购于Aldrich化学公司.所有溶液均用Milli-Q超纯水(18.2 MΩ·cm)配制.
PAR-263恒电位仪电化学工作站,Nexus 870 FT-IR仪(美国Nicolet),配备液氮冷却的MCT-A型检测器.
1.2 催化剂的制备
按Pt载量为18%(质量分数,下同),各元素按n(Pt)∶n(Rh)=6∶1,n(Pt)∶n(Sn)=3∶1和n(Pt)∶n(Rh)∶n(Sn)=6∶1∶2的比例将H2PtCl6·6H2O、SnCl2·2H2O和RhCl3的乙二醇溶液加入到洁净的50 mL圆底烧瓶中,加入计算量的GN,然后加入适量乙二醇溶液使得混合液达到40 mL,在混合液中加入50 mg四甲基溴化铵,置于超声仪中室温超声30 min.将圆底烧瓶置于油浴锅(甲基硅油)中,配上冷凝回流装置,在180 ℃下磁力搅拌还原2 h.将所得黑色沉淀多次离心清洗,于60 ℃恒温箱真空蒸干后研磨备用,制得的催化剂命名为Pt/GN、PtRh/GN、PtSn/GN和PtRhSn/GN.
1.3 工作电极的制备
将1 mg上述制备的催化剂加入1 mL异丙醇中,充分混合并超声.玻璃碳电极(GC)的预处理:将GC用氧化铝抛光剂作为磨料在研磨布上抛光,然后置于超声清洗器内的超纯水介质中超声清洗.取5 μL上述混合液滴加到GC上,待异丙醇挥发完毕,滴加4 μL Nafion溶液于催化剂上使其固定,待溶剂再次挥发完毕即可使用.
1.4 电化学测量
电化学测量在PAR-263恒电位仪电化学工作站上进行.对电极为铂黑电极,参比电极为饱和甘汞电极(SCE),本文所述电位均相对于SCE.电解液为0.5 mol/L硫酸、0.1 mol/L高氯酸和0.5 mol/L甲醇溶液,测试温度为20 ℃.电化学测量前向各电解液中通入15 min氩气以消除溶液中的氧气.循环伏安测量时,电位扫描速率为50 mV/s,实验过程中电解液始终处于氩气保护下.
1.5 原位FT-IR表征
本文采用电位差谱,即在两个电位(研究电位ES和参考电位ER)下分别采用单光束光谱R(ES)和R(ER),结果谱图为电位差谱:
根据差谱定义,向下谱峰归属于研究电位下生成的物种,向上谱峰归属于参考电位下的物种.根据FT-IR的工作原理,红外检测器记录的是干涉图,经累加平均并进行傅里叶变换成为单光束光谱.谱图的信噪比与累加平均的干涉图数目(N)之平方根成正比,本工作选择N为800.
2 结果与讨论
2.1 XRD结果分析

图1 合成催化剂的XRD谱图(a)和37°~43°间的放大谱图(b);PtRhSn/GN的拉曼光谱(c)
图1(a)和(b)为制备得到的Pt/GN、PtRh/GN、PtSn/GN、PtRhSn/GN的XRD谱图.在4种催化剂上,均出现2θ约为39.9°,46.4°,67.8°和81.6°的衍射峰.分别对应Pt的(111)、(200)、(220)和(331)晶面,表明这些催化剂中都含有面心立方结构的Pt.对于PtSn/GN和PtRhSn/GN催化剂而言,除了这4个衍射峰,在34°和52°处也出现强度很小的衍射峰,归属于SnO2的(101)和(211)晶面.图1(c)为催化剂PtRhSn/GN的拉曼光谱,谱图中约568 cm-1处对应的是无定形相的SnO2[17],进一步证明了SnO2的存在.对于纯Pt[18],4个晶面对应的衍射峰分别位于39.84°,46.35°,67.59°和81.38°;而在纯Rh上[19],对应衍射峰分别位于40.52°,47.56°,69.56°和84.10°.从图1(a)可以看到PtRh/GN催化剂的衍射峰分别为39.94°,46.44°,67.74°和81.55°,相较于单一Pt催化剂,PtRh催化剂的衍射峰整体向右略有偏移,这归因于Pt中合金化了更小的Rh原子到Pt的面心立方中[20].而对于PtSn催化剂而言,4个衍射峰分别为39.18°,45.60°,66.85°和79.84°,相较于单一Pt整体向低角度偏移,其主要原因是Sn的掺杂使得Pt的晶面指数增大[21].可以看到PtSn的偏移程度要大于PtRh,这归因于掺杂元素Sn的含量是Rh的2倍.而三元催化剂PtRhSn则向低角度有微小偏移,4个衍射峰为39.46°,45.70°,67.40°和79.96°.这是由于添加元素Sn的含量大于Rh,所以整体相较于Pt向低角度偏移.图1(a)中37°~43°间的放大谱图如图1(b)所示,可以明显看到多元催化剂(111)晶面谱峰的偏移.

(a)Pt/GN;(b)PtRh/GN;(c)PtSn/GN;(d)PtRhSn/GN.
2.2 TEM结果分析
图2为Pt/GN、PtRh/GN、PtSn/GN和PtRhSn/GN的TEM图,从图中可以看到,Pt/GN催化剂呈现不规律的立方体形貌,粒径约为13 nm,这是由于在结构导向剂四甲基溴化铵的作用下Pt原子按立方体结构生长.而Rh的添加使得Pt出现规则的立方体形貌,粒径仅为7 nm,这可归因于Rh与Pt拥有相近的晶格结构.PtRh立方体粒径更小,则是由于在四甲基溴化铵的作用下,形成的[PtBr6]2-和[RhBr6]3-的配位能力不同,以及Rh原子粒径小于Pt所致[17].将Sn添加到Pt中,呈现如图2(c)所示的一种三维网络形貌,且催化剂颗粒的截面直径进一步减小,约为4 nm.三元催化剂PtRhSn/GN形貌呈现PtRh/GN与PtSn/GN的综合结果,呈现由立方体延伸而成的三维网络形貌.由此可以看出,添加元素Sn由于原子结构和表面电子结构与Pt和Rh存在明显差异,不能很好地形成规则的立方形貌,但是所形成的三维网络形貌分布很均匀且截面直径小,具有高的比表面积,能有效提高其活性表面积.对4种催化剂进行EDS表征,得到所合成4种催化剂的原子比如表1所示,催化剂的实际Pt载量约为15%.

表1 合成催化剂的原子比
2.3 循环伏安研究
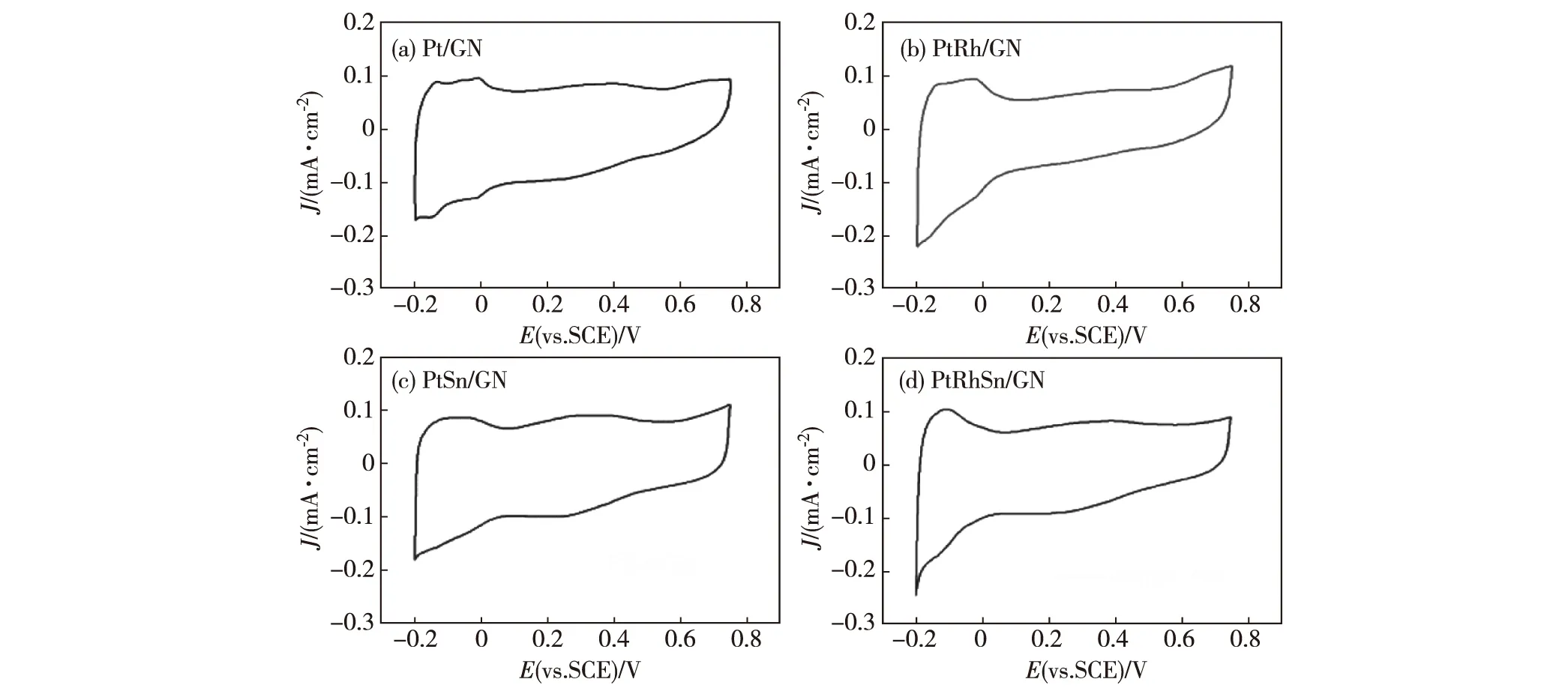
图3 4种催化剂在0.5 mol/L硫酸中的循环伏安曲线图(扫描速率50 mV/s)
图3为Pt/GN、PtRh/GN、PtSn/GN和PtRhSn/GN 4种催化剂在0.5 mol/L硫酸中的循环伏安曲线,通过公式QH/(210 μC/cm2)可计算Pt基催化剂的电化学活性表面积[22],其中QH为氢区吸附峰积分面积.一般说来,当Pt中添加Sn元素时,由于表面亲氧性Sn和其氧化物的存在而导致双电层增大[23-24].所合成4种催化剂中,PtSn/GN纳米颗粒催化剂存在最宽的双电层,表明其导电性能最低.这是由于Sn的加入,产生部分与Pt相邻的具有半导体特性的SnO2所致.而Rh的加入则使得双电层变窄,这种差别从成分上看,明显是由于元素Rh的加入所致.从氢的吸脱附区可以看到,单一Pt催化剂存在特征的两个氢吸附峰,归属于-0.01 V处氢在Pt(100)位上的吸附和-0.15 V处氢在的Pt(110)位上的吸附;在PtRh/GN上也可以看到属于Pt(100)的特征吸附峰;而在PtSn/GN、PtRhSn/GN上,于氢吸脱附电位区间只观察到一个宽的氢吸脱附峰,这与已有文献中Pt基二元和三元催化剂的循环伏安曲线相似[25-27].
图4为Pt/GN、PtRh/GN、PtSn/GN和PtRhSn/GN在0.1 mol/L 高氯酸+0.5 mol/L 甲醇溶液中的线扫伏安曲线,表2为对应的甲醇起始氧化电位、峰值电位和峰值电流密度.从中可以看出:相同Pt载量时,Rh元素的添加使甲醇起始氧化电位负移42 mV,活性提升为Pt/GN的1.2倍.这归因于Rh与Pt的双功能作用[28].相关文献也有报道,Rh与Pt形成合金时,对甲醇电催化展现出较好的抗CO中毒能力[29].而Sn的加入,则更明显地降低了Pt催化剂的起始氧化电位,负移达到106 mV,且活性提升为1.34倍.另有文献报道,Sn与Pt形成合金,可以明显降低其起始氧化电位,且由于表面Sn部分以四价的SnO2形式存在,既能降低CO中间产物的吸附,又可与Pt通过双功能作用在低电位下提供更多的羟基物种以提高Pt的催化活性[30-32].通过峰值电流密度对比可以发现,三元催化剂PtRhSn同时有元素Rh和Sn的加入,Rh的添加可以改变Pt的d原子轨道电子密度,通过配体效应使得催化剂活性提升[33];而Sn的加入,通过其双功能效应,能在低电位下吸附更多的羟基物种,有效促进Pt的催化性能,而表面SnO2能降低CO中间产物的吸附情况,且能促进CO进一步氧化为CO2.当2种添加元素Rh和Sn通过不同的作用机理共同作用于Pt,使PtRhSn/GN展示出更好的电催化性能,相较于Pt/GN催化剂,起始氧化电位负移60 mV,活性达到其1.57倍.
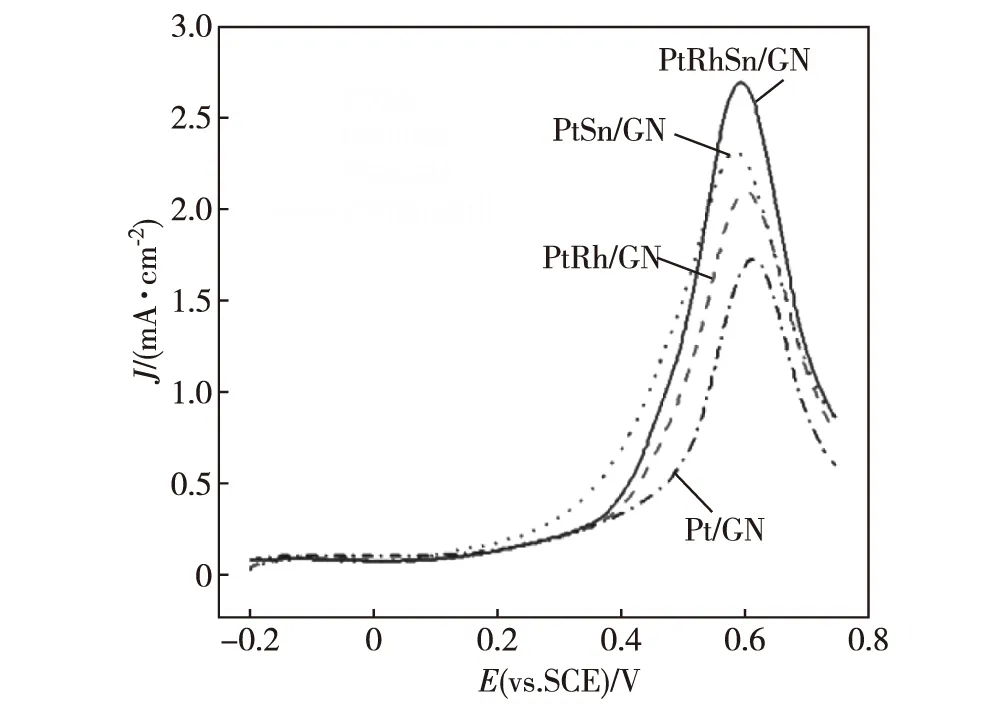
溶液:0.1 mol/L 高氯酸+0.5 mol/L 甲醇,扫描速率50 mV/s.
2.4 电化学原位FT-IR分析
传统的电化学技术只能得到纳米粒子电催化的整体信息,而电化学原位FT-IR技术可以在分子水平研究反应分子与电催化剂表面相互作用的规律,检测反应中间产物,从而更深刻地认识电化学催化反应的机理.图5为4种催化剂对甲醇电催化氧化的多步电位阶跃FT-IR谱图.为了研究不同电位下催化剂对甲醇的电催化氧化过程,测量范围为-0.15~0.35 V,电位间隔为50 mV,由此可以看到4种催化剂在不同电位下对甲醇电催化氧化的特性.
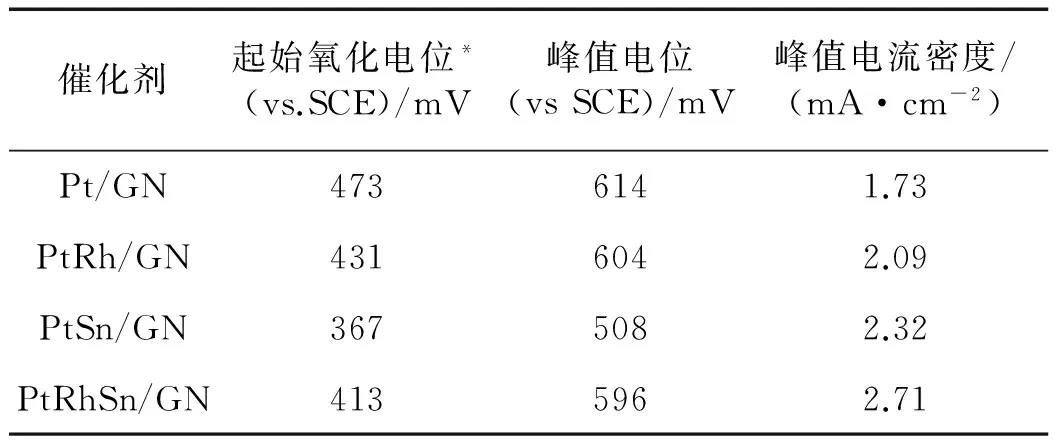
表2 活性催化剂在不同电位下的甲醇催化循环伏安曲线特征参数
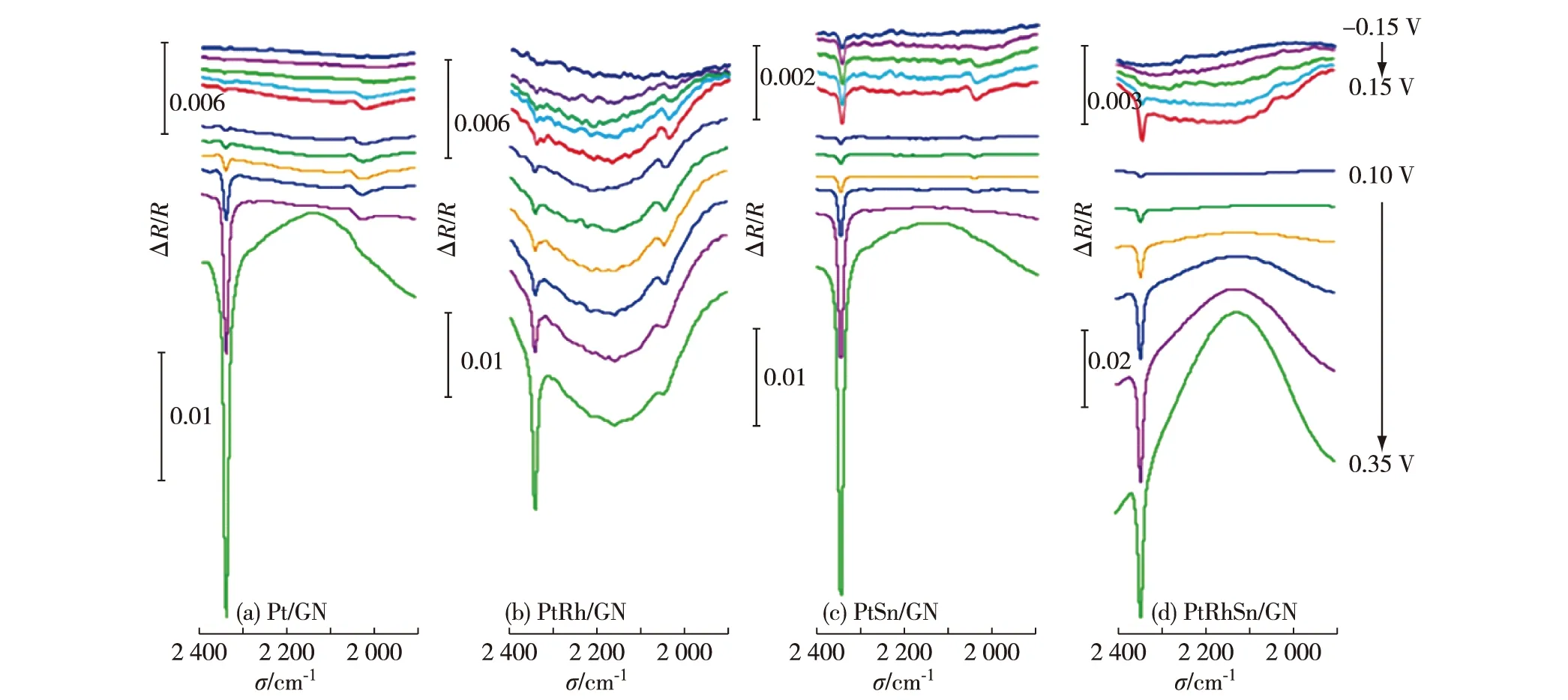
ER=-0.2 V,ES=-0.15~0.35 V,分辨率:8 cm-1,电位间隔:50 mV,溶液:0.1 mol/L高氯酸+0.5 mol/L甲醇.
图5中可以明显观察到2 050 cm-1附近甲醇解离吸附生成的线性吸附态CO(COL)的双极峰,其高波数谱峰为向上谱峰,对应于高电位下产生的CO(ES);低波数谱峰为向下谱峰,对应于低电位下产生的CO(ER).相较于差谱定义,此时观测到的COL谱峰方向发生倒反,说明CO吸附于所制备的4种催化剂表面产生异常红外效应[34].从图5可以看到在相同的电位下PtRh/GN上COL谱峰更强,归因于CO在Rh表面的吸附能力强于Pt,这也有助于甲醇在PtRh/GN上脱氢反应的进行.而在PtSn/GN和PtRhSn/GN上只观察到微弱的COL谱峰,由此说明,Sn和SnO2能促进CO中间产物完全氧化为CO2,有效降低CO在电极表面的富集,从而降低催化剂的中毒现象.
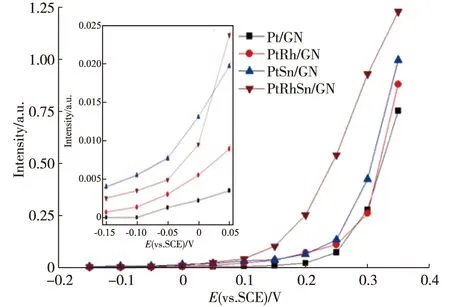
图6 催化剂对甲醇电氧化过程产生CO2的多步阶跃FT-IR谱图强度-电位曲线
图5中2 343 cm-1处的负向峰归属于甲醇完全氧化生成的CO2的非对称伸缩振动,其谱峰强度体现了甲醇完全氧化生成CO2的能力.随着电极电位的升高,该谱峰强度逐渐增大,表明生成CO2的量越来越多.如图6中催化剂对甲醇电氧化过程中不同电位下产生CO2谱峰强度插图所示,在Pt/GN、PtRh/GN、PtSn/GN和PtRhSn/GN上分别于0.05,-0.05,-0.15和-0.10 V观察到明显的CO2谱峰(CO2积分强度达到0.003).可知Rh和Sn的加入均能降低Pt基催化剂对甲醇电催化的起始氧化电位.这归因于Rh可在比Pt低约0.25 V的电位下解离水生成吸附态羟基物种[35],将甲醇解离吸附产生的CO氧化为CO2,从而释放出Pt的活性位点[36];而Sn的添加,当与Pt形成合金时可以有效降低催化反应活化能[32],从而使甲醇电氧化反应更容易进行.对于三元催化剂PtRhSn/GN而言,其起始氧化电位虽然低于Pt/GN,但是高于二元催化剂PtSn/GN,这可能是由于Rh与Pt类似,具有碳氢键断键能力[37],在低电位下可以发生水的解离反应且对甲醇有吸附作用[38],因而协助Pt电催化产生更多CO中间产物,而该产物强吸附于Rh和Pt表面,使得甲醇催化氧化反应难以顺利进行.图6中CO2谱峰积分强度-电位关系曲线可以看出Rh和Sn的添加都使得Pt对于甲醇电氧化产生CO2的量有所提升,但在低于0.10 V电位下差别不明显.这可能归因于Rh也具有碳氢键断键能力,但明显弱于Pt,产生更多的CO强吸附与Rh表面,产生更强的CO峰,释放出更多的Pt活性位点,但Rh的活性位点被占据,故CO2产量提升较小.对比PtSn/GN和Pt/GN,虽然Sn在低电位下能提供羟基物种,但是量较小,导致CO2电位虽低至-0.15 V,但产量小且增长缓慢.这可能归因于Sn单一的低电位羟基吸附作用.而观察三元催化剂PtRhSn/GN可以发现,其甲醇起始氧化电位提前且在低电位(0.05~0.30 V)下CO2产量增长速率明显较高(CO2积分强度增长斜率更大),这可能归因于Rh的低电位碳氢键断键作用,产生的CO强吸附于Rh,能释放更多的Pt活性位点,且Sn的加入在低电位下能够有效提供羟基物种,同时释放Pt和Rh吸附CO中间产物的活性位点,使得反应能够顺利进行.图6插图中通过对比4种催化剂在-0.15~0.05 V的CO2强度-电位曲线放大图谱,可以进一步发现:Rh同样具有低电位解离水吸附羟基物种作用,但强度明显低于Sn,且其使得Pt基催化剂对甲醇电催化产生CO2增长速率也低于Sn;当Rh与Sn共同作用于Pt时,Rh的碳氢键断键能力、解离水吸附羟基物种能力以及CO中间产物强吸附特性与Sn更强的低电位羟基吸附性能共同作用与Pt,使得三元催化剂PtRhSn/GN拥有更好的甲醇电催化性能.通过FT-IR研究,证明了Rh与Sn作为添加元素对于Pt基于甲醇催化氧化作用的不同机理,2种添加元素共同作用于Pt能有效提升其电催化性能.
3 结 论
以GN为载体,四甲基溴化铵为结构导向剂,通过多元醇还原法制备了系列催化剂Pt/GN、PtRh/GN、PtSn/GN、PtRhSn/GN.Pt/GN呈现粒径为13 nm的不规则立方体;PtRh/GN呈现规则的立方体,粒径更小仅为7 nm;Sn与Pt和Rh原子结构和表面电子结构具有明显差异,导致PtSn形成了三维网络形状;而三元催化剂PtRhSn由于有Rh和Sn的共同加入,形成了一种立方体延伸的三维网络.添加元素Rh和Sn都能降低Pt对甲醇催化氧化的起始氧化电位,Sn和Rh的加入分别使得Pt基催化剂对甲醇氧化电位负移106和42 mV.进一步的电化学原位FT-IR研究发现,CO优先吸附于Rh,从而可以减少Pt的催化剂中毒情况;而Sn的添加不仅可以促进Pt对于甲醇电催化性能,还可以有效降低甲醇氧化中间产物CO在Pt表面的富集.三元催化剂中由于Rh的添加,既可以降低甲醇氧化的过电位又能对甲醇电催化展现出较好的CO抗毒性;而Sn和SnO22种存在形式,都展现出低电位吸附羟基,继而有效降低CO中间产物在催化剂表面富集并有效促其进一步氧化的特性,使得催化剂的起始氧化电位明显负移,且拥有更高的电催化活性.在添加元素Rh与Sn的电子效应及双功能效应共同作用下,三元催化剂PtRhSn/GN表现出更优异的甲醇电催化氧化性能,相较于Pt/GN催化剂,起始氧化电位负移60 mV且活性达到其1.57倍,表明该三元催化剂将在DMFC中具有较好的应用前景.
[1] Liu H,Song C,Zhang L,et al.A review of anode catalysis in the direct methanol fuel cell [J].Journal of Power Sources,2006,155(2):95-110.
[2] Wasmus S,Küver A.Methanol oxidation and direct methanol fuel cells:a selective review [J].Journal of Electroanalytical Chemistry,1999,461(1):14-31.
[3] Tian N,Zhou Z Y,Sun S G,et al.Synthesis of tetrahexahedral platinum nanocrystals with high-index facets and high electro-oxidation activity [J].Science,2007,316:(5825):732-735.
[4] Tian N,Zhou Z Y,Sun S G.Platinum metal catalysts of high-index surfaces:from single-crystal planes to electrochemically shape-controlled nanoparticles [J].The Journal of Physical Chemistry C,2008,112(50):19801-19817.
[5] 党岱,高海丽,王晔.高性能核壳结构催化剂PdRu@Pt/CNT的制备 [J].物理化学学报.2011,27(10):2379-2384.
[6] Wang X,Wang W,Qi Z,et al.Novel Raney-like nanoporous Pd catalyst with superior electrocatalytic activity towards ethanol electro-oxidation [J].International Journal of Hydrogen Energy,2012,37(3):2579-2587.
[7] Du C,Chen M,Wang W,et al.Electrodeposited PdNi2alloy with novelly enhanced catalytic activity for electrooxidation of formic acid [J].Electrochemistry Communications,2010,12(6):843-846.
[8] Morales-Acosta D,Rodríguez G H,Godinez L A,et al.Performance increase of microfluidic formic acid fuel cell using Pd/MWCNTs as catalyst [J].Journal of Power Sources,2010,195(7):1862-1865.
[9] Lima F H B,Gonzalez E R.Ethanol electro-oxidation on carbon-supported Pt-Ru,Pt-Rh and Pt-Ru-Rh nanoparticles [J].Electrochimica Acta,2008,53(6):2963-2971.
[10] Liu Z,Ling X Y,Su X,et al.Carbon-supported Pt and PtRu nanoparticles as catalysts for a direct methanol fuel cell [J].The Journal of Physical Chemistry B,2004,108(24):8234-8240.
[11] Wu B,Hu D,Kuang Y,et al.Functionalization of carbon nanotubes by an ionic-liquid polymer:dispersion of Pt and PtRu nanoparticles on carbon nanotubes and their electrocatalytic oxidation of methanol [J].Angewandte Chemie International Edition,2009,48(26):4751-4754.
[12] Paulus U A,Endruschat U,Feldmeyer G J,et al.New PtRu alloy colloids as precursors for fuel cell catalysts [J].Journal of Catalysis,2000,195(2):383-393.
[13] Santiago E I,Camara G A,Ticianelli E A.CO tolerance on PtMo/C electrocatalysts prepared by the formic acid method [J].Electrochimica Acta,2003,48(23):3527-3534.
[14] Choi J H,Park K W,Park I S,et al.Methanol electro-oxidation and direct methanol fuel cell using Pt/Rh and Pt/Ru/Rh alloy catalysts [J].Electrochimica Acta,2004,50(2):787-790.
[15] Tu Dandan,Wu Bing,Wang Bingxing,et al.A highly active carbon-supported PdSn catalyst for formic acid electrooxidation[J].Applied Catalysis B:Environmental,2011,103(1/2):163-168.
[16] Yang J,Tian C,Wang L,et al.An effective strategy for small-sized and highly-dispersed palladium nanoparticles supported on graphene with excellent performance for formic acid oxidation [J].Journal of Materials Chemistry,2011,21(10):3384-3390.
[17] Singkammo S,Wisitsoraat A,Sriprachuabwong C,et al.Electrolytically exfoliated graphene-loaded flame-made Ni-doped SnO2composite film for acetone sensing [J].ACS Applied Materials & Interfaces,2015,7(5):3077-3092.
[18] Rodriguez P,Tichelaar F D,Koper M T M,et al.Cathodic corrosion as a facile and effective method to prepare clean metal alloy nanoparticles [J].Journal of the American Chemical Society,2011,133(44):17626-17629.
[19] Rao L,Jiang Y X,Zhang B W,et al.High activity of cubic PtRh alloys supported on graphene towards ethanol electrooxidation [J].Physical Chemistry Chemical Physics,2014,16(27):13662-13671.
[20] Kim Y S,Nam S H,Shim H S,et al.Electrospun bimetallic nanowires of PtRh and PtRu with compositional variation for methanol electrooxidation [J].Electrochemistry Communications,2008,10(7):1016-1019.
[21] Liu Z,Guo B,Hong L,et al.Microwave heated polyol synthesis of carbon-supported PtSn nanoparticles for methanol electrooxidation [J].Electrochemistry Communications,2006,8(1):83-90.
[22] Chen T Y,Luo T J M,Yang Y W,et al.Core dominated surface activity of core-shell nanocatalysts on methanol electrooxidation [J].The Journal of Physical Chemistry C,2012,116(32):16969-16978.
[23] Zhou W P,Axnanda S,White M G,et al.Enhancement in ethanol electrooxidation by sno x nanoislands grown on Pt (111):effect of metal oxide-metal interface sites[J].The Journal of Physical Chemistry C,2011,115(33):16467-16473.
[24] Zhu F,Wang M,He Y,et al.A comparative study of elemental additives (Ni,Co and Ag) on electrocatalytic activity improvement of PdSn-based catalysts for ethanol and formic acid electro-oxidation [J].Electrochimica Acta,2014,148:291-301.
[25] Zhu F,Ma G,Bai Z,et al.High activity of carbon nanotubes supported binary and ternary Pd-based catalysts for methanol,ethanol and formic acid electro-oxidation [J].Journal of Power Sources,2013,242(22):610-620.
[26] Zhang B W,He C L,Jiang Y X,et al.High activity of PtBi intermetallics supported on mesoporous carbon towards HCOOH electro-oxidation [J].Electrochemistry Communications,2012,25(21):105-108.
[27] Cheng Y,Shen P K,Saunders M,et al.Core-shell structured PtRuCoxnanoparticles on carbon nanotubes as highly active and durable electrocatalysts for direct methanol fuel cells [J].Electrochimica Acta,2015,doi:10.1016/j.electacta.2015.01.137.
[28] Oliveira R T S,Santos M C,Nascente P A P,et al.Nanogravimetric and voltammetric studies of a Pt-Rh alloy surface and its behavior for methanol oxidation [J].Int J Electrochem Sci,2008,3(8):970-979.
[29] Narayanamoorthy B,Datta K K R,Eswaramoorthy M,et al.Highly active and stable Pt3Rh nanoclusters as supportless electrocatalyst for methanol oxidation in direct methanol fuel cells [J].ACS Catalysis,2014,4(10):3621-3629.
[30] Liu Z,Zhang X.Carbon-supported PdSn nanoparticles as catalysts for formic acid oxidation [J].Electrochemistry Communications,2009,11(8):1667-1670.
[31] Zhao X,Yin M,Ma L,et al.Recent advances in catalysts for direct methanol fuel cells [J].Energy & Environmental Science,2011,4(8):2736-2753.
[32] Dupont C,Jugnet Y,Loffreda D.Theoretical evidence of PtSn alloy efficiency for CO oxidation [J].Journal of the American Chemical Society,2006,128(28):9129-9136.
[33] Janssen M M P,Moolhuysen J.Binary systems of platinum and a second metal as oxidation catalysts for methanol fuel cells [J].Electrochimica Acta,1976,21(11):869-878.
[34] Lu G Q,Sun S G,Cai L R,et al.In situ FTIR spectroscopic studies of adsorption of CO,SCN-,and poly (o-phenylenediamine) on electrodes of nanometer thin films of Pt,Pd,and Rh:Abnormal infrared effects (AIREs) [J].Langmuir,2000,16(2):778-786.
[35] Rand D A J,Woods R.A study of the dissolution of platinum,palladium,rhodium and gold electrodes in 1 M sulphuric acid by cyclic voltammetry [J].Journal of Electroanalytical Chemistry and Interfacial Electrochemistry,1972,35(1):209-218.
[36] 徐佳,郭晓晓,刘跃鹏,等.甲醇在PtRh双金属薄膜表面的电催化氧化研究 [J].山西大学学报:自然科学版,2010,33(1):126-130.
[37] Lima F H B,Profeti D,Chatenet M,et al.Electro-oxidation of ethanol on Rh/Pt and Ru/Rh/Pt sub-monolayers deposited on Au/C nanoparticles[J].Electrocatalysis,2010,1(1):72-82.
[38] Tokarz W,Siwek H,Piela P,et al.Electro-oxidation of methanol on Pt-Rh alloys [J].Electrochimica Acta,2007,52(18):5565-5573.
The Preparation Method and Methanol Electrocatalytic Activity of Ternary PtRhSn/GN
ZHU Fu-chun,YOU Le-xing,QU Xi-ming,ZHANG Bin-wei,ZHANG Zong-cheng,JIANG Yan-xia*,SUN Shi-gang
(State Key Laboratory of Physical Chemistry of Solid Surfaces,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China)
Pt/GN,PtRh/GN,PtSn/GN and PtRhSn/GN catalysts were synthesized through a polyol method.The results of transmission electron microscopy (TEM) and X-ray diffraction (XRD) indicated that the as-synthesized catalysts were uniformly dispersed on the graphene(GN) surface.Both Pt/GN and PtRh/GN were composed of homogeneous cubics,while PtSn/GN showed three-dimensional network morphology (TDNM) and PtRhSn/GN presented a cubic extended TDNM.Electrochemical cyclic voltammetric (CV) result revealed that the additive element Rh was able to promote the activity,while Sn lowered the onset potential as much as 106 mV compared with Pt/GN catalyst for methanol electro-oxidation.In-situ electrochemical Fourier transform infrared spectroscopy (FT-IR) results showed that Rh and Sn could lower the onset potential,and Sn declined the CO peak intensity while Rh increased it.The electronic effect and synergistic effect between the additive element Rh,Sn and Pt make ternary PtRhSn/GN a promising low-Pt catalyst for direct methanol fuel cells,which shows a peak current of 1.57 times as much and the onset potential shifting negatively by 60 mV compared with Pt/GN.
PtRhSn/GN;graphene;methanol;cyclic votammograme;in-situ electrochemical Fourier transform infrared spectroscopy(FT-IR)
2015-04-13 录用日期:2015-06-10
国家自然科学基金(21273180,21361140374,21321062)
朱复春,游乐星,瞿希铭,等.PtRhSn/GN的制备及其对甲醇电催化氧化性能研究[J].厦门大学学报:自然科学版,2015,54(5):685-692.
:Zhu Fuchun,You Lexing,Qu Ximing,et al.The preparation method and methanol electrocatalytic activity of ternary PtRhSn/GN[J].Journal of Xiamen University:Natural Science,2015,54(5):685-692.(in Chinese)
10.6043/j.issn.0438-0479.2015.05.012
新能源材料专题
O 646.542
A
0438-0479(2015)05-0685-08
* 通信作者:yxjiang@xmu.edu.cn

