运动训练对成年大(小)鼠大脑海马形态结构与功能的影响及其机制
方春露,魏 源
运动训练对成年大(小)鼠大脑海马形态结构与功能的影响及其机制
方春露,魏 源
目的:探究运动训练对海马形态、结构及其功能的干预效果及其分子机制。方法:通过文献资料法对运动训练影响大脑海马神经元的形态变化和生理功能的发挥及其各生理因子信号通路的研究进展进行综合分析。结果:发现运动训练可以通过影响神经营养因子而增加海马神经元突触的蛋白含量和树突的长度及密度,进而改善大脑海马的生理功能,降低各种神经退行性疾病的发生率。结论:运动训练可以改善海马结构并有效延缓其机体功能的退行性变化,其作用机制可能与 FMRP 突变通过 DGCR8 基因 3′UTR 相互作用下调报告基因表达有关。
大(小)鼠;海马神经元形态;海马生理功能;运动训练
人体内海马是一个双侧结构,为弓状隆起的皮质脑回,位于大脑半球内,侧脑室下角的底壁上,全长约5cm ,前端较膨大。哺乳动物的海马位于侧脑室中央部的内侧,为弯曲带状隆起,左右海马均由脑的前内侧斜向后外侧,再弯向后下方。海马(hippocampus)又称海马本部(hippocampus proper)、安蒙氏角(cornu Ammonis)[1]。海马并非等同于海马结构,高等哺乳动物海马结构除包括海马外,还包括:(1)海马内侧一条窄而呈锯齿状的齿状回(dentate gyrus);(2)海马下方皮质区的下托(subiculum);(3)在发生上残留在聠胝体上面的一簿层原皮质的灰被(indusium griseum),又称聠胝体上回(supracallosal gyrus)。美国比较解剖学家罗默(Romer)根据其奇特形状,由冠状面观测极似海马,故名海马[2]。罗斯 (Rose,1927)根据细胞形态的差异将海马和齿状回分为hl-h55个区。洛伦特(Lorenter,1934)依纤维长径又将其分 CA1、CA2、CA3及CA44个区[3]。当前颇多学者将海马的机体功能视为重要的课题。
1 大脑海马的生理功能
海马体如计算机的内存可暂留几周或几个月的记忆,便能快速提取。心理学家与神经学家均认为[2]:海马的损伤通常造成难以组织新的记忆(顺行性失忆症),而且造成难以搜索过去的记忆(逆行性失忆症),病人HM有组织新的概念记忆的能力。老鼠实验的研究显示[2],海马体的神经元(neurons)有空间放电区,这些细胞称为地点细胞(place cells),可发电的细胞对大脑移动的方向特敏感。海马体可能扮演“认知地图“(环境格局的神经重现)的角色。海马体对在熟悉环境中寻找捷径、新的路线发挥重要作用。在伦敦大学(University College London)的研究显示[2]:相对一般市民,计程车司机的海马体体积较大,且有经验的计程车司机的海马体体积更大。相反,有较大的海马体是否有助于成为计程车司机仍待研究。印第安那大学(Indiana University)进行的老鼠实验提出[2]:海马体的形态跟“性别双态”(sexual dimorphism)密切相关。
2 运动训练对成年大(小)鼠海马神经元形态的影响
成年大(小)鼠海马齿状区(GD区)神经再生是一种重构造,每天新颗粒细胞于大脑海马齿状区颗粒下层数以千计的生成,且形成的新细胞具体数目受到运动训练和生理内环境的影响。新颗粒细胞一旦成熟,将从海马(GD 区)下层向外迁移至边缘,颗粒细胞的内层(inner granule zone:IGZ)与外层(outer granule zone:OGZ)均存在神经再生。Kuczewski等[4]提出运动训练影响大脑海马神经再生,在不同区域的树突其数量,复杂的程度以及其总长度受运动训练的影响有所差异,长期运动训练的成年大(小)鼠海马齿状回颗粒细胞外层(the subgranular zone:SGZ)神经元的树突增生均值、总长度数值与未经常运动训练的成年大(小)鼠其树突分支数值、总长度存在显著性差异(P<0.05)。而颗粒细胞的内层(inner granule zone:IGZ)差异较小。由成年大(小)鼠实验显示[5-7]:海马神经元的树突可释放脑源性神经营养因子(BDNF),参加长期运动训练的成年大(小)鼠BDNF的mRNA水平上调,促进BDNF的生成,而BDNF又可促进突触发生,且其附加的分泌物对海马CA3区神经元前体的形成可能有再一次的促进作用,而且能够加快基底树突的分化和轴突的分支速度,对增加海马CA3区神经元树突的形成有生理选择性作用,促进海马DG区颗粒细胞发出新的轴突并向CA3区蔓延[8-9]。CA3神经元的可能作用:为突触源性生长提供营养方面的支持;促使其与苔状纤维突触的连接;被运输到苔状纤维的BDNF通过PI3K信号分子机制增加CA3区神经元的脑源性神经营养因子(BDNF)的mRNA基因水平,从而促进CA3区神经元BDNF的树突突触的形成[10]。Vaynman、Yau等人[11-12]的研究结果显示:长期运动训练可增加海马CA3区和DG区神经元的突触蛋白I含量,增加CA3区的锥体神经元树突的分支速度、以及其长度和密度。
长期的运动训练可提高成年大(小)鼠大脑海马CA1区、CA3区和GD区神经元数量的增加速度,改善新生颗粒细胞的树突形态,增强锥体神经元“树突网络”的复杂性,确保神经信号回路的完整性,但长期的运动训练对海马CA2区神经元的影响较小,其长度、密度,以及其树突的网络结构均无明显变化。
3 运动训练对成年大(小)鼠海马区神经元机体功能的影响
Raffaella等[13]利用阵列技术检测主观运动训练3天、7天、28天后大脑中1 176种基因的表达,通过Taqman探针RT-PCR(逆转录与荧光定量PCR生物技术)实验和核糖核酸酶实验对选择性表达的基因进行量化分析,结果发现:在中枢神经系统突触发育过程中,突触前递质释放装置的发育与突触后受体的转运尤为重要。Raffaella等[13]通过成年大(小)鼠实验表明:运动训练通过BDNF介质诱发成年大(小)鼠海马神经元的塑造,且能加快塑造过程。通过基因表达的时域剖面观察发现成年大(小)鼠通过长期的运动训练均可开通特殊的分子信号通道,CaM-K信号系统无论是在急性运动训练还是慢性运动训练后均能被激活,但是,MAP-K 系统只有在较长时间的运动训练后才能被激活。
Famer[14]等人的成年大(小)鼠实验的结果显示:经长期观察运动训练过程中转化为神经元的细胞的百分比,发现不同运动训练的干预方式对细胞分裂的影响力有显著性差异(P<0.05)。在试管中用成年大(小)鼠的海马切片为实验样品,得知长期运动训练能加强海马DG区LTP的能力。他们还通过用water treatment plant sludge (WTPS)实验法诱导体内产生机体感应程序,结果表明:仅参加过长期运动训练的小鼠的LTP能够被感应,如果不断加强刺激的强度,则可发现参加过运动训练的成年大(小)鼠比未能参加长期运动训练的成年小鼠具有更强的STP和LTP作用,从而他们提出:各种刺激的不同频率达到不同的阈值(较低机体感应得达400hz阈值,较为敏感的机体则阈值只需400hz)。
Vaynman[15]等人通过观察突触蛋白I的mRNA水平、冬氨酸受体、钙或钙调蛋白的蛋白激酶II和与有丝分裂原激活蛋白激酶等指标的活性,进而探讨长期运动训练对成年大(小)海马神经元的可塑性的影响,发现BDNF可诱导海马神经元的再生,其机制可能是通过调节海马组织中BDNF 的mRNA基因水平,进而影响蛋白的形成,其影响基因转录进行调控与神经元突触功能紧密相关的分子主要有:NMDA-R、CAMKII和MAP-K等分子,它们通过以BDNF信号通路塑造海马神经元。
由国内外的研究结果可得:BDNF可提高CREB蛋白与突触蛋白I的mRNA水平、增加其酪氨酸激酶受体(TrkB),长期的运动训练可使机体通过生物介质的反馈回路提高BDNF对突触可塑性的影响力度,经过分子或是离子运用信号回馈通路实验和Taqman探针法反向转录为RNA聚合酶反应(rt - pcr)量化实验,结果显示:BDNF可调节mRNA水平,其水平可上调也可下调,且深入地研究了环磷酸腺苷反应结合蛋白(cAMP-response element binding proteins,CREB)和突触蛋白I,这两种生物介质对神经元机体功能通过上调或是下调基因的转录水平与影响突触传递两种方式调节神经元的形态塑造与机体功能。
4 FMR1基因错义突变对成年大(小)鼠海马神经元退行性病变的影响
4.1 FMR1基因与多种神经系统疾病密切相关
脆性 X 智力低下基因(fragile X mental retardation 1,FMR1)负责编码脆性 X 智力低下蛋白(fragile X mental retardation protein, FMRP)。FMR1基因主要在神经系统中表达,在脑发育过程和神经元突触可塑性中发挥重要作用[16]。目前已阐明 FMR1 基因全突变及重复元件内 CpG岛异常甲基化可引起 FMRP 的表达水平显著性下调甚至消失[17],从而证实 FMRP 蛋白缺失导致了 FXS 发生。这一结论在 FMR1 基因全缺失的 FXS 患者及该基因敲除小鼠及果蝇中得到证实[18]。随后发现前突变的携带者进入老年后可发展为一种退行性疾病——脆性 X 相关震颤和(或)共济失调综合征(fragile X associated tremor/ataxia syndrome FXTAS)。除上述 CGG 异常扩增致病外,还陆续有 FMR1 基因编码区错义突变导致 FXTAS 的报道(如图1,表示FXTAS患者FMR1基因存在一个错义突变P626L。),其中P626L与I304N 突变被证实导致 FMRP 功能异常[19]。最近研究发现,FMRP 所调控的信号通路异常还可参与自闭症、精神分裂症等多种疾病的发生[20-22]。以上研究显示FMR1基因突变不仅可导致脑发育障碍而且可致神经退行性病变。
4.2 DGCR8-miRNA信号途径及其在多种神经系统疾病中的作用
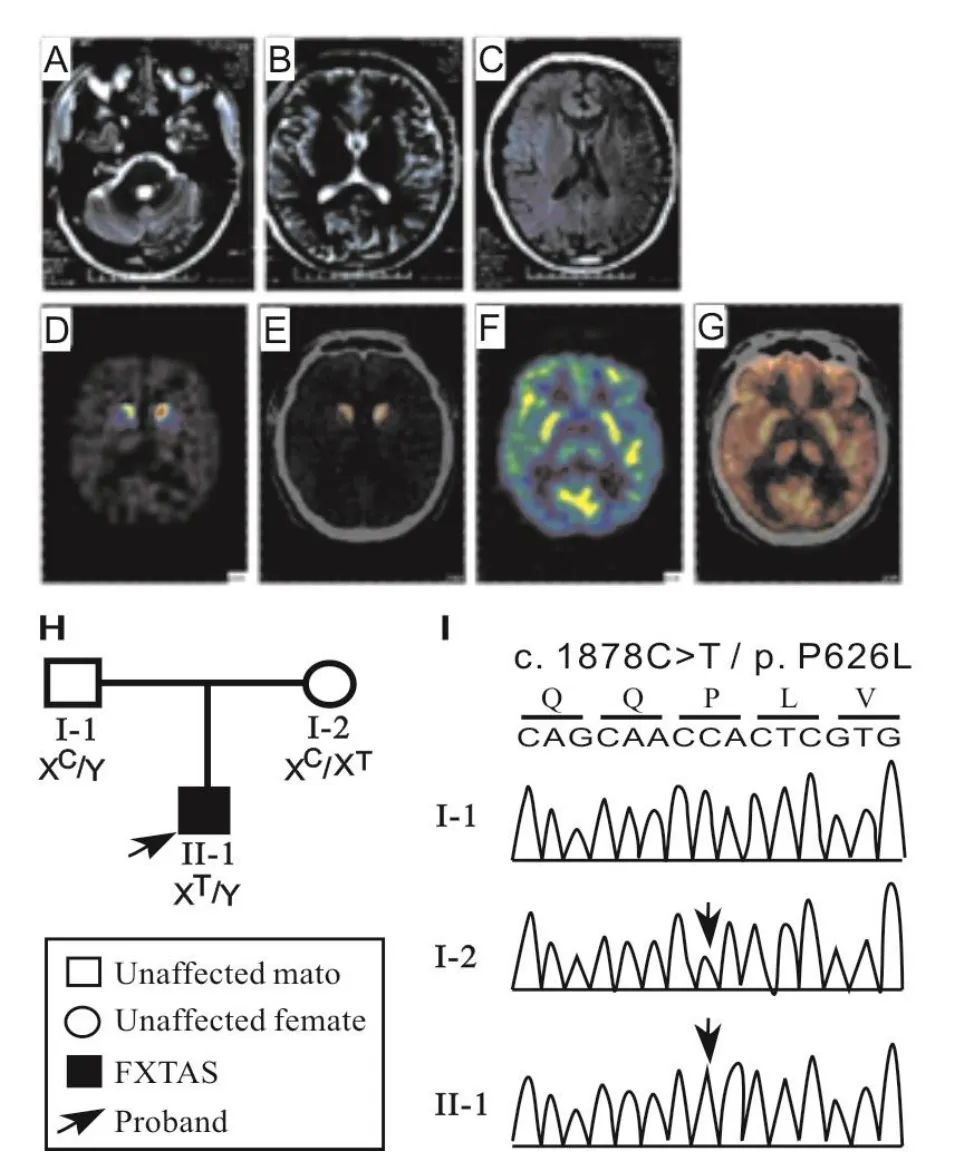
图1 FXTAS患者FMR1基因存在一个错义突变P626L
RNA 绑定蛋白 DiGeorge 关键区域 8(RNA-binding protein DiGeorge critical region-8,DGCR8)是一种 RNA 结合蛋白,是 microRNA(miRNA)的原始转录本(pri-miRNA)加工成前体转录本(pre-miRNA)的关键因子[23]。DGCR8 与另外一种重要蛋白 DROSHA(RNA 聚合酶 III)组合成DGCR8-DROSHA 复合体,共同完成 miRNA 原始转录本的初级加工过程。在这个微处理器复合体(microprocessor complex)中,DGCR8 同时与pri-miRNA 及 DROSHA 结合,是联系后两者之间的纽带[24]。目前已证实,人及小鼠DGCR8基因3′UTR 存在多个保守区(如图3所示),DGCR8在神经发育中发挥重要作用[25-26]。如图2所示,FMRP突变通过DGCR8基因基因 3′UTR 相互作用下调报告基因表达。DGCR8 基因表达异常可损害神经元突触信息传递,表现为学习记忆下降、精神分裂症、帕金森症等疾病[27-29]。图4揭示了FMRP-DGCR8-miRNA在FXTAS发病机理中的作用。由此可见,DGCR8 精确表达对维持正常脑功能非常重要。
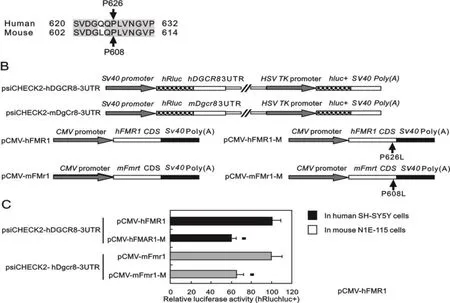
图2 FMRP突变通过DGCR8基因3′UTR相互作用下调报告基因表达
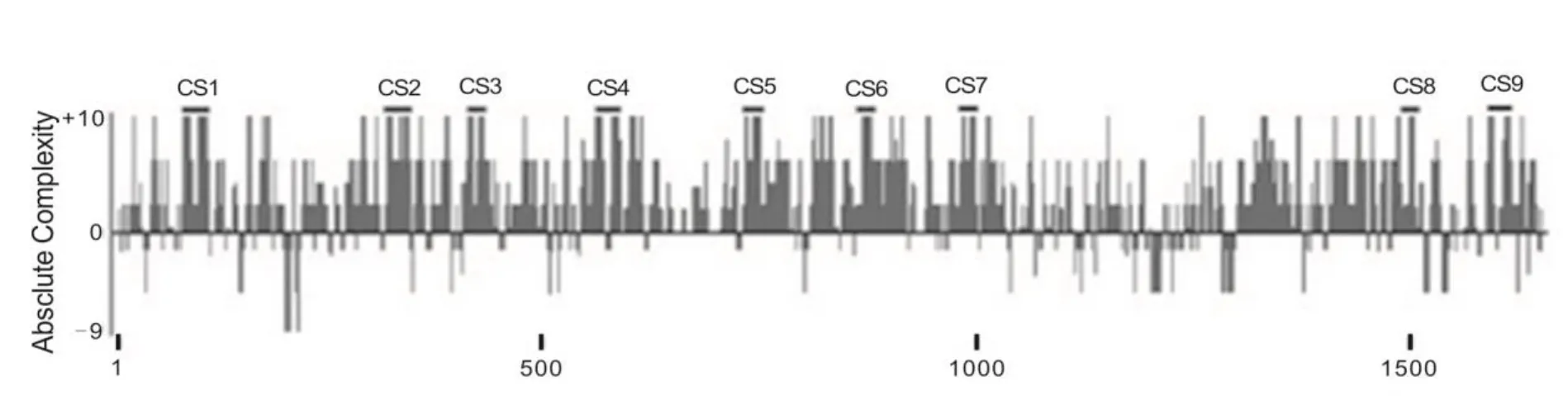
图3 人及小鼠DGCR8基因3′UTR 存在多个保守区
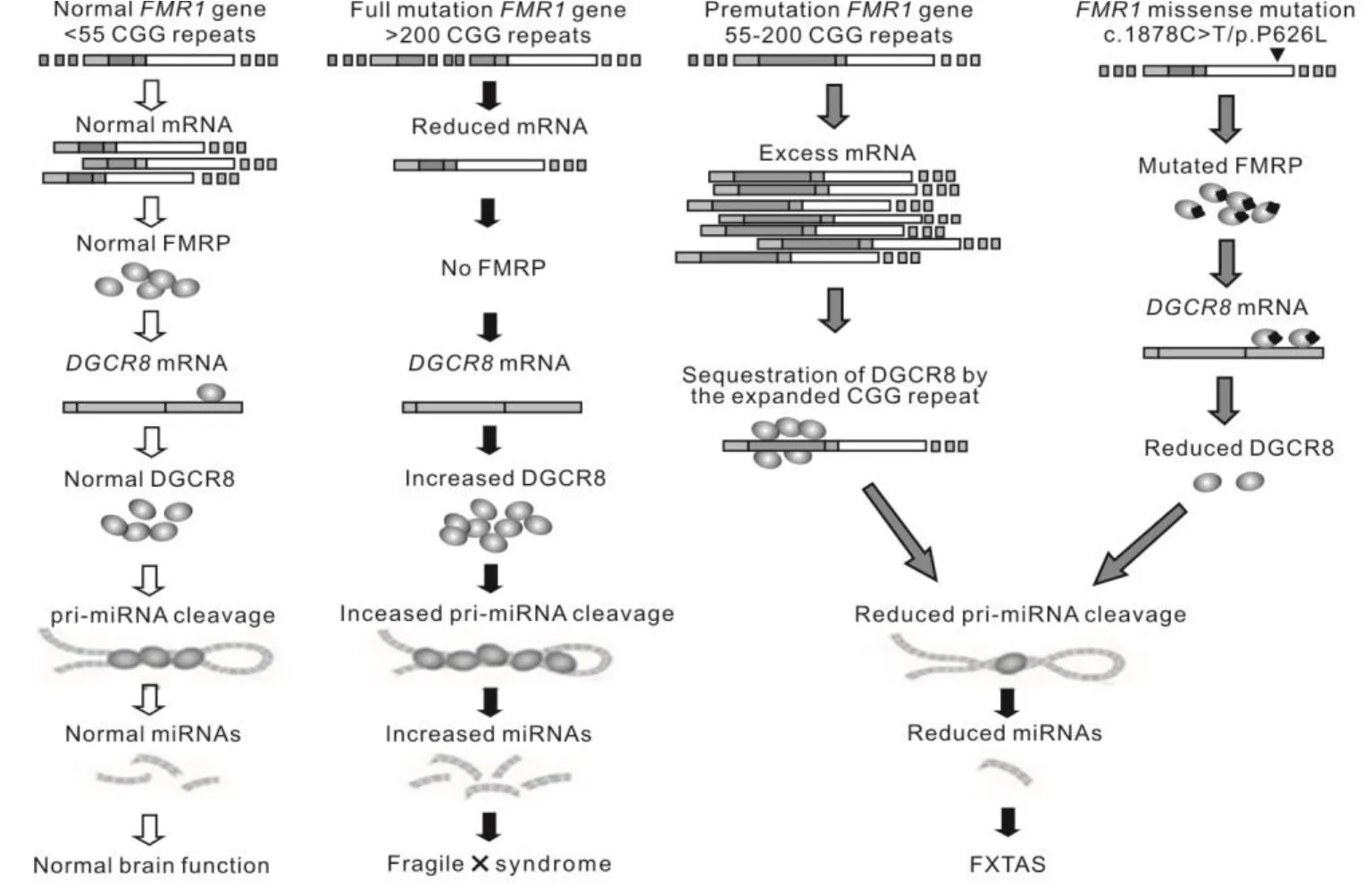
图4 FMRP-DGCR8-miRNA在FXTAS发病机理中原理图
4.3 FMRP调控DGCR8表达途径及其在FXS和FXTAS机制中的可能差异
FMRP 是一种 RNA 结合蛋白,参与调节核蛋白复合物组装、mRNAs 出核运输、树突 mRNAs 定位、RNA 及蛋白翻译过程调节等过程[43-46]。如图5所示,FMRP及其突变在转录后水平上影响DGCR8基因的表达。FMRP 参与快速调控突触中新蛋白质合成,以适应频繁的突触连接变化,为学习和记忆过程提供物质基础[18,46]。最近研究发现Fmr1 基因敲除小鼠海马组织多个miRNAs 表达上调,并证实这些上调 miRNAs 的前体 pre-miRNAs 水平也同样发生改变,而其相应原始转录本 pri-miRNAs水平没有显著性变化[48],提示 FMRP 缺失可能通过某种途径促进pri-miRNAs 加工成pre-miRNAs。
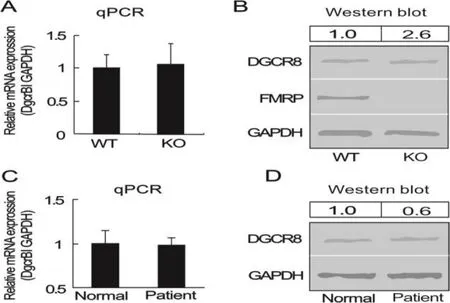
图5 FMRP及其突变在转录后水平上影响DGCR8基因的表达
5 拟待解决的科学问题
(1)长期运动训练对成年大(小)鼠海马形态与机体功能的影响有了初步的了解,但需深入地剖析其作用机制。
(2)目前已证实,FMRP 可通过与 mRNA 的相互作用参与其他多个基因的转录后调控,但长期运动对FMRP与 DGCR8 基因 mRNA 相互作用的影响尚未见报道。
(3)FXTAS 的神经元退行性病变机制非常复杂,长期运动训练对其作用机制的影响尚未明晰。
[1] 曾小鲁,辜 清,戴惠娟.海马的形态结构与生理功能[J].生物学通报,1996,31(3):1~3.
[2] 中国科学院 http://wwww.cas.cn/html/Dir/2008/08/11/16/ 05/29.htm.
[3] 新华网 http://news.xinhuanet.com/world/2007-01/17/content_ 5617580.htm.
[4]Kuczewski N, Porcher C, Lessmann V, et al.Activity-dependent dendritic release of BDNF and biological consequences[J]. Mol Neurobiol, 2009, 39: 37~49.
[5]Cohen-Cory S, Kidane AH, Shirkey NJ, et al. Brain-derived neurotrophic factor and the development of structural neuronal connectivity [J]. Dev Neurobiol, 2010,70: 271~288.
[6]Jeanneteau F, Deinhardt K, Miyoshi G, et al. The MAP kinase phosphatase MKP-1 regulates BDNF-induced axon branching [J]. Nat Neurosci , 2010, 13: 1373~1379.
[7]Magarinos AM, Li CJ, Gal Toth J, et al. Effect of brain-derived neurotrophic factor haploinsuffi-ciency on stress-induced remodeling of hippocampal neurons[J].Hippocampus, 2011,21: 253~264.
[8]Santarelli L, Saxe M, Gross C, et al. Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants [J]. Science 301: 805~809.
[9]Castren E. Neurotrophic affects of antidepressant drugs [J].Curr Opin Pharmacol, 2004, 4: 58~64.
[10]Righi M, Tongiorgi E, Cattaneo A. Brain-derived neuro-trophic factor (BDNF) induces dendritic targeting of BDNF and tyrosine kinase B mRNAs in hippocampal neurons through a phosphatidylinositol-3 kinase-dependent pathway [J]. J Neurosci 20:3165~3174.
[11] Vaynman S, Ying Z, Gomez-Pinilla F. Exercise induces BDNF and synapsin I to specific hippocampal subfields [J]. J Neurosci Res 76: 356~362.
[12]Yau SY, Lau BW, Tong JB, et al.Hippocampal neurogenesis and dendritic plasticity support running-improved spatial learning and depression-like beha-viour in stressed rats [J]. PLoS One 6: e24263.
[13]Raffaella Molteni, Zhe Ying and Femando Gomez-Pinilla. Differential effects of acute and chronic exercise on plasticity-related genes in the rat hippocampus revealed by microarray [J]. European Journal of Neuroscience, 2002,16:1107~1116.
[14]J. Farmer, X.zhao, H. Vanpraag,et al. Effects of voluntary exercise on synaptic plasticity and gene expression in the dentate gyrus of adult male sprague-dawley rats in vivo[J]. Neuroscience,2004,124:71~79.
[15]S.Vaynman, Z. Ying and, F. Gomez-pinill,A. Interplay between brain-derived neurotrophic factor and signal transduction modulators in the regulation of the effects of exercise on synaptic-plasticity[J]. Neuroscience,2003,122:647~657.
[16]Sidorov MS, Auerbach BD, Bear MF. Fragile X mental retardation protein and synaptic plasticity. Mol Brain2013 Apr 8; 6(1):15.
[17] Verkerk AJ, Pieretti M, Sutcliffe JS, et al. Identification of a gene(FMR-1) containing a CGG repeat coincident with a breakpoint cluster region exhibiting length variation in fragile X syndrome. Cell 1991.
May 31;65(5): 905~14.
[18] Zhang YQ, Bailey AM, Matthies HJ ,et al.Drosophilafragile X-related gene regulates the MAP1B homolog Futsch to control synaptic structure and function. Cell 2001Nov 30;107(5):591~603.
[19] Zang JB, Nosyreva ED, Spencer CM, et al. A mouse model of the human Fragile X syndrome I304N mutation. PLoS genetics 2009 Dec; 5(12):e1000758.
[20] Fromer M, Pocklington AJ, Kavanagh DH, et al. De novo mutations in schizophrenia implicate synaptic networks. Nature 2014 Jan 22.
[21] Parikshak NN, Luo R, Zhang A, et al.Integrative functional genomics analyses implicate specific molecular pathways and circuits in autism. Cell 2013 Nov21; 155(5): 1008~21.
[22] Steinberg J, Webber C. The roles of FMRP-regulated genes in autism spectrum disorder: single- and multiple-hit genetic etiologies. American journal of human genetics 2013 Nov 7; 93(5): 825~39.
[23] Gregory RI, Yan KP, Amuthan G, et al. The Microprocessor complex mediates the genesis of microRNAs. Nature 2004 Nov 11;432(7014): 235~40.
[24] Roth BM, Ishimaru D, Hennig M. The core microprocessor component DiGeorge syndrome critical region 8(DGCR8) is a nonspecific RNA-binding protein. The Journal of biological chemistry 2013 Sep13;288(37): 26785~99.
[25] Luhur A, Chawla G, Wu YC, et al. Drosha-independent DGCR8/Pasha pathway regulates neuronal morphogenesis. Proceedings of the National Academy of Sciences of the United States of America 2014 Jan 28;111(4): 1421~6.
[26] Petri R, Malmevik J, Fasching L, et al. miRNAs in brain development. Experimental cell research 2014 Feb 1;321(1): 84~9.
[27] Di Carlo V, Grossi E, Laneve P, et al.TDP-43 regulates the microprocessor complex activity during in vitro neuronal differentiation. Molecular neurobiology 2013 Dec;48(3): 952~63.
[28] Ouchi Y, Banno Y, Shimizu Y, et al. Reduced adult hippocampal neurogenesis and working memory deficits in the Dgcr8-deficient mouse model of 22q11.2 deletion-associated schizophrenia can be rescued by IGF2. J Neurosci 2013 May 29;33(22): 9408~19.
[29] Heman-Ackah SM, Hallegger M, Rao MS, et al. RISC in PD: the impact of microRNAs in Parkinson's disease cellular and molecular pathogenesis. Frontiers in molecular neuroscience 2013; 6:40.
[30] Darnell JC, Klann E. The translation of translational control by FMRP: therapeutic targets for FXS. Nat Neurosci 2013 Nov;16(11): 1530~6.
[31] Zhou Z, Cao M, Guo Y,et al. Fragile X mental retardation protein stimulates ribonucleoprotein assembly of influenza A virus.Nature communications 2014 Feb 10;5: 32~59.
[32] Liu T, Wan RP, Tang LJ, et al. A microRNA profile in Fmr1 knockout mice reveals microRNA expression alterations with possible roles in fragile X syndrome. bioRxiv 2014 Jan 26:doi: 10.1101/002071.
The Research Progress on Effect of Exercise Training On Hippocampus in Adult Brain of Rat/Mouse
FANG Chunlu, WEI Yuan
To investigate the intervention effect of exercise training on the structure and function of hippocampus morphology, and its molecular mechanism. The research methods: by consulting a large number of domestic and foreign literatures to make the comprehensive analysis about the research progress on effect the morphology changes of hippocampus neurons and the exertion of physiological function and each physiological factor of signaling pathways. The result:finding that exercise training can influence brain-derived neurotrophic factor (BDNF) and increase the protein content of hippocampus neuron synapses and dendrites' length and density, and improve brain hippocampus physiological function, reduce the incidence of various neurodegenerative diseases. The conclusion:Exercise training can improve the function of hippocampus structure and delay the degenerative changes of the body function, and its mechanism may be related to FMRP mutation by DGCR8 gene 3 'UTR cut report gene expression related interactions.
The rat/mouse; Morphologic of neurons in hippocampus; Hippocampus function; Exercise training
G804.22
A
1007―6891(2015)04―0036―05
2015-04-27
科技部科研院所专项资金项目“高准确度运动训练能量消耗模型构建及样机研制”,项目编号:2013EG145136。
广州体育学院,广东 广州,510500。Guangzhou Sport University, Guangdong Guangzhou, 510500, China.

