陶瓷羟基磷灰石去除单抗聚集体的工艺研究
王宁,赵燕燕,Δ,陶文杰,刘丽丽,刘万卉,3
(1.烟台大学 药学院,山东 烟台 264005;2.山东博安生物技术有限公司 抗体技术研究部,山东 烟台 264005;3.绿叶制药集团有限公司 长效和靶向制剂国家重点实验室,山东 烟台 264005)
陶瓷羟基磷灰石去除单抗聚集体的工艺研究
王宁1,赵燕燕1,2Δ,陶文杰2,刘丽丽2,刘万卉1,3
(1.烟台大学 药学院,山东 烟台 264005;2.山东博安生物技术有限公司 抗体技术研究部,山东 烟台 264005;3.绿叶制药集团有限公司 长效和靶向制剂国家重点实验室,山东 烟台 264005)
目的 研究陶瓷羟基磷灰石(ceramic hydroxyapatite,CHT) I型和II型对2种单克隆抗体(monoclonal Ab,mAb)1和2聚集体的去除工艺。方法 层析仪为AKTA AVANT 150,层析柱为Tricon 10/50,先进行CHT I、CHT II 2种填料的动态载样量研究,然后选取合适的载量进行分离纯化研究。上样条件为5 mmol/L磷酸二氢钠(NaH2PO4),pH 6.5,上样,然后用10 mmol/L NaH2PO4,pH 6.5和10 mmol/L NaH2PO4,2 mol/L NaCl,pH 6.5梯度洗脱来分离单体和聚集体。用分子尺寸排阻高效液相色谱(SEC-HPLC)测定上样蛋白溶液和洗脱峰单体及聚集体的含量。使用20 cm高的XK 16/40的层析柱进行工艺放大研究。结果 mAb 1在CHT I型的载量为40 mg/mL,去除后单体含量为98.6%,工艺收率为92.5%;mAb 2在CHT I型的载量为45 mg/mL,去除后单体含量为98.8%,工艺收率为91.5%;mAb 1在CHT II型载量为16 mg/mL,去除后单体含量为99.8%,工艺收率为91.8%;mAb 2在CHT II型载量为20 mg/mL,去除后单体含量为99.9%,工艺回收率为92.2%。结论 2种类型的陶瓷羟基磷灰石填料在聚集体含量高于10%的情况下,都有很好的去除能力,去除结果符合法规要求。该方法操作简单,能够很顺利的进行工艺放大,满足中试和生产需求。
陶瓷羟基磷灰石;单克隆抗体;纯化工艺;聚集体
近年来,单克隆抗体(简称单抗)已成为世界生物工程制药业的支柱产业之一[1]。在单抗的纯化过程中,如果pH<3,单抗会发生不可逆聚集;盐浓度过高会增加疏水聚集;碱性单抗在多价阴离子缓冲液中易形成稳定的离子复合物,导致单抗之间的聚合;这些过程都可能产生聚集体。单抗中的聚集体是工艺过程中产生的杂质,聚集体过高会促进形成中和单抗、引起血栓等[2-3]。在工业化生产中,为保证终产品的均一性和高比活,简单有效的去除单抗聚集体的方法对提高单抗药物的质量至关重要[4-6]。
聚集体的去除可以通过阳离子交换和疏水层析进行去除,研究发现,当聚集体含量超过10%的时候,阳离子交换树脂和疏水层析很难达到理想的效果,而羟基磷灰石层析方法能够去除单抗中含量较高的聚集体[7-10]。
羟基磷灰石(hydroxyapatite,HA)的分子式为[Ca5(PO4)3OH]2[11],包括带正电荷的钙离子和带负电荷的磷酸根离子,其与单抗主要有两种作用机制,磷酸根易与单抗中的碱性基团作用,通过增加中性盐离子例如氯化钠会破坏这种作用力,结合的单抗从柱子上解离下来;钙离子与单抗中的酸性基团以金属螯合方式结合,主要通过磷酸盐将吸附的单抗洗脱下来[12]。
本文采用伯乐公司生产的陶瓷羟基磷灰石(ceramic hydroxyapatite,CHT),对比研究CHT I和CHT II 2种填料对2种单抗(mAb1和mAb2)中聚集体的去除效果。层析条件是伯乐公司提供的单抗聚集体去除的普遍适用条件,经过简单优化[13-14]。单体和聚集体含量测定采用SEC-HPLC方法[15-18]。
1 材料与方法
1.1 单抗 单抗mAb 1和mAb 2,聚集体含量分别为14.5%和12.8%。2种单抗是细胞培养液经过亲和层析纯化后的样品,由山东博安生物技术有限公司抗体技术研发部提供。
1.2 仪器 Cedex Bio生物过程分析仪(Roche公司);HiprepTM26/10 Desalting脱盐柱(GE Healthcare公司);TSK-Gel G30000SWxl 凝胶色谱柱7.8 mm×300 mm(东曹公司);生物安全柜(Heraeus公司);AKTA AVANT 150(GE Healthcare公司)。
1.3 填料 CHTTMceramic hydroxyapatite,Type I,40 μm;CHTTMceramic hydroxyapatite,Type II, 40 μm(Bio-Rad公司)。
1.4 试剂 氢氧化钠(天津永大化学试剂有限公司);氯化钠、磷酸二氢钠(天津博迪化工有限公司)。
1.5 方法
1.5.1 样品处理:5 mmol/L NaH2PO4pH 6.5缓冲液平衡HiprepTM26/10 Desalting柱,使用同一缓冲液洗脱,然后依次用0.2 mol/LNaOH、平衡缓冲液清洗脱盐柱后保存在20%乙醇里。流速4 mL/min。接收洗脱峰,在生物安全柜中使用微孔滤膜过滤后作为上样蛋白。
1.5.2 CHT I、CHT II的单抗动态载量:用2种填料装柱,使用量均为1 mL,取过滤后的蛋白作为测试样品,用缓冲液A(10 mmol/L NaH2PO4pH 6.5)平衡好离子交换柱,CHT I按照载量为30、40、45、50、55 mg/mL上样;CHT II按照载量为10、15、20、25、30 mg/mL上样,分析流穿组分。
1.5.3 CHT I去除2种单抗中的聚集体:取过滤后的蛋白,使用Tricon10/50 (CV4.9 mL) CHT I离子交换柱,缓冲液A为平衡缓冲液,缓冲液A和缓冲液B(10 mmol/L NaH2PO4,2 mol/LNaCl pH 6.5)梯度洗脱(0~50%,40 CV),收集洗脱峰,然后使用缓冲液C(500 mmol/L NaH2PO4pH 6.5)冲洗柱子上未洗脱下来的成分,收集再生峰[19-20]。流速1 mL/min。检测洗脱峰聚集体含量,计算回收率。
回收率(%)=纯化后单体重量(mg)/纯化前单体重量(mg)×100%
1.5.4 CHT II去除2种单抗中的聚集体:取过滤后的蛋白,使用Tricon10/50(CV4.9 mL)CHT II离子交换柱,缓冲液A为平衡缓冲液,缓冲液A和缓冲液B梯度洗脱(20%~50%,30 CV),收集洗脱峰,然后使用缓冲液C冲洗柱子上未洗脱下来的成分,收集再生峰[19-20]。流速1 mL/min。检测洗脱峰聚集体含量,计算回收率。
1.5.5 层析柱放大去除2种单抗的聚集体:按照1.5.2和1.5.3方法,使用2种填料分别装填20 cm高XK16/40层析柱,进行放大,收集洗脱峰和再生峰。检测洗脱峰聚集体含量,计算回收率。
1.5.6 蛋白浓度的测定:采用紫外分光光度计在280 nm和320 nm处测定吸光度进行定量,用超纯水在280 nm和320 nm空白校正,分别测定样品在280 nm和320 nm处的吸收值。
公式:A=(A280-A320)样品-(A280-A320)空白
A=ECL;E:摩尔吸光系数;C:样品浓度;L:光程1 cm
1.5.7 SEC-HPLC检测聚集体含量:用0.35 mol/L磷酸钠和0.35 mol/L氯化钠混合溶液,pH 7.2作为流动相,样品用流动相稀释至0.5 mg/mL,微孔滤膜过滤后进样检测。流速0.5 mL/min,检测波长280 nm,进样量100 μL,拖尾因子应为0.95~1.40,按面积归一化法计算供试品中单体和多聚体的含量。
1.6 SEC-HPLC方法学验证
1.6.1 精密度:取供试品连续进样6针,进样分析,记录色谱图,计算峰面积。
1.6.2 准确度:以加样回收率方法计算,制备聚体含量分别为高、中、低的样品各3份,进样分析,记录色谱图,计算峰面积。
1.6.3 线性方称:取高分子量物质(多聚体含量较高的纯化物质)溶液和单体物质(单体含量较高的纯化物质)溶液,按供试品溶液制备项制备。分别连续进样6针,按面积归一化法,分别计算聚体、单体的平均含量。然后以一定比例混合分别配制成聚体含量为0.1%、3.0%、6.4%、9.4%、12.4%、14.2%、16.4%和18.0%的系列溶液,进样分析,以聚体含量为横坐标,峰面积为纵坐标绘制标准曲线。
1.6.4 重复性:取供试品配制6份,进样分析记录色谱图,计算峰面积。
1.6.5 中间精密度:操作者1和操作者2,分别取供试品配制6份,进样分析,记录色谱图,计算峰面积。
2 结果
2.1 CHT I、CHT II填料对2种单抗的动态载量结果 使用生物过程分析仪分析流穿组分,结果表明CHTI的对mAb 1、mAb 2载量分别为40 mg/mL、45 mg/mL,见图1;CHT II对 mAb 1、 mAb 2载量分别为16 mg/mL、20 mg/mL,见图2。
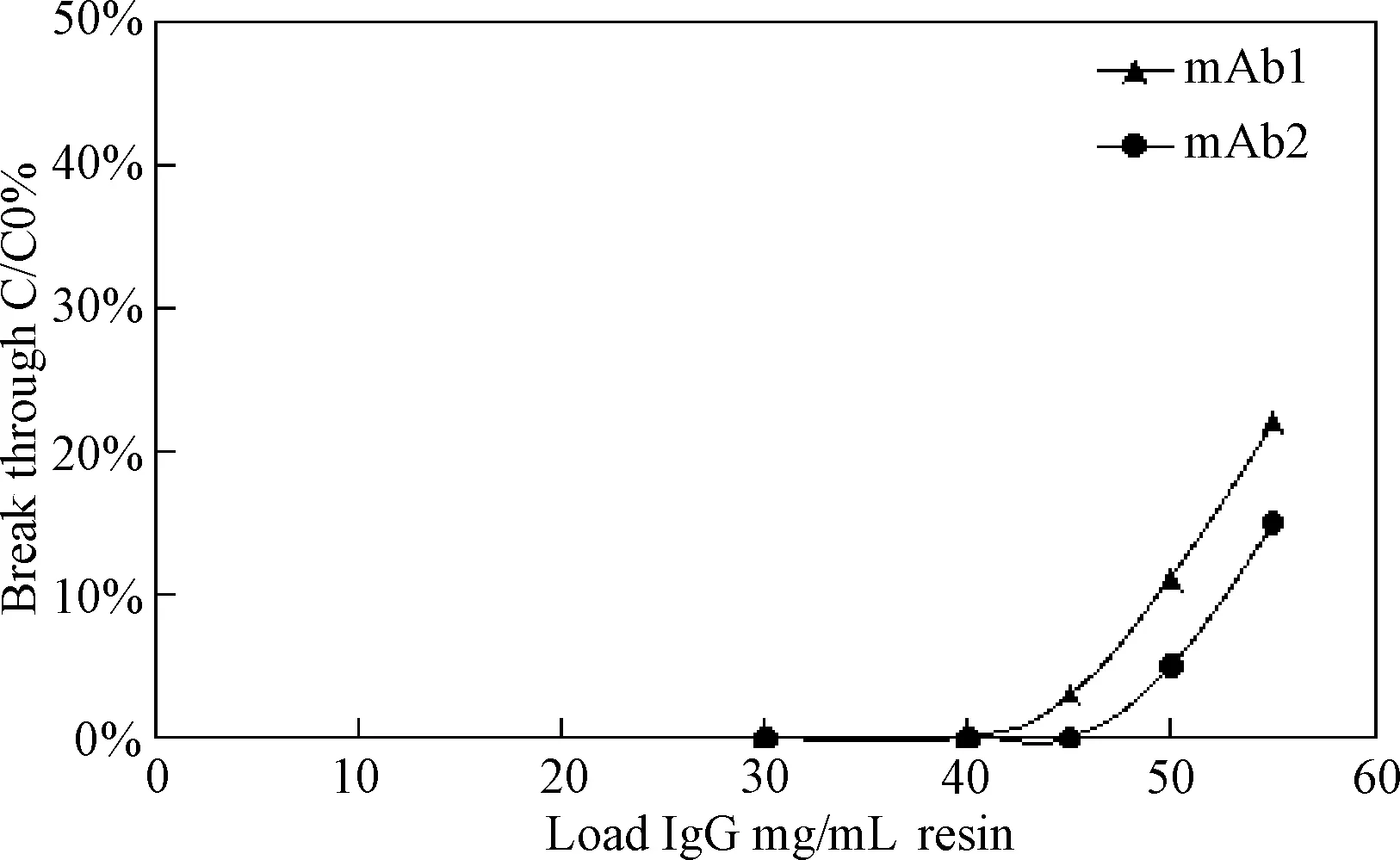
图1 CHT I 动态结合载量Fig.1 CHT I dynamic binding capacity
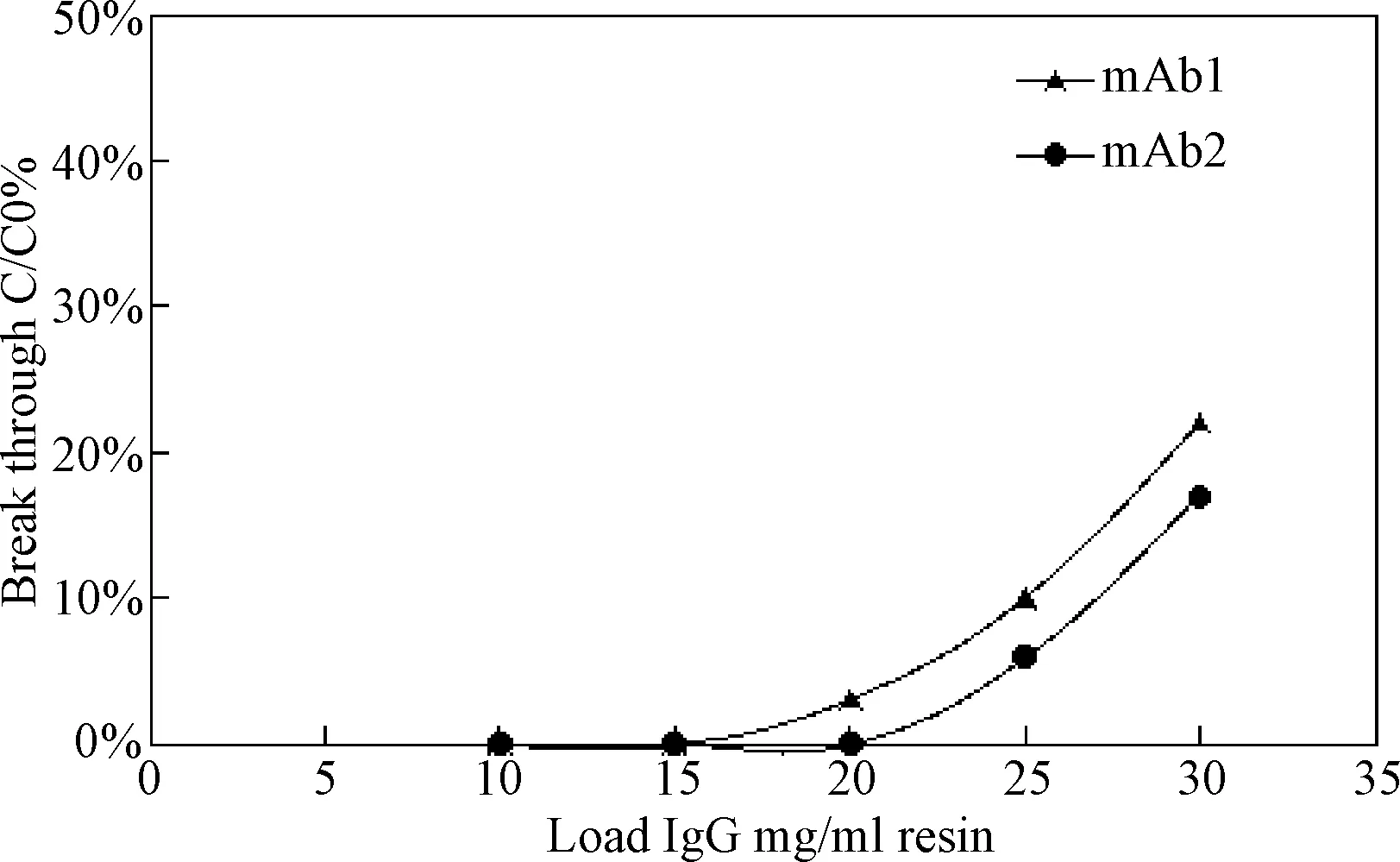
图2 CHT II 动态结合载量Fig.2 CHT II dynamic binding capacity
2.2 CHT I、CHT II填料去除2种单抗中聚集体的效果 使用SEC-HPLC分别检测2种单抗的洗脱峰聚集体含量,见图3。结果表明:CHT I纯化 mAb1、 mAb 2的洗脱峰单体含量分别为98.6%、98.8%。,回收率分别为92.5%、91.5%。CHT II纯化mAb 1、mAb 2的洗脱峰单体含量分别为99.8%、99.9%,回收率分别为91.8%、92.2%。
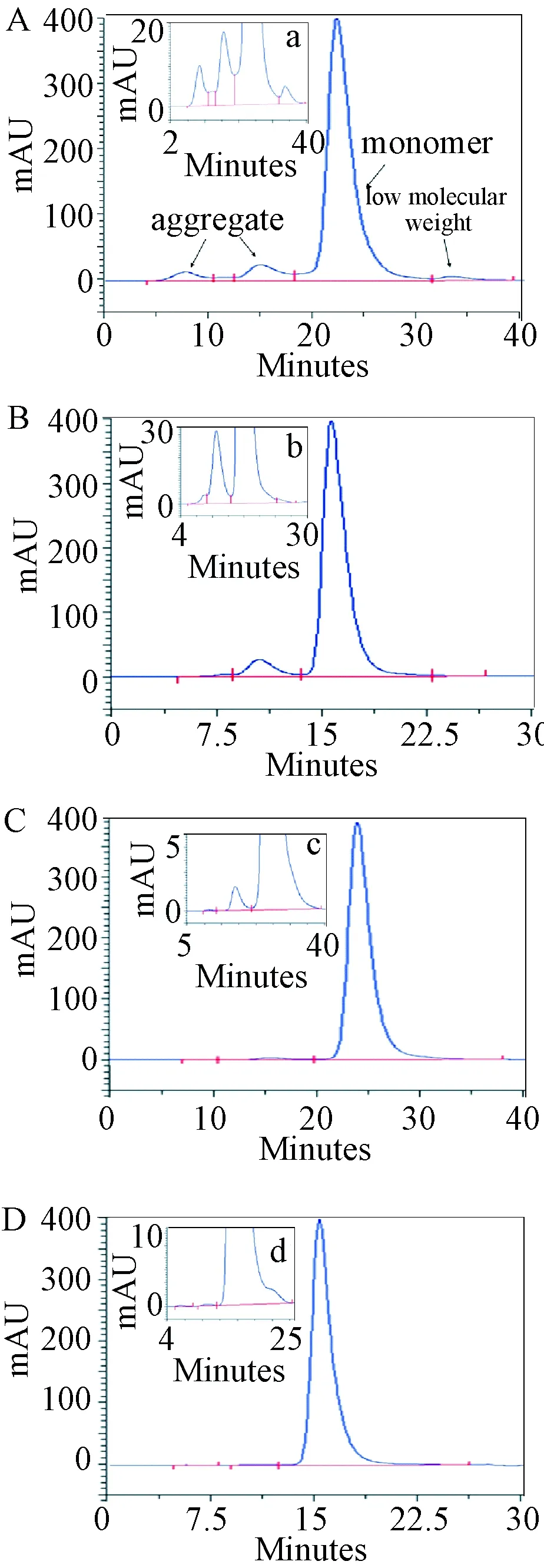
图3 抗体纯化前/后的分子排阻色谱结果A: 抗体1(前) B:抗体2(前) C:抗体1(后) D:抗体2(后)Fig.3 SEC-HPLC chromotagram of mAb before/after purificationA: mAb1 (before) B: mAb2 (before) C: mAb1 (after) D: mAb2 (after )
2.3 SEC-HPLC方法学验证结果
2.3.1 精密度试验结果:精密度试验结果表明RSD值为0.01%,仪器精密度良好。
2.3.2 准确度试验结果:准确度试验结果表明平均回收率分别为88.6%、87.9%、99%,RSD值分别为0.13%、0.01%、0.46%,证明方法准确度良好。
2.3.3 线性曲线:标准曲线的回归方程为:Y=3×106X+275853,R2=0.9997,此方法在聚体含量0.1%~18.0%的范围内呈良好的线性关系。
2.3.4 重复性试验结果:重复性试验结果表明样品的RSD值为0.2%,符合要求。
2.3.5 中间精密度试验结果:不同试验者批内精密度RSD分别为0.14%、0.16%,结果符合中间精密度要求。
2.4 工艺放大结果 使用SEC-HPLC检测2种单抗的洗脱峰中聚集体含量。结果表明:CHT II去除聚集体的效果要优于CHT I,分辨率高,与放大前的结果基本一致,方法重现性好。CHT I、CHT II放大结果见表1。
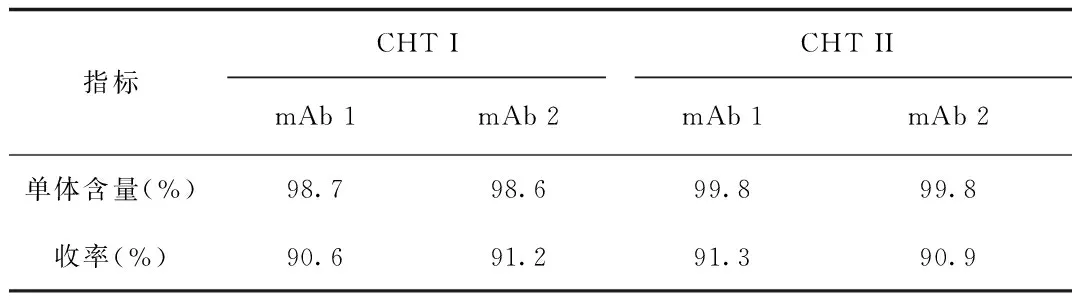
表1 20 cm XK16/40 层析柱分析结果Tab.1 Results of 20 cm height XK16/40 column
3 讨论
本实验使用CHT I和CHT II 2种类型的陶瓷羟基磷灰石填料去除2种单抗中的聚集体,2种单抗的聚集体含量都高于10%,层析方法经过进一步优化梯度洗脱条件,获得纯度超过98.5%的单体。
载样量实验证明了CHT I载样量高于CHT II。聚集体含量测定采用SEC-HPLC方法,结果显示CHT II纯化后单体比例均高于99.8%,聚集体含量均低于0.2%;CHT I单体比例均高于98.5%,聚集体含量均低于1.5%,而且蛋白的回收率均在90%以上,说明CHT II去除单抗聚集体效果优于CHT I。使用XK16/40层析柱对工艺进行了放大,结果显示方法具有较好的重现性。实验中,层析柱使用多次后出现反压大的问题,需要在每次实验结束后进行彻底的清洗,否则会影响聚集体的去除效果。
使用CHT I和CHT II 2种填料去除多聚体方法简单,容易实现工艺放大。单抗结构在序列上有相当高的一致性,可以在本方法的基础上优化用于去除目标单抗中的聚集体,本文为单抗聚集体的去除提供了实验依据和有利参考。
[1] Reichert JM.Monoclonal antibodies as innovative therapeutics[J].Curr Pharm Biotechnol,2008, 9(6):423.
[2] Mire-Sluis AR,Barrett YC,Devanarayan V,et al.Recommendations for the design and optimization of immunoassays used in the detection of host antibodies against biotechnology products[J].J Immunol Methods,2004,289(1-2) :1-16.
[3] Gupta S,Indelicato SR,Jethwa V,et al.Recommendations for the design,optimization,and qualification of cell-based assays used for the detection of neutraliazing antibody responses elicited to biological therapeutics[J].J Immunol Methods,2007,321(1-2):1-18.
[4] 232ndNational Meeting of the Americal Chemical Society.San Francisco, California USA,2006.
[5] Vázquez-Rey M, Lang DA. Aggregates in monoclonal antibody manufacturing processes[J]. Biotechnol.Bioeng,108(7):1494-1508.
[6] Rosenberg AS.Effects of protein aggregates.an immunologic perspective[J].AAPS J,2006,8 (3) :E501-507.
[7] Josics DJ, Loster K, Kuhl R, et al. Purification of monoclonal antibodies by hydroxyapatite HPLC and size exclusion HPLC[J].Biol.Chem.Hoppe-Seylars,1991,372(3):149-156.
[8] Gagnon P.Monoclonal antibody purification with hydroxyapatite[J].N Biotechnol,2009,25(5): 287-293..
[9] Sun S.Removal of high molecular weight aggregates from an antibody preparation using ceramic hydroxyapatite chromatography,oral presentation[C]. 3rd International Hydroxyapatite Conference,Lisbon,2003.
[10] Sun S.Ceramic hydroxyapatite chromatography in antibody and Fcfusion protein purification[C]. (Oral presentation). 12th Annual Waterside Conference,San Juan,Puerto Rico.2007.
[11] Gagnon P,Ng P,Zhen J,et al.A ceramic hydroxypatite-based purification platform:simultaneous removal of leached protein A,aggregates,DNA,and endotoxins from mAbs[J].Bioprocess Int,2006,4:50-60.
[12] Chen J,Tetrault J,Zhang YY,et al.The distinctive separation attributes of mixed-mode resins and their application in monoclonal antibody downstream purification process[J].J Chromatogr A,2010,1217 (2):216-224.
[13] Ng PK,He J,Gagnon P.Mechanistic model for adsorption of immunoglobulin on hydroxyapatite[J].J Chromatogr A,2007,1142 (1):13-28.
[14] Franklin S.Removal of aggregate from an IgG4 product using CHT ceramic hydroxyapatite.chromatography Tech Note 2940, Bio-Rad Laboritories,Inc.2002.
[15] Luo P,Hayes RJ,Cha I,et al.Development of a cytokine analog with enhanced stability using computational ultrahigh throughput screening[J].Pro Sci,2002,11(5):1218-1226.
[16] kramarczyk JF, kelley BD, coffman JL. High-throughput screening of chromatographic separations:Ⅱ.Hydrophobic interaction[J].Biotechnol Bioeng, 100(4):707-720.
[17] Tosoh Bioscience LLC.Analysis of human immunoglobulins by size exclusion chromatography,application note G00951.
[18] Diederich P,Hansen SK,Oelmeier SA.A sub-two minutes method for monoclonal antibody aggregate quantification using parallel interlaced size exclusion high performance liquid chromatography[J].J Chromatogr A,2011,1218: 9010-9018.
[19] Gagnon P.Improved antibody aggregate removal by hydroxyapatite chromatography in the presence of polyethylene glycol[J].J Immunol Methods,2008,336 (2):222-228..
[20] Gagnon P,Beam K.Antibody aggregate removal by hydroxyapatite chromatography[J].Curr Pharm Biotechnol,2009,10 (4): 440-446.
(编校:王冬梅)
Study on the process of ceramic hydroxyapatite for removing monoclonal antibody aggregates
WANG Ning1, ZHAO Yan-yan1,2Δ, TAO Wen-jie2, LIU Li-li2, LIU Wan-hui1,3
(1.School of Pharmacy, Yantai University, Yantai 264005, China; 2.Department of Antibody Technology, BoanBiotech Group Ltd., Yantai 264005, China; 3.State Key Laboratory of Long-acting and Targeting Drug Delivery System, Luye Pharma Group Ltd., Yantai 264005, China)
ObjectiveTo compare the purification process of two types of ceramic hydroxyapatite(CHT I and CHT II)to remove the aggregates from two monoclonal antibodies(mAb 1 and mAb 2).MethodsAll the chromatography runs were performed on AKTA AVANT 150 with Tricon 10/50 column.The dynamic binding capacity(DBC) of two types of CHT was studied firstly, and then purification research was carried out selecting the suitable DBC.The column was equilibrated with 5 mmol/L sodium dihydrogen phosphate pH 6.5, and then was eluted with gradient buffers which were 10 mmol/L sodium dihydrogen phosphate pH 6.5 and 2 mol/L sodium chloride pH 6.5.Aggregate content in loading and elution pool was evaluated by size exclusion chromatography.Scale-up process was carried on 20 cm height chromatography column XK16/40.ResultsDBC of CHT I for mAb 1 was 40 mg/mL and mAb 2 was 45 mg/mL.After purity, monomer content of mAb 1 reached 98.6% and yield was 92.5% and monomer content of mAb 2 reached 98.8% and yield was 91.5% .DBC of CHT II for mAb1 was 16 mg/mL and mAb 2 was 20 mg/mL.After purity, monomer content of mAb 1 reached 99.8% and yield was 91.8% and monomer content of mAb 2 reached 99.9% and yield was 92.2%.ConclusionTwo types of CHT both can remove aggregates effectively from monoclonal antibodies when aggregate content reaches more than 10%, and results conform to the regulations.CHT I has higher dynamic binding capacity than CHT II, and CHT II is superior to CHT I in removing aggregate efficiency.The purification process is simple and can be easily scaled up in pilot and manufacture.Therefore, it meets the requirement pilot and scale production.
ceramic hydroxyapatite; monoclonal antibody; purification process; aggregate
国家863计划(2012AA02A302 )
王宁,女,硕士在读,研究方向:生物制药,E-mail:294316576@qq.com;赵燕燕,通讯作者,女,博士,讲师,研究方向:生物制药,E-mail:zhaoyy@luye.cn。
R367.2
A
1005-1678(2015)05-0177-04

