sARMS-PCR检测非小细胞肺癌肿瘤组织中KRAS、BRAF基因突变研究
邵 璐,侯丹阳,冷再君,徐修才,伍 权,操乐杰
sARMS-PCR检测非小细胞肺癌肿瘤组织中KRAS、BRAF基因突变研究
邵璐1,侯丹阳1,冷再君1,徐修才2,伍权2,操乐杰1
摘要目的针对非小细胞肺癌(NSCLC)患者组织标本鼠类肉瘤病毒癌基因同源基因(KRAS)和鼠类肉瘤滤过性毒菌致癌同源体B1(BRAF)驱动基因突变使用特异引物双扩增实时蝎形探针扩增阻滞突变系统(sARMS-PCR)检测的可行性;了解KRAS和BRAF基因突变患者临床病理特征,为NSCLC患者个体化治疗提供理论依据。方法收集89例NSCLC患者肿瘤组织甲醛固定石蜡包埋标本(FFPE),采用FFPE样品DNA分离试剂盒(离心柱型)提取DNA,使用sARMS-PCR同时进行KRAS及BRAF基因突变检测。结果①KRAS基因突变21例(21/89);其中KRAS基因7种热点突变中,检出6种热点突变,均位于第12、13位密码子,1例同时检出存在G12D及G12V位点突变,1例同时检出存在G12C及G12V位点突变;未发现G12S突变型;②BRAF基因突变1例(1/89),突变位点为V600E,为女性,黏液腺癌;③未见KRAS和BRAF基因同时突变现象。结论临床使用sARMS-PCR技术检测NSCLC患者KRAS和BRAF基因突变有较强敏感性,且石蜡组织标本取材方便,可以作为两种基因的临床检测方法;KRAS和BRAF基因突变与年龄、吸烟史、病理分型等均无明显相关性,KRAS基因突变与性别相关,男性高于女性;KRAS与BRAF基因是独立存在的。
关键词非小细胞肺癌;鼠类肉瘤病毒癌基因同源基因;鼠类肉瘤滤过性毒菌致癌同源体B1;特异引物双扩增即时PCR技术
2015-07-15接收
操乐杰,男,教授,主任医师,硕士生导师,责任作者,E-mail:sycaolejie@163.com
针对驱动基因的靶向治疗药物逐渐成为目前肺癌个体化治疗研究的热点,主要集中在包括表皮生长因子受体(epidermal growth factor receptor,EGFR)在内的数个信号转导途径,尤其是表皮生长因子受体络氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase Inhibitors,EGFR-TKI)药物的研发及临床应用,延长了非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的生存期,EGFR基因突变与EGFR-TKI的相关性已经得到了很好的验证[1-4]。但临床观察显示,虽然有部分患者存在EGFR基因突变,但对EGFR-TKI的治疗效果变异很大,可能与RAS-RAF-丝裂原激活蛋白激酶的激酶(mitogen-activated protein kinase kinase,MEK)-细胞外信号调节激酶(extracellular-signal-regulated kinase,ERK)信号传导系统的下游信号因子鼠类肉瘤病毒癌基因同源基因(kirsten rat sarcoma viral oncogene homolog,KRAS)或鼠类肉瘤滤过性毒菌致癌同源体B1(V-rafmurine sarcoma viral oncogene homologB1,BRAF)基因突变部分相关[5],因此给患者行TKI治疗前仅仅检测EGFR是否突变可能不够全面,在行EGFR基因突变检测同时需行KRAS和BRAF突变检测有利于做出更全面的治疗决策。目前KRAS、BRAF基因检测主要有直接测序法、焦磷酸测序法、高分辨率熔解曲线分析法(high resolution melting,HRM)等,但大多存在敏感性低、易污染等问题,而特异引物双扩增实时蝎形探针扩增阻滞突变系统(amplitieafionrefractory mutationsystem,ARMS)因其高敏感性、高特异性等优势受到临床广泛欢迎。该研究旨在对KRAS、BRAF基因突变的检测确立临床检验方法及两种基因与临床病理特征关系进行探讨,为肺癌个体化治疗提供实验依据。
1 材料与方法
1.1标本来源选取安徽医科大学附属省立医院2013年1月~12月NSCLC组织学石蜡包埋组织标本89例,其中经胸外科手术切除标本83例,锁骨上转移性淋巴结活检3例,肺穿刺活检1例,恶性胸腔积液2例。标本经病理学确诊为NSCLC,均为甲醛固定石蜡包埋标本。标本采集前均未接受任何抗肿瘤治疗,无其他原发肿瘤病史。患者临床资料主要包括性别、年龄、吸烟史、肿瘤类型、TNM分期等;分期依据2011年由国际肺癌研究学会(IASLC)、美国胸科学会(ATS)及欧洲呼吸学会(ERS)制定的肺癌的国际多学科分类标准。
1.2主要试剂甲醛固定石蜡包埋标本(formalinfixed paraffin-embedded,FFPE)样品DNA分离试剂盒(离心柱型)、人类KRAS基因7种突变检测试剂盒(荧光实时PCR)、人类BRAF基因V600E突变检测试剂盒(荧光实时 PCR)均购自厦门艾德生物科技有限公司。
1.3FFPE标本处理及DNA提取所有石蜡组织标本均经病理学确诊,且肿瘤细胞含量≥10%,佩戴一次性手套,使用徕卡手动切片机连续切取每份FFPE标本,切片厚度为5μm,共8~10张,放置离心管中备用,更换FFPE标本时需用 75%乙醇溶液擦拭切片机,避免切片机上残余的蜡块交叉污染。所有标本应用FFPE样品DNA分类试剂盒(离心柱型)提取DNA,具体操作步骤按说明书进行。提取的DNA均使用SMA4000超微量紫外分光度计(AmoyDx北京仪器有限公司)行浓度测定,DNA的260 nm和280 nm处光密度(optical delnsity,OD)比值 OD260/OD280均在 1.8~2.0,并放置-20℃环境保存。
1.4KRAS、BRAF基因检测所提取的DNA分别根据人类KRAS基因7种突变检测试剂盒(荧光实时PCR),人类BRAF基因V600E突变检测试剂盒(荧光实时PCR)所附说明书的步骤操作并运用Applied Biosystems 7500实时PCR及操作系统(美国应用生物系统公司)行KRAS、BRAF联合检测。见图1。
1.5统计学处理运用SPSS 16.0软件分析数据,基因突变状态与临床病理学特征采用X2检验。
2 结果
2.1临床病理学资料特点本研究89例NSCLC患者,其中男54例,女35例,男女比例约为1.5∶1;年龄37~82岁,中位年龄60岁,平均水平和变异程度指标61岁,<61岁49例,≥61岁40例;吸烟组39例,非吸烟组50例;腺癌88例,非腺癌1例;I~II期73例,III~IV期16例。
2.2KRAS及BRAF基因状态与临床病理特征的相关性89例NSCLC患者中,KRAS基因突变率23.6%(21/40),男17例,女4例,男性和女性突变率分别为31.5%(17/54)和11.4%(4/35),两者之间差异有统计学意义(P<0.05)。吸烟者39例,检出KRAS基因突变12例;非吸烟者50例,检出KRAS基因突变9例,突变率分别为30.8%和18.0%,吸烟者高于非吸烟者,但两者之间差异无统计学意义。Ⅰ~Ⅱ期与Ⅲ~Ⅳ期患者之间突变率差异无统计学意义。见表1。BRAF基因突变率2.5%(1/40),与年龄、性别、吸烟史、病理类型、分期差异均无统计学差异。
2.3KRAS基因突变类型分析89例NSCLC患者标本行7种KRAS基因突变类型检测,分别为G13D、G12A、G12D、G12C、G12R、G12V、G12S,其中检出KRAS基因突变21例,均发生在第12或13号密码子,其中1例p.G13D,6例p.G12A,6例p.G12D,5例p.G12C,1例p.G12R,1例复合突变为p.G12V和p.G12D,1例复合突变为p.G12V和p.G12C,未检出p.G12S。见表2。
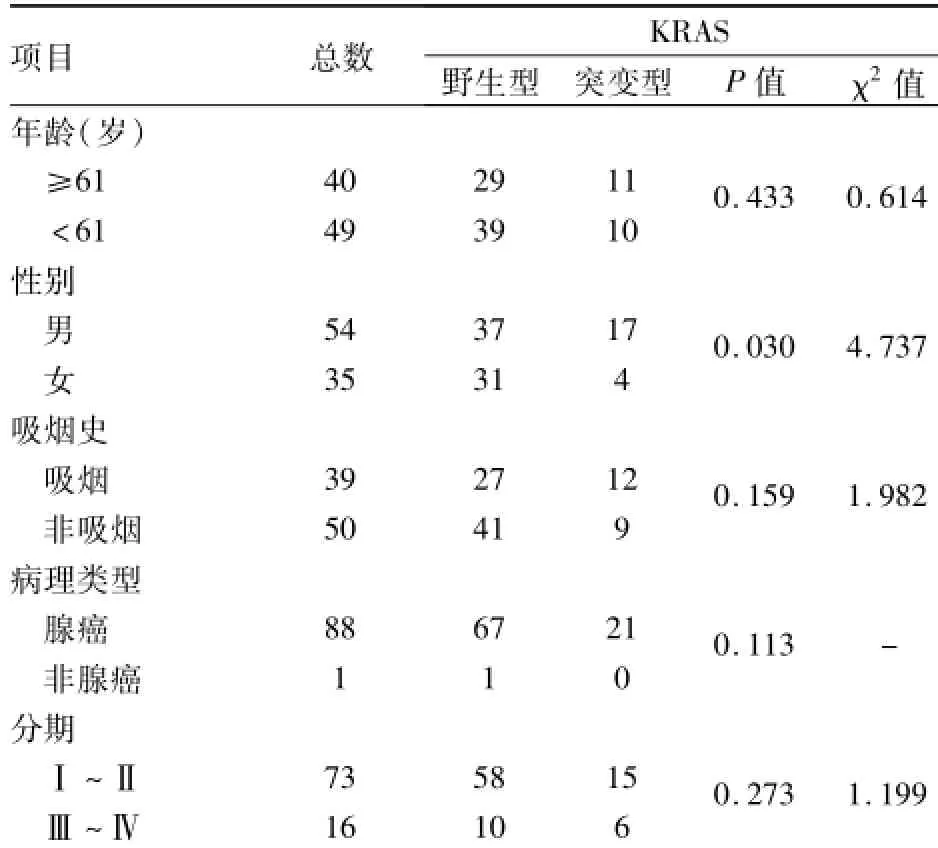
表1 KRAS基因状态与临床病理特征的相关性(n)
2.4KRAS基因与BRAF基因共存情况89例NSCLC肿瘤标本同步行KRAS和BRAF基因检测,同一患者未检出KRAS、BRAF双突变。

表2 KRAS基因突变类型分析
3 讨论
RAS蛋白又称P21蛋白,普遍存在于哺乳动物基因组中,突变的RAS蛋白持续与GTP结合处于活化状态,引起下游信号分子持续活化,促进肿瘤细胞的增殖、存活和转移。RAF蛋白是EGFR信号通路中KRAS下游重要的信号分子,是RAS-RAF-MEKERK信号转导通路重要的转导因子,其将信号从KRAS传导至MEK1/2,参与调控细胞的生物学事件,如细胞生长、分化和凋亡。在人类癌症中突变的RAS基因编码的蛋白质突变发生在G12、G13或Q61。1984年人类首次在肺癌中发现KRAS基因突变,主要发生在密码子12或13。
在西方国家中,肺癌的KRAS突变率达15%~30%,低于亚裔患者[6~9]的20% ~30%,更频发于来自吸烟者的腺癌[10-11],KRAS突变在非吸烟肺癌患者中并不罕见,约占15%,本研究中的89例实验标本,运用ARMS-PCR测出KRAS基因突变率为23.6%,与文献[6~9]报道一致,吸烟者突变率为30.8%(12/39),非吸烟者突变率为18%(9/50),LCINS突变率虽略高于文献报道,但吸烟者和未吸烟者突变率之间差异无统计学意义,与国外研究[18]的KRAS基因突变更常见于吸烟者的报道不一致,是否存在相关性可以扩大样本量进一步研究。
本实验中,KRAS基因突变与年龄、病理类型、吸烟、肿瘤分化程度等临床病理特点无相关性,与相关报道[12-13]一致,与性别是否相关,在国内外报道中未能统一,本实验中男性KRAS突变率为31.5%,女性为11.4%,差异有统计学意义,提示KRAS基因突变在男性中更常见。
KRAS点突变好发在第12或13号密码子,本实验中第12号密码子突变率为22.5%(20/89),1例发生在第13号密码子,突变率为1.1%(1/89),发生在第12号密码子的突变数目远高于第13号密码子的突变数目,其中检测出2例复合突变,均发生于第12号密码子,1例为p.G12V和p.G12D,1例为p.G12V和p.G12C,均为男性,有吸烟史,腺癌患者,同时行EGFR基因检测,结果均为野生型。
BRAF基因突变见于多种肿瘤,以直肠癌突变率最高,约15%,在黑色素瘤、肺癌、甲状腺癌、肝癌及胰腺癌中均存在不同比例的突变。在NSCLC中,突变率为1%~2%,其中大部分是腺癌。目前识别超过40种突变,在各种不同类型的突变中,约90% 的BRAF突变发生于谷氨酸残基600单个替换为缬氨酸(V600E)。本研究中,只有1例患者检测出BRAF基因突变,发生在女性,非吸烟,KRAS基因野生型患者,突变率为1.1%(1/89),研究标本量较少,可通过扩大样本量来进一步证实突变率。在目前的研究[14]中,BRAF突变与KRAS突变是排斥存在的,本实验中未发现KRAS和BRAF基因同时存在的病例。
原发灶和转移灶中相关基因突变位点可能不完全相同,在使用靶向治疗时,不应忽略原发灶和转移灶可能存在基因突变位点不一致的现象。本研究中,标本选择有3例来自于转移性淋巴结,2例来自恶性胸腔积液,由于标本来源少,故未行原发灶及转移灶基因突变状态对比研究。
对于EGFR突变型的 NSCLC患者,EGFR-TKIs治疗有效率为70%~80%,有20%~30%的患者存在原发性耐药,还有些患者初始治疗有效,后出现继发性耐药,这可能与KRAS或BRAF基因突变部分相关,因此给患者行TKI治疗前仅仅检测EGFR是否突变可能是不够的,在行 EGFR基因突变检测同时需行KRAS和BRAF突变检测。
目前基因检测方法有很多种,直接测序法仍为金标准,但存在操作复杂、易污染、特异性低等,张海萍等[15]通过对827例肿瘤病理石蜡切片样品提取DNA,同时运用ADX-ARMs技术和测序法进行检测,两种检测方法总体一致率为94.4%,突变一致率为100.0%,野生型一致率为92.5%,提示ADXARMs技术检测突变率较高,支持了ADX-ARMs技术的优势,指出了ADX-ARMs技术具有较高的检测灵敏度和可靠性。本实验运用sARMS-PCR法对NSCLC患者石蜡包埋组织同时检测KRAS、BRAF基因的突变状态,检测出基因突变率与国内外研究报道一致,临床使用sARM-PCR技术检测NSCLC患者KRAS基因和BRAF基因突变有较强敏感性,且石蜡组织标本取材方便,可作为这两种基因的临床检测方法。
带有KRAS第12号密码子突变的患者和野生型相比,化疗反应率相似,但带有KRAS基因第13号密码子突变的患者比KRAS野生型患者化疗后总体反应率更差,BRAF基因是多种肿瘤的驱动基因,可能成为NSCLC患者治疗的新靶点,因此NSCLC患者多基因检测对肺癌个体化治疗有重要意义。
参考文献
[1]Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J].N Engl JMed,2010,362(25):2380-8.
[2]Mitsudomi T,Morita S,Yatabe Y,etal.Gefitinib versus cisplatin plus docetaxel in patientswith non-small-cell lung cancer harbouringmutationsoftheepidermalgrowthfactorreceptor (WJTOG3405):an open label,randomised phase3 trial[J].LancetOncol,2010,11(2):121-8.
[3]Zhou C,Wu Y L,Chen G,et al.Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutationpositive non-small-cell lung cancer(OPTIMAL,CTONG-0802):amulticentre,open-label,randomised,phase 3 study[J].Lancet Oncol,2011,12(8):735-42.
[4]Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFRmutation-positive non-small-cell lungcancer (EURTAC):amulticentre,open-label,randomised phase 3 trial [J].Lancet Oncol,2012,13(3):239-46.
[5]Aviel-Ronen S,Blackhall F H,Shepherd F A,et al.K-rasmutations in non-small-cell lung carcinoma[J].Clinc Lung Cancer,2006,8(1):30-8.
[6]Shiqematsu H,Lin L,Takahashi T,et al.Clinicaland biological features associated with epidermal growth factor receptor genemutations in lung cancers[J].JNatl Cancer Inst,2005,97(5):339 -46.
[7]Massarelli E,Varella-Garcia M,Tang X,etal.KRASmutation is an important predictor of resistance to therapy with epidermal growth factor receptor tyrosine kinase inhibitors in non-small-cell lung cancer[J].Clin Cancer Res,2007,13(10):2890-6.
[8]O’Byrne K J,Gatzemeier U,Bondarenko I,et al.Molecular biomarkers in non-small-cell lung cancer:a retrospective analysis of data from the phase 3 FLEX study[J].Lancet Oncol,2011,12 (8):795-805.
[9]Douillard JY,Shepherd F A,Hirsh V,et al.Molecular predictors of outcome with gefitinib and docetaxel in previously treated non-small-cell lung cancer:data from the randomized phase III INTEREST trial[J].JClin Oncol,2010,28(5):744-52.
[10]Gealy R,Zhang L,Siegfried JM,et al.Comparison ofmutations in the p53 and K-ras genes in lung carcinomas from smoking and nonsmoking women[J].Cancer Epidemiol Biomarkers Prev,1999,8(4 Pt1):297-302.
[11]Porta M,Crous-Bou M,Wark P A,et al.Cigarette smoking and K-rasmutations in pancreas,lung and colorectaladenocarcinomas:etiopathogenic similarities,differences and paradoxes[J].Mutat Res,2009,682(2-3):83-93.
[12]Riely G J,Marks J,Pao W.KRASmutations in non-small cell lung cancer[J].Proc Am Thorac Soc,2009,6(2):201-5.
[13]Riely G J,Kris M G,Rosenbaum D,et al.Frequency and distinctive spectrum of KRASmutations in never smokers with lung adenocarcinoma[J].Clin Cancer Res,2008,14(18):5731-4.
[14]Li S,Li L,Zhu Y,et al.Coexistence of EGFR with KRAS,or BRAF,or PIK3CA somatic mutations in lung cancer:a comprehensive mutation profiling from 5125 Chinese cohorts[J].Br J Cancer,2014,110(11):2812-20.
[15]张海萍,付莉,陈培琼,等.特异引物双扩增即时PCR与传统测序法检测肠癌、肺癌患者K-ras基因突变的比较[J].中华病理学杂志,2010,39(11):757-61.
sARMS-PCR detection in non-small cell lung cancer tumor tissue KRAS,BRAF genemutation
Shao Lu,Hou Danyang,Leng Zaijun,etal
(Dept of Respiratory,The Affiliated Provincial Hospital of Anhui Medical University,Hefei230001)
AbstractObjectiveTo explore the feasibility of use scorpion probe amplification refractory mutation system (sARMS-PCR)to detect Kirsten rat sarcoma viral oncogene homolog(KRAS)and V-rafmurine sarcoma viral oncogene homologB1(BRAF)gene mutations in non-small cell lung cancer(NSCLC)patients.To realize the clinical and pathological feature of KRAS,BRAF genemutations in NSCLC patients,and to provide a theoretical basis for individualized treatment of NSCLC patients.MethodsWe collected 89 cases of tumor formalin-fixed paraffin-embedded tissue specimens(FFPE)in NSCLC patients,then used DNA isolation kit to extract DNA,and used sARMS to test KRAS and BRAF genemutation.Resu lts①We found KRASmutations in 21 patients(21/89),themutation rate was23.6%;the KRASgenemutations included seven kinds of hot spotsmutations,in which 6 were located at codon 12 and 13;the G12D and G12V site mutation and the G12C and G12C were detected from the 6 hot spots respectively;G12Smutantwas not found;②We only found BRAF genemutation in one patient(1/89),the mutation rate was 1.1%.The mutation site was located at V600E,was a women,mucinous adenocarcinoma patient;③KRAS and BRAF gene never co-existed in the same patient.ConclusionUsing sARMS-PCR technology to detect KRAS and BRAF gene mutations is feasible in NSCLC patients.There is no significant correlation with age,smoking history,pathological type in KRASand BRAF genemutations in NSCLC patients.KRASgenemutation is related to gender,more common in women than in men(P<0.05);KRAS and BRAF gene never coexist in the same patient.
Key wordsNSCLC;KRAS;BRAF;sARMS
中图分类号R 734.2
文献标志码A
文章编号1000-1492(2015)11-1669-05
基金项目:安徽省卫生厅医学科研课题计划(编号:13ZC001);安徽省科技攻关计划项目(编号:1301042216)
作者单位:安徽医科大学附属省立医院1呼吸内科、2中心实验室,合肥230001
作者简介:邵璐,女,硕士研究生;

