吲哚胺2,3-二氧酶(IDO)与CINⅢ及宫颈癌T淋巴细胞的相关性研究
杜世华,胡传玉,鲁大伟,李 燕,桑 琳
吲哚胺2,3-二氧酶(IDO)与CINⅢ及宫颈癌T淋巴细胞的相关性研究
杜世华,胡传玉,鲁大伟,李燕,桑琳
摘要目的研究吲哚胺2,3-二氧酶(IDO)表达对子宫颈癌患者T淋巴细胞活性的影响,进一步了解子宫颈癌的免疫逃逸机制。方法选择子宫颈上皮内瘤变Ⅲ级(CINⅢ)组织20例(CINⅢ组),子宫颈癌患者组织20例(宫颈癌组),正常宫颈组织20例(正常组),采用流式细胞仪检测各组外周血中CD3+T细胞、CD8+T细胞、CD4+T细胞、CD4+CD25+Foxp3+Tregs数量、CD4+T细胞/CD8+T细胞。采用Western blot法和半定量RT-PCR法检测各组子宫颈组织IDOmRNA及其蛋白表达,分析各组子宫颈组织中IDO的表达对宿主T淋巴细胞活性的影响。结果正常组、CINⅢ组及宫颈癌组3组之间IDO蛋白表达强度差异有统计学意义(P<0.001)。宫颈癌组IDO表达高于CINⅢ和正常组(P<0.001),CINⅢ组高于正常组(P<0.001)。宫颈癌组外周血中CD3+T细胞、CD8+T细胞、CD4+T细胞、CD4+CD25+Foxp3+Tregs数量与正常组和CINⅢ组差异有统计学意义(P <0.001)。3组中IDO蛋白表达与外周血中CD3+T细胞、CD4+T细胞/CD8+T细胞呈负相关性,与CD4+CD25+Foxp3+Tregs呈正相关性。结论IDO抑制外周血T淋巴细胞对肿瘤的杀伤效应,使子宫颈癌患者免疫功能低下,有利于肿瘤细胞免疫逃逸,从而使病情进展。
关键词吲哚胺2,3-二氧酶;子宫颈癌;CINⅢ;T淋巴细胞
子宫颈癌在全球妇女的癌症死因中高居第2位,世界上每年新发病例大约为40多万例,死亡率约为50%[1]。子宫颈癌细胞通过调节宿主机体相关免疫反应引起免疫耐受,在机体对子宫颈癌的免疫监控中,细胞毒性T淋巴细胞发挥了十分重要的作用[2]。肿瘤细胞可以逃避免疫系统的清除,在肿瘤微环境修饰和自身免疫编辑的作用下,成为可以存活的休眠期肿瘤细胞,在恶性肿瘤的发生、发展过程中,免疫逃逸发挥了重要的作用[3]。研究[4]表明,吲哚胺 2,3-二氧酶(indoleamine 2,3-dioxygenase,IDO)相对分子量为42 000,由403个氨基酸组
成,是一种催化色氨酸吲哚环氧化裂解的限速酶,IDO能在许多肿瘤的肿瘤浸润组织、间质中表达,在肿瘤的发生、发展以及转移过程中起到非常重要的作用。最近对IDO的研究[5]中,显示其对T细胞的诱导增殖作用,引起了广泛的关注,暗示IDO可能在肿瘤的侵袭和转移中发挥了重要的作用。目前国内外对IDO在子宫颈癌患者机体免疫系统中的影响的具体机制研究较少,该课题研究IDO在CINⅢ及宫颈癌组织中的表达,探讨其对T淋巴细胞活性的调控及在子宫颈癌发生、发展中的机制,以期为子宫颈癌预防和治疗寻求新途径。
1 材料与方法
1.1病例资料
随机选择2012年2月~2015年1月因子宫平滑肌瘤在安徽医科大学附属合肥医院妇产科手术患者的正常子宫颈组织20例,年龄41~62岁,中位年龄49.5岁;同期在我科手术的子宫颈癌患者20例,年龄41~68岁,中位年龄49岁。同期CINⅢ患者20例,年龄40~72岁,中位年龄49岁。各组之间年龄差异无统计学意义(P>0.05)。
1.2主要仪器及试剂
FACSCalibur流式细胞仪(美国Becton Dikinson公司);Biorad MJMini梯度PCR仪(美国Bio-Rad公司);小鼠抗人IDO抗体、鼠抗人CD4FITC CD8PE/CD3PE-Cy5、CD4+CD25+Foxp3+T细胞检测试剂盒(美国Biolegend公司);IDO上、下游引物及GAPDH上、下游引物由上海捷瑞生物工程公司合成。
1.3取材方法
对纳入标准的宫颈癌及CINⅢ患者于阴道镜下取病变组织,约100~140 mg,子宫肌瘤患者于子宫切除术后取宫颈组织,约100~140 mg,并置于液氮罐中冷冻保存。
1.4实验方法
对符合标准的患者于取标本的第2天抽取空腹静脉血约1m l置于抗凝管中通过流式细胞仪检测各组外周静脉血中CD3+T细胞、CD8+T细胞、CD4+T细胞、CD4+CD25+Foxp3+Tregs的数量及CD4+T细胞/CD8+T细胞,步骤按说明书。采用半定量RT-PCR法检测各组子宫颈组织中IDO mRNA及其蛋白含量的表达:将RNA浓度调至相同
2015-06-25接收
1.5统计学处理
2 结果
2.1各组半定量RT-PCR检测结果
正常组、CINⅢ组、宫颈癌组3组半定量RT-PCR检测IDOmRNA值分别为0.724±0.070 4、0.321 1±0.224 2、0.621 8±0.142 1。采用Tamhane法进行组间比较显示宫颈癌组表达高于CINⅢ组和正常组(P<0.001),CINⅢ组则高于正常组(P<0.001),差异均有统计学意义。
表1 外周静脉血 CD3+T细胞、CD8+T细胞、CD4+T细胞及 CD4+CD25+Foxp3+Tregs数量的变化(±s)
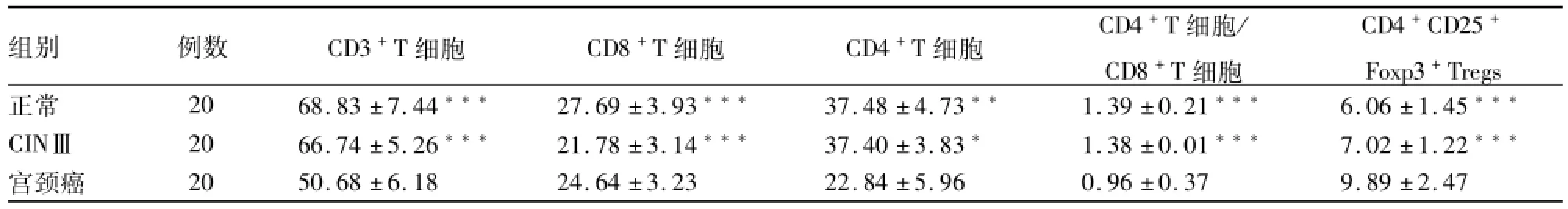
表1 外周静脉血 CD3+T细胞、CD8+T细胞、CD4+T细胞及 CD4+CD25+Foxp3+Tregs数量的变化(±s)
与宫颈癌组比较:*P<0.05,**P<0.01,***P<0.001
组别 例数 CD3+T细胞 CD8+T细胞 CD4+T细胞 CD4+T细胞/CD8+T细胞Tregs正常 20 68.83±7.44*** 27.69±3.93*** 37.48±4.73** 1.39±0.21*** 6.06±1.45 CD4+CD25+Foxp3+*** CINⅢ 20 66.74±5.26*** 21.78±3.14*** 37.40±3.83* 1.38±0.01*** 7.02±1.22***宫颈癌 20 50.68±6.18 24.64±3.23 22.84±5.96 0.96±0.37 9.89±2.47
2.2W estern b lot法检测IDO蛋白表达
本实验结果显示,正常组中65% (13/20)出现了目的条带的显示,35%(7/20)未见明显目的条带的显示,仅有2例(2/20,10%)IDO相对积分光密度值>0.1。CINⅢ组织中相对积分光密度值>0.1的有15例(15/20,75%),相对积分光密度值<0.1的有4例(4/20,20%),1例(1/20,5%)未见目的条带。宫颈癌组在45 ku处均可见目的条带的显示(20/20,100%),相对光密度值>0.1。对未出现目的条带显示的子宫颈组织相对积分光密度值标记为0。分析显示正常组、CINⅢ组和宫颈癌组中IDO蛋白的表达量均不同,3组IDO表达相对积分光密度值分别为0.048 5±0.034 7、0.290 5±0.264 1、0.511 5 ±0.153 8,差异均有统计学意义(F=45.548,P<0.001)。采用Tamhane法进行比较显示宫颈癌组IDO蛋白表达明显高于CINⅢ组和正常组(P<0.001),而CINⅢ组明显高于正常组(P<0.001),差异均有统计学意义。
2.3IDO表达与外周静脉血CD3+T细胞、CD4+CD25+Foxp3+Tregs数量及CD4+T细胞/CD8+T细胞的相关性
流式细胞仪检测显示外周静脉血T细胞亚群数量变化见表1。宫颈癌组外周静脉血中CD3+T细胞、CD8+T细胞、CD4+T细胞数量均低于正常组(P<0.001,P<0.001,P<0.01)和 CINⅢ组(P<0.001,P<0.001,P<0.05),正常组和CINⅢ组差异无统计学意义(P=0.288、0.658、0.524),宫颈癌组外周静脉血中CD4+T细胞/CD8+T细胞显著低于正常组和CINⅢ组(P<0.001),正常组和CINⅢ组差异无统计学意义(P=0.964)。宫颈癌组CD4+CD25+Foxp3+Tregs的数量显著高于CINⅢ组和正常组(P<0.001)。CINⅢ组和正常组差异无统计学意义(P=0.086)。
2.4相关性分析
采用Bivariate相关性分析结果显示,正常组 IDO mRNA表达及其蛋白表达与CD4+T细胞/CD8+T细胞(r=-0.644、-0.686,P <0.05)、CD3+T细胞(r=-0.547、-0.455,P<0.05)呈负相关性;与CD4+CD25+Foxp3+Tregs(r=0.477、0.514,P<0.05)呈正相关性。CINⅢ组IDO mRNA表达及其蛋白表达与CD 3+T细胞(r=-0.785、-0.768,P<0.001),CD4+T细胞/CD8+T细胞(r=-0.778、-0.771,P<0.001)呈负相关性;与 CD4+CD25+Foxp3+Tregs(r=0.843、0.850,P<0.001)呈正相关性。宫颈癌组IDO mRNA及其蛋白表达与CD3+T细胞(r=-0.882、-0.919,P<0.001),CD4+T细胞/CD8+T细胞(r=-0.871、-0.733,P<0.001)呈负相关性;与CD4+CD25+Foxp3+Tregs(r=0.886、0.824,P<0.001)呈正相关性。
3 讨论
研究[6]显示,宿主免疫功能受到抑制的妇女是正常妇女患子宫颈癌大约4~5倍。细胞毒T淋细胞能有效识别和杀伤肿瘤细胞[7]。目前研究[8]表明,宿主外周T细胞亚群的数量与肿瘤的发生、发展、预后有着密切的相关性。IDO的高表达是导致宿主对肿瘤细胞产生免疫逃逸的重要因素之一[9]。本研究采用流式细胞仪检测正常子宫颈组织,CINⅢ和子宫颈癌3组患者外周静脉血中T淋巴细胞亚群的数量,采用Western blot法和半定量RT-PCR法检测上述3组子宫颈组织中IDOmRNA及其蛋白的表达量,分析各组子宫颈组织中IDO的表达对宿主外周静脉血T淋巴细胞的影响,初步探讨IDO在子宫颈癌的发生发展中的作用,同时了解IDO对机体免疫系统的影响。
研究[10]显示宫颈肿瘤组织中的IDO的表达量均显著高于邻近正常的组织。本研究结果显示宫颈癌组IDO mRNA表达高于CINⅢ和正常组,而CINⅢ组高于正常组。这提示随着肿瘤的发生、发展,IDO引起的宫颈癌免疫抑制功能逐步增加。
陈婉玲等[11]发现T淋巴细是宿主抗肿瘤免疫的比较重要的部分,研究显示,T淋巴细胞与宫颈癌的发展、预后有着较为密切的关系,正常时候T淋巴细胞及其亚群功能及数量相对稳定,假如发生机体免疫抑制,则较易发生肿瘤的免疫逃逸从而引起肿瘤的发生、发展,机体预后则较差。本研究结果表明:宫颈癌患者外周静脉血中上述T细胞数量均显著低于CINⅢ组和正常组,CINⅢ组和正常组却差异无统计学意义,宫颈癌组外周静脉血中CD4+T细胞/CD8+T细胞显著低于正常组和CINⅢ组。宫颈癌组CD4+CD25+Foxp3+Tregs的数量显著高于正常组,这可能提示宫颈癌患者机体的免疫功能得到抑制。
Mumn etal[8]研究发现,IDO可以抑制机体T淋巴细胞及其亚群的发生、发展,从而可以促进T淋巴细胞及其亚群发生细胞凋亡。本实验中正常组IDOmRNA表达及蛋白表达与CD3+T细胞、CD4+T细胞/CD8+T细胞呈负相关性;与 CD4+CD25+Foxp3+Tregs呈正相关性。CINⅢ组IDO mRNA表达及其蛋白表达与T淋巴细胞亚群数量呈负相关性,与CD4+CD25+Foxp3+Tregs呈正相关性。宫颈癌组IDOmRNA及其蛋白表达与T淋巴细胞亚群数量呈负相关性,与CD4+CD25+Foxp3+Tregs呈正相关性。结果提示宫颈癌患者机体中IDO的高表达可能是影响T细胞及其亚群数量及功能的重要原因。
参考文献
[1]蒋卫,李宁丽.人乳头瘤病毒的免疫逃逸机制[J].细胞生物学杂志,2008,30(1):25-9.
[2]Carter J J,Koutsky L A,Hahes JP,et al.Comparison of human papillomavirus types 16,18,and 6 capsid antibody responses follewing incident infection[J].JInfect Dis,2000,181(6):1911 -9.
[3]Gu T,Rowswell-Turner R B,Kilimc M O,et al.Central role of IFN gamma-indoleamine 2,3-dioxygenase axis in regulation of interleukin-12-mediated antitumor immunity[J].Cancer Res,2010,70(1):129-38.
[4]Ferdinande L,Decaestecker C,Verset L,et al.Clinicopathological significance of indoleamine 2,3-dioxygenase 1 expression in colorectal cancer[J].Br JCancer,2012,106(2):141-7.
[5]Inaba T,Ino K,Kajiyana H,et al.Indoleamine 2,3-dioxygenase expression predictsimpaired survivalof invasive cervical cancer patients treated with radicalhysterectomy[J].Gynecol Oncol,2010,117(3):423-8.
[6]Chow Y,Miyamoto M,Kato K,et al.CD4+and CD8+T cells cooperete to improve prognosis of patients with esophageal squamous cell carcinoma[J].Cancer Res,2003,63(7):1555-9.
[7]Samooski R,Gissmann L,Osen W.Codon optimized expression of HPV 16 E6 renderstarget cells susceptible to E6-specific CTL recognition[J].Immunol Lett,2006,107(1):41-9.
[8]Kim R,Emi M,Tanabe K.Cancer immunoediting from immune survoillance to immuneescape[J].Immunology,2007,121(1):1 -4.
[9]Mellor A L,Munn D H.IDO expression by dendriaic cells:tolerance and tryptophancatabolism[J].Nat Rev Immunol,2004,4 (10):762-74.
[10]Karanikas V,Zamanakou M,kerenide T,et al.Indoleamine 2,3-dioxygenase expression in cancer[J].Cancer Biol Ther,2007,6 (7):1258-62.
[11]陈婉玲,杨承钢,杨宏英,等.宫颈癌患者外周血T细胞亚群数量变化及临床意义[J].武警医学院学报,2011,20(9):694-7.
中图分类号R 737.33
文献标志码A
文章编号1000-1492(2015)10-1497-04
作者单位:安徽医科大学附属合肥医院妇产科,合肥230011
作者简介:杜世华,女,副主任医师,责任作者,E-mail:13855195735@163.com浓度,RT-PCR检测各宫颈组织中的IDO。IDO上游引物:5′-TTCAGTGCTTT-GACGTCCTG-3′,下游引物:5′-CCTTTGGCTTCAGTTTTGA-3′,扩增片段305 bp;GAPDH上游引物:5′-CAGCCTCAAGATCATCAGCA-3′,下游引物:5′-GTCTTCTGGGTGGCAGTGAT-3′,扩增片段134 bp。Western blot法检测各宫颈组织中IDO表达:取20~70 mg组织加400μl去污剂裂解液,裂解30 min,取上清液,蛋白定量后取20μg总蛋白分离,电转移蛋白至聚偏二氟乙烯膜上,室温下用5%牛血清蛋白封闭,分别与小鼠抗人IDO抗体、抗GAPDH抗体杂交过夜,用过氧化物酶标记羊抗鼠IgG孵育。
Correlation study between indoleam ine 2,3-dioxygenase(IDO)and T lymphocytes in cervical cancer and CINⅢ
Du Shihua,Hu Chuanyu,Lu Dawei,et al
(Dept of Obstetrics and Gynecology,The Affiliated Hefei Hospital of AnhuiMedical University,Hefei230011)
AbstractObjectiveTo investigate the expression of indoleamine2,3-dioxygenase(IDO)how to effect on T lymphocyte activity,in order to understand the mechanism of immune escape of cervical cancer.MethodsSelected 20 patientswith CINⅢ,20 caseswith cervical cancer and 20 caseswith normal cervical for comparison,used flow cytometry to detcet the number of each group CD3+T,CD4+T,CD8+T,CD4+CD25+Foxp3+Tregs and CD4+/CD8+.Used semi-quantitative RT-PCR and Western blot to detect IDOmRNA and expression of IDO,and to analyze the effection on T lymphocyte active in cervical tissue.ResultsThe expression of IDO was significantly different among the three group(P<0.001).The positive rate of IDO in cerival cancerwas significantly higher than that in CINIIIand normal cerival(P<0.001).The positive rate of IDO in CINⅢwas significantly higher than that in normal cerival(P<0.001).The number of CD3+T,CD4+T,CD8+T and CD4+CD25+Foxp3+Tregs was significantly different among the three group(P<0.001).The positive expression of IDO was negatively correlated with the number of CD3+T,CD4+T,CD8+T,and positively correlated with CD4+CD25+Foxp3+Tregs.Conclusion IDO inhibits T lymphocyte activity.Cervical cancer patientswith low immune function can cause the tumor cells escape form immune surveillance,may lead to disease progression.
Key wordsindoleamine 2,3-dioxygenase;cervical cancer;CINⅢ;T lymphocytes

