同步去除氨氮和铁、锰的滤池中细菌群落解析
李 涛,沙 净,韩 珀
(郑州自来水投资控股有限公司,郑州450013)
由于黄河中下游汾河、涑水河、渭河和伊洛河等入黄支流污染物排放量大,氨氮已成为黄河干流的主要污染物之一,不但直接影响着黄河中下游郑州等大中城市的地表水水源水质,而且被污染的黄河水在入渗补给地下水的过程中对沿岸地下水也造成不同程度的影响,因此一些沿黄城市的地下水中除了常见的铁、锰等污染物外,还存在着较严重的氨氮污染.利用锰砂作为填料的接触氧化法是目前去除地下水中铁、锰的最常用的技术.然而,随着锰砂滤池的长期运行,硝化细菌也逐渐附着锰砂生长,因而锰砂滤池也会成为硝化生物滤池[1].如果进水溶解氧充足,则能在同一滤池同时实现铁、锰和氨氮的去除[2-3].
生物滤池内微生物群落的解析有助于了解污染物的去除机制,从而能更有效地设计和运行管理生物滤池[4].目前有别于传统培养法的分子生物学技术对饮用水生物滤池中微生物群落结构分析成为饮用水研究的一个热点,然而,这些研究主要集中于处理地表水的生物滤池[4-8],目前关于地下水生物滤池中微生物群落结构分析的研究报道仍极其有限[1,9],国内外尚未见关于铁、锰和氨氮同步去除的锰砂滤池的微生物群落结构分析的研究报道,因而本研究主要研究目的是:针对黄河沿岸地下水为水源的郑州市东周水厂的锰砂滤池,利用分子生物学技术进行滤池内微生物群落结构的解析,并探讨微生物与污染物去除的内在关系,为今后同步去除氨氮和铁、锰的地下水砂滤池的设计和运行管理提供微生物学基础信息.
1 试验装置及方法
1.1 试验装置及运行参数
郑州市东周水厂的锰砂滤池为双阀滤池,设计能力为20万m3/d.双阀滤池分为东、西两个滤池.每个滤池各有8格池子组成,共计16格池子.每格滤池的滤层厚度为1.2 m,滤料粒径为0.6~1 mm石英砂,经长期运行后熟化成为锰砂.滤池过滤速度为10.2 m/h,采用单独水冲的反冲洗方式.长期的监测资料表明,东周水厂原水中铁质量浓度约为1.1 ~1.4 mg/L,锰约为0.05 ~0.14 mg/L,经过锰砂滤池去除后,出水能达到我国饮用水水质的标注(即铁质量浓度不大于0.3 mg/L,锰质量浓度为不大于0.1 mg/L).而原水中氨氮平均值约为0.27 mg/L,滤池出水中氨氮平均值为0.04 mg/L,亚硝酸盐氮通常低于检测限,说明锰砂滤池已经成为硝化生物滤池.
1.2 细菌群落分析方法
用于微生物分析的样品采集与距滤层表面0.4 m处的锰砂.采用美国Mobio公司的强力土壤DNA提取试剂盒提取样品总DNA,具体DNA提取方法参照试剂盒产品说明书.提取的DNA放于–20℃保存以待后续的微生物学分析.采用细菌通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和 1492R(5'-GGTTACCTTGTTACGACTT-3')进行扩增.采用50 μL的 PCR反应体系:25 μL2 × Taq PCR MasterMix;2 μL 正反引物;21 μL DNA模板.反应条件:94℃预变性5 min;94℃变性 30 s,55 ℃退火 30 s,72℃延伸 90 s,共 30 个循环;最终72℃延伸10 min.PCR扩增产物纯化后进行克隆文库的构建,具体方法与文献一致[4,10].
将所得阳性克隆子送往北京诺赛基因组研究中心有限公司测序,用美国密西根州立大学的在线数据库 Ribosomal Database Project II(下文简称RDP)分析各序列的微生物学种类.采用DOTUR程序对克隆文库中的序列进行操作分类单元(OTU)划分,把相似性为97%或以上的序列聚类成一个OTU,然后进行细菌群落多样性指数的计算[4].选取每个 OTU中的一个代表性序列用BLAST在GenBank中搜索相近序列和进行相似性比对.(本研究所得克隆文库中细菌序列在Gen-Bank中登记号为:KC414945-KC415002).
2 结果与讨论
本研究中构建的细菌克隆文库有58个克隆子构成,克隆文库的覆盖率在90%,因而覆盖度较高.从稀释曲线(图1)可以看出,构成文库的克隆子采集样品数已经充分.文库仅可以划分成10个OTUs,Chao1指数和 Shannon指数分别是 15和1.05,说明锰砂填料上附着的细菌群落多样性较低.Li等采用克隆文库方法分析了处理地下水的生物活性炭滤池中细菌群落,发现滤池内细菌群落的 Shannon 指数为3.77 ~2.93[9].Liao 等采用克隆文库方法分析了处理地表水的升流式生物活性炭滤池系统,发现滤池内细菌群落的Shannon指数为1.0 ~2.9[4].由于锰砂的比表面积和表面粗糙度要比活性炭小,因而不利于微生物附着生长,这也可能是锰砂滤池中细菌群落多样性较小的一个主要原因.同时,生物滤池内微生物群落的多样性还与其它很多因素有关(如基质种类和质量浓度、营养物质量浓度、采样点部位、水力停留时间、滤池运行周期等)[8].

图1 文库的稀释曲线分析
图2反映了克隆文库中细菌序列的门纲分布,可以看出,锰砂填料上细菌属于变形杆菌门(Proteobacteria)或硝化螺旋菌门(Nitrospirae).硝化螺旋菌门成为优势菌(相对丰度为81%),而α变形杆菌纲(Alphaproteobacteria)、β变形杆菌纲(Betaproteobacteria)、γ变形杆菌纲(Gammaproteobacteria)和δ变形杆菌纲(Deltaproteobacteria)的相对丰度分别只有6.9%、1.7%、6.9% 和 3.4%.以往的研究资料表明,饮用水生物滤池中优势菌一般都为α变形杆菌纲[4,8],或 β 变形杆菌纲[5,9].然而,本研究中α变形杆菌纲和β变形杆菌纲都没能成为优势菌,这主要是可能是地下水中有机物含量很低,TOC 只有 0.1~0.2 mg/L,因而限制了异养细菌的生长.硝化螺旋菌门的细菌属于亚硝酸盐氧化菌,而其在每个样品中占据绝对优势,说明各滤池中存在强烈的硝化作用而已经成为硝化生物滤池,这主要与原水中氨氮质量浓度较高有关.而也有文献报道,对于存在氨氮污染的地下水原水,硝化螺旋菌门也在砂滤池中成为优势菌[1].
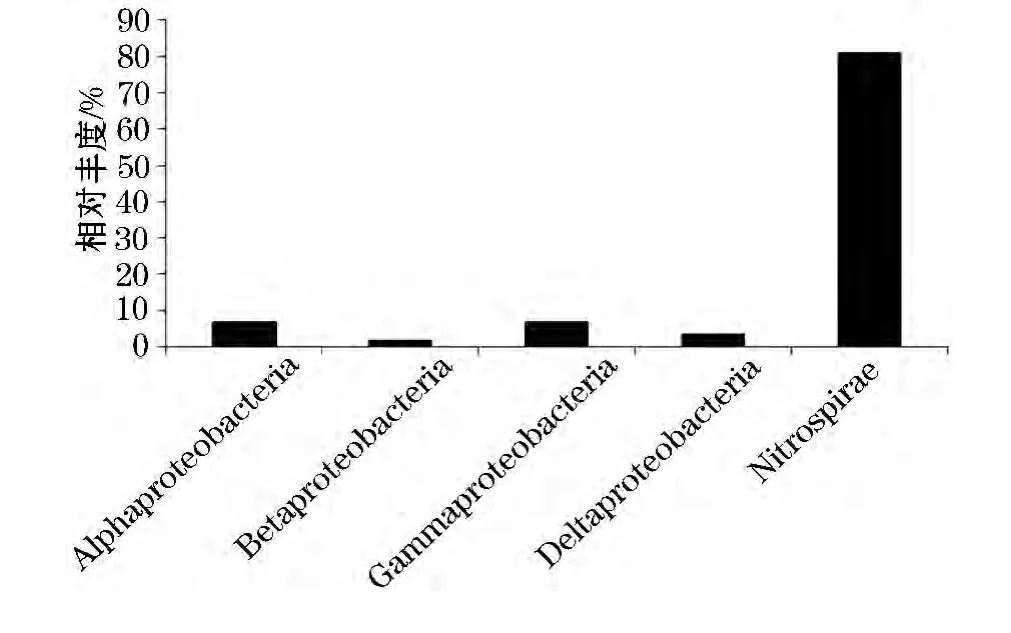
图2 克隆文库中细菌序列的门纲分布
表1反映了克隆文库中各OTU中代表性序列的进化发育情况,可以看出,大多数序列可以分类到属的水平,有3个细菌属被检出,即硝化螺旋菌属(Nitrospira)、Pseudolabrys和生丝微菌属(Hyphomicrobium).硝化螺旋菌属可将亚硝酸盐氧化成硝酸盐,而来自3个OTUs中的49个克隆子属于硝化螺旋菌属,OTU1中的代表性序列ZC39和OTU5中的代表性序列ZC48的最相似的分离菌也都来自硝化反应器[11-12],因而也间接解释了锰砂滤池能高效去除氨氮并且出水中亚硝酸氮低于检测限的原因.de Vet等也发现硝化螺旋菌属是一个生产性地下水砂滤池中惟一的亚硝酸盐氧化菌[1].如果需要进一步研究氨氧化细菌去除氨氮的机制,则将来可以设计专门的引物进行检测[7].生丝微菌属(Hyphomicrobium)是常见的锰氧化细菌[13],而它的存在说明滤池中锰氧化细菌都可能对锰的去除起了重要作用.生丝微菌属是异养细菌,与自养性的硝化螺菌相比,生长相对较快,因而在硝化生物滤池中仍能生长.硝化螺旋菌属和生丝微菌属的共存解释了硝化滤池内生物除锰的可行性.然而,本文并没有发现锰砂滤池中与铁氧化有关的细菌.这说明该工艺中铁氧化主要由曝气作用完成,微生物发挥的作用可以忽略.
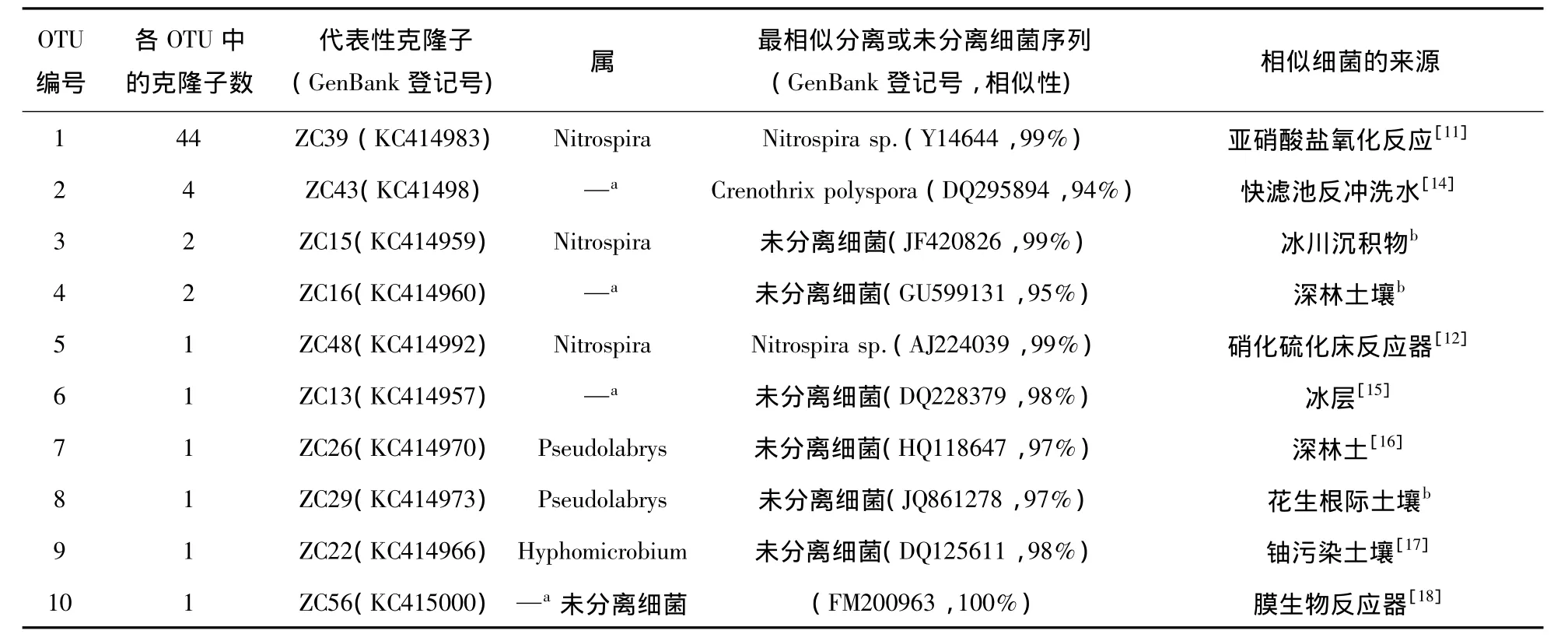
表1 克隆文库中克隆序列分类和数量
3 结语
郑州市东周水厂的生产性锰砂滤池填料上附着的细菌群落多样性较低,而硝化螺旋菌门是优势菌.锰砂滤料上检测出了硝化螺旋菌属、Pseudolabrys和生丝微菌属.硝化螺旋菌属和生丝微菌属的共存解释了硝化滤池内生物除锰的可行性,但没有检测出锰砂滤池中与铁氧化有关的细菌.
[1]DE VET W W J M,DINKLA I J T,MUYZER G,et al.Molecular characterization of microbial populations in groundwater sources and sand filters for drinking water production[J].Water Research,2009,43(1):182-194.
[2]李灿波.溶解氧对含氨氮地下水生物除铁除锰效果的影响[J].供水技术,2009,3(3):16-18.
[3]李 冬,曾辉平,张 杰.高铁锰氨氮伴生地下水生物深度净化的工程实践[J].给水排水,2011,37(9):11-16.
[4]LIAO X B,CHEN C,CHANG C-H,et al.Heterogeneity of microbial community structures inside the up-flow biological activated carbon(BAC)filters for the treatment of drinking water[J].Biotechnology and Bioprocess Engineering,2012,17(4):881-886.
[5]NIEMI R M,HEISKANEN I,HEINE R,et al.Previously uncultured β-Proteobacteria dominate in biologically active granular activated carbon(BAC)filters[J].Water Research,2009,43:5075-5086.
[6]ZHANG X X,ZHANG Z Y,MA L P,et al.Influences of hydraulic loading rate on SVOC removal and microbial community structure in drinking water treatment biofilters[J].Journal of Hazardous Materials,2010,178:652 -657.
[7]FENG S,ZHANNG X J,WANG Q F,et al.Heterogeneity of ammonia-oxidizing community structures in a pilot-scale drinking water biofilter[J].International Biodeterioration &Biodegradation,2012,70:148-152.
[8]LIAO X B,CHEN C,WANG Z,et al.Changes of biomass and bacterial communities in biological activated carbon filters for drinking water treatment[J].Process Biochemistry,2013,DOI:10.1016/j.procbio.2012,12.016.
[9]LI X,UPADHYAYA G,YUEN W,et al.Changes in the structure and function of microbial communities in drinking water treatment bioreactors upon addition of phosphorus[J].Applied and Environmental Microbiology,2010,76:7473-7481.
[10]邹 莉,黄 艺,谢曙光.武进港浮游微生物群落研究[J].北京大学学报:自然科学版,2011,47(3):513-518.
[11]BURRELL P C,KELLER J,BLACKALL L L.Microbiology of a nitrite-oxidizing bioreactor[J].Applied and Environmental Microbiology 1998,64(5):1878-1883.
[12]SCHRAMM A,DE BEER D,WAGNER M,et al.Identification and activities in situ of Nitrosospira and Nitrospira spp.as dominant populations in a nitrifying fluidized bed reactor[J].Applied and Environmental Microbiology,1998,64(9):3480-3485.
[13]FERRIS F G,KONHAUSER K O,LYVEN B,et al.Accumulation of metals by bacteriogenic iron oxides in a subterranean environment[J].Geomicrobiology Journal,1999,16(2):181-192.
[14]STOECKER K,BENDINGER B,SCHONING B,et al.Cohn's Crenothrix is a filamentous methane oxidizer with an unusual methane monooxygenase[J].Proceedings of The National A-cademy of Sciences of the United States of America,2006,103(7):2363-2367.
[15]SKIDMORE M,ANDERSON S P,SHARP M,et al.Comparison of microbial community compositions of two subglacial environments reveals a possible role for microbes in chemical weathering processes[J].Applied and Environmental Microbiology,2005,71(11):6986-6997.
[16]WILLIAMSON K E,KAN J,POLSON S W,et al.Optimizing the indirect extraction of prokaryotic DNA from soils[J].Soil Biology & Biochemistry,2011,43(4):736 -748.
[17]BRODIE E L,DE SANTIS T Z,JOYNER D C,et al.Application of a high-density oligonucleotide microarray approach to study bacterial population dynamics during uranium reduction and reoxidation[J].Applied and Environmental Microbiology,2006,72(9):6288-6298.
[18]HUANG L N,DE WEVER H,DIELS L.Diverse and distinct bacterial communities induced biofilm fouling in membrane bioreactors operated under different conditions[J].Environmental Science& Technology,2008,42(22):8360-8366.

