FK1706促进外周神经移植术后大鼠神经轴突再生的研究*
肖毓华 徐 杰
FK1706促进外周神经移植术后大鼠神经轴突再生的研究*
肖毓华①徐杰①
目的:探讨FK1706是否能够促进外周神经移植术后大鼠神经轴突再生。方法:20只雄性SD大鼠,行左侧坐骨神经离断、自体桡神经移植术。术后随机分为两组,A组术后当天开始患肢局部肌肉注射FK1706(0.32 mg/kg),持续8周。B组作为对照组不施加干预,仅常规喂养。术后8周,行大鼠左坐骨神经再生有髓神经纤维数及截面积测定、神经电生理检测、左腓肠肌肌湿重测定。结果:A组近端有髓神经纤维数与B组比较差异无统计学意义(P>0.05),但远端有髓神经纤维数、远端纤维截面积明显优于B组,差异有统计学意义(P<0.01)。A组再生有髓神经纤维的髓鞘厚度(mt)及直径比(d/D)明显优于B组,差异有统计学意义(P<0.05)。A组复合运动动作电位(CMAP)、运动神经传导速度(MNCV)及腓肠肌肌湿重明显优于B组,差异有统计学意义(P<0.01)。结论:大鼠坐骨神经移植术后应用FK1706具有神经营养作用,可加快神经功能的恢复。
FK1706; 营养神经; 自体神经移植; 神经再生
First-author's address:Fujian Provincial Hospital,Fuzhou 350001,China
doi:10.3969/j.issn.1674-4985.2015.27.005
用移植神经的方法桥接缺损治疗周围神经完全损伤,临床上称神经移植术。人类周围神经的再生速度慢,神经修复效果欠佳,临床上希望找到一种能够显著促进神经再生的药物。
1998年国外首例异体手移植成功[1],发现用于抗异体免疫排斥的药物FK506对神经的再生有明显的促进作用,异体手移植的神经功能恢复显著优于自体断手再植[2]。基础研究证实免疫抑制剂FK506对神经有再生及保护作用[3],但其具有的免疫抑制的毒副作用限制了其在临床神经修复中的应用。FK1706为FK506衍生物,是一种非免疫抑制剂。有国外研究显示,FK1706有可能促进促使轴突生长的基因表达[4]。本实验通过建立大鼠坐骨神经损伤神经移植模型,术后应用FK1706,探讨其对神经再生的促进作用。
1 材料与方法
1.1试剂 二甲基亚砜:日本sigma-D2650;FK1706:南京大学医药生物技术实验室合成;药液配置:用电子分析天平称取FK1706粉末0.0560 g,盛于干净烧杯中,用移液管吸取56 mL二甲基亚砜溶液放入烧杯中,充分搅拌直至完全溶解,然后将溶液移入试剂瓶中,标记为FK1706溶液,4 ℃冰箱保存备用。
1.2神经移植模型制备 以质量浓度为2.5%的苯巴比妥钠(40 mg/kg)行腹腔麻醉后,术区常规备皮消毒,将大鼠仰卧位固定,取左侧桡神经10 mm备用。改俯卧位固定,取左侧臀部斜形切口长约2 cm,钝性分离肌肉,于梨状肌下显露坐骨神经主干,用玻璃分针小心将周围组织与坐骨神经主干进行钝性分离。于梨状肌下0.5 cm处,用刀片整齐切除8 mm长的坐骨神经。在放大10倍的手术显微镜下,用11-0无损伤缝合线将桡神经与坐骨神经两断端分别行端端吻合,两个吻合处均缝4~6针,彻底止血后关闭切口。建立自体神经移植模型,见图1。
图1 神经移植模型示意图
1.3实验动物与分组 成年雄性健康SD大鼠20只,体重250~300 g[由福建医科大学实验动物研究中心提供,许可证号:SCXK(闽)2012-0001],随机分成实验组(FK1706组)和对照组,每组10只,并用苦味酸进行标记。所有大鼠均采用专门鼠笼分笼管理,全价营养颗粒饲料喂养,由专人统一饲养,隔日更换垫料,水和食物无限制供给,饲养环境维持室温20 ℃。实验过程中对动物的处置符合科学技术部2006年发布的《关于善待实验动物的指导性意见的要求》[5]。术后大鼠分笼,在相同条件下饲养,自然苏醒,并于术后当天开始,实验组大鼠每日1次,于左大腿外侧肌肉注射FK1706溶液0.32 mg/kg,连续给药直至术后8周。对照组神经移植术后不做干预,常规喂养。
1.4观察指标与方法 神经电生理测定:术后8周应用Medtronic Keypoint肌电/诱发电位仪对实验动物进行坐骨神经电生理检测。以质量浓度为2.5%的苯巴比妥钠(40 mg/kg)对大鼠实施腹腔麻醉,取俯卧位固定,术区常规备皮消毒,显露大鼠左侧坐骨神经,并解剖出腓肠肌,将针形记录电极插入腓肠肌肌腹,接地电极置于大鼠尾部。以平行刺激电极(两极间距固定为2 mm)分别置于坐骨神经吻合口近端坐骨结节水平(P点)和远端坐骨神经分支处(D点),进行超强刺激(电流10 mA),重复刺激数次,待示波器屏幕显示的诱发电位图形稳定、起点清楚后冻结图形,记录复合运动动作电位(Compound Motor Action Potential,CMAP),并测定其波幅,用游标卡尺测量并输入刺激电极间距离,计算出运动神经传导速度(Motor Nerve Conduction Velocity, MNCV)。MNCV=两次刺激电极间距离/动作电位潜伏期差值。整个电生理检测过程均在28 ℃室温下进行,并经常用生理盐水保持受检肌肉处于湿润状态。
有髓神经纤维数与截面积:肌电图检查完毕后,于坐骨神经近近端吻合口3 mm、远远端吻合口3 mm处取材(大小约2~3 mm)。以质量分数为10%的福尔马林固定,切片厚0.5 μm,HE染色。用Olympus光学显微镜,在放大400倍的视野下,计算有髓神经纤维总数。用TJTY-300图像分析仪,在目镜放大40倍、定标值为0.38 μm/象数的条件下测定有髓神经纤维截面积。规定1条过中心的直线,测定此直线上有髓神经纤维的截面积。
再生有髓神经纤维的髓鞘厚度(mt)及直径比(d/D):于坐骨神经近近端吻合口3 mm、远远端吻合口3 mm处及移植神经的中点处取材(大小约2~3 mm)。取材后,于4 ℃环境下,先经3%戊二醛-1.5%多聚甲醛前固定24 h,再用1%锇酸-1.5%亚铁氰化钾后固定1.5 h,PBS漂洗;70%酒精饱和醋酸铀染液块染,酒精-丙酮梯度脱水,环氧树脂618包埋剂包埋。超薄切片80 nm,醋酸铀、柠檬酸铅各染色5 min;在飞利浦EM 208型透射电镜下观察、摄影。每个标本在放大1000倍的条件下,随机选取3个视野拍摄照片。用TJTY-300图像分析仪,在目镜放大40倍、定标值为0.38 μm/象数的条件下测定椭圆髓鞘的内径(ai、bi)、外径(ao、bo),内周长(Pi)、外周长(Po),内面积(Ai)、外面积(Ao)。根据下列公式(图2)计算有髓神经纤维的髓鞘厚度(mt)和轴突纤维的直径比(d/D)[8]。
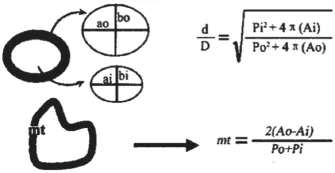
图2 mt和d/D的计算公式
肌湿重:钝性分离肌肉,完整取下大鼠左侧的腓肠肌,剔除表面结缔组织,即刻置于Sartorius-BS224S电子分析天平上称重,测定肌肉湿重。
1.5统计学处理 采用计算机软件SPSS 17.0对数据进行统计分析,计量资料以(x-±s)表示,采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1一般情况 由于麻醉意外死亡2只,及时补齐总数。建立模型动物均于术后2 h内完全苏醒,围手术期存活率100%,实验大鼠切口愈合良好,无切口感染情况发生。实验观察期间各组大鼠进食及健康状况良好。
2.2两组神经电生理测定结果比较 术后8周,与对照组相比,FK1706组CMAP的波幅明显较高,运动神经传导速度更快,差异具有统计学意义(P<0.05),见表1。
表1 两组神经电生理结果比较(±s)

表1 两组神经电生理结果比较(±s)
组别CMAP波幅(mV)MNCV(m/s)实验组(n=10)7.34±1.226.07±0.95对照组(n=10)6.07±1.183.78±0.46 t值2.3576.808 P值0.030<0.001
2.3两组有髓神经纤维数与截面积比较 坐骨神经远端吻合口处,实验组再生有髓神经纤维数及截面积情况明显优于对照组,差异具有统计学意义(P<0.05),见表2。
表2 两组有髓神经纤维数及横截面积比较(±s)
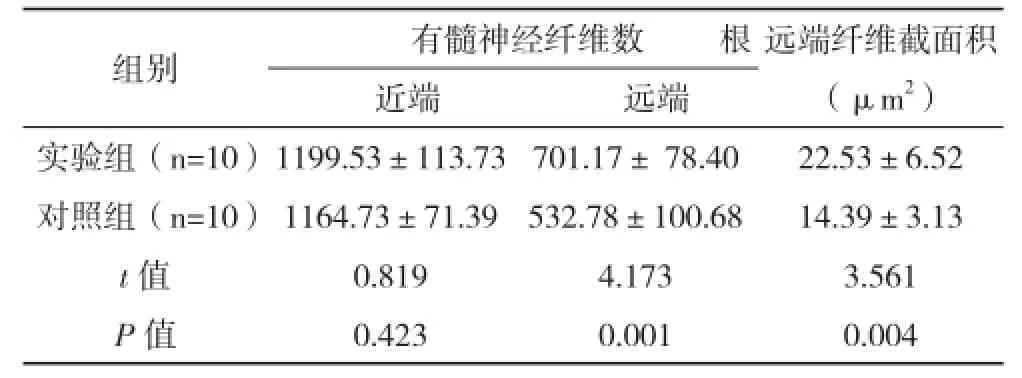
表2 两组有髓神经纤维数及横截面积比较(±s)
组别 有髓神经纤维数 根远端纤维截面积(μm2)近端 远端实验组(n=10)1199.53±113.73 701.17± 78.4022.53±6.52对照组(n=10)1164.73±71.39532.78±100.6814.39±3.13 t值0.8194.1733.561 P值0.4230.0010.004
2.4两组电镜观察结果比较 在透视电镜下,观察到坐骨神经近近端吻合口、远远端吻合口处以及移植神经中点处实验组的再生有髓纤维数量较多而粗大,排列较整齐有序,结构清晰,结缔组织含量少,对照组再生有髓纤维数量较少而纤细,排列较稀疏,结缔组织增生。两组间再生有髓神经纤维的髓鞘厚度与d/D比值差异具有统计学意义(P<0.05),见表3。
表3 两组电镜观察结果比较(±s)
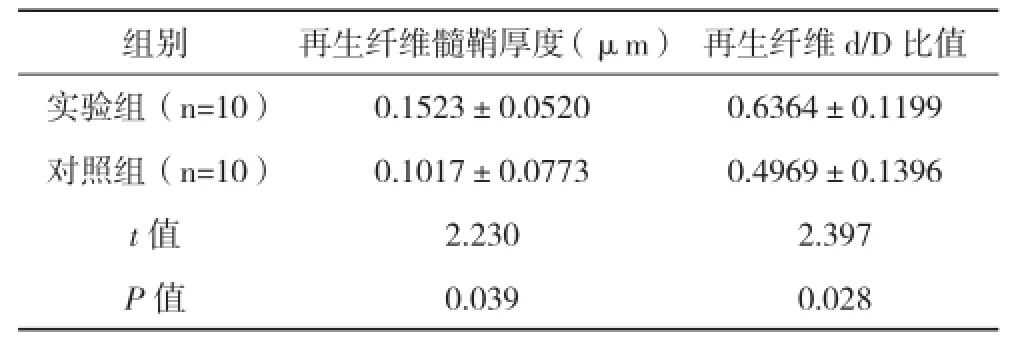
表3 两组电镜观察结果比较(±s)
组别再生纤维髓鞘厚度(μm)再生纤维d/D比值实验组(n=10)0.1523±0.05200.6364±0.1199对照组(n=10)0.1017±0.07730.4969±0.1396 t值2.2302.397 P值0.0390.028
2.5两组肌湿重比较 术后8周,实验组腓肠肌肌湿重为(805.91±98.82)mg,重于对照组的(702.26±78.46)mg,组间比较差异具有统计学意义(t=2.598,P<0.05)。
3 讨论
周围神经损伤后的功能恢复受到年龄、神经损伤平面、损伤神经及其类型、神经损伤机制与程度、神经修复时机、神经修复技术、合并损伤、术后处理及康复训练等一系列因素的影响[6]。譬如,从损伤到对去神经肌肉实现神经重建之间耽误的时间,对于功能恢复具有重要的影响[7]。许多因素决定了延误时间的长短,包括损伤后开始接受治疗干预的时间、损伤部位到去神经肌肉之间的距离和神经轴突的再生速度。轴突的再生速度大约是每日1~3 mm[8-9]。以临床为例,上肢神经损伤后需要再生距离通常是10~70 cm,以轴突延长的速度来计算,神经再生所需的时间高达24个月。而Mackinnon等[10]在临床工作中发现,远端肌肉所能承受最长的去神经时限仅是12个月。而恢复时间延长又可降低恢复的质量,因而外周神经损伤后修复一直是外科棘手的难题。
迄今为止,FK506是唯一表现出持续的加速神经再生作用的治疗手段[11]。其已被证实在一系列中枢神经和周围神经损伤模型中发挥加速神经再生和功能恢复的疗效[12-20]。但由于其免疫抑制功效,限制了其临床长期应用。合成的FK1706在保留了FK506的促进神经修复再生特性的同时,去除了免疫抑制的副作用,使其具有广阔的临床前景。
非免疫抑制的免疫亲和素FK1706具有神经生长和神经保护功能的化合物,其合成的前身是免疫抑制剂FK506,目前针对其主要作用的两种免疫亲和配体FKBP-12和FKBP-52的研究众多。周围神经损伤后,神经生长相关蛋白-43(GAP-43)含量可增加20~100倍[21]。神经生长相关蛋白-43(GAP-43)的活性增加,可促使神经再生。既往研究发现,FK506进入细胞内,与胞浆中的FKBP-12相结合,形成FK506-FKBP12复合物,该复合物可通过抑制对神经生长相关蛋白-43(GAP-43)具有抑制作用的神经钙蛋白(CaN)[22],进而发挥促进神经生长的功效。也有观点认为,抑制神经钙蛋白(CaN)活性,也是发挥其免疫抑制功效的开始,这一说法尚未得到证实,但是抑制神经钙蛋白(CaN)活性,确实具有促进神经生长的作用。目前研究认为,FKBP-12存在两种结合配体,分别具有和不具有抑制神经钙蛋白(CaN)活性的作用,而限制神经钙蛋白(CaN)的磷脂酶活性,可能对FK506发挥神经保护作用影响重大。Udina等[23]通过胫神经挤压和横断模型,认为无CaN抑制活性的非免疫抑制免疫亲和素V-10367并不具备促进损伤后胫神经再生修复功能,Udina等[24]在对另一种无CaN抑制活性的非免疫抑制免疫亲和素GPI-1046的研究中,也得出了相同的结果,并认为其不具备神经保护作用。
FK1706对于FKBP-12和FKBP-52两种FKBP亚型具有基本相似的高亲和力,其与FKBP-12结合形成的复合物是否具有抑制CaN的活性,尚无研究证据支持。但在抑制T细胞增殖和白介素-2合成方面,与FK506相比,却仅有相当微弱的功效,或者说至少在促进神经轴突生长的剂量范围内,并没有出现免疫抑制的情况。FK1706是否具有抑制CaN的活性尚不明确,而FK1706的促进神经生长的功效又有广大实验研究证据支持,因此笔者推断,如果FK1706具有抑制CaN的活性,则抑制CaN的活性与发挥免疫抑制功效无必然关联,如果FK1706不具有抑制CaN的活性,则其所具备的促进神经生长作用可能通过其他机制实现。
目前研究发现,FK1706的神经生长作用可能是通过与FKBP-52结合并活化下游Ras/Raf/丝裂原活化蛋白激酶(MAPK)信号转导通路,引起神经生长因子(NGF)介导的神经轴突生长来实现的[25],但FKBP-52和神经生长因子(NGF)信号转导通路之间的衔接点尚未明确。FK1706的促进神经损伤修复再生的功效不仅呈现剂量依赖性,并且有良好的治疗时间窗。
在剂量与给药途径的选择上,Yamaji等[25]曾就长期应用FK1706对大鼠脊髓挫伤后运动功能恢复的治疗效果进行研究,通过每日单次肌肉注射FK1706,连续给予29 d,通过倾斜平板试验评价其对运动功能障碍的改善情况。该研究不仅发现,FK1706能显著提高脊髓挫伤后大鼠在倾斜平板试验中的得分,还通过分组给予不同治疗剂量FK1706,观察FK1706对脊髓挫伤后大鼠运动功能恢复的量效关系。
本实验研究对坐骨神经损伤大鼠进行桡神经移植,术后给予FK1706局部肌肉注射,连续治疗8周。在术后8周时,FK1706组坐骨神经电生理功能检测结果明显优于对照组,并且在神经肌肉结构方面也有显著改善,主要表现在腓肠肌肌湿重、远端有髓神经纤维数目等方面均有所增加。因此,FK1706不仅有利于能显著改善神经移植动物术后神经电生理功能,在对于相关神经结构损伤修复,如增加有髓神经纤维数目和横截面积以及腓肠肌肌湿重等,也同样有效。
然而笔者也观察到,远端神经轴突的再生情况仍有些不满意,原因可能有:(1)给药剂量;(2)给药方式与时间;(3)观察的时间点。今后研究中将更加关注药物浓度对效果的影响,以及选择合适的给药方式与观察的时间点。
本实验研究证实了,FK1706能显著促进神经移植动物术后神经再生,为FK1706可能作为一种潜在的显著促神经再生作用药物用于周围神经损伤提供了实验依据。
[1] Dubermard J M,Owen E,Herzberg G,etal. Human hand allograft:Report on first 6 months[J].Lancet,1999,353 (9161):1315-1320.
[2]裴国献,顾立强.异体手移植两例报告[J].中华医学杂志,2000,80(6):417-421.
[3] Minematsu T,Lee J,Zha J,etal.Time-dependent inhibitory effects of (1R,9S,12S,13R,14S,17R,18E,21S,23S,24R,25S,27R)-1,14-dihydroxy-12-(E)-2-[(1R,3R,4 )-4-hydroxy-3-methoxycyclohexyl]-1-methylvinyl-23,25-dimethoxy-13,19,21,27-tetramethyl-17-(2-oxopropyl)-11,28-dioxa-4-azatricyclo[22.3.1.0(4.9)]octacos-18-ene-2, 3,10,16-tetrone (FK1706), a novel nonimmunosuppressive immunophilin ligand, on CYP3A4/5 activity in humans in vivo and in vitro[J]. Drug Metab Dispos, 2010,38(2):249-259.
[4] Yamazaki S,Yamaji T,Murai N,etal.FK1706,a novel nonimmunosuppressive immunophilin ligand, modifies the course of painful diabetic neuropathy[J].Neuropharmacology,2008,55(7):1226-1230.
[5]科技部.关于善待实验动物的指导性意见[J].[2011-07-09]. http:// wenku.baidu.com/view/c4042a8a84868762caaed585.html, 2006.
[6] Goto T,Kino T,Hatanaka H,etal.Discovery of FK-506,a novel immunosuppressant isolated from Streptomyces tsukubaensis[C]. Transplantation Proceedings,1987,19(5 Suppl 6):4.
[7] Kobayashi J,Mackinnon S E,Watanabe O,etal.The effect of duration of muscle denervation on functional recovery in the ratmodel[J].Muscle & Nerve,1997,20(7):858-866.
[8] Gutmann E,Guttmann L,Medawar P B,etal.The rate of regeneration of nerve[J].Journal of Experimental Biology, 1942,19 (1):14-44.
[9] Pan Y A,Misgeld T,Lichtman J W,etal. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo[J].The Journal of Neuroscience,2003,23 (36):11 479-11 488.
[10] Mackinnon S E,Dellon A L.Surgery of the peripheral nerve[M].New York: Thieme Medical Publishers, 1988.
[11] Yan Y, Sun H H, Hunter D A, etal. Efficacy of short-term FK506 administration on accelerating nerve regeneration[J]. Neurorehabilitation and Neural Repair, 2012, 26(6): 570-580.
[12] Chabas J F, Alluin O, Rao G, etal. FK506 induces changes in muscle properties and promotes metabosensitive nerve fiber regeneration[J]. Journal of Neurotrauma, 2009, 26(1): 97-108.
[13] Gold B G,Katoh K,Storm-Dickerson T.The immunosuppressant FK506 increases the rate of axonal regeneration in rat sciatic nerve[J]. The Journal of Neuroscience,1995,15(11): 7509-7516.
[14] Jensen J N, Brenner M J, Tung T H, etal. Effect of FK506 on peripheral nerve regeneration through long grafts in inbred swine[J]. Annals of Plastic Surgery, 2005, 54(4): 420-427.
[15] Jost S C, Doolabh V B, Mackinnon S E, etal. Acceleration of peripheral nerve regeneration following FK506 administration[J]. Restorative Neurology and Neuroscience, 2000,17(1):39-44.
[16] Lee M, Doolabh V B, Mackinnon S E, etal.FK506 promotes functional recovery in crushed rat sciatic nerve[J].Muscle & Nerve,2000, 23(4): 633-640.
[17] Sobol J B, Lowe Iii J B, Yang R K, etal. Effects of delaying FK506 administration on neuroregeneration in a rodent model[J]. Journal of Reconstructive Microsurgery, 2003, 19(02): 113-118.
[18] Sulaiman O A R, Voda J, Gold B G, etal. FK506 increases peripheral nerve regeneration after chronic axotomy but not after chronic Schwann cell denervation[J].Experimental Neurology,2002,175(1):127-137.
[19] Udina E, Ceballos D, Gold B G, etal. FK506 enhances reinnervation by regeneration and by collateral sprouting of peripheral nerve fibers[J]. Experimental Neurology, 2003, 183(1): 220-231.
[20] Yang R K, Lowe Ⅲ J B, Sobol J B, etal. Dose-dependent effects of FK506 on neuroregeneration in a rat model[J]. Plastic and Reconstructive Surgery, 2003, 112(7): 1832-1840.
[21] 许建中, 李起鸿. 生长相关蛋白-43 与周围神经损伤及再生[J].中华创伤杂志, 1999, 15(5):391-392.
[22] Dawson T M,Steiner J P,Lyons W E,etal.The immunophilins,FK506 binding protein and cyclophilin, are discretely localized in the brain: relationship to calcineurin[J]. Neuroscience, 1994, 62(2):569-580.
[23] Udina E, Rodr í guez F J, Verdú E, etal.FK506 enhances regeneration of axons across long peripheral nerve gaps repaired with collagen guides seeded with allogeneic Schwann cells[J].Glia,2004,47(2):120-129.
[24] Udina E, Verdú E, Navarro X. Effects of the immunophilin ligand FK506 on nerve regeneration in collagen guides seeded with Schwann cells in rats[J]. Neuroscience Letters, 2004, 357(2): 99-102.
[25] Yamaji T, Yamazaki S, Li J, etal. FK1706,a novel nonimmunosuppressant neurophilin ligand, ameliorates motor dysfunction following spinal cord injury through its neuroregenerative action[J].European Journal of Pharmacology, 2008, 591(1): 147-152.
The Study of FK 1706 on Promoting the Axon Regeneration of Peripheral Nerves for Rats after Neural Transplantation
/XIAO Yu-hua,XU J ie.//Medical Innovation of China,2015,12(27):016-020
Objective:To investigate whether FK1706 can promote the axon regeneration of peripheral nerve for rats after neural transplantation.Method:20 male SD rats were randomly assigned into two groups after they were performed with left sciatic nerve transection and autologous radial nerve grafting.Group A received FK1706 (0.32 mg/kg) local intramuscular injected once a day on left lower limb for 8 weeks, while Group B as control were routinely fed without special intervention. Electrophysiological studies of left sciatic nerve were performed.The number and area of the regenerated myelinated nerve fiber in cross section pane, and wet muscle weight of the left gastrocnemius muscle were measured,respectively,at 8 weeks after operation.Result:The number of myelinated nerve fiber in proximal end, two groups has no significant difference in statistic (P>0.05), however, in distal end,number of myelinated nerve fiber in Group A was significantly higher than in Group B(P<0.01). The thickness of myelin sheath (mt) of the myelinated nerve fiber, and the ratio that bare axon diameter divided by the total fiber diameter (d/D) were more favorable in Group A than the other, which difference has statistical significance(P<0.05).The wet muscle weight of left gastrocnemius muscle, as well as the compound motor action potential (CMAP) amplitude and motor nerve conduction velocity (MNCV) in Group A,were much better than in Group B,with significant differences (P<0.01).Conclusion:FK1706 has neurotrophy effect that,significantly promote neuroregeneration in rats after autologous nerve transplantation repairing surgery.
FK1706; Neurotrophy; Nerve autograft; Neuroregeneration
福建省卫生厅中青年骨干人才项目(2013-ZQNZD-1)
①福建省立医院 福建 福州 350001
徐杰
(2015-07-03) (本文编辑:陈丹云)

