-15℃下Na+,K+,Mg2+//Cl-,-H2O体系相平衡
朱巧丽,黄雪莉
(新疆煤炭洁净转化与化工过程重点实验室,新疆大学化学化工学院,新疆 乌鲁木齐 830046)
引 言
Na+,K+,Mg2+//Cl-,-H2O 体系是一个典型的硫酸盐水盐体系,海水、新疆罗布泊及玛纳斯盐湖、青藏高原的一些盐湖的主要成分都属于该体系,研究其基础数据意义重大。常温下该体系稳定相平衡关系已有大量研究,成果纂成手册[1-2];Teeple 等[3-7]还对不同温度下的介稳情况作了研究。在盐湖开发过程中,通常是利用丰富的太阳能和风能对盐田进行自然蒸发,但代价是大量水的散失,这对干旱缺水地区是一个巨大的损失。应指出的是夏季高温是一种自然能量,而冬季低温同样是一种可利用的能量资源。一些地区冬季寒冷漫长,可充分利用其低温能量,实现盐湖化学成分的无蒸发或小蒸发量分离,既可以获得目标产品,又在某种程度上淡化了卤水,对干旱缺水地区意义重大,因此研究低温下卤水体系的物理化学性质是非常必要的。Ringer 等[8-13]对海水冷冻进行了研究。此外,科研人员还研究了盐湖卤水低温淡化和含盐量较高废水的低温处理技术。高世扬等[14]研究了含硼浓缩盐卤在冷冻条件下析出的盐类;乌志明等[15]进行了模拟卤水实验室冷冻和自然冷冻、自然冷冻和融化的对比实验;张永生等[16]以西藏高原扎布耶盐湖冬季富锂卤水为对象,现场实验研究了在一系列冷冻温度下卤水的组成演变规律;李青海等[17]研究了南翼山油田卤水低温结晶过程。低温液固相平衡规律是研究低温下卤水的组成演变、盐类结晶路线的基础,但目前,对各种水盐体系的低温相平衡研究报道很少,其中Na+,K+,Mg2+//Cl-,-H2O 体系在-10℃以下卤水的相平衡关系和成盐规律尚未见相关研究报道。本文采用等温溶解平衡法[18]研究了-15℃时Na+,K+,Mg2+//Cl-,-H2O 体系的相平衡关系,并研究不同组成的卤水在降温过程中的析盐规律,为开发卤水低温加工工艺提供新思路和依据。
1 实验部分
1.1 实验仪器与试剂
仪器:低温恒温搅拌反应浴(DHJF-4010)(控温精度±0.2 ,℃用精密温度计校验),X 射线衍射仪(D8)。试剂均为分析纯或基准试剂。
1.2 实验方法
1.2.1-15℃下Na+,K+,Mg2+//Cl-,-H2O 体系液固相平衡实验研究 采用等温溶解平衡法,即以同温度下次级体系的共饱点为基准,加入另外一种盐,计算出合适的物料和水的比例,据此在常温下配制样品于烧瓶中,置于低温恒温搅拌反应浴中不断搅拌以达平衡。平衡时间通过预实验确定。平衡后用特定的取样器取液相进行化学分析;平衡固相通过体式显微镜或X衍射以及参考文献结论等方法综合确定;平衡液相密度采用比重瓶法测得。预实验是配制数组代表性样品,按照上述实验过程,定期取上层清液进行化学分析,以其化学组成不变作为达到平衡的标志,由此确定平衡时间为24 h。通过不断减少实验点中加入的水量,使体系的平衡液相组成逐渐靠近四盐共饱点。
为检验实验装置及实验方法的可靠性,重复测定了-15℃下Na+,Mg2+//Cl-,-H2O 、Na+,K+,Mg// Cl--H2O两个四元体系中三盐共饱点,实验结果表明,实验结果与文献值[2,19]相吻合。
为确定NaCl、MgCl2在-15℃的析出形式,分别对纯NaCl、MgCl2在-15℃下析出的固相进行化学分析,确定 NaCl、MgCl2在-15℃下分别以NaCl·2H2O、MgCl2·8H2O 的形式析出。依据纯物质的析出形式和大量的文献数据可判断混合物中NaCl、MgCl2在-15℃下分别以 NaCl·2H2O、MgCl2·8H2O 的形式析出。
1.2.2 典型硫酸盐卤水降温过程研究 本文针对有代表性的硫酸盐型盐湖如新疆的罗布泊和玛纳斯盐湖及青海东台吉尔乃盐湖,依据其组成配制溶液,在冬季置于自然环境中进行降温实验,每隔15 min搅拌一次。当温度降到指定温度时用取样器取上层清液进行分析,并分离固相进行鉴别。
1.3 分析方法
Mg2+采用EDTA 容量法;Cl-采用硝酸银容量法;K+采用四苯硼钠重量法;Na+采用差减法;采用比浊法;固相鉴定采用体式显微镜或X 射线晶体衍射法。
2 结果与讨论
2.1-15℃ Na+,K+,Mg2+//Cl-,-H 2O 体系液固相平衡实验研究
五元体系Na+,K+,Mg2+//Cl-,-H2O 在-15℃、NaCl·2H2O 饱和条件下的平衡液相组成数据及密度见表1(氯化钠、氯化镁的析出形式鉴定困难,依据纯物质在-15℃的析出形式及文献[1-2],推断其分别为2、8 水合物),并列出相应的Jänecke指数。据此绘制出相应的干盐图、水图、氯图及密度-组成图见图1~图4。为比较不同温度下的相平衡关系变化,依据文献数据[19],将25℃、0℃、-15℃的干盐图同时绘制于图5中。
表1 -15℃下NaCl·2H2O 饱和时Na+,K+,Mg2+//Cl-,H 2O 体系的溶解度Table 1 Solubilities of Na+,K+,Mg2+//Cl-,-H 2O system under saturation of NaCl·2H2O at -15℃
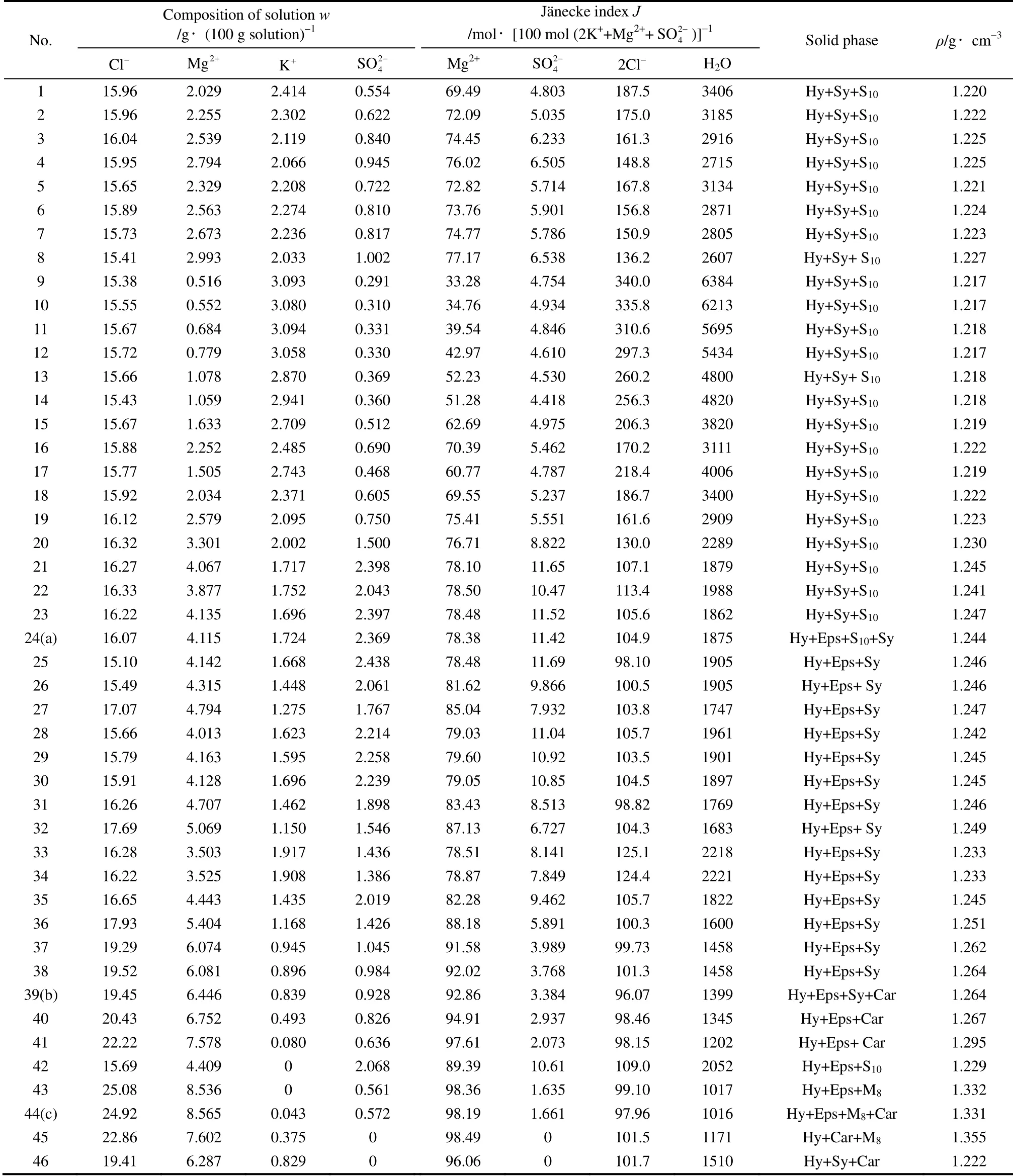
表1 -15℃下NaCl·2H2O 饱和时Na+,K+,Mg2+//Cl-,H 2O 体系的溶解度Table 1 Solubilities of Na+,K+,Mg2+//Cl-,-H 2O system under saturation of NaCl·2H2O at -15℃
Note:Hy—NaCl·2H2O; Sy—KCl; S10-Na2SO4·10H2O; Eps—MgSO4·7H2O; Car—KCl·MgCl2·6H2O; M8—MgCl2·8H2O; a,b,c—invariant points.
No.Composition of solution w /g·(100 g solution)-1 Jänecke index J /mol·[100 mol (2K++Mg2++ 2 SO-)]-1 Solid phase ρ/g·cm-3 4 Cl- 2 SO - Mg2+ 2 Mg + K+ 2 4 SO - 2Cl- H2O 4 1 15.96 2.029 2.414 0.554 69.49 4.803 187.5 3406 Hy+Sy+S10 1.220 2 15.96 2.255 2.302 0.622 72.09 5.035 175.0 3185 Hy+Sy+S10 1.222 3 16.04 2.539 2.119 0.840 74.45 6.233 161.3 2916 Hy+Sy+S10 1.225 4 15.95 2.794 2.066 0.945 76.02 6.505 148.8 2715 Hy+Sy+S10 1.225 5 15.65 2.329 2.208 0.722 72.82 5.714 167.8 3134 Hy+Sy+S10 1.221 6 15.89 2.563 2.274 0.810 73.76 5.901 156.8 2871 Hy+Sy+S10 1.224 7 15.73 2.673 2.236 0.817 74.77 5.786 150.9 2805 Hy+Sy+S10 1.223 8 15.41 2.993 2.033 1.002 77.17 6.538 136.2 2607 Hy+Sy+ S10 1.227 9 15.38 0.516 3.093 0.291 33.28 4.754 340.0 6384 Hy+Sy+S10 1.217 10 15.55 0.552 3.080 0.310 34.76 4.934 335.8 6213 Hy+Sy+S10 1.217 11 15.67 0.684 3.094 0.331 39.54 4.846 310.6 5695 Hy+Sy+S10 1.218 12 15.72 0.779 3.058 0.330 42.97 4.610 297.3 5434 Hy+Sy+S10 1.217 13 15.66 1.078 2.870 0.369 52.23 4.530 260.2 4800 Hy+Sy+ S10 1.218 14 15.43 1.059 2.941 0.360 51.28 4.418 256.3 4820 Hy+Sy+S10 1.218 15 15.67 1.633 2.709 0.512 62.69 4.975 206.3 3820 Hy+Sy+S10 1.219 16 15.88 2.252 2.485 0.690 70.39 5.462 170.2 3111 Hy+Sy+S10 1.222 17 15.77 1.505 2.743 0.468 60.77 4.787 218.4 4006 Hy+Sy+S10 1.219 18 15.92 2.034 2.371 0.605 69.55 5.237 186.7 3400 Hy+Sy+S10 1.222 19 16.12 2.579 2.095 0.750 75.41 5.551 161.6 2909 Hy+Sy+S10 1.223 20 16.32 3.301 2.002 1.500 76.71 8.822 130.0 2289 Hy+Sy+S10 1.230 21 16.27 4.067 1.717 2.398 78.10 11.65 107.1 1879 Hy+Sy+S10 1.245 22 16.33 3.877 1.752 2.043 78.50 10.47 113.4 1988 Hy+Sy+S10 1.241 23 16.22 4.135 1.696 2.397 78.48 11.52 105.6 1862 Hy+Sy+S10 1.247 24(a) 16.07 4.115 1.724 2.369 78.38 11.42 104.9 1875 Hy+Eps+S10+Sy 1.244 25 15.10 4.142 1.668 2.438 78.48 11.69 98.10 1905 Hy+Eps+Sy 1.246 26 15.49 4.315 1.448 2.061 81.62 9.866 100.5 1905 Hy+Eps+ Sy 1.246 27 17.07 4.794 1.275 1.767 85.04 7.932 103.8 1747 Hy+Eps+Sy 1.247 28 15.66 4.013 1.623 2.214 79.03 11.04 105.7 1961 Hy+Eps+Sy 1.242 29 15.79 4.163 1.595 2.258 79.60 10.92 103.5 1901 Hy+Eps+Sy 1.245 30 15.91 4.128 1.696 2.239 79.05 10.85 104.5 1897 Hy+Eps+Sy 1.245 31 16.26 4.707 1.462 1.898 83.43 8.513 98.82 1769 Hy+Eps+Sy 1.246 32 17.69 5.069 1.150 1.546 87.13 6.727 104.3 1683 Hy+Eps+ Sy 1.249 33 16.28 3.503 1.917 1.436 78.51 8.141 125.1 2218 Hy+Eps+Sy 1.233 34 16.22 3.525 1.908 1.386 78.87 7.849 124.4 2221 Hy+Eps+Sy 1.233 35 16.65 4.443 1.435 2.019 82.28 9.462 105.7 1822 Hy+Eps+Sy 1.245 36 17.93 5.404 1.168 1.426 88.18 5.891 100.3 1600 Hy+Eps+Sy 1.251 37 19.29 6.074 0.945 1.045 91.58 3.989 99.73 1458 Hy+Eps+Sy 1.262 38 19.52 6.081 0.896 0.984 92.02 3.768 101.3 1458 Hy+Eps+Sy 1.264 39(b) 19.45 6.446 0.839 0.928 92.86 3.384 96.07 1399 Hy+Eps+Sy+Car 1.264 40 20.43 6.752 0.493 0.826 94.91 2.937 98.46 1345 Hy+Eps+Car 1.267 41 22.22 7.578 0.080 0.636 97.61 2.073 98.15 1202 Hy+Eps+ Car 1.295 42 15.69 4.409 0 2.068 89.39 10.61 109.0 2052 Hy+Eps+S10 1.229 43 25.08 8.536 0 0.561 98.36 1.635 99.10 1017 Hy+Eps+M8 1.332 44(c) 24.92 8.565 0.043 0.572 98.19 1.661 97.96 1016 Hy+Eps+M8+Car 1.331 45 22.86 7.602 0.375 0 98.49 0 101.5 1171 Hy+Car+M8 1.355 46 19.41 6.287 0.829 0 96.06 0 101.7 1510 Hy+Sy+Car 1.222

图1 -15℃下NaCl·2H2O 饱和时五元体系平衡干盐相图Fig.1 Equilibrium dry salt diagram of quinary system at -15℃ (saturated with NaCl·2H2O)

图2 -15℃下NaCl·2H2O 饱和时五元体系水图Fig.2 Water diagram of quinary system at -15℃ (saturated with NaCl·2H2O)

图3 -15℃下NaCl·2H2O 饱和时五元体系氯图Fig.3 Chlorine diagram of quinary system at -15℃ (saturated with NaCl·2H2O)
分析图1可知:该五元体系平衡相图中有3 个 共饱点,7 条溶解度单变量曲线及5 个两盐结晶区,5 个两盐结晶区分别对应Sy+Hy、S10+Hy、Eps+Hy、M8+Hy 和Car+Hy,其中S10结晶区最大,这说明该体系在氯化钠饱和时其溶解度最小。3 个共饱点分 别为a、b、c,其对应的平衡固相分别为:S10+Eps+ Sy+Hy、Eps+Sy+Car+Hy、Eps+Car+M8+Hy。

图4 -15℃下NaCl·2H2O 饱和时五元体系的密度-组成Fig.4 Composition-density of quinary system at -15℃(saturated with NaCl·2H2O )

图5 25、0、-15℃下五元体系干盐图的比较Fig.5 Dry diagram of quinary system at -15,0 and 25℃
分析图2、图3可知,随着Mg2+含量的增加,溶液中的水量减小、密度增加,主要原因是镁盐较其他盐类的溶解度更大,导致饱和时的溶液水量较低,并主导了溶液密度的变化。在p 点处对应的水量最大、密度最小、Mg2+含量最小。
图5中标出了25℃相图的结晶区,有10 个两盐结晶区,分别为:Na2SO4·3K2SO4(Gla)+NaCl、Na2SO4+NaCl、KCl+NaCl、K2SO4·MgSO4·6H2O (Pic)+NaCl、Na2SO4·MgSO4·4H2O (Ast)+NaCl、K2SO4·MgSO4·4H2O (Leo)+NaCl、KCl·MgSO4·3H2O (Kai)+NaCl、KCl·MgCl2·6H2O (Car)+NaCl、MgCl2·6H2O (Bis)+NaCl、MgSO4·(4~7)H2O+NaCl。与25℃相图相比,-15℃相图中Leo、Kai、Gla、Ast、Pic、MgSO4·(4~6)H2O 结晶区均消失,Na2SO4结晶区转变为Na2SO4·10H2O 且结晶区扩大,Sy、Eps、Car 结晶区缩小,Bis 结晶区转变为M8;与 0℃相图相比,-15℃相图的结构基本一致,但S10的结晶区扩大较多,Sy、Eps、Car 结晶区缩小,Pic结晶区消失,Bis 结晶区转变为M8。因此,低温条件下极大的简化了相平衡关系,如罗布泊卤水在自然条件下蒸发,其结晶路线为:NaCl+Ast、NaCl + Ast+Pic、NaCl+Pic+Eps、NaCl+Sy+Eps、NaCl +Eps+ Car,在低温条件蒸发,其结晶路线为:NaCl(或Hy)+S10、Hy+Eps、Hy+Car,复盐种类减少。这个现象对生产工艺的简化,产品质量的保障意义很大。
2.2 典型硫酸型卤水降温实验液相数据
典型硫酸型卤水组成[20-21]见表2,据此配制的实验体系在降温过程中液相的组成见表3,将其换算成Jänecke 指数,绘制出这些卤水在降温过程中液相组成变化的走向曲线(图6)和密度-温度图(图7),为比较同时依据文献[2,19]及本工作研究数据绘制出0℃、-5℃、-10℃、-15℃的相图。

表2 典型硫酸型卤水组成Table 2 Composition of typical sulfate brine
由表3、图6、图7并结合固相分析可知,降温过程中的液相组成变化及析盐规律与理论基本一致,稍有差别,主要因为相图研究的是平衡体系,而降温过程未达到平衡。六组卤水组成点均落在NaCl(或Hy)与S10的共结晶区,降温过程中,钾含量较高的卤水,盐结晶顺序为:NaCl(或Hy)+ S10、Hy+KCl;钾含量较低的卤水,盐结晶顺序为:NaCl(或Hy)+S10、Hy+Eps、Hy+Sy 或Car。虽然氯化钠始终饱和,但由于其溶解度受温度的影响不大,只是由于其他水合盐析出,减少了水量而少量析出。对于硫酸盐型卤水生产钾盐,常温蒸发将会有大量各种复盐析出,使得加工工艺复杂,本研究工作表明,卤水先经过低温析出硫酸盐,降低卤水中硫酸根的含量,再进行蒸发或其他方式加工,过程将大大简化。另外,随着温度的降低,盐类析出,卤水密度逐渐降低。
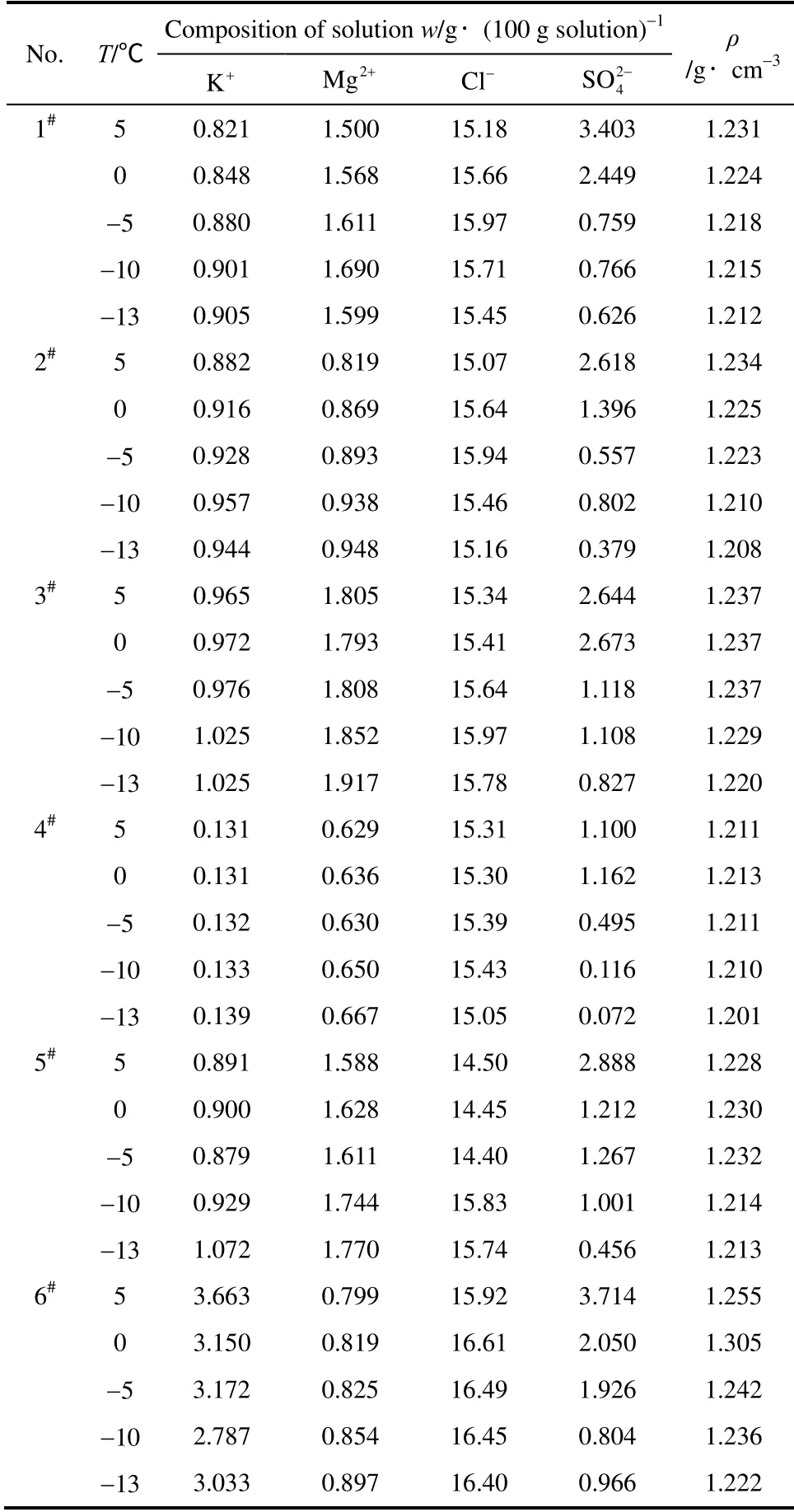
表3 含硫酸盐卤水体系降温过程液相组成Table 3 Liquid compositions of brine systems with sulfate in cooling process

图6 典型硫酸盐卤水降温过程中液相组成变化Fig.6 Change of liquid composition of typical sulfate brine in cooling process

图7 典型硫酸盐卤水降温过程中密度-温度Fig.7 Density-temperature of typical sulfate brine in cooling process
3 结 论
(1)采用等温溶解平衡法,研究了-15℃ NaCl·2H2O 饱和时Na+,K+,Mg2+//Cl-,-H2O 五元体系相图,其中有3 个四盐共饱点,7 条溶解度单变量曲线及5 个两盐结晶区,5 个两盐结晶区分别对应Sy+Hy、S10+Hy、Eps+Hy、M8+Hy 和Car+Hy。
(2)低温可以极大地简化本五元体系相平衡关系,随着温度的降低,S10的结晶区扩大,Sy、Eps、Car 结晶区缩小,Pic 结晶区消失,Bis 结晶区转变为M8。这种简单的相平衡关系有利于盐湖生产加工工艺的简化。
[1]Silcok H.Solubililies of Inorganic and Organic Compounds [M].3rd ed.New York:Pergamon Press,1979:473-769
[2]Yang Zhen (杨珍).Study on the phase equilibrium for system Na+,K+,Mg2+//Cl-,,-H2O and its sub-systems at 298.16K [D].Xinjiang:Xinjiang University,2008
[3]Jin Zuomei (金作美),Xiao Xianzhi (肖显志),Liang Shimei (梁式梅).Study of the metastable phase equilibrium for pentanary system of Na+,K+,Mg2+//Cl-,-H2O [J].Acta Chim.Sinica(化学学报),1980,38 (4):313-321
[4]Jin Zuomei (金作美),Zhou Huinan (周惠南),Wang Lisheng (王励生).Studies on the metastable phase equilibrium of Na+,K+,Mg2+// Cl-,-H2O quinary system at 15℃ [J].Chem.J.ChineseUniversities(高等学校化学学报),2002,23 (4):690-694
[5]Jin Zuomei (金作美),Zhou Huinan (周惠南),Wang Lisheng (王励生).Studies on the metastable phase equilibrium of Na+,K+,Mg2+// Cl-,-H2O quinary system at 35℃ [J].Chem.J.ChineseUniversities(高等学校化学学报),2001,22 (4):634-638
[6]Su Yuguang (苏裕光),Li Jun (李军).Metastable phase equilibrium of Na+,K+,Mg2+//Cl-,-H2O quinary system at 15℃ [J].Journal of Chemical Industry and Engineering(China) (化工学报),1992,43 (5):549-555
[7]Teeple J E.The Industrial Development of Searles Lake Brine with Equilibrium Data [M].New York:ACS,1929:112-154
[8]Ringer W E.De veranderingen in sam enstelling Van zeewater bij het bevriezen [J].Chem.Weekblad,1906 (3):1-49
[9]Nelson K H,Thompson T G.Deposition of salts from seawater by frigid concentration[R].Seattle:Office of Naval Research,University of Washington Department of Oceanography,1977
[10]Thompson T G,Nelson K H.Concentration of brines and deposition of salts from sea water under frigid conditions [J].Amer.J.Sci.,1956,254 (4):227-238
[11]Gitteman K E.Thermal analysis of seawater[R].Hanover:USA Cold Regions Research and Engineering Laboratory,1937
[12]Marion G M,Komrowski A J.Alternative pathways for sea water freezing [J].Cold Regions Science and Technology,1999,29 (3):259-266
[13]Spencer R J,Mller N,Weare H J.The prediction of mineral solubilities in natural waters:a chemical equilibrium model for the Na-K-Ca-Mg-Cl-SO4-H2O system at temperatures below 25℃ [J].Geochimica et Cosmochimiea Acta,1990,54 (3):575-590
[14]Gao Shiyang (高世扬),Zhao Jinfu (赵金福),Xue Fangshan (薛方山).An experimental study on cooling MgCl2saturated brine containing borate [J].Journal of Salt Lake Research(盐湖研究),1998,6 (1):1-10
[15]Wu Zhiming (乌志明),Deng Xiaochuan (邓小川).Study on desalination of salt water by the refrigeration method [J].Inorganic Chemicals Industry(无机盐工业),2001,33 (2):6-8
[16]Zhang Yongsheng (张永生),Mie Zhen (乜贞),Zheng Mianping (郑绵平).Rich in carbonate type brine test the rule of composition evolution of the brine under serial freezing temperature [J].Sea-lake Salt and Chemical Industry(海湖盐与化工),2001,30 (1):3-6
[17]Li Qinghai (李青海),Gu Tongxin (顾同欣),Yu Shengsong (于升松),Yao Yan (姚燕),Li Bing (李冰),Li Wu (李武).Study on the precipitation pathway of Nanyishan OilfieId brine at subzero temperatures [J].Acta Phys.Chim.Sin.(物理化学学报),2011,27 (8):1803-1808
[18]Huang Xueli (黄雪莉).The liquid-solid equilibria of the system Na+,K+,Mg2+// Cl-,SO24-,at 298.16 K and its application [D].Dalian:Dalian University of Technology,2008
[19]Niu Zide (牛自得),Cheng Fangqin (程芳琴).The Phase Diagram of Salt-water System and Its Application (水盐体系相图及应用) [M].Tianjin:Tianjin University Press,2002:266-267
[20]Huang Xueli (黄雪莉),Ma Fengyun (马风云),Hu Zizhao (胡子昭).Study on evaporation experiment of the brine in Manasi Lake in Xinjiang [J].Journal of Xinjiang University(新疆大学学报),2002,19 (4):471-474
[21]Li Hao (李浩).Characteristics of potassium sulfate deposit from salt lake brine and its application study on chemical process in Lop Nur [D].Anhui:China University of Mining & Technology,2011

