富氧燃烧气氛下石灰石煅烧/硫化特性及模型模拟
王春波,张斌,陈亮,郭泰成
(华北电力大学能源动力与机械工程学院,河北 保定 071003)
引 言
循环流化床锅炉(CFBB)富氧燃烧技术是一种能综合控制燃煤污染物排放的新型燃烧技术[1-3]。富氧气氛下,CO2在烟气中的体积浓度可达80%(干基)甚至更高。石灰石分解温度和CO2分压关系如下[4]
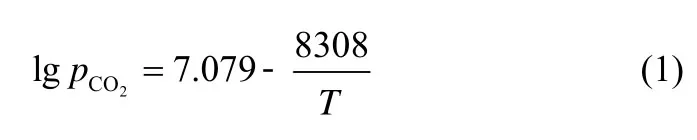
在80% CO2浓度下石灰石分解平衡温度为885℃,常规运行温度下石灰石不会发生分解并与SO2发生直接硫化反应

但当燃用石油焦或无烟煤时,炉内运行温度需在900℃以上,此时炉内会发生石灰石的煅烧及间接硫化反应
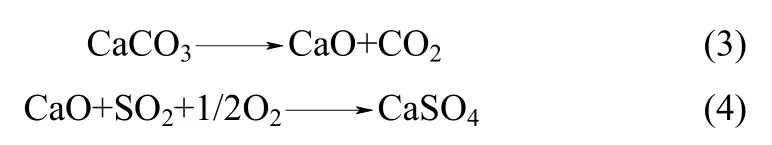
对反应(3)、(4),一般先在纯N2气氛下将石灰石煅烧成CaO,然后针对CaO 硫化特性进行研究[5-8]。目前关于富氧燃烧CFBB 内石灰石直接硫化反应的研究较多,而关于其内发生的反应(3)、(4)则报道较少。王宏等[9]利用管式炉对富氧气氛下石灰石硫化特性进行了研究,认为高温下石灰石在富氧气氛下的脱硫仍为CaO 的硫化反应;Olas 等[10]认为富氧气氛下石灰石会发生同时煅烧硫化反应,煅烧过程中CaSO4的生成阻碍石灰石分解;陈传敏等[11]利用TGA-XRD 对石灰石在O2/CO2气氛中的硫化特性进行了分析,发现石灰石在分解过程中同时进行硫化反应,在煅烧过程中硫化速率达到最大。
需要指出的是,对石灰石硫化特性实验常采用TGA 逐步升温(一般升温速率为20~30℃·min-1)的研究方法[6-8,12-13],这与工程实际中石灰石突然置于高温下差别较大且无法研究富氧燃烧CFBB 内高温下(900℃以上,即使在纯CO2保护气下石灰石在升温到指定温度过程中也会分解)同时煅烧硫化特性;流化床反应器的研究方法虽然很接近实际工况,但不能评估反应动力学,导致不能有效评估各反应阶段的影响因素。为弥补目前研究中仅以N2和CO2(没有考虑SO2的影响)为模拟煅烧气氛以及TGA 逐步升温系统和模拟流化床反应器的部分不足,本文利用自制恒温热重装置,进行了富氧气氛下石灰石同时煅烧/硫化实验,并进行了机理分析与模型验证。
1 实验测试方法
图1为能够实现恒温下热重信号实时测量系统。管式炉管长800 mm,内径40 mm。石灰石反应质量变化通过计算机实时在线监测,质量传感器精度为0.1 mg。石灰石同时煅烧/硫化反应过程中,模拟烟气各组分体积分数分别为φ(CO2)=75%、φ(O2)=5%、φ(SO2)=0.2%,N2为平衡气。进入反应炉内的气体流速为0.1 m·s-1,前期重复性实验证明该气体流速下可消除反应过程中气体扩散影响。利用该装置前期进行的研究表明,其具有足够的精度和准确度[14-15]。
实验用石灰石化学成分采用XRF 分析示于表1。每次实验称取约80 mg 左右石灰石样品,平铺于90 mm 长,12 mm 宽,9 mm 深的石英舟内形成均匀的单颗粒薄层。为尽可能接近工业工况,首先将炉温升到设定温度并稳定60 min,然后通过滑轨将石英舟(内置石灰石)迅速送入炉内进行反应。根据式(5)计算反应过程中(石灰石完全分解后)石灰石钙转化率X

图1 实验系统Fig.1 Experimental system
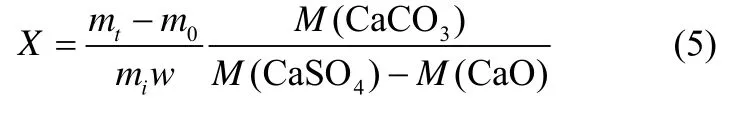
式中,mt为反应过程中样品质量;m0为煅烧阶段无SO2时石灰石完全煅烧后质量;mi为石灰石样品质量;w为石灰石中CaCO3质量分数;M(CaCO3)、M(CaSO4)以及M(CaO)分别为CaCO3、CaSO4以及CaO 的摩尔质量。

表1 石灰石样品的化学组成Table 1 Chemical composition of limestone sample /%(mass)
孔结构测量采用TristarⅡ3020 比表面积及孔隙度分析仪。硫化产物电导率采用FT-301 多功能粉末电阻率测试仪进行测量。
2 结果与分析
2.1 煅烧过程中SO2 的影响
首先在900℃下,对150~250 μm 石灰石进行了同时煅烧/硫化实验,如图2所示。为对比分析,同时进行了煅烧过程中不含SO2气体(其他气体成分相同)时石灰石先煅烧生成CaO 然后再硫化的实验(硫化气氛相同),文中称为“煅烧-硫化”,图里简写为“calcination-sulfation”,以下各图类似。

图2 900℃下石灰石同时煅烧/硫化特性Fig.2 Simultaneous calcination/sulfation of limestone at 900℃
图2中,纵坐标为反应过程中样品质量与初始质量比,横坐标为反应时间。相比煅烧-硫化工况,石灰石同时煅烧/硫化最大的特点为:在失重阶段,由于石灰石煅烧生成CaO 的同时CaO 也进行硫化反应,所以最低密度点更高。需要注意的是,同时煅烧硫化时,最低密度点并不是石灰石完全分解点,而是其煅烧失重和硫化反应增重的平衡点。
为确定同时煅烧/硫化过程中石灰石完全分解时间,进行了前期验证性实验:取同时煅烧/硫化失重曲线最低点后不同反应时刻样品并在N2气氛下快速冷却到室温,经磨碎后在900℃、N2气氛下煅烧。发现实验进行到680 s 后样品在此过程中质量不再变化,说明同时煅烧/硫化反应进行到680 s 时石灰石已完全分解。石灰石完全分解后即可用式(5)进行钙转化率计算,如图3所示。

图3 同时煅烧/硫化与煅烧-硫化钙转化率Fig.3 Utilization of limestone for simultaneous calcination/sulfation and calcination-sulfation
图3为相同硫化反应时间时,两种工况下石灰石钙转化率。为保证同时煅烧/硫化过程中石灰石完全分解,起始时刻选为700 s。根据已反应的CaO的摩尔质量对时间求导所得硫化反应速率如图4所示。
间接硫化反应包含两个阶段[8,16],化学反应控制阶段和由CaSO4产物层扩散控制阶段。由图3、图4可知,700 s 时两种工况下石灰石硫化反应速率相对较快,均处于化学反应控制阶段;且同时煅烧/硫化工况下石灰石钙转化率更高,但硫化反应速率更低。随硫化反应的进行,同时煅烧/硫化工况下硫化反应速率降低更快。由图3可知,化学反应控制阶段结束时其钙转化率相对较低,反应更早进入产物层扩散控制阶段。由图4可以看出,相比煅烧-硫化工况,同时煅烧/硫化工况下硫化速率降低更加缓慢。结合图3,在产物层扩散控制阶段,石灰石同时煅烧/硫化工况下钙转化率增加更快,经足够反应时间后可能获得更高的钙转化率。

图4 同时煅烧/硫化与煅烧-硫化速率Fig.4 Sulfation rate of simultaneous calcination/sulfation and calcination-sulfation of limestone
2.2 机理分析
为了深入了解石灰石同时煅烧/硫化反应特性,针对煅烧硫化产物孔结构进行了分析。900℃下相同时间320 s(同时煅烧/硫化失重最低点)时产物孔结构如图5所示。
由图5可以看出,经历相同时间时,石灰石同时煅烧/硫化工况下,其样品孔径分布、孔容积及比表面积均相对减小,其中比表面积、孔容积分别相对减少4.34%、7.05%。主要原因是:反应前期CaO一边由石灰石分解产生,一边与SO2进行硫化反应。由2.1 节可知,化学反应阶段前期,石灰石同时煅烧/硫化工况下硫化速率更快、钙转化率相对更高,但在较高的硫化反应速率下,小孔径的孔隙很快被CaSO4堵塞从而使孔结构特性变差。而煅烧-硫化工况分解产生CaO 经历更长烧结时间,孔径分布向大孔方向移动,较大的孔径不易堵塞且更有利于硫化反应的深入进行[17-18]。这也进一步解释了图3、图4中的现象。
研究[19-21]表明:硫化反应产物层以固态离子扩散为主。电导率是表征其固态离子扩散难易程度的物理量,因此针对硫化产物进行了电导率测量。尽管同一种物质在不同条件下测得的电导率有差别,但固体电解质的电导率具有补偿效应[22],即:不同导电机制或不同载流子产生的电导率相交于特征点[23]。将以往人们对CaSO4测得电导率数据[24-26]以及本实验测得数据绘于图6。
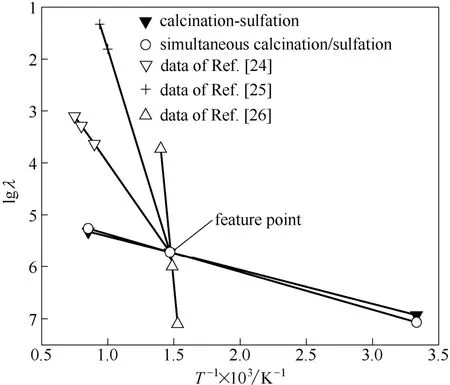
图6 电导率补偿效应Fig.6 Conductivity compensation effect
由图6可以看出,各补偿效应线相交于特征点,电导率对数值与热力学温度倒数有良好线性关系。根据室温下硫化产物电导率,得到900℃下同时煅烧/硫化、煅烧-硫化两种工况下硫化产物电导率分别为10-5.265、10-5.321S·cm-1。同时煅烧/硫化下硫化产物具有更大的离子扩散系数,这也解释了图4中产物层扩散控制阶段其具有更高的硫化反应速率的现象。其原因可能是由于同时煅烧/硫化过程中,石灰石生成CO2扩散使得硫化产物层具有一定的疏松性,而煅烧-硫化工况下,CaO 硫化反应生成相对致密的CaSO4产物层。产物层的疏松多孔性更有利于固态离子的扩散[12]从而表现出较高的反应速率。
3 同时煅烧及硫化模型
3.1 模型描述
以往人们对石灰石硫化反应模型研究多集中在CaO-SO2反应[13,27-28]。本文首次同时考虑了石灰石煅烧、煅烧产物烧结及硫化,对其进行了模型模拟。
本文提出描述石灰石同时煅烧/硫化的晶粒-微晶粒模型物理概念如图7所示。假设石灰石颗粒为无孔晶粒,反应开始后,CaCO3晶粒首先由外到内发生煅烧分解,在未分解的CaCO3晶粒周围形成CaO 微晶粒,CaO 微晶粒同时经历烧结与硫化。

图7 晶粒-微晶粒模型Fig.7 Grain-micrograin model
3.2 同时煅烧硫化反应模型
石灰石颗粒煅烧反应速率

式中,kc为石灰石颗粒煅烧反应速率常数;pe为CO2平衡分压;θ为CO2活性点分数;pc为煅烧反应界面CO2分压。
石灰石分解产生CO2通过CaO 微晶粒之间的孔隙向颗粒外扩散,CO2扩散方程为

式中,De为CO2颗粒内有效扩散系数,主要由Kundsen 扩散控制;εt为反应过程中CaO 颗粒孔隙率,主要受烧结作用和硫化的影响。
CaCO3煅烧转化率Xc计算式为

式中,rp为石灰石晶粒原始半径。
环境中SO2气体通过CaO微晶粒之间的孔隙向颗粒内部扩散,SO2在CaO 晶粒间扩散的微分质量平衡方程为

式中,r(SO2)为硫化反应速率;Dse为SO2在CaO 颗粒内的有效扩散系数。
硫化反应中,固体CaO 硫化反应速率r(CaO)可通过r2的变化速率表示
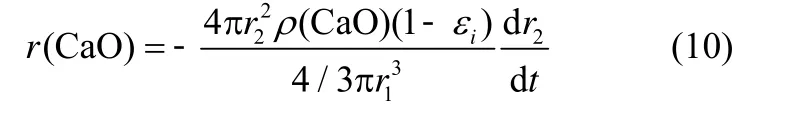
Mahuli 等[29]以固态离子扩散机理为基础,推导出单位晶粒体积的硫化反应速率为
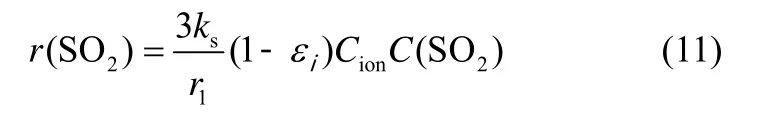
式中,ks为硫化速率常数;Cion为产物层表面钙离子浓度;C(SO2)为晶粒内SO2浓度。
CaO 晶粒局部硫化反应速率等于通过硫化产物层固态离子扩散速率[30]

式中,L=r1-r2;Dion为产物层固态离子扩散系数;Cc为反应界面处离子浓度,其值等于CaO密度值,Cc=ρ(CaO);Sav为离子扩散横断比表面积平均值。
联立式(11)与式(12),得到取决于本征动力学及硫化产物层固态离子扩散率的硫化反应速率表达式

由式(10)与式(13)可得

晶粒局部转化率xs可表示为

由于硫化产物CaSO4生成,考虑晶粒尺寸在反应过程中的变化

通过对各层局部转化率进行积分,可得石灰石颗粒钙转化率为

石灰石颗粒同时煅烧/硫化反应过程中,相对质量变化可用式(18)表示
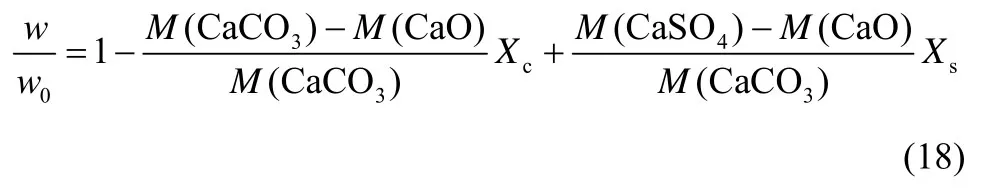
3.3 模拟验证及讨论
3.3.1 粒径影响 图8为不同粒径石灰石同时煅烧/ 硫化反应模拟值与实验值。温度为900℃,气氛反应工况同图1。模拟值与实验值吻合较好。可以看出,小粒径石灰石更容易煅烧,分解速率更快。3 种粒径石灰石最终钙转化率分别为53.5%、36.9%、15.7%,随粒径减小最终钙转化率明显提高。小粒径石灰石具有更大的反应比表面积,有利于气固反应的进行,表现为硫化反应速率的提高。

图8 粒径对石灰石同时煅烧/硫化特性影响Fig.8 Effect of particle size on simultaneous calcination/ sulfation of limestone
3.3.2 温度影响 图9为不同温度下石灰石同时煅烧/硫化反应模拟值与实验值。石灰石为150~250 μm,气氛工况同图1。可以看出,随温度升高钙转化率提高,900、950、1000℃下,最终钙转化率分别为36.9%、45.2%、46.2%。本实验范围内,随温度升高硫化反应活性提高,但过高的温度导致CaO高温烧结严重不利于反应进行,出现950 和1000℃时转化率基本一样的情况。
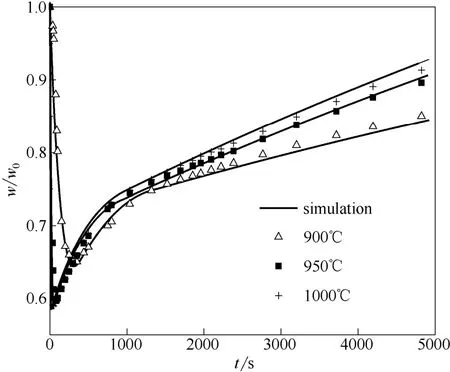
图9 温度对石灰石同时煅烧/硫化特性影响Fig.9 Effect of temperature on simultaneous calcination/ sulfation of limestone
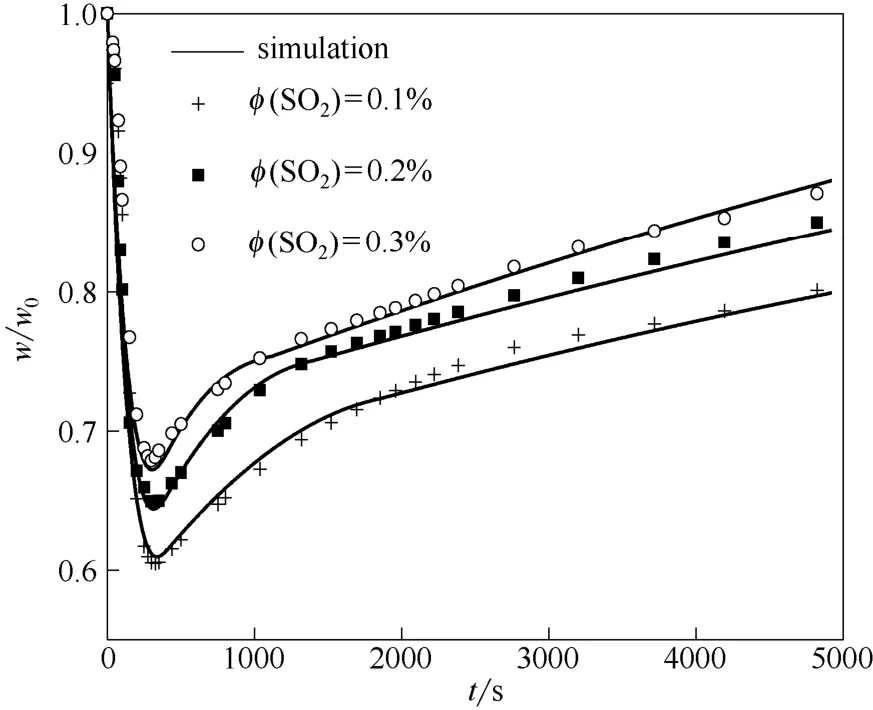
图10 SO2 浓度对石灰石同时煅烧/硫化特性影响Fig.10 Effect of SO2 concentration on simultaneous calcination/sulfation of limestone
3.3.3 SO2浓度影响 图10为不同SO2浓度下石灰石同时煅烧/硫化反应模拟值与实验值。石灰石为150~250 μm,温度900℃。由图可以看出,随反应气氛中SO2浓度的提高,最终钙转化率相应提高。如SO2体积浓度0.1%、0.2%、0.3%时,最终钙转化率分别为30.5%、36.9%与39.6%。随SO2浓度升高,颗粒反应表面SO2富集浓度提高,从而促进了SO2在气膜与硫化产物层之间的扩散,导致化学反应速率增加,最终表现为钙转化率的提高。
4 结 论
(1)富氧气氛下石灰石同时煅烧/硫化相比先煅烧再硫化呈现不同的特点:石灰石未完全分解之前硫化速率更大,但由于孔隙容易堵塞,反应速率下降较快,化学反应控制阶段结束时钙转化率相对较低;产物层扩散控制阶段有利于固态离子扩散,提高了硫化反应速率。
(2)本实验范围内提高反应温度有利于反应活性提高,但烧结会极大影响CaO 的钙转化率,尤其当温度高于950℃时。粒径效应明显,随石灰石颗粒减小钙转化率明显提高;提高SO2浓度有利于提高石灰石钙利用率。
(3)以产物层固态离子扩散为基础,采用晶粒-微晶粒模型,首次对石灰石同时煅烧硫化反应进行了模拟计算,模拟结果与实验结果较为吻合。
[1]Liu H,Okazaki K.Simultaneous easy CO2recovery and drastic reduction and NOxin O2/CO2coal combustion with heat recirculation [J].Fuel,2003,82(11):1427-1436
[2]Liu Hao(刘皓),Ren Ruiqi(任瑞琪),Huang Yongjun(黄永俊),Yang Luohui(杨落恢),Zhu He(祝贺),Ando Takashi,Okazaki Ken.Reduction and emission of NO in oxy-fuel system [J].CIESC Journal(化工学报),2011,62(2):495-501
[3]Duan Lunbo(段伦博),Zhao Changsui(赵长遂),Lu Junying(卢俊营),Zhou Wu(周骛),Chen Xiaoping(陈晓平).SO2/NO emission characteristics during O2/CO2coal combustion process [J].CIESC Journal(化工学报),2009,60(5):1268-1274
[4]Baker E H.The calcium oxide-carbon dioxide system in the pressure range 1—300 atm [J].Journal of the Chemical Society,1962:464-470
[5]Wang W Y,Bjerle I.Modeling of high-temperature desulfurization by Ca-based sorbents [J].Chemical Engineering Science,1998,53(11):1973-1989
[6]Wang C,Jia L,Tan Y,Anthony E J.The effect of water on the sulphation of limestone [J].Fuel,2010,89(9):2628-2632
[7]Stewart M C,Manovic V,Anthony E J,Macchi A.Enhancement of indirect sulphation of limestone by steam addition [J].Environmental Science and Technology,2010,44(22):8781-8786
[8]Francisco García-Labiano,Aránzazu Rufas,Luis F de Diego,Margarita de las Obras-Loscertales,Pilar Gayán,Alberto Abad,Juan Adánez.Calcium-based sorbents behaviour during sulphation at oxy-fuel fluidised bed combustion conditions [J].Fuel,2011,90(10):3100-3108
[9]Wang Hong(王宏),Zhang Lizhi(张礼知),Qiu Jianrong(邱建荣),Zheng Chuguang(郑楚光).Experimental study on the desulfurization of calcium-based sorbent in CO2enriched environment [J].Journal of Engineering Thermophysics(工程热物理学报),2001,22(3):374-377
[10]Olas M,Kobylecki R,Bis Z.Simultaneous calcinations and sulfation of limestone-based sorbents in CFBC-Effect of mechanical activation //Proceedings of the 9th International Conference on Circulating Fluidized Beds[C].Hamburg,Germany,2008
[11]Chen Chuanmin(陈传敏),Zhao Changsui(赵长遂),Zhao Yi(赵毅),Liang Cai(梁财),Pang Keliang(庞克亮).Investigation on sulfation characteristics of limestone under O2/CO2atmosphere by TGA-XRD [J].Proceedings of the CSEE(中国电机工程学报),2006,26(13):108-112
[12]Chen Chuanmin,Zhao Changsui,Liu Songtao,Wang Chunbo.Direct sulfation of limestone on oxy-fuel combustion technology [J].Environmental Engineering Science,2009,26(10):1481-1488
[13]Zevenhoven R,Yrjas P,Hupa M.Sulfur dioxide capture under PFBC conditions:the influence of sorbent particle structure [J].Fuel,1998,77(4):285-292
[14]Wang Chunbo,Zhang Yue,Jia Lufei,Tan Yewen.Effect of water vapor on the pore structure and sulfation of CaO [J].Fuel,2014,130:60-65
[15]Wang Chunbo,Wang Jinxing,Lei Ming,Gao Haining.Investigations on combustion and NO emission characteristics of coal and biomass blends [J].Energy & Fuel,2013,27:6185-6190
[16]De Diego L F,de las Obras-Loscertales M,García-Labiano F,Aranzazu Rufas,Alberto Abad,Pilar Gayan,Juan Adanez.Characterization of a limestone in a batch fluidized bed reactor for sulfur retention under oxy-fuel operating conditions [J].International Journal of Greenhouse Gas Control,2011,5(5):1190-1198
[17]Chen Hongwei( 陈 鸿 伟),Zhao Zhenghui( 赵 争 辉),Huang Xinzhang(黄新章),Huang Xueli(黄雪丽).Sequential SO2/CO2capture using CaO-based sorbents reactivated by steam [J].CIESC Journal(化工学报),2012,63(8):2566-2575
[18]Cao Liyong(曹立勇),He Rong(何榕).Effect of CaO pore parameters on desulfurization reaction rates [J].Journal of Tsinghua University:Science and Technology(清华大学学报:自然科学版),2010,50(2):283-286
[19]Yang Haibo(杨海波),Wu Zenghua(武增华),Qiu Xinping(邱新平).Development of mechanism of CaO sulfation reaction [J].Journal of Fuel Chemistry and Technology(燃料化学学报),2003,31(1):92-97
[20]Hsia C,St Pierre G R,Fan L S.Isotope study on diffusion in CaSO4formed during sorbent-flue-gas reaction [J].AIChE Journal,1995,41(10):2337-2340
[21]Hsia C,St Pierre G R.Diffusion through CaSO4formed during the reaction of CaO with SO2and O2[J].AIChE Journal,1993,39(4):698-700
[22]Wu Xiaoping (吴小平),Zheng Yongfei(郑永飞).Compensation for electrical conductivity in minerals and its constraints on element diffusivity [J].Acta Petrologica Sinica(岩石学报),2003,19(4):729-738
[23]Li Ying(李英),Gong Jianghong(龚江红),Tang Zilong(唐子龙),Zhang Zhongtai(张中太).Effect of additive on the high-temperature conductivity of ZrO2materials [J].Journal of The Chinese Ceramic Society(硅酸盐学报),1997,25(6):705-710
[24]Yang Haibo(杨海波),Wu Zenghua(武增华),Qiu Xinping(邱新平),Wang Junmin(王军民),Liu Jinquan(刘金权),Guo Fen(郭峰).Ca2+cation diffusion through CaSO4product layer during sulfur retained reaction with CaO [J].Acta Chimica Sinica(化学学报),2003,61(9):1410-1415
[25]Brosda S,Bouwmeester H,Guth U.Electrical conductivity and thermal behavior of solid electrolytes based on alkali carbonates and sulfates [J].Solid State Ionics,1997,101(103):1201-1205
[26]Jagdale S H,Pawar S H.Crystal growth and electrical properties of CaSO4,Dy single crystals [J].Bulletin of Materials Science,1983,5(5):389-397
[27]Spartinos Demetrios N,Vayenas Costas G.Kinetics of sulphation of limestone and precalcined limestone [J].Chemical Engineering and Processing,1991,30(2):97-106
[28]Liu Ni(刘妮).Study on performance evaluation and reaction mechanism of calcium-based sorbent[D].Hangzhou:Zhejiang University,2002
[29]Mahuli S K,Agnihotri R,Jadhav R,Shriniwas Chauk,Fan L-S.Combined calcination,sintering and sulfation model for CaCO3SO2reaction [J].AIChE Journal,1999,45(2):367-382
[30]Lindner B,Simonsson D.Comparison of structural models for gas-solid reactions in porous solids undergoing structural changes [J].Chemical Engineering Science,1981,36:1519-1527

